摘 要: 目的 探讨流感病毒培养过程中的污染预防及处理。方法 分析2016年11月—2017年12月4次实验室流感病毒的培养被微生物污染的情况、菌种种类、处理办法, 检查可能的污染源, 开展细菌培养分离, 以查找污染源。结果 培养流感病毒时出现4次实验室污染, 其中白色假丝酵母菌污染3次, 从一次性使用的移液管包装套上提取白色假丝酵母菌进行分离培养;缺陷短波单胞菌污染1次, 在培养实验室空气时, 缺陷短波单胞菌产生, 成为污染环境的病菌。结论 培养流感病毒时会把一定浓度的抗菌药物提前注入培养液中, 在实际执行时, 如果不遵循试验实施规定、实验室生物安全预防规定, 就会污染实验室, 从而导致试验失败, 流感病毒培养结果大受影响。
关键词: 流感病毒培养; 污染; 预防; 处理;
流行性感冒是常见急性呼吸道传染病, 由流感病毒引发, 有极强的传染性, 易流行, 监测流感病毒可以掌握流感病毒的变异特性, 对流感流行的态势作出预测, 从而实行科学预防与控制, 并提供安全可靠的诊断方案与治疗方案[1]。本文分析2016年11月—2017年12月4次实验室流感病毒培养被微生物污染的情况、菌种种类、处理办法, 抽样检查可能的污染源, 并行细菌培养分离, 以查找到污染源。现汇报如下。
1、 资料与方法
1.1、 一般资料
回顾性分析2016年11月—2017年12月4次实验室所培养的流感病毒被微生物污染状况、菌种种类、处理办法;针对培养流感病毒当中, 疑似被污染的以DMEM为基础的培养液分别选择无菌管给予收集。连续10次培养实验室空气, 选择无菌生理盐水与双抗的标本监测实验仪器耗材的细菌情况。实验仪器耗材包括移液器的物体表面、一次性手套、一次性移液管、一次性移液管包装套、生物安全柜。见表1。
表1 污染菌菌落特点

1.2、 处理方法
把疑似被污染的培养液放置到血平板中;对实验室空气样本加以培养;接着将仪器耗材与包含双抗的标本样本都放置到血平板之上。将上述样本放置在35~37℃温度下培养24 h~48 h, 观测血平板上细菌成长情况, 检测结果为:菌落呈灰白色, 体积呈中等, 较为湿润;或菌落呈浅黄色, 体积偏小, 较为湿润。
1.3、 鉴定微生物及分析药敏
选择全自动微生物鉴定分析仪, 根据仪器使用说明鉴定分离到的菌株, 并分析药敏。
2、 结果
2.1、 污染菌基本情况
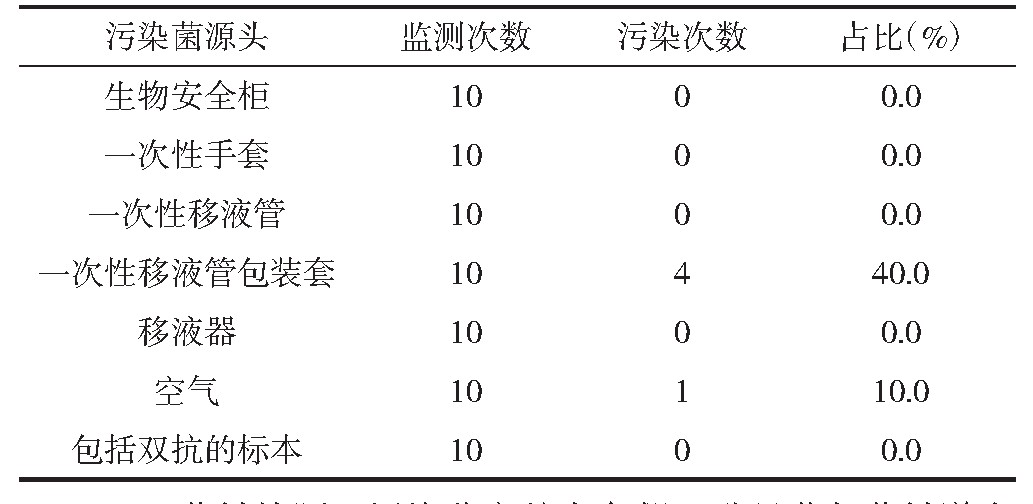
一次性移液管包装套污染是主要污染菌的来源, 所占比率为40%。见表2。
表2 污染菌来源污染次数所占比率情况
2.2、 药敏检测
污染分离的白色假丝酵母菌与药敏谱有着一致性, 对以下药物敏感:两性霉素B、氟康唑、氟胞嘧啶、伊曲康唑、伏立康唑。污染分离的缺陷短波单胞菌与药敏谱有着一致性, 对以下药物敏感:呋喃妥因、亚胺培南、厄他培南、阿米卡星;并对以下药物产生耐药性:环丙沙星、头孢唑林、氨苄西林、头孢曲松、头孢他啶、氨曲南、庆大霉素。
2.3、 防止污染的处置
实验室培养流感病毒过程中, 严格遵照试验操作规程与实验室生物安全防护操作规程开展实验, 因为碘酊可以作为广谱消毒剂, 因此采用2.5%碘酊代替75%乙醇, 用于消毒接种病毒当中所用到的所有器械工具, 清除并避免细菌和真菌导致的污染。因为及时正确的处理, 本实验室到目前没有再次出现因细菌或真菌所致的污染。
3、 讨论
培养流感病毒之前, 一般会提前注入双抗, 即注入一定浓度的青霉素、链霉素到标本与DMEM为基础的维持液当中, 以抑制细菌的生长, 促进处在DMEM为基础的维持液中的流感病毒的繁殖[2,3]。
监测流感流行态势的最佳方式是培养分型流感病毒, 为防止在培养流感病毒过程中被微生物污染, 在配制病毒生长液与接种流感病毒标本时, 所有环节都必须在无菌环境下实施且严格消毒, 以保证实验室生物安全[4]。培养流感病毒时提前注入一定浓度的双抗至培养液当中, 双抗所包含的青霉素会对大部分革兰阳性菌产生抑制作用, 链霉素会对大部分革兰阴性菌产生抑制作用[5];选择浓度为100~250 U/m L青霉素、浓度为100 mg/m L链霉素, 共同制成抑制剂。在35~37℃温度下, 青霉素降解灭活时间为2 d, 链霉素降解灭活时间为4 d, 狗肾上皮细胞 (MDCK) 培养流感病毒的最长时间为7 d, 在接种培养病毒时, 如果其中一个环节没有按照流感病毒培养试验规定与实验室生物安全防护规定执行, 消毒就会达不到要求, 污染的细菌不可避免地会在5 d之后繁殖, 以致实验室被污染, 最终实验失败, 使培养流感病毒受到影响[6,7]。根据国家流感监测中心的规定, 合格的流感毒株须在30 d内往上报送, 由于培养流感病毒被污染, 导致无法及时把合格的流感毒株报送至国家流感监测中心, 对整个区域的流感病原学监测与分析都造成一定影响, 从而也就无法适时掌握本地区流感流行态势, 防碍流感的预防与治疗工作。
当第一次出现试验室污染时, 实验室就采取了有效消毒措施, 但是仍旧有实验室污染出现, 经过连续10次监测可疑污染源, 检测结果为白色假丝酵母菌、缺陷短波单胞菌, 受污染的培养液培养的细菌与药敏谱有着一致性, 由此判断它们属于同一来源, 由此确定污染源。
本次实验分析了2016年11月—2017年12月4次培养的流感病毒被微生物污染状况, 白色假丝酵母菌、缺陷短波单胞菌属于主要污染菌。对一次性移液管包装套进行监测时, 4次为白色假丝酵母, 污染占比为40%;对实验室空气细菌学进行监测时, 1次为缺陷短波单胞菌, 污染占比为10%, 此两类微生物都为实验室污染的主要污染菌。对污染源监测发现, 试验所用一次性耗材与实验室环境成为污染源, 试验当中不注意某个环节, 就会大大增加污染概率。因此, 在对实验室进行常规消毒外, 还选择2.5%碘酊取代75%乙醇执行严格消毒, 防止再次出现污染, 预防与降低因微生物污染带给流感病毒培养的影响, 使流感病毒培养的阳性率得到提升, 及时报送合格流感病毒毒株[8]。因此, 培养流感病毒的每一个环节都极为重要, 均需严格按照试验操作规定与实验室生物安全防护规定操作。
另外, 在培养流感病毒当中, 对实验室严格消毒并加以防护, 当调配好病毒生长液, 在没注入双抗前提取一部分生长液, 之后再注入双抗到生长液中, 将提取的两种生长液标本进行阴性对照培养;以利于及时查找到污染菌与病菌来源, 并实施执行预防措施, 避免延误培养流感病毒的时间, 有利于预测流感流行态势, 并及时开展预防治疗[9]。
参考文献:
[1]秦笙, 伍时冠, 孟少伟, 等.人副流感病毒的快速分离培养与鉴定[J].医学研究生学报, 2016, 29 (8) :858-861.
[2]靳佩轩, 高洁.流感病毒组成蛋白质序列的分析与预测[J].食品与生物技术学报, 2016, 35 (4) :393-398.
[3]李玉香, 汪杨, 高玉伟, 等.甲型H1N1流感病毒流行病学调查[J].中国免疫学杂志, 2014, (8) :1098-1100.
[4]张旭, 曾玲, 姚雯.流感病毒培养过程中污染预防处理研究[J].中华医院感染学杂志, 2015, 25 (16) :3615-3628.
[5]胡澜怀, 周霞.高原地区流感病毒培养的条件优化[J].现代检验医学杂志, 2016, 31 (3) :131-134.
[6]余钧池.流感病毒在MDCK细胞中培养的条件优化[J].国际检验医学杂志, 2014, 35 (1) :92-94.
[7]郭琦, 耿兴良, 龙云凤, 等.H3 N2流感病毒冷适应株的无血清培养[J].医学研究杂志, 2015, 44 (7) :26-29.
[8]耿兴良, 戴宗祥, 段盼盼, 等.Vero细胞培养流感病毒的低血清培养基的筛选[J].中国生物制品学杂志, 2014, 27 (5) :687-690.
[9]李在晗, 苏杨起, 常亚军, 等.Vero细胞无血清培养基的筛选及其培养流感病毒H5N1条件的优化[J].中国生物制品学杂志, 2016, 29 (4) :407-412.