摘 要: 本研究测定了实验室2018~2019年分离的11株鸭甲型肝炎病毒1型(DHAV-1)和37株鸭甲型肝炎病毒3型(DHAV-3)的VP1基因序列,并选取代表毒株与已知阳性血清进行中和试验,分别分析DHAV-1或DHAV-3的遗传和抗原稳定性。结果表明,DHAV-1进化为两个遗传分支,2018~2019年的分离毒株分布在1b分支上,而经典DHAV-1毒株处于不同的1a分支上。DHAV-3进化为两个不同的分支,2018~2019年分离毒株大部分集中在3a分支上,个别毒株分布在3b分支上。DHAV-1或DHAV-3毒株之间均无明显的地理分布差异。血清交叉中和试验结果表明,DHAV-1或DHAV-3同一血清型之间仍具有较好的交叉保护,表明同一血清型的DHAV尚未发生抗原变异。
关键词: 鸭甲型肝炎病毒; 遗传演化;
Abstract: The VP1 coding sequences of 11 DHAV-1 and 37 DHAV-3 isolates(spanning2018-2019) associated with disease outbreaks were determined.Antigenic stability of representative DHAV-1 and DHAV-3 strains were study by Serum neutralization assay.We demonstrated that DHAV-1 viruses evolved into two genetic lineages,isolated strains spanning 2018-2019 were distributed into the same 1 b lineages. DHAV-3 viruses exhibited two distinct lineages,majority isolated strains spanning 2018-2019 were distributed into the same 3 a lineages.No Distribution differences were observed for DHAV-1 or DHAV-3 viruses.Antigenic study of representative DHAV-1 and DHAV-3 strains revealed no detectable changes in viral neutralization properties within the same serotype.Results of our experiments described here shall give novel insights into genetic properties and antigenic stability of duck hepatitis A viruses.
Keyword: Duck hepatitis virus; genetic and antigenic stability;
鸭甲型肝炎病毒(Duck hepatitis A virus,DHAV)主要危害3周龄以下的雏鸭,死亡率高达90%以上,给养鸭业造成巨大危害[1]。DHAV分为DHAV-1、DHAV-2和DHAV-3[2]。DHAV-1的危害普遍存在,DHAV-2仅见我国台湾报道[3]。近年来,DHAV-3的流行仍占主导地位,个别鸭场还见有DHAV-1和DHAV-3混合感染的现象[4]。三者之间存在显着的序列差异,遗传进化关系表明三者属于三个不同的基因型,血清学试验证明三者之间无交叉反应[5,6]。随着DHAV-1和DHAV-3的危害日趋严重[7,8,9],该病的遗传演化备受关注。为进一步分析当前DHAV的流行特点和变异现状,本研究对本实验室2018-2019年保存的11株DHAV-1和37株DHAV-3以及Genbank中下载的DHAV代表株的VP1基因进行了生物信息学分析,结合代表毒株的生物学特性,揭示了近两年DHAV-1和DHAV-3的遗传演化情况,对鸭甲型肝炎病毒的综合防控具有重要的指导意义。
1、 材料与方法
1.1 DHAV毒株和阳性血清
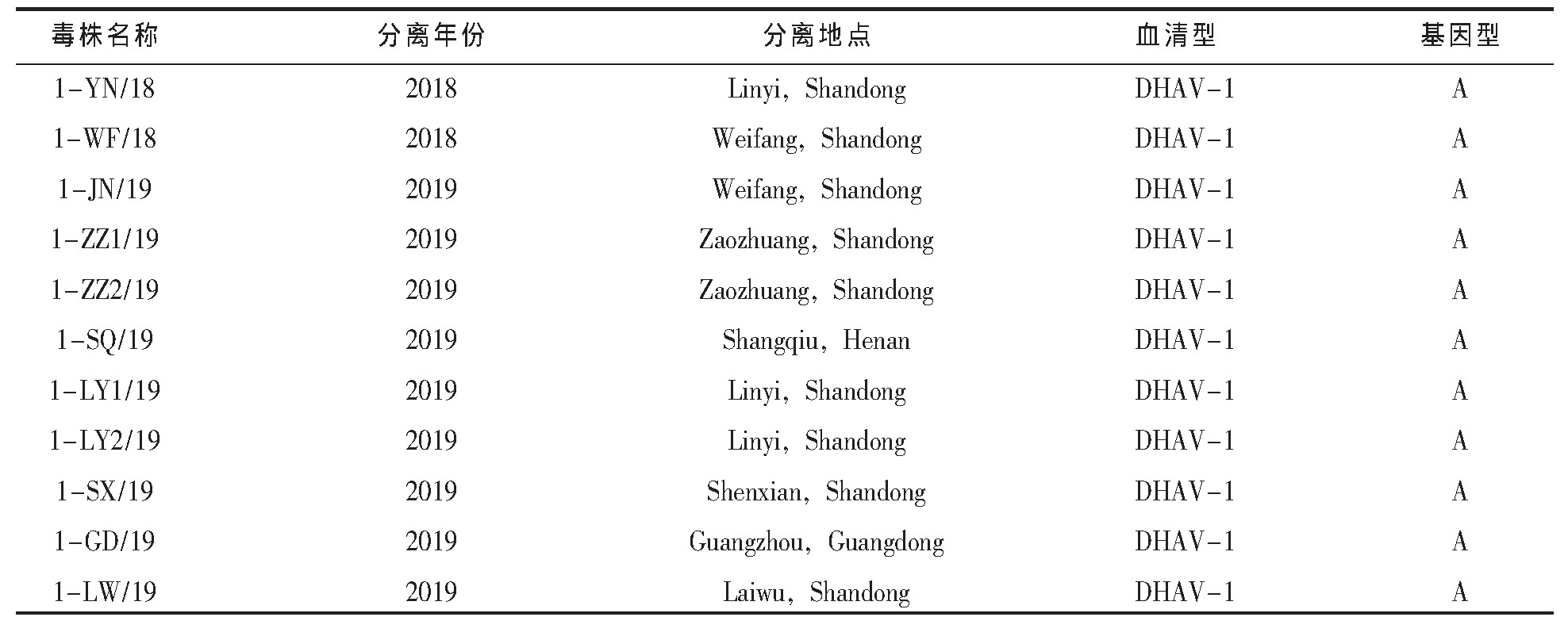
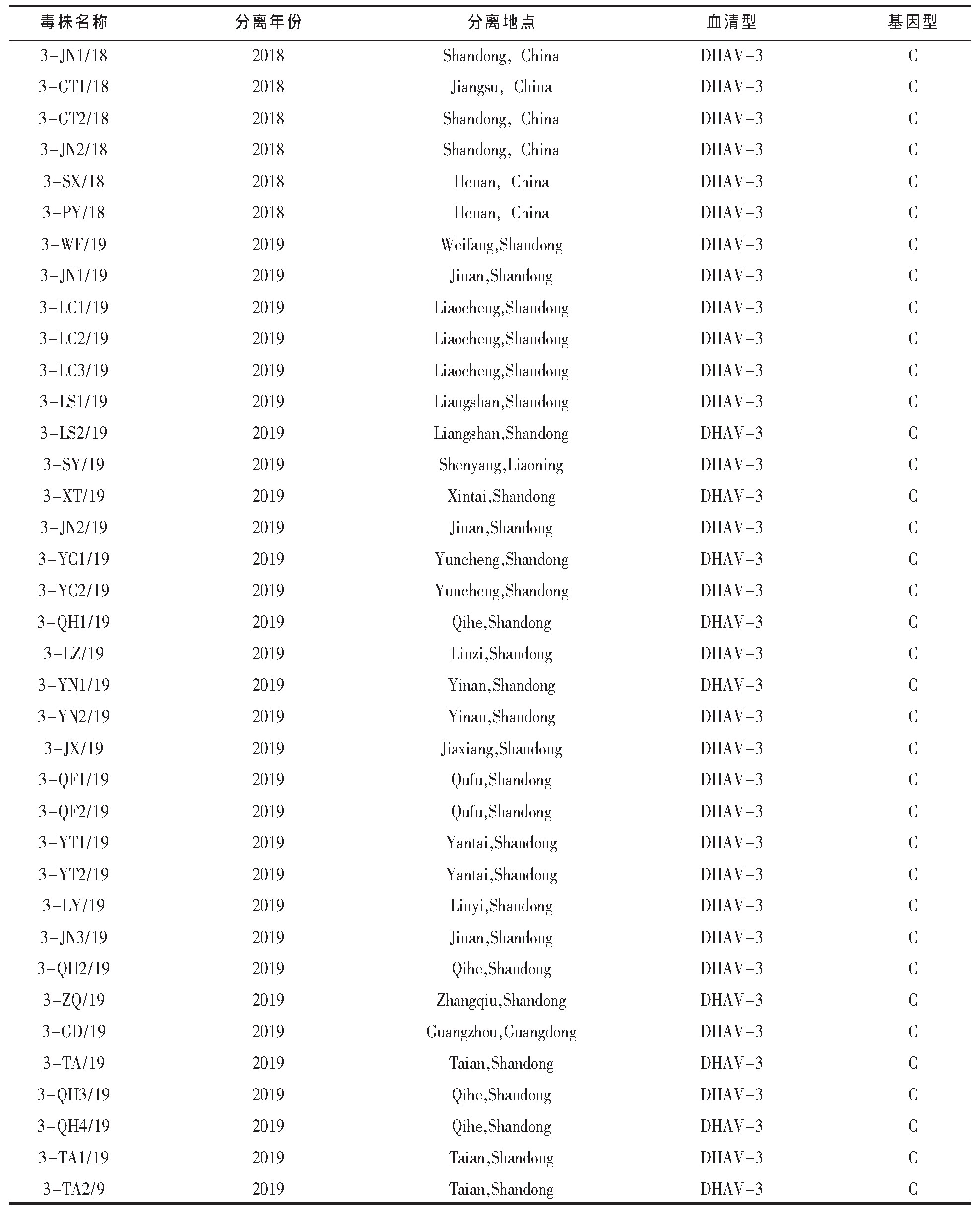
本实验室分离保存的11株DHAV-1,见表1;37株DHAV-3,见表2。1-CL/03和3-FX/08单因子阳性血清由本实验室制备并保存。
表1 收集的DHAV-1毒株背景
1.2、 DHAV VP1基因的扩增
参考Genbank中已发表的DHAV-1和DHAV-3 VP1基因组序列,分别设计一对特异性引物。
DHAV-1:Sense primer:
5'CTCGAGGGTGATTCTAACCAGTT 3',
DHAV-1:Anti-sense primer:
5'GCGGCCGCTTCAATTTCCAGATT 3';
DHAV-3:Sense primer:
5'CTCGAGGGTGATTCCAATCAGCT 3',
DHAV-3:Anti-sense primer:
5'GCGGCCGCTTCAATYTCCARAT 3'。
Trizol方法提取病毒RNA,按常规RT-PCR方法扩增收集DHAV毒株的VP1基因,回收的PCR产物克隆至pMD18-T载体中,双酶切法鉴定阳性重组子,由北京博尚生物有限公司完成测序。
1.3 DHAV VP1蛋白的遗传进化分析
采用MEGA6.0软件对测定的DHAV毒株与Genbank中下载的参考序列(表3)的VP1基因的核苷酸和氨基酸序列进行比较,用Boot-strap法(Replication值为1000)计算遗传距离并绘制N-J进化树,分析当前国内DHAV的流行情况及不同毒株氨基酸的变异程度。
表3 Genbank中下载的DHAV-1和DHAV-3序列
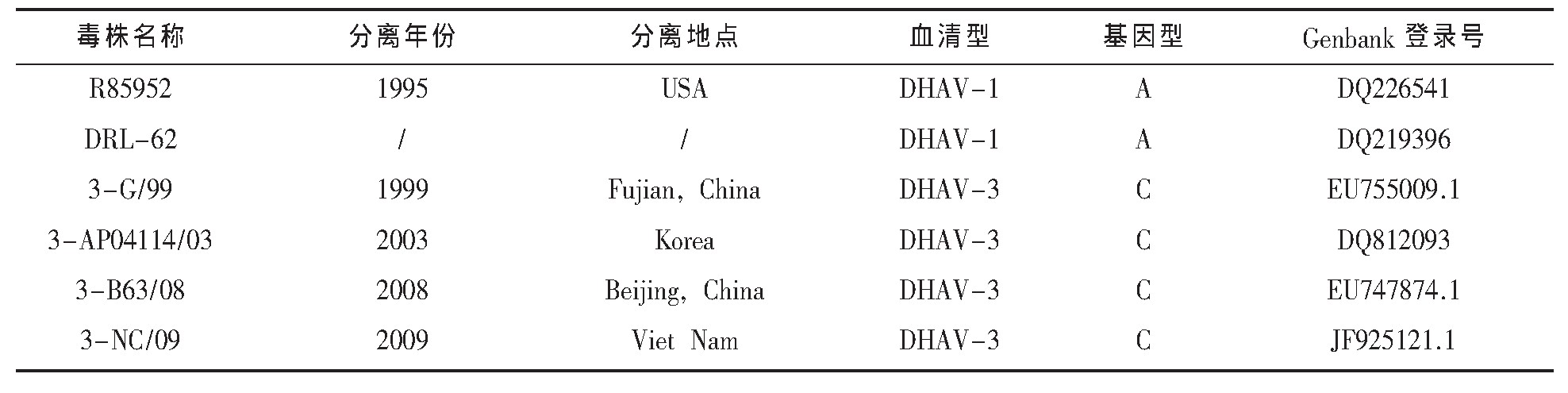
表2 收集的DHAV-3毒株背景
1.4、 血清交叉中和试验
采用固定病毒稀释血清方法进行交叉中和试验。将自制的1-CL/03单因子血清作2倍倍比稀释,分别与等体积的病毒含量为200ELD50/0.1mL的DHAV-1代表毒株1-WF/18和1-LY1/19混合;将自制的3-FX/08单因子血清作2倍倍比稀释,分别与等体积的病毒含量为200ELD50/0.1mL的DHAV-3代表毒株3-JN1/18和3-TA1/19混合,充分作用后分别接种非免鸭胚,37℃温箱培养,记录结果,用Reed和Muench两氏法计算血清中和指数。
2、 结果与分析
2.1、 DHAV VP1基因的序列分析
序列分析发现,近两年分离的DHAV-1毒株之间VP1基因的核苷酸序列相似性为97.7%~99.9%,与早些年分离毒株1-CL/03之间序列相似性仅为93.8%~94.4%。近两年DHAV-3毒株之间VP1基因的核苷酸序列相似性为96.4%~99.7%,与早些年分离毒株3-FX/08之间序列相似性为94.3%~95.6%。DHAV-1和DHAV-3毒株之间VP1存在一些氨基酸变异位点,主要集中在143~147位、171~201位、204~212和217~224位。由于这些氨基酸变异位点的存在导致了DHAV-1和DHAV-3之间抗原性的差异,因此表现出DHAV-1与DHAV-3的交叉反应性很低或无交叉中和反应[3,6]。2018~2019年DHAV-1分离毒与1-CL/03比较,结果发现存在5处氨基酸位点的改变(43位,180位、184位和213位)。2018~2019年DHAV-3分离毒株与3-FX/08代表株比较,主要存在6处氨基酸位点的改变(49位、141位、185位、188位、207位和210位),结合血清中和试验结果,表明这些氨基酸位点的改变并没有影响DHAV-1或DHAV-3之间的中和特性。
2.2 、遗传进化分析
根据绘制的系统发育树可以看出,DHAV-1进化为两个分支1a和1b(图1),1a分支为2013年以前的分离毒株,1b分支为近几年的分离毒,2018~2019年分离毒都分布在该分支上,其中2013年的分离毒1-HA5/13也分布在这个分支上。DHAV-3也进化为2个大分支3a和3b(图2),3b分支为经典的毒株3-AP0411403,3-B63/08和3-NC/09,仅有一株3-JN1/18分离株分布在该分支上;2018~2019年其余36株分离毒株均分布在该分支上。


2.3 、DHAV血清交叉中和试验
分别选用DHAV-1代表毒株1-WF/18和1-LY1/19与已知1-CL/03血清进行中和试验,中和指数均分别为209和256。DHAV-3代表毒株3-GT2/18和3-TA1/19与已知3-FX/08血清进行中和试验,中和指数分别为170和174。结果表明不同分支的毒株之间仍有较好的交叉反应。
3、 讨论
3.1 、DHAV遗传进化分析
本文根据DHAV-1和DHAV-3 VP1基因的遗传进化分析发现,2018年至2019年的DHAV-1毒株全部集中分布在1b分支,处于1a分支的毒株均为2013年的部分毒株及2013年以前的毒株。结果表明,自2013年DHAV-1开始出现不同程度的变异。过去2年内DHAV-3的进化未发生大的变化,2018年至2019年的DHAV-1毒株大部分集中分布在3a分支上,另一分支3b中只有早期分离的3个毒株,韩国的3-AP04114/03、越南的3-NC/09和北京的3-B6308。3a分支的毒株又进一步分化成更小的亚分支,但这些毒株之间无明显的时间和地理分布差异。
3.2、 DHAV-1和DHAV-3的血清学特征
我们选取近两年分离的DHAV-1和DHAV-3代表毒株分别与已知的阳性血清1-CL/03和3-FX/08进行血清交叉中和试验,其主要目的就是分析DHAV遗传多样性对抗原性的影响。结果表明,2018~2019年分离的DHAV-1和DHAV-3的抗原性相对稳定,相同血清型之间仍有很好的交叉保护。
综上所述,2018~2019年间DHAV的遗传性和抗原性相对稳定。目前来看DHAV-3的高进化速率并未造成该血清型病毒抗原性的改变[10,11]。尽管如此,我们还应一如既往地做好DHAV的流行病学监测,防止潜在的遗传变异引发该病的暴发和流行。
参考文献
[1] Woolcock, P R. Diseases of Poultry,11th ed.[M]Iowa State Press, Ames, IA, 2003, pp:343-354.
[2]Fu Yu,Pan Meng,Wang Xiaoyan,et al.Molecular detection and typing of duck hepatitis A virus directly from clinical specimens[J].Vet Microbiol, 2008, 131:247-257.
[3]Tseng C H, Tsai H J. Molecular characterization of a new serotype of duck hepatitis virus[J].Virus Res, 2007,126(2):19-31.
[4] 孙晓军,任建亭,刘金凤,等.一起鸭甲肝病毒1型和3型混合感染的研究报道[J].家禽科学,2014(7):15-18.
[5] Kim MC, Kwon Y K, Joh S J, et al. Molecular analysis of duck hepatitis virus type 1 reveals a nove lineage close to the genus Parechovirus in the family Picornaviridae[J]. J Gen Virol, 2006, 87(Pt11):3307-3316.
[6]Kim M C, Kwon Y K, Joh S J, et al. Recent Koren isolates of duck hepatitis virus revealed the presence of a new geno-and serotype when compared to duck hepatitis virus type 1 type strain[J]. Arch Virol, 2007, 152:2059-2072.
[7]Ding C Y,Zhang D B. Molecular analysis of duck hepatitis virus type 1[J]. Virology, 2007, 361(1):9-17.
[8]Tseng C H, Knowle N J, Tsai H J. Molecular analysis of duck hepatitis virus type 1 indicates that it should be assigned to a new genus[J].Virus Res, 2007,123(2):190-203.
[9]Liu G Q,Wang F,Ni Z,et al.Complete genomic sequence of a Chinese isolate of duck hepatitis virus[J].Virol Sinica, 2007, 22(5):353-359.
[10] Xiuli Ma,Zizhang Sheng,Bing Huang,et al. Molecular Evolution and Genetic Analysis of the Major Capsid Protein VP1 of Duck Hepatitis A Viruses Implications for Antigenic Stability[J]. PLOS ONE.DOI:10.1371/journal.pone.0132982, July 14, 2015.
[11] 马秀丽,黄兵,李玉峰,等.鸭甲型肝炎病毒的遗传和抗原稳定性分析[J].中国动物传染病学报,2018,26(6):48-52.