摘 要: 假病毒是一种人工构建的复制缺陷型病毒样颗粒(virus-like particles,VLPs),具有与活病毒相近的宿主细胞感染能力,且其无法产生具有感染性的子代病毒,因此具有宿主范围广、转染效率高、生物安全性高、定量准确客观等优点,已在病毒的生物学特性、药物筛选、检测方法研究及疫苗评价研究中广泛应用。肠道病毒(enterovirus,EV)感染引起的疾病谱广,重症包括脑炎、脊髓灰质炎、心肌炎等。本文就假病毒在EV的中和抗体检测方法、可视化动物模型建立、抗病毒药物筛选等领域应用的研究进展作一综述。
关键词: 假病毒; 肠道病毒; 中和抗体;
Abstract: Pseudovirus is an artificially constructed replication-defective virus-like particle with similar infectivity to that of live virus,which produces no infectious offspring virus.With the advantages such as a wide host range,high transfection efficiency,high biosafety as well as accurate and objective quantitation,pseudovirus has been applied in the researches on biological characteristics of viruses,drug screening,detection method and the assessment of vaccines.Enterovirus(EV)may cause a wide spectrum of diseases including severe encephalitis,polio and myocarditis.In this paper,the progress in research on application of pseudovirus in the detection method for neutralizing antibody,establishment of visual animal model,screening of drugs and other fields of EV are reviewed.
Keyword: Pseudovirus; Enterovirus(EV); Neutralizing antibody;
肠道病毒(enterovirus,EV)属于小RNA病毒科肠道病毒属,是一类无包膜病毒,包括EV-A~L共12个组,约163种病毒(https://talk.ictvonline.org.)。EV为20~30 nm的二十面体立体对称球形颗粒,由1个裸露在外的病毒蛋白衣壳和内含的一条单股正链RNA构成,引起的重症疾病包括无菌性脑膜炎、脑干脑炎、心肌炎和脊髓灰质炎[1,2,3]等。20世纪上半叶,脊髓灰质炎病毒曾在全球范围内流行,直至疫苗的普及和应用,有效控制了疾病流行。WHO提出了全球消除脊髓灰质炎的倡议和目标[4],使人类进入后脊髓灰质炎时代。自20世纪90年代以来,由EV71、CV-A16等多种EV引起的婴幼儿手足口病(hand-foot-mouth disease,HFMD)在亚太地区出现持续大范围暴发流行,呈现出流行强度高、范围广、重症和死亡人数多的特点[5],引起了人们高度关注。

2015年12月,在国家的重点支撑下,经过8年的联合攻关,由我国自主研发的EV71全病毒灭活疫苗获批上市。上市后我国HFMD死亡病例持续降低,至2018年我国HFMD的死亡病例已较该疫苗上市前(2010—2015年均值)下降了93%(http://www.nhc.gov.cn.),使我国成为全球唯一可以有效防控EV71所致HFMD的国家。而由CV-A16、CV-A6及CV-A10等其他EV[6]引起的HFMD仍呈持续高流行态势,近年来由EV71为核心的多价HFMD疫苗的研发得到越来越多的重视[7]。相关领域的病原学、流行病学、动物模型、检测方法等相关研究均得到了快速发展。
假病毒由于可携带报告基因,且只能进行一个细胞周期的感染,具有生物安全性高、与真病毒特性相近、定量准确客观、研发速度快等优势,已被广泛应用于多种病毒的相关研究中。本文就假病毒在EV中和抗体检测方法、抗病毒药物筛选、可视化动物模型建立等方面的研究进展作一综述。
1 、假病毒的定义
假病毒是一种人工构建的不具有完整基因组的病毒样颗粒(virus-like particles,VLPs),与天然病毒相比,其表达包膜蛋白或衣壳蛋白的序列被删除或被修饰,通常由报告基因代替,使其保持了天然病毒可感染宿主细胞的特性,但又不能扩增、复制,无法产生具有感染性的子代病毒颗粒,因此不会污染环境,生物安全性高,不需要在BSL-3及以上级别实验室进行操作[8]。同时假病毒还可通过携带特定报告基因,如荧光素酶等,利用化学发光,达到对病毒客观、准确定量的目的,也可通过活体成像、定位,直观反映病毒在动物体内的动态转归[9]。近年来已越来越多地应用于病毒进入宿主细胞过程和特异性受体、中和抗体表位、假病毒疫苗、中和抗体滴度检测方法、抗病毒药物筛选、病毒基因治疗、可视化动物模型建立等研究中[10]。另外,假病毒由于其整合衣壳蛋白的能力及较高的转染效率,具有宿主范围广泛、可抵抗血清补体的灭活等作用[10]。
2 、假病毒的构建
病毒的构建是假病毒研究的关键环节。以人EV、乳头瘤病毒(human papilloma virus,HPV)为代表的非包膜病毒[11]通常使用多质粒共转染,或RNA与质粒共转染哺乳动物细胞构建假病毒[4]。多质粒共转染系统是将T7 RNA聚合酶质粒、复制子质粒、衣壳子质粒共转染至敏感细胞,复制子在T7 RNA聚合酶的作用下在细胞内转录。RNA与质粒共转染系统是先将复制子质粒进行体外转录获得RNA,再与衣壳子质粒共转染至敏感细胞获得假病毒。而包膜病毒通常使用人类免疫缺陷病毒(human immunodeficiency virus,HIV)、水泡性口炎病毒(vesicular stomatitis virus,VSV)、鼠白血病病毒(murine leukemia virus,MLV)等商业化载体构建假病毒[12]。
3、 EV假病毒的构建
EV基因组为1条长约7 500 nt的单股正链RNA,包括5′UTR、1个开放阅读框(open reading frame,ORF)和3′Poly(A)尾。ORF编码1个多聚前体蛋白,可进一步水解为P1、P2、P3 3个前体蛋白,P1编码VP1、VP2、VP3、VP4 4个衣壳蛋白,P2、P3编码2A、2B、2C、3A、3B、3C、3D 7个非结构蛋白[14]。
假病毒主要由复制子质粒、衣壳子质粒两部分构成。其中,复制子质粒通常采用T7启动子、EV 5′UTR、荧光素酶报告基因、2A蛋白酶切割序列、EV非结构蛋白P2和P3序列及3′Poly(A)尾构建;衣壳子质粒通常采用增强绿色荧光蛋白(enhanced green fluorescent protein,EGFP)、2A蛋白酶切割序列和EV衣壳蛋白P1序列构建。通过多质粒共转染系统或RNA与质粒共转染系统获得假病毒[14]。近年肠道病毒假病毒的构建情况和应用现状见表1。
表1 已构建的EV假病毒的应用现状
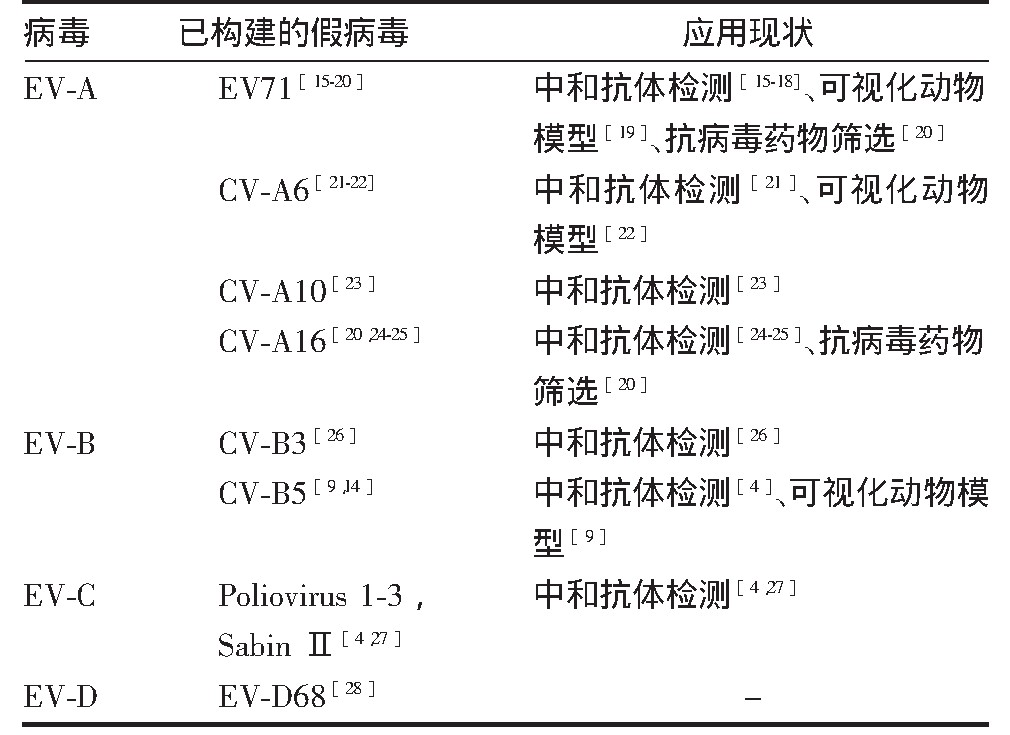
注:Poliovirus 1-3为野毒株,分别为Mahoney、MEF-1和Saukett株;Poliovirus SabinⅡ为2型减毒株;-表示假病毒已成功构建但未经应用。
衣壳蛋白是决定EV特性的核心区域,因此衣壳子质粒需使用目的病毒的衣壳蛋白区基因序列构建,而复制子质粒或复制子RNA通常可由与目的病毒同型或同组病毒的基因组(除衣壳蛋白外)所构建。除CV-B5假病毒外,通常使用与衣壳子同组病毒的复制子(如均为EV-A的EV71复制子与CV-A16衣壳子)共转染可成功获得假病毒;但使用与衣壳子不同组病毒的复制子(如EV71复制子与CV-B3衣壳子、CV-B5复制子与CV-A6衣壳子)均无法成功获得有效的假病毒,可能是由于同一种类的病毒包装机制有共同点或相似点,但不同种病毒的包装机制均不相同[29]。见表2。CHEN等[14]采用多质粒共转染系统与RNA及质粒共转染系统均无法获得以CV-B5基因组为复制子的CV-B5假病毒,最终使用CV-B3复制子构建假病毒,可能是由于CV-B5的基因结构本身不太稳定,而采用报告基因替换P1序列的假病毒构建方式加重了该结构的不稳定性。
表2 EV假病毒的构建

注:*表示使用该复制子质粒或复制子RNA未能成功构建假病毒;-表示未进行相关研究。
4 、假病毒在EV相关研究中的应用
4.1、 中和抗体检测
中和抗体是评价疫苗有效性、人体保护效果等方面的关键指标。因此,经验证的中和抗体方法对疫苗生产的质控和评价十分重要。传统中和抗体检测(conventional neutralization test,c NT)通常采用细胞病变(cytopathic effect,CPE)法或蚀斑减少法进行,即通过中和抗体可特异性抑制目的病毒对细胞的致病变能力,反映抗体对病毒的中和能力,但由于c NT需要人为观察CPE来判定结果,具有主观性强、精确度低、耗时长、操作繁琐[14]及实验室安全级别要求高等问题。为缩短检测周期,近年来,改良的酶联免疫吸附斑点试验(enzyme-linked immunosorbent spot assay)采用包被的HRP标记单克隆抗体,可捕获病毒感染后细胞分泌的蛋白,通过酶联斑点显色的方式反映中和抗体对病毒感染细胞的能力,检测周期短(14 h)[30]、特异性高[31],但仍需使用活病毒,且灵敏度低、线性差[27]。而基于假病毒的中和试验(pseudovirus-based neutralization test,p NT)仅需将一定拷贝数的假病毒与血清样本于37℃,5%CO2条件下中和数小时,随后加入病毒的敏感细胞,孵育10~16 h,经清洗、裂解细胞内假病毒后,加入报告基因底物,经化学发光仪检测即可准确得到假病毒含量。结果以相对光单位(relative light unit,RLU)表示,通过标准曲线的线性方程即可得到中和抗体效价,从而避免了人为观察的主观性,具有客观、准确、快速、安全性高的优势。
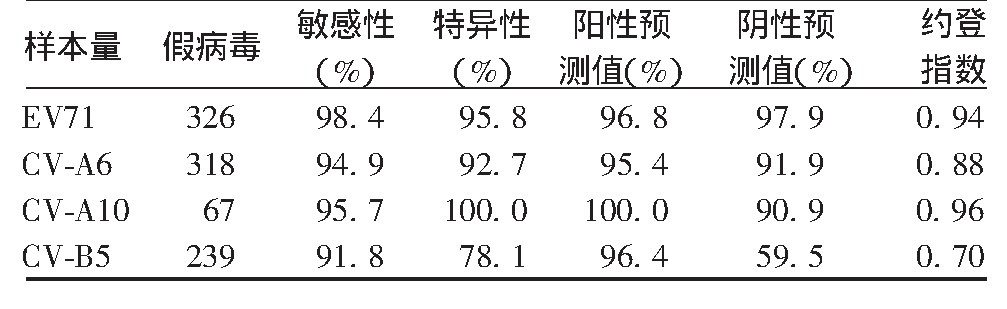
临床样本考核是评价检测方法的有效手段。部分EV p NT的临床样本考核结果[14,15,21,22,23]见表3,可见EV71、CV-A6、CV-A10、CV-B5 4种p NT试验的敏感性均>90%,敏感性较高;EV71、CV-A6、CV-A10的特异性较好,而CV-B5的特异性较低,导致其假阳性率偏高;p NT试验的阳性预测值均>95%;EV71、CV-A6、CV-A10的阴性预测值较高,CV-B5较低;EV71、CV-A6、CV-A10的约登指数较高,CV-B5相对较低。
相关性分析是反映新建检测方法的另一关键指标。作为目前公认的金标准,p NT常以c NT为依据,通过统计学手段进行相关性与一致性分析。已建立的EV71、CV-A6、CV-A10、CV-A16、CV-B3 5种p NT均表现出了与c NT良好的相关性(P均<0.000 1)和较高的一致性[4,14,15,21,23,24,26],见表4。PV p NT的相关性较高(P均<0.01),其一致性分析采用口服脊髓灰质炎疫苗(oral poliomyelitis vaccine,OPV)、野毒株脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine from salk strain,w IPV)、Sabin株脊髓灰质炎灭活疫苗(inactivated poliovirus vaccine from sabin strain,s IPV)的免疫血清进行评价,结果表明,p NT与c NT的检测结果相近,均具有较高一致性。研究还使用PV-2和PV-SabinⅡ的p NT与c NT检测不同疫苗免疫血清中和滴度,结果表明,当采用同一型检测毒株,两种方法具有较高的一致性[27]。提示已建立的EV p NT结果准确,可作为c NT的替代方法用于临床样本的检测和评价[14]。
表3 EV p NT的临床样本考核评价
4.2 、可视化动物模型
动物模型是疾病研究及相关疫苗、药物研发和评价的另一关键工具。由于多数EV可对新生实验动物具有一定致病能力,但对成年实验动物不敏感,因此多数EV动物模型只能采用新生动物模型建立,如EV71、CV-A16等乳鼠模型。但由于新生动物免疫系统发育不完全,在疫苗保护效果等研究中只能通过免疫母体,通过母传抗体保护新生动物的能力间接进行保护效果评价。而假病毒由于可带有发光报告基因,同时又具有活病毒相应的感染能力和特性,可用于建立直观、且可动态观察的可视化动物感染模型建立,并可通过活体成像技术检测报告基因的RLU值,定量反映病毒在动物体内特定部位的相对含量。同时,由于不需要观察动物发病或死亡情况,从而避免了只能采用乳鼠间接评价保护效果的局限性,通过活体成像技术直接检测成年小鼠的感染情况,直接反映疫苗对病毒感染的保护效果。
ZHOU等[19]采用导入h SCARB2基因的C57BL/6小鼠建立了EV71报告基因假病毒的可视化感染模型,通过将灭活病毒疫苗注射至动物体内,随后采用一定剂量假病毒对实验动物进行攻击,评价疫苗主动免疫的保护效果,结果显示,灭活病毒疫苗的平均保护率为88%。以BALB/c小鼠建立的CV-B5假病毒可视化感染模型[9]与CV-A6假病毒可视化感染模型[22]也已成功构建,并证实了灭活病毒疫苗的免疫保护效果,为CV-A6、CV-B5疫苗研发提供了有效的研究工具。
表4 EV c NT与p NT的比较分析
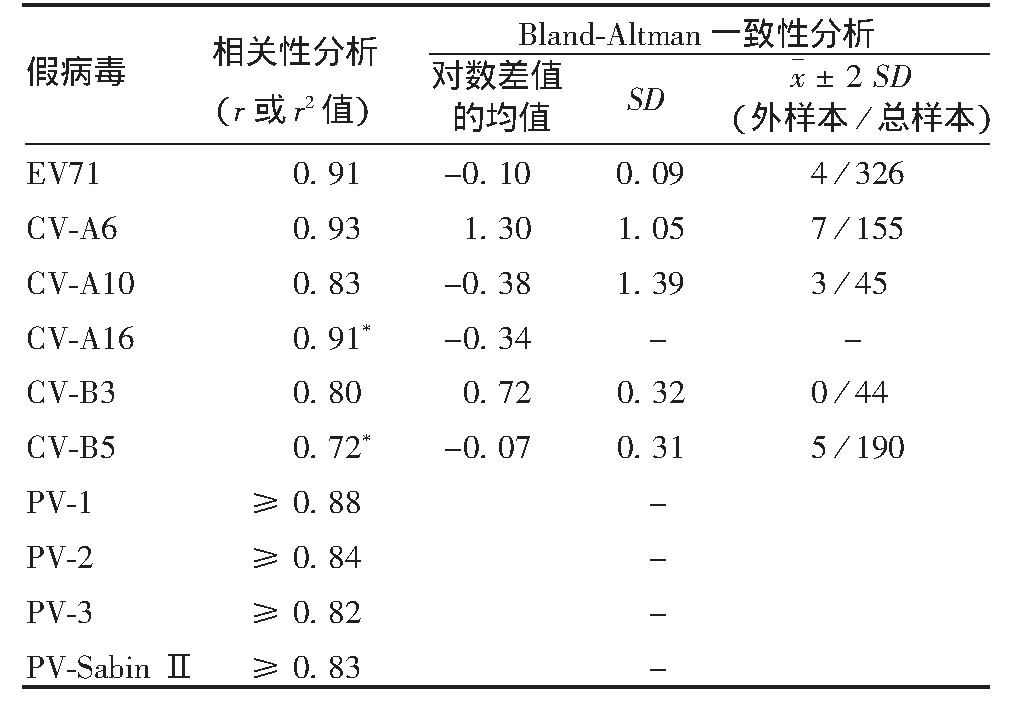
注:-表示未进行Bland-Altman一致性分析;*表示r2值。
4.3、 抗病毒药物筛选
与中和抗体检测的方法相近,传统的抗病毒药物筛选也往往以活细胞为载体,即通过观察病毒在活细胞上引起的CPE评价药物的抗病毒作用[32]。除具有与c NT方法相同的缺点和问题外,还难以区分因药物本身可能对细胞存在毒性的问题。包含报告基因的假病毒可有效避免以上问题,实现快速、高通量地检测病毒感染情况,从而准确反映药物对病毒的抑制能力。但由于假病毒的报告基因在病毒粒子包装之前已经表达,对作用于病毒转录后的药物难以进行评价,使假病毒在抗病毒药物筛选中的应用存在一定局限性[32]。
SU等[21]使用EV71和CV-A16的假病毒及感染性克隆建立了药物筛选方法,并应用该方法对400种天然化合物库进行抗EV71和CV-A16药物的初筛,发现了44种化合物可抑制报告基因的表达,经活细胞法复筛确认,证明木犀草素、高良姜素和榭皮素3种化合物可有效抑制EV71和CV-A16对活细胞的感染。
5 、小结及展望
目前已建立了EV71、CV-A6,10,16、CV-B3,5、PV-1~3,SabinⅡ等7种EV的p NT法及EV71、CV-A6、CV-B5可视化动物模型,EV71和CV-A16假病毒已在药物筛选中初步应用,显示了良好的应用效果和前景,但仍存在检测病原单一、方法标准化、替代野毒株c NT法的验证等问题。应充分利用可人工构建的优势,进一步开展高通量多通道p NT方法研究,加强p NT与c NT法的比较,完善方法验证和转换的依据,为EV的疫苗评价和药物筛选提供工具。
参考文献
[1]ASWATHYRAJ S,ARUNKUMAR G,ALIDJINOU E K,et al.Hand,foot and mouth disease(HFMD):emerging epidemiology and the need for a vaccine strategy[J].Med Microbiol Immunol,2016,205(5):397-407.
[2]TSUNO K,MIYATAKE C,NISHIJIMA H,et al.Coxsackievirus B5 aseptic meningitis in infants in Chiba Prefecture,Japan,in2016[J].J Nippon Med Sch,2018,85(3):187-190.
[3]LIU S H,SONG D M,BAI H,et al.A safe and reliable neutralization assay based on pseudovirus to measure neutralizing antibody titer against poliovirus[J].J Med Virol,2017,89(12):2075-2083.
[4]刘桂秀.脊髓灰质炎假病毒的构建及其在中和抗体检测方法中的应用研究[D].北京:中国食品药品检定研究院,2017.
[5]BIAN L L,GAO F,MAO Q Y,et al.Hand,foot,and mouth disease associated with coxsackievirus A10:more serious than it seems[J].Expert Rev Anti Infect Ther,2019,17 (4):233-242.
[6]FU X M,WAN Z Z,LI Y P,et al.National epidemiology and evolutionary history of four hand,foot and mouth diseaserelated enteroviruses in China from 2008 to 2016[J].Virol Sin,2020,35(1):21-33.
[7]ZHANG W,DAI W L,ZHANG C,et al.A virus-like particle-based tetravalent vaccine for hand,foot,and mouth disease elicits broad and balanced protective immunity[J].Emerg Microbes Infect,2018,7(1):94.
[8]TIAN Y B,ZHAO H,LIU Q,et al.Development of in vitro and in vivo neutralization assays based on the pseudotyped H7N9 virus[J].Sci Rep,2018,8(1):8484.
[9]郝晓甜.柯萨奇病毒B组5型野生型及假病毒小鼠模型的建立和初步应用[D].北京:中国食品药品检定研究院,2017.
[10]DONG Z Z,GAO X J,YU L.Advances in application of pseudovirus[J].Prog Microbiol Immuno,2014,42(2):59-64.(in Chinese)董占柱,高雪军,余黎.假病毒的应用研究进展[J].微生物学免疫学进展,2014,42(2):59-64.
[11]NIE J H,LIU Y Y,HUANG W J,et al.Development of a triple-color pseudovirion-based assay to detect neutralizing antibodies against human papillomavirus[J].Viruses,2016,8(4):107.
[12]LI Q Q,LIU Q,HUANG W J,et al.Current status on the development of pseudoviruses for enveloped viruses[J].Rev Med Virol,2018,28(1):10.
[13]NOISUMDAENG P,SANGSIRIWUT K,PRASERTSOPON J,et al.Complete genome analysis demonstrates multiple introductions of enterovirus 71 and coxsackievirus A16 recombinant strains into Thailand during the past decade[J].Emerg Microbes Infect,2018,7(1):214.
[14]CHEN P,WU X,SU Y,et al.Development of a pseudovirus based assay for measuring neutralizing antibodies against coxsackievirus B5[J].J Virol Methods,2017,246:21-26.
[15]WU X,MAO Q Y,YAO X,et al.Development and evaluation of a pseudovirus-luciferase assay for rapid and quantitative detection of neutralizing antibodies against enterovirus 71[J].PLo S One,2013,8(6):e64116.doi:10.1371/journal.pone.0064116.
[16]ZHANG H F,AN D,LIU W,et al.Analysis of cross-reactive neutralizing antibodies in human HFMD serum with an EV71pseudovirus-based assay[J].PLo S One,2014,9 (6):e100545.doi:10.1371/journal.pone.0100545.
[17]ZHAO D,SUN B,JIANG H,et al.Enterovirus 71 virus-like particles produced from insect cells and purified by multistep chromatography elicit strong humoral immune responses in mice[J].J Appl Microbiol,2015,119(4):1196-1205.
[18]SUN S Y,JIANG L P,LIANG Z L,et al.Evaluation of monovalent and bivalent vaccines against lethal Enterovirus 71and Coxsackievirus A16 infection in newborn mice[J].Hum Vaccin Immunother,2014,10(10):2885-2895.
[19]ZHOU S Y,LIU Q,WU X,et al.A safe and sensitive enterovirus A71 infection model based on human SCARB2 knockin mice[J].Vaccine,2016,34(24):2729-2736.
[20]XU L,SU W H,JIN J,et al.Identification of luteolin as enterovirus 71 and coxsackievirus A16 inhibitors through reporter viruses and cell viability-based screening[J].Viruses,2014,6(7):2778-2795.
[21]SU Y,CHEN P,GAO F,et al.A surrogate assay for measuring Coxsackievirus A6 neutralizing antibodies[J].Hum Vaccin Immunother,2018,14(12):3034-3040.
[22]WU X,SU Y,DONG F Y,et al.Establishment of bioluminescent imaging mouse model for coxsackievirus A6 vaccine using the pseudovirus system[J].Chin J Viral Dis,2018,8 (6):515-520.(in Chinese)吴星,苏瑶,董方玉,等.柯萨奇病毒A组6型报告基因假病毒可视化感染模型的建立[J].中国病毒病杂志,2018,8(6):515-520.
[23]LI K L,DONG F Y,CUI B P,et al.Development of a pseudovirus-based assay for measuring neutralizing antibodies against Coxsackievirus A10[J].Hum Vaccin Immunother,2020,16(6):1434-1440.
[24]HAO X T,CHEN P,MAO Q Y,et al.Establishment and preliminary application of a pseudovirus luciferase assay for quantitative detection of coxsackievirus A16 neutralizing antibody[J].Chin J Viral Dis,2016,6(1):6-11.(in Chinese)郝晓甜,陈盼,毛群颖,等.柯萨奇病毒A组16型中和抗体假病毒荧光定量检测方法的建立及初步应用[J].中国病毒病杂志,2016,6(1):6-11
[25]JIN J,MA H X,XU L,et al.Development of a Coxsackievirus A16 neutralization assay based on pseudoviruses for measurement of neutralizing antibody titer in human serum[J].J Virol Methods,2013,187(2):362-367.
[26]CHEN P,WU X,MAO Q Y,et al.A rapid and quantitative assay for measuring neutralizing antibodies of Coxsackievirus B3[J].J Virol Methods,2016,232:1-7.
[27]JIANG Z,LIU G X,LIAO G Y,et al.A simple and safe antibody neutralization assay based on polio pseudoviruses[J].Hum Vaccin Immunother,2019,15(2):349-357
[28]DONG F Y,CUI B P,LI K L,et al.Construction of enterovirus D68 pseudovirus[J].Prog Microbiol Immuno,2019,47(6):8-14.(in Chinese)董方玉,崔博沛,李克雷,等.肠道病毒D组68型假病毒的构建[J].微生物学免疫学进展,2019,47(6):8-14.
[29]WU X,DONG F Y,SU Y,et al.Establishment and application of a surrogate neutralizing antibody detection platform based on HFMD pseudovirus[J].Chin J Viral Dis,2018,8(6):439-444.(in Chinese)吴星,董方玉,苏瑶,等.手足口病假病毒中和抗体检测平台的建立和初步应用[J].中国病毒病杂志,2018,8(6):439-444
[30]LIU D X,XU L F,ZHU R,et al.Development of an efficient neutralization assay for Coxsackievirus A10[J].Appl Microbiol Biotechnol,2019,103(4):1931-1938.
[31]HOU W H,YANG L S,HE D L,et al.Development of a coxsackievirus A16 neutralization test based on the enzymelinked immunospot assay[J].J Virol Methods,2015(215-216):56-60.
[32]WANG P,ZHANG G H,ZHENG Y T.Antiviral drug screening based on pseudoviruses:research advances[J].J Int Pharm Res,2015,42(3):316-322.(in Chinese)王萍,张高红,郑永唐.基于假病毒筛选抗病毒药物的研究进展[J].国际药学研究杂志,2015,42(3):316-322.
新冠病毒精准检测是加强疫情防控的重要手段。因此,有必要持续开展新冠病毒检测标准物质研究,完善新冠病毒精准测量系统,以更好地为我国新冠疫情防控提供全面的计量技术支撑。...
在人们的肠道中,病毒的实际数量明显多于细菌,它能够控制好肠道菌群的平衡,甚至起到益生作用。在日常生活中,人们时时刻刻都会接触到病毒,病毒在协助生命的维系的同时,也会带来各种疾...