摘 要: 外泌体(exosomes)是一种活细胞分泌的囊性小泡,能携带脂质、蛋白质和遗传物质,在体内进行生物信息传输。外泌体中独特的组织或细胞特异性蛋白质和遗传物质,可反映其细胞来源和细胞的生理状态,因此不同细胞来源的外泌体有不同的特点和功能。基于其内源性、生物相容性和多功能特性,外泌体有望成为药物递送系统、免疫治疗、精准治疗的新手段。本综述聚焦近年来报道的不同细胞分泌的外泌体的特点及功能化研究成果,对其进行归纳总结。
关键词: 外泌体; 细胞来源; 药物递送载体; 疾病治疗;
Abstract: Exosomes,cystic vesicles secreted by living cells,carry lipids,proteins and genetic materials,and transmits biological informations in the body. The unique tissue or cell-specific proteins and genetic materials in the exosomes generally reflect the cell origin and the physiological state of cells,so the exosomes from different cell sources appear to have different characteristics and functions. In view of the endogenous character,biocompatibility and functional versatility,the exosomes are expected to be a new means for the drug delivery systems,immunotherapies,and precision treatment. This review summarizes the exosomes secreted by different cells,focusing on the research achievement in their characteristics and functionalization studies in recent years.
Keyword: exosomes; cell sources; drug delivery vehicles; disease treatment;
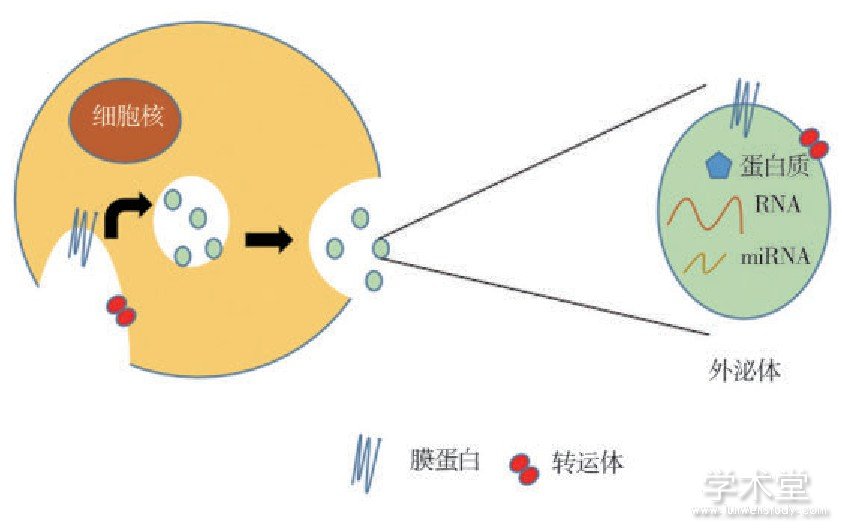
外泌体(exosomes)是活细胞吞噬异源物质后以出芽方式向内凹陷形成含有多个小泡的多泡体(multivesicular body,MVB),再由多泡体与细胞膜融合而释放的小囊泡(图1)。是一种直径约为30~100 nm的细胞外囊性小泡,1987年首次在成熟的哺乳动物网织红细胞中发现。其可由间充质干细胞、肿瘤细胞、巨噬细胞、树突状细胞(dendritic cells,DC)、肥大细胞、人羊膜上皮细胞、内皮祖细胞等不同类型的细胞释放,且广泛分布于各种体液中,如唾液、腹水、心包积液、尿液、羊水、乳汁、脑脊液和血液等[1,2,3]。外泌体以往曾被认为是细胞分泌的垃圾,但随着研究的深入,发现其在细胞间通讯和细胞免疫应答中发挥重要作用。外泌体中携带脂质、蛋白质和遗传物质,其中蛋白质和遗传物质是其发挥生物学功能的有效成分。外泌体还携带多种分子成分参与细胞通讯、细胞迁移、血管新生和肿瘤细胞生长等生理和病理过程。据报道,外泌体分泌的微小RNA(miRNA)在肺癌、结肠直肠癌、前列腺癌等中可作为癌症早期诊断及预后的生物标志物[4,5,6]。
图1 细胞分泌外泌体的过程
纳米药物载体的研究已经取得了一定成绩,外源性载体目前研究较多的有脂质体、纳米粒、微球等[7,8,9]。外源性载体在体外的物理化学性质稳定,但进入体内后,在血液循环中很快被网状内皮系统(reticuloendothelial system,RES)识别和清除,而且由于调理素、抗体等作用,有些载体易发生破裂,使包封药物快速渗漏,从而影响稳定性及其在特定病灶部位的累积,极大地降低了外源性载体的靶向性[10,11]。外泌体具有脂质双层结构,可通过电穿孔[12]、共孵育[13]、超声处理[14]、超滤离心处理[15],以及挤出和冻融循环[16]等技术将药物载入外泌体中,也可通过转染技术将miRNA递送进特定的细胞,使其分泌小RNA外泌体。外泌体膜表面有各种蛋白分子,可通过细胞间信号转导接触远端受体细胞,也通过定位于靶组织的能力选择性进入靶细胞,如胶质母细胞瘤分泌的外泌体膜表面含有小窝蛋白-1(caveolin-1),其通过抑制细胞外调节蛋白激酶1/2(extracellular regulated protein kinases1/2,ERK1/2)的激活负调控外泌体的内化[17]。作为内源性载体,与外源性纳米载体相比,外泌体具有更低的免疫原性,可避免RES的吞噬,更有效地穿过许多药物难以穿透的血脑屏障[18,19]。目前外泌体载体的研究进展还处于实验室和临床试验阶段。不同组织细胞分泌的外泌体携带不同的生物学组分,赋予外泌体独特的生物学作用。基于其内源性、生物相容性和多功能特性,外泌体有望成为药物递送系统、免疫治疗和精准治疗的新手段。
根据其来源的细胞类型和分化状态,作为一种新的和更复杂的细胞间通讯形式,外泌体在不同的生理和病理过程中发挥作用。虽然科研人员正积极地对外泌体进行不同侧重点的研究,但目前的研究还不够系统,对不同细胞分泌的外泌体的认识还不全面,此前尚无针对此方面内容的概括和总结。本文聚焦近年来报道的不同细胞分泌的外泌体的特点及功能化研究所取得的成果,对其进行归纳和介绍。
1、 间充质干细胞来源的外泌体
间充质干细胞(mensenchymal stem cells,MSC)是一种来源于中胚层的细胞,具有自我更新及多向分化能力[19]。近年来,由于其具有再生能力以及免疫抑制特性[21,22,23,24],推动了MSC应用于多种疾病治疗的临床试验[25,26,27,28,29,30]。而且MSC能从多种组织中分离得到,常见的MSC一般是从骨髓、脂肪、脐带、脐血等组织提取,并具有很好的离体增殖能力,因此极大地推动了其应用[31]。在许多动物模型中可观察到MSC的旁分泌作用,相关研究证明,MSC是通过分泌因子来发挥其治疗作用以减少细胞损伤和增强修复的,这种分泌因子是被称为外泌体的膜囊泡。
MSC作为外泌体的来源具有两个显着的特征,即免疫调节特性和低生产成本。MSC的免疫调节作用是其独特能力,且初步数据表明,MSC的一些免疫调节特性能转移到它们的外泌体中。MSC来源的外泌体可调控固有免疫与适应性免疫应答,通过抑制T淋巴细胞功能,降低B细胞活化、增殖与分泌,影响巨噬细胞分化与树突状细胞成熟,抑制自然杀伤细胞的细胞毒活性来发挥其免疫调控作用,从而提高MSC外泌体衍生药物递送载体的寿命和药物的生物利用度[32]。而且,越来越多的证据显示MSC相比其他细胞能产生大量的外泌体[33]。通过测量外泌体相关蛋白CD81的量来评估不同细胞系中外泌体的水平,发现MSC外泌体的产量最高,所以用MSC产生外泌体能降低外泌体的生产成本[34]。
MSC外泌体作为一种天然的药物递送载体已用于多种疾病的治疗研究。MSC外泌体能携带包括核酸、蛋白质和脂质的复杂物质,可发挥其作为细胞间穿梭物质的许多功能。它在效应细胞内装载“货物”,然后将其穿过靶细胞的质膜到达正确的位置来发挥功能性作用。如Braun等[35]研究了大鼠腹腔注射MSC外泌体预防实验性支气管肺发育不良。研究证明MSC外泌体具有抗炎和促血管生成机制,以保护肺免受与支气管发育不良相关和高氧诱导的肺部和心脏疾病。Toh等[36]研究了MSC外泌体减轻大鼠颞下颌关节骨关节炎模型的疼痛和退变。研究结果表明,在颞下颌关节骨关节炎动物模型中,MSC外泌体具有减轻关节疼痛和逆转退化的作用,该研究为未来人骨髓MSC外泌体作为颞下颌关节骨关节炎的一种无细胞治疗提供了基础。Chew等[37]研究结果首次证明了MSC外泌体可能通过增加牙周韧带(periodontal ligament,PODL)迁移和增殖来增强牙周再生。该研究同时表明,MSC外泌体是一种可行的即用型和无细胞MSC治疗方法,可用于治疗牙周缺损。
2、 肿瘤细胞来源的外泌体
肿瘤细胞分泌的外泌体在肿瘤的生长、转移和免疫调节过程起着重要作用。外泌体可携带用于白三烯(leukotriene,LT)生物合成的酶,Lukic等[38]首次探索了外泌体携带LT在非小细胞肺癌中的作用,结果表明,外泌体将外源性LTC4转化为LTD4促进了肿瘤的迁移和存活,突出了外泌体通过LT对肿瘤的生长促进作用。Sanderson等[39]发现黑素瘤细胞分泌的外泌体能够为肿瘤转移创造微环境,增强黑色素瘤细胞的迁移能力。肿瘤细胞表面的细胞程序性死亡配体1(programmed cell death 1 ligand 1,PD-L1)结合效应T细胞上的程序性死亡受体1(programmed cell death receptor 1,PD-1)可抑制T细胞活性,从而引发免疫逃逸。理论上通过PD-L1抗体阻断该过程以激活肿瘤免疫应答,但是对于诸如前列腺癌细胞,它对肿瘤细胞免疫疗法的反应非常小。最近的研究发现,肿瘤来源的外泌体上的PD-L1也参与了免疫逃逸。外泌体PD-L1将成为一种新的免疫治疗靶点[40]。
肿瘤细胞分泌大量的外泌体,且其外泌体可从体液中分离得到,如腹水、唾液等,其内含物包含能反映供体细胞状态的物质,因此外泌体可能作为肿瘤诊断的生物标志物。Sakaue等[41]发现表面黏附分子CD133在来自晚期胰腺癌患者腹水外泌体中表达。在检查的癌干细胞相关蛋白中,与胃癌患者和失代偿期肝硬化患者腹水中的外泌体相比,CD133主要在胰腺癌患者腹水的外泌体中表达。因此外泌体CD133作为患者化学抗性和预后的潜在生物标志物的研究还有待进一步开展。Zlotogorski等[42]比较了从癌症患者唾液中分离的外泌体与健康个体的外泌体。结果显示,从口腔癌患者的唾液中分离的外泌体与健康个体唾液中外泌体的浓度、分布和大小均有不同,应进一步探索这些差异用于诊断和治疗的可能。
3、 巨噬细胞来源的外泌体
巨噬细胞(macrophage)是骨髓免疫细胞,分布在机体的各个脏器和组织中,参与非特异性免疫和特异性免疫。巨噬细胞具有异质性,不同器官组织的巨噬细胞在功能和表型上存在差异,推测不同来源的巨噬细胞分泌的外泌体在细胞通信间也发挥着不同功能。Wang等[43]证明活化的巨噬细胞分泌mir-155富集的外泌体,巨噬细胞衍生的mir-155是成纤维细胞增殖和炎症的旁分泌调节剂。Zheng等[44]发现,脂多糖刺激的巨噬细胞RAW264.7细胞系分泌的外泌体可通过增强小胶质细胞抗炎M2表型极化,诱导缺血性中风后神经保护功能。Osada-Oka等[45]发现血清来源巨噬细胞的外泌体在高血压条件下,增加内皮细胞中细胞内黏附分子-1(intracellular adhesion molecule-1,ICAM1)和纤溶酶原激活物抑制剂-1(plasminogen activator-1,PAI-1)的蛋白水平。
4、树突状细胞来源的外泌体
作为免疫系统的前哨抗原呈递细胞,树突状细胞在启动抗原特异性免疫和耐受中发挥重要作用。树突状细胞衍生的外泌体(DC-derived exosomes,Dex)是纳米尺寸的膜囊泡[46]。与树突状细胞类似,Dex表面表达的分子组成包括功能性MHC-肽复合物、共刺激分子(CD80、CD86、CD40)以及细胞相互作用的其他组分。Dex具有免疫刺激功能,与基于树突状细胞的免疫疗法相比具有显着优势。Dex是针对多种人类癌症的基于树突状细胞免疫疗法的有力候选者。Dex免疫疗法已进入临床试验阶段,并有望形成一类新的癌症免疫疗法疫苗。Lu等[47]研究了3种不同肝细胞癌(hepatocellular carcinoma,HCC)小鼠模型中表达HCC抗原的Dex,证明富含甲胎蛋白(α-fetoprotein)的Dex可触发有效的抗原特异性抗肿瘤免疫应答,并重塑HCC小鼠中的肿瘤微环境,从而为HCC免疫疗法提供无细胞疫苗选择。Li等[48]用人外周血来源的树突状细胞装载有携带甲胎蛋白基因的重组腺相关病毒载体,分离纯化得到的Dex能有效刺激T细胞增殖,并诱导T细胞活化成为抗原特异性细胞毒性T淋巴细胞,从而表现出抗HCC的抗肿瘤免疫应答。
5 、肥大细胞来源的外泌体
肥大细胞(mast cell)来源于骨髓造血干细胞[49],广泛分布于皮肤及内脏黏膜下的微血管周围,分泌多种细胞因子参与免疫调节。Dimitris等[50]报道了肥大细胞与免疫系统其他细胞通讯的新机制,该机制是基于肥大细胞释放被称为外泌体的膜囊泡,具有特异性和非特异性免疫刺激活性。Xie等[51]研究发现,肥大细胞外泌体可通过IgE受体与游离过敏原特异性IgE结合,因此肥大细胞外泌体具有抗IgE作用,可降低IgE水平并抑制肥大细胞活化从而抑制变态反应,使得肥大细胞外泌体有可能被开发为新型抗IgE剂。殷亚男[52]研究了肥大细胞外泌体对骨髓MSC迁移能力的影响,肥大细胞外泌体能促进MSC向炎症部位迁移,协助MSC在过敏性哮喘中的治疗作用。
6 、其他细胞来源的外泌体
除上述几种细胞分泌的外泌体外,还有许多其他细胞来源的外泌体,如人羊膜上皮细胞、内皮祖细胞等。外泌体携带着大量的蛋白质和核酸,这些物质反映了它们的细胞来源和细胞来源的病理生理状态,可作为生物标志物来诊断、预测疾病。这些细胞分泌的外泌体也已被用于疾病的治疗研究。Hadley等[53]研究了羊膜上皮细胞衍生的外泌体诱导子宫内膜细胞的炎性变化。这种外泌体介导的信号转导是胎儿和母体交流的新机制,可通过增加母体妊娠组织细胞的炎症反应来发出分娩信号。Kong等[54]研究发现来自内皮祖细胞的外泌体可抑制大鼠颈动脉损伤后的新内膜增生,外泌体的保护作用可通过促进内皮细胞修复而不是直接抑制平滑肌细胞的增殖和迁移来表现。
然而,病毒感染的细胞也会使用外泌体作为传播疾病的载体,许多致病病毒利用外泌体途径有效地将生物活性成分从感染细胞转移。Reyes-Ruiz等[55]的研究结果表明,来自登革热病毒感染细胞的外泌体比未感染细胞分泌的外泌体大,含有病毒样颗粒,它们能感染白纹伊蚊(C6/36)细胞,表明外泌体在病毒传播中发挥作用。
7 、体液来源的外泌体
外泌体在体液中普遍存在(如心包积液、尿液、羊水、乳汁、脑脊液、血液等),且可用作疾病的生物标志物和治疗剂。Let-7 miRNA家族是生物体内最早发现的miRNA之一,在细胞周期调节、细胞增殖、感染等病理生理过程中发挥着重要作用。Beltrami等[56]通过研究let-7 miRNA家族miR-let-7b-5p提供了分子证据,即miR-let-7b-5p在心包积液来源的外泌体中以高水平存在。结果显示,与外周血浆相比,心包积液含有富含miRNA的外泌体,这些miR-NA在患者的心肌和脉管中共表达;在功能水平上,心包积液外泌体改善了培养的内皮细胞(endothelial cells,EC)的存活和增殖,并恢复了其内源miRNA耗尽(通过Dicer沉默)的EC的血管生成能力;此外,心包积液外泌体改善了小鼠的缺血后血流恢复和血管生成。Sahoo等[57]证明miR-let-7b-5p部分介导心包积液外泌体的血管生成潜力,这支持了心包积液外泌体可能具有治疗血管疾病的治疗潜力。Lv等[58]研究了基于尿液外泌体的肾间充质纤维化(renal interstitial fibrosis,RIF)的液体活检生物标志物。RIF很难诊断,但在RIF患者中可观察到不同程度的尿液外泌体衍生的上皮间充质转换标志物。特别是,外泌体miR-29c具有高稳定性和高诊断价值,值得进一步研究。Parchem等[59]探讨了羊水外泌体在双输血综合征(twin transfusion syndrome,TTTS)中的诊断和预后潜力。TTTS与严重缺乏羊水外泌体有关,可能导致胎膜修复和完整性差,并最终导致激光手术后的主要临床后遗症。羊水外泌体可能携带反映妊娠和胎儿健康的重要信息,因此是诊断和研究妊娠并发症的有潜力工具。
Hock等[60]发现源自小鼠乳汁的外泌体促进肠上皮细胞活性,增强增殖并刺激肠干细胞活性。这些发现进一步加深了对母乳在肠道中作用机制的理解。当母乳不耐受时,外泌体给药对于有发生坏死性小肠结肠炎风险的婴儿是有效的预防措施。Spaull等[61]首次报道了早产儿出血性脑积水中脑脊液外泌体的特征。未改变的脑脊液的纳米颗粒跟踪分析(nanoparticle tracking analysis,NTA)揭示了细胞外囊泡(extracellular vesicles)的异质性和动态群体。通过差异超速离心分离患儿外泌体大小的细胞外囊泡,并用透射电镜图像证实存在CD63+和CD81+外泌体,且在外泌体中检测到mi-RNA(miR),miR-9、miR-17、miR-26a、miR-124和miR-1911。结果表明,外泌体出现在出血后脑积水的早产儿脑脊液中。Qu等[62]发现采用负载多巴胺的血液外泌体靶向大脑可更好地治疗帕金森病。这一发现证明,血液外泌体是用于针对帕金森病的脑靶向治疗的动力载体,也可能用于治疗中枢神经系统的其他疾病。
8、 结语
外泌体具有独特的组织或细胞特异性蛋白质和遗传物质,可反映其细胞来源和细胞的生理状态,因此不同细胞的外泌体具有不同的特点和功能。探索不同细胞来源的外泌体的特点和功能有助于不同疾病的研究。除此之外,外泌体具有理想药物载体的许多特征。与一般外源性纳米载体相比,由于其内源性来源和表面功能性分子,在治疗神经退行性疾病方面显示出优越的治疗效果。目前在选择外泌体装载药物治疗癌症方面已取得了一些进展,但如选择肿瘤源性外泌体治疗,则有必要考虑其促进肿瘤生长的潜在风险。目前,外泌体的治疗研究还处于动物实验阶段,需要进一步的临床试验。其作为有前途的药物递送载体的使用高度依赖于可靠的细胞来源。在已知分泌外泌体的细胞类型中,人MSC是最有希望的细胞来源,但如何有效地分离和纯化外泌体仍然是一个巨大的挑战。需要开发大规模生产质量可控和快速纯化外泌体的技术平台。此外,将治疗剂引入外泌体靶向病变部位可能是未来医学诊断和治疗的重要手段。
参考文献
[1]Yang Q,Diamond MP,Hendy A. The emerging role of extracellular vesicle-derived miRNAs:implication in cancer progression and stem cell related diseases[J]. J Clin Epigenet,2016,2(1):13.
[2]Samanta S,Rajasingh S,Drosos N,et al. Exosomes:new molecular targets of diseases[J]. Acta Pharmacol Sin,2018,39(4):501-513.
[3]Colombo M,Raposo G,Théry C. Biogenesis,secretion,and intercellular interactions of exosomes and other extracellular vesicles[J]. Annu Rev Cell Dev Biol,2014,30:255-289.
[4]Sempere LF,Keto J,Fabbri M. Exosomal microRNAs in breast cancer towards diagnostic and therapeutic applications[J]. Cancers(Basel),2017,9(7):e71.
[5]Cheng L,Wu S,Zhang K,et al. A comprehensive overview of exosomes in ovarian cancer:emerging biomarkers and therapeutic strategies[J]. J Ovarian Res,2017,10(1):73.
[6]Liu Q,Yu Z,Yuan S,et al. Circulating exosomal microRNAs as prognostic biomarkers for non-small-cell lung cancer[J]. Oncotarget,2017,8(8):13048-13058.
[7]Jhaveri A,Deshpande P,Pattni B,et al. Transferrin-targeted,resveratrol-loaded liposomes for the treatment of glioblastoma[J]. J Control Release,2018,277:89-101.
[8]Ashfaq UA,Riaz M,Yasmeen E. et al. Recent advances in nanoparticle-based targeted drug-delivery systems against cancer and role of tumor microenvironment[J]. Crit Rev Ther Drug Carrier Syst,2017,34(4):317-353.
[9]Nouri YM,Kim JH,Yoon HK,et al. Update on transarterial chemoembolization with drug-eluting microspheres for hepatocellular carcinoma[J]. Korean J Radiol,2019,20(1):34-49.
[10]Youn YS,Bae YH. Perspectives on the past,present,and future of cancer nanomedicine[J]. Adv Drug Deliv Rev,2018,130:3-11.
[11]Mignani S,Rodrigues J,Roy R,et al. Exploration of biomedical dendrimer space based on in-vitro physicochemical parameters:key factor analysis[J]. Drug Discov Today,2019,24(5):1176-1183.
[12]Gilligan KE,Dwyer RM. Engineering exosomes for cancer therapy[J]. Int J Mol Sci,2017,18:e1122.
[13]Emam SE,Ando H,Lila ASA,et al. Liposome co-incubation with cancer cells secreted exosomes(extracellular vesicles)with different proteins expressions and different uptake pathways[J]. Sci Rep,2018,8(1):14493.
[14]Yuana Y,Jiang L,Lammertink BHA,et al. Microbubblesassisted ultrasound triggers the release of extracellular vesicles[J]. Int J Mol Sci,2017,18(8):e1610.
[15]Wang J,Yao1 Y,Wu J,et al. Identification and analysis of exosomes secreted from macrophages extracted by different methods[J]. Int J Clin Exp Pathol,2015,8(6):6135-6142.
[16]Akers JC,Ramakrishnan V,Yang I,et al. Optimizing preservation of extracellular vesicular miRNAs derived from clinical cerebrospinal fluid[J]. Cancer Biomark,2016,17(2):125-132.
[17]王宇鑫,张叶军,邬晶新,等.肿瘤细胞外泌体与窖蛋白-1[J].生物技术通讯,2018,29(5):718-722.
[18]Liao W,Du Y,Zhang CH,et al. Exosomes:the next generation of endogenous nanomaterials for advanced drug delivery and therapy[J]. Acta Biomaterialia,2019,86:1-14.
[19]Whiteside TL. Exosomes carrying immunoinhibitory proteins and their role in cancer[J]. Clin Exp Immunol,2017,189(3):259-267.
[20]赵贵芳,何江双,彭林茂,等.间充质干细胞源性外泌体对组织损伤修复的研究进展[J].吉林医药学院学报,2019,40(2):123-126.
[21]Toh WS,Lai RC,Hui JHP,et al. MSC Exosome as a cellfree MSC therapy for cartilage regeneration:implications for osteoarthritis treatment[J]. Semin Cell Dev Biol,2017,67:56-64.
[22]Hosseini Shamili F,Alibolandi M,Rafatpanah H,et al. Immunomodulatory properties of MSC-derived exosomes armed with high affinity aptamer toward mylein as a platform for reducing multiple sclerosis clinical score[J]. J Control Release,2019,299:149-164.
[23]Showalter MR,Wancewicz B,Fiehn O,et al. Primed mesenchymal stem cells package exosomes with metabolites associated with immunomodulation[J]. Biochem Biophys Res Commun,2019,512(4):729-735.
[24]Zhang B,Yeo RWY,Lai RC,et al. Mesenchymal stromal cell exosome-enhanced regulatory T-cell production through an antigen-presenting cell-mediated pathway[J]. Cytotherapy,2018,20(5):687-696.
[25]Zhang S,Teo KYW,Chuah SJ,et al. MSC exosomes alleviate pain and degeneration in a rat model of temporomandibular joint osteoarthritis[J]. Biomaterials,2019,200:35-47.
[26]Zhao X,Wu X,Qian M,et al. Knockdown of TGF-β1 expression in human umbilical cord mesenchymal stem cells reverts their exosome-mediated EMT promoting effect on lung cancer cells[J]. Cancer Lett,2018,428:34-44.
[27]Villatoro AJ,Alcoholado C,Martín-Astorga M.C,et al. Comparative analysis and characterization of soluble factors and exosomes from cultured adipose tissue and bone marrow mesenchymal stem cells in canine species[J]. Vet Immunol Immunopathol,2019,208:6-15.
[28]Sun X,Shan A,Wei Z,et al. Intravenous mesenchymal stem cell-derived exosomes ameliorate myocardial inflammation in the dilated cardiomyopathy[J]. Biochem Biophys Res Commun,2018,503(4):2611-2618.
[29]Li Z,Liu F,He X,et al. Exosomes derived from mesenchymal stem cells attenuate inflammation and demyelination of the central nervous system in EAE rats by regulating the polarization of microglia[J]. Int Immunopharmacol,2019,67:268-280.
[30]Bier A,Berenstein P,Kronfeld N,et al. Placenta-derived mesenchymal stromal cells and their exosomes exert therapeutic effects in Duchenne muscular dystrophy[J]. Biomaterials,2018,174:67-78.
[31]Lai R,Yeo R,Tan S,et al. Biochemical potential of MSC exosome[J]. Cytotherapy,2014,16(4):S43.
[32]韩睿,李琳,王润清,等.间充质干细胞来源外泌体对免疫功能调控的作用与应用前景[J].中国组织工程研究,2019,23(17):2762-2769.
[33]Lai RC,Chen TS,Lim SK. Mesenchymal stem cell exosome:a novel stem cell-based therapy for cardiovascular disease[J]. Regen Med,2011,6(4):481-492.
[34]Adelipour M,Babaei F. Mirzababaei M. et al. Correlation of microvessel density and c-Myc expression in breast tumor of mice following mesenchymal stem cell therapy[J]. Cell Tissue Res,2017,49(2):315-322.
[35]Braun RK,Chetty C,Balasubramaniam V,et al. Intraperitoneal injection of MSC-derived exosomes prevent experimental bronchopulmonary dysplasia[J]. Biochem Bioph Res Commun,2018,503(4):2653-2658.
[36]Toh W,Zhang S,Teo K,et al. MSC Exosomes alleviate pain and degeneration in a rat model of temporomandibular joint osteoarthritis[J]. Cytotherapy,2018,20(5):16.
[37]Chew JRJ,Chuah SJ,Teo KYW,et al. Mesenchymal stem cell exosomes enhance periodontal ligament cell functions and promote periodontal regeneration[J]. Acta Biomaterialia,2019,89:252-264.
[38]Lukic A,Wahlund CJE,Gómez C,et al. Exosomes and cells from lung cancer pleural exudates transform LTC4 to LTD4,promoting cell migration and survival via CysLT1[J]. Cancer Lett,2019,444:1-8.
[39]Sanderson RD,Bandari SK,Vlodavsky I. Proteases and glycosidases on the surface of exosomes:newly discovered mechanisms for extracellular remodeling[J]. Matrix Biol,2017,6(4):3955.
[40]Poggio M,Hu T,Pai CC,et al. Suppression of exosomal PD-L1 induces systemic anti-tumor immunity and memory[J]. Cell,2019,177(2):414-427.
[41]Sakaue T,Koga H,Fukahori M,et al. Expression of CD133in exosomes derived from ascites of patients with advanced pancreatic cancer[J]. Pancreatology,2016,16(4):143.
[42]Zlotogorski A,Vered M,Chaushu G,et al. Exosomes isolated from saliva of cancer patients differ from those of healthy individuals[J]. Oral Oncol,2013,49:70-71.
[43]Wang C,Zhang C,Liu L,et al. Macrophage-derived mir-155-containing exosomes suppress fibroblast proliferation and promote fibroblast inflammation during cardiac injury[J]. Mol Ther,2017,25(1):192-204.
[44]Zheng Y,He R,Wang P,et al. Exosomes from LPS-stimulated macrophages induce neuroprotection and functional improvement after ischemic stroke by modulating microglial polarization[J]. Biomater Sci,2019,7(5):2037-2049.
[45]Osada-Oka M,Shiota M,Izumi Y,et al. Macrophage-derived exosomes induce inflammatory factors in endothelial cells under hypertensive conditions[J]. Hypertens Res,2017,40(4):353-360.
[46]Wahlund CJE,Güclüler G,Hiltbrunner S,et al. Exosomes from antigen-pulsed dendritic cells induce stronger antigenspecifc immune responses than microvesicles in vivo[J]. Sci Rep,2017,7(1):17095.
[47]Lu Z,Zuo B,Jing R,et al. Dendritic cell-derived exosomes elicit tumor regression in autochthonous hepatocellular carcinoma mouse models[J]. Hepatology,2017,67(4):739-748.
[48]Li J,Huang S,Zhou Z,et al. Exosomes derived from rAAV/AFP-transfected dendritic cells elicit specific T cell-mediated immune responses against hepatocellular carcinoma[J].Cancer Manag Res,2018,10:4945-4957.
[49]廖焕金,李莉.肥大细胞分化与成熟[J].现代免疫学,2019,39(2):150-154.
[50]Dimitris S,Hany GB,Michele R,et al. Immunoregulatory properties of mast cell-derived exosomes[J]. Mol Immunol,2002,38(16-18):1359-1362.
[51]Xie GG,Yang HW,Peng X,et al. Mast cell exosomes can suppress allergic reactions by binding to IgE[J]. Allergy Clin Immunol,2018,141(2):788-791.
[52] 殷亚男.肥大细胞来源的外泌体对骨髓间充质干细胞迁移能力的影响[C].中国免疫学会:中国免疫学会,2017:1.
[53]Hadley EE,Miller SS,SaadeG,et al. Amnion epithelial cellderived exosomes induce inflammatory changes in uterine cells[J]. Am J Obstet Gynecol,2018,219(5):478.
[54]Kong J,Wang F,Zhang J,et al. Exosomes of endothelial progenitor cells inhibit neointimal formation after carotid artery injury[J]. Surg Res,2018,232:398-407.
[55]Reyes-Ruiz JM,Osuna-Ramos JF,Jesús-González LA. Isolation and characterization of exosomes released from mosquito cells infected with dengue virus[J]. Virus Res,2019,266:1-14.
[56]Beltrami C,Besnier M,Shantikumar S,et al. Human pericardial fluid contains exosomes enriched with cardiovascular-expressed microRNAs and promotes therapeutic angiogenesis[J]. Mol Ther,2017,25(3):679-693.
[57]Sahoo S,Mathiyalagan P,Hajjar RJ. Pericardial fluid exosomes:a new material to treat cardiovascular disease[J].Mol Ther,2017,25(3):568-569.
[58]Lv CY,Zhao ZY,Yang TL,et al. Liquid biopsy biomarkers of renal interstitial fibrosis based on urinary exosome[J].Exp Mol Pathol,2018,105(2):223-228.
[59]Parchem J,Papanna R,Yang S,et al. Exploring the diagnostic and prognostic potential of amniotic fluid exosomes in twin-twin transfusion syndrome[J]. Am J Obstet Gynecol,2017,216(1):63-64.
[60]Hock A,Miyake H,Li B,et al. Breast milk-derived exosomes promote intestinal epithelial cell growth[J]. J Pediatr Surg,2017,52(5):755-759.
[61]Spaull R,Mcpherson B,Gialeli A,et al. Exosomes populate the cerebrospinal fluid of preterm infants with posthaemorrhagic hydrocephalus[J]. Int J Dev Neurosci,2019,73:59-65.
[62]Qu M,Lin Q,Huang LY,et al. Dopamine-loaded blood exosomes targeted to brain for better treatment of Parkinson′s disease[J]. J Control Release,2018,287:156-166.
外泌体(exosome)是细胞分泌的纳米级细胞外囊泡样体,它的直径30~150 nm,是一种膜囊泡,来源于体内各种活细胞分泌的晚期核内体(多囊泡体)。...
外泌体因其独特的优势, 成为近年来学者关注的重点, 但在软组织损伤修复领域的研究仍处于起步阶段。外泌体是一种新型细胞间通讯方式, 为精确和全面阐述软组织损伤后修复分子机制和精准治疗靶点指明了新研究方向, 对优化软组织相关疾病的诊治、预防具有重要的临...