
近年来,随着我国经济水平的快速发展和人民生活水平提高,我国居民粮谷类食物摄入量逐年减少,脂肪供能比明显增加,并有向西方国家膳食结构转化的趋势[1],由此带来一系列健康问题,如高脂血症、脂肪肝、心脑血管疾病等。因此,研究高脂饮食对机体的影响具有极其重要的意义。长爪沙鼠(以下简称沙鼠)亦称蒙古沙鼠或黑爪蒙古沙土鼠、黄耗子、砂耗子等,属哺乳纲,啮齿目,仓鼠科,沙鼠亚科,沙鼠属,其肝内类脂质含量高,能保持高血脂和高胆固醇水平,血清胆固醇含量极易受饲料胆固醇含量影响,且高胆固醇饮食可导致肝脏脂沉积,对研究高血脂、胆固醇吸收和食源性胆固醇代谢等很具价值。本次实验旨在研究高脂饮食对沙鼠的病理生理学影响,为脂质代谢紊乱相关疾病的造模提供新思路。
1 材料和方法
1. 1 实验动物
清洁级成年雄性 Z:ZCLA 长爪沙鼠 48 只,体重(50 ±10)g,浙江省医学科学院实验动物中心提供,许可证:【SCXK(浙)2008 -0033】,饲养于浙江中医药大学动物实验研究中心屏障动物实验设施中【SYXK(浙)2008 -0115】。
1. 2 主要试剂
胆固醇由上海思吉生物制品有限公司提供,3 号胆盐由杭州微生物试剂有限公司提供,蛋黄粉由浙江省长兴县艾格生物制品有限公司提供,血糖(Glu)、甘油三酯(TG)、胆固醇(CHOL)、高密度脂蛋白胆固醇(HDL-C)、尿酸(UA)、肌酐(CREA)、尿素氮(BUN)、丙氨酸氨基转移酶(ALT)、天冬酸氨基转移酶(AST)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBil)、淀粉酶(AMS)等诊断试剂盒均由上海申能-德赛诊断技术有限公司提供;低密度脂蛋白胆固醇(LDL-C)诊断试剂盒由上海复星长征医学有限公司提供;苏木素和伊红染料为 Sigma 进口分装,Masson 染色试剂合由中国福州迈新生物技术有限公司提供。
1. 3 主要仪器设备
日立 7020 全自动生化分析仪,德国 BecrmanAllegra X-15R centrifuge 离 心 机,德 国 MicromSTR120 自动组织脱水机,德国 Microm HM335E 半自动石腊包埋机,德国 LeicaRM 2025 病理切片机,德国 Leica DMLB2 显微镜。
1. 4 高脂饲料配制
由 80. 5%的普通饲料、10% 的蛋黄粉、7% 的猪油胆、2%的胆固醇及 0. 5% 的 3 号胆盐组成。普通饲料和高脂饲料均经浙江省医学科学院实验动物中心加工生产。
1. 5 分组及处理
48 只沙鼠适应性饲养 1 周后,随机分为正常组及模型组,每组 24 只,每组又分 4 周、8 周及 16 周 3个时相点。正常组予普通饲料喂养,模型组予高脂饲料喂养,自由饮水,两组分别在第 4、8、16 周末 3个时相点各随机处理沙鼠 8 只。处理前晚起禁食不禁水 18 h,次日上午空腹麻醉下采血,分离血清待用;取部分肝组织立即进行冰冻切片,油红 O 染色;收集心、肺、肝、胰、肾、脾、小肠(近回盲部)等脏器标本,于 10% 中性甲醛溶液中固定,经脱水、透明、浸蜡、包埋制成组织蜡块待用。
1. 6 检测指标
动态观察两组沙鼠 3 个时相点体重,全自动生化仪检测 3 个时相点血清 Glu、TG、CHOL、HDL-C、LDL-C、UA、Cr、BUN、TBil、TP、ALB、ALT、AST、AMS水平,冰冻切片肝组织油红 O 染色观察肝脏脂质沉积情况,各脏器石蜡组织切片后常规 HE 染色光学显微镜观察组织病理学变化,Mossan 染色观察肝组织纤维化程度。
1. 7 统计学方法
计量资料采用均数 ± 标准差(x± s) 表示,以SPSS17. 0 统计软件进行分析,两组之间比较采用独立标本的 t 检验,当 P < 0. 05 时表示差异有统计学意义。
2 结果
2. 1 高脂饮食对沙鼠体重的影响
高脂饮食喂养 4 周后,模型组沙鼠体重增加稍快于正常组,但差异无统计学意义(P > 0. 05),至 8周时较正常组明显增加(P <0. 05),而 16 周时正常组体重略有增加,而模型组基本维持与 8 周同一水平,见表 1.
2. 2 高脂饮食对沙鼠血糖及血脂的影响
模型组沙鼠血糖水平随高脂饲料喂养时间增加而降低,模型组 16 周时相点较 4 周、8 周时相点显著降低(P < 0. 05),模型组 16 周时也较正常组 16周时明显降低(P <0. 01)。
血脂方面,除模型组 4 周时 TG 水平与正常组差异无统计学意义外,模型组 8 周、16 周时的 TG 水平及 3 个时相点的 CHOL、HDL、LDL 水平均较同期正常组显著增高(P < 0. 01);高脂喂养 4 周时和 8 周时的血脂水平总体持平,而至 16 周时则较 4 周、8周显著增高(P <0. 01)。见表 2.
2. 3 高脂饮食对长爪沙鼠肝功能的影响
模型组沙鼠血清 ALT、AST 水平在 4 周时即较同一时相点正常组显著增高(P < 0. 01),8 周时达到高峰,16 周时 ALT 有所降低、AST 则维持在高水平,均较同一时相点正常组明显增高(P < 0. 01)。
模型组 TP 水平 8 周时较同一时相点正常组明显增高(P <0. 01),4 周、16 周时则与正常组差异无统计学意义(P > 0. 05);随高脂饮食时间增加模型组沙鼠血清 ALB 水平 8 周时较 4 周时显著增高,而 16周时则较 4 周、8 周显著降低; 模型组 球 蛋 白(GLB)、TBil 水平则随造模时间延长而逐渐增高,而ALB / GLB 则逐渐降低,见表 3.
2. 4 高脂饮食对沙鼠肾功能及血清淀粉酶的影响
高脂喂养 4 周、8 周及 16 周 3 个时相点沙鼠血清 BUN、CREA 水平均与同一时相点正常组差异无统计学(P > 0. 05);模型组沙鼠血清 UA 水平在 4周、8 周时与正常组差异无统计学,在 16 周时则较同一时相点正常组及模型组 4 周、8 周时相点均显著增高(P <0. 01);模型组沙鼠血清 AMS 水平在 4周、8 周时与正常组无统计学差异,在 16 周时则较同一时相点正常组明显增高(P <0. 01)。见表 4.
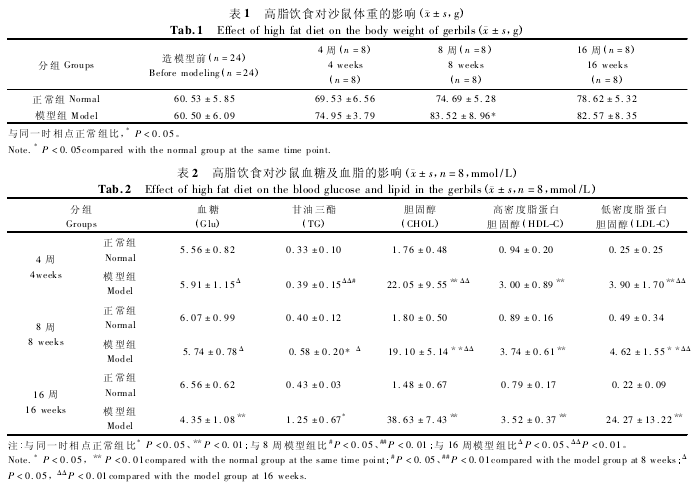
2. 5 高脂饮食对沙鼠心、肺、肝、胰腺、脾、肾、小肠等的组织病理学影响
HE 染色光镜下观察发现正常组沙鼠心肌纤维排列整齐,高倍镜下显示有横纹,细胞间质较少,内见少量血管及结缔组织。模型组 4 周心肌纤维排列仍整齐,胞浆内少量的细小脂肪空泡;至 8 周心肌纤维变性,横纹不清,模糊,胞浆内可见数量不等脂肪小空泡,间质水肿、血管扩张,少量炎性细胞渗出;16周间质水肿更明显,炎性细胞渗出有增加,胞浆内脂肪空泡增多,间质内脂肪细胞明显增加;模型组各时相点间质纤维化不明显(图 1)。
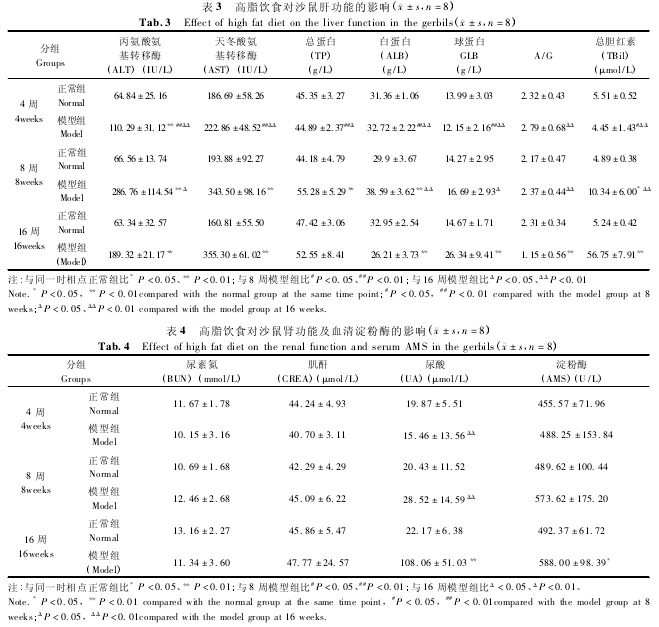
HE 染色光镜下观察沙鼠正常组肺结构清楚,未见肺泡膈增厚,未见炎细胞浸润。模型组 4 周时肺结构清楚,肺泡毛细血管充血,肺胞膈略有增厚,伴少量炎症细胞渗出;至 8 周时肺胞膈增厚较 4 周时明显;16 周时肺泡结构欠完整,肺泡腔逐渐消失,内可见大量泡沫细胞代替,部分见脂肪肉芽肿(图 2)。
沙鼠正常组肝脏大体观察颜色鲜红,边缘锐利,表面光滑,质软而韧;模型组 4 周及 8 周时肝脏体积增大,边缘变钝,颜色呈奶油黄,质地较正常组软且韧性差,触之似泥块并有油腻感;至 16 周时肝脏色泽晦暗淡黄色,表面粗糙,质地较正常组稍硬。油红 O 染色发现正常组各组沙鼠肝细胞胞浆见少量细小的红染物质,模型组 4、8 周肝细胞内沉积大量被染成红色的脂肪,至 16 周时染成红色脂肪的范围有所减少。HE 染色正常组肝组织结构完整,肝细胞以中央静脉为中心,向四周放射状排列,汇管区结缔组织略多,其内见小叶间静脉、小叶间动脉和小叶间胆管断面。模型组 4 周肝细胞内弥漫脂肪空泡,肝小叶内见少量点状坏死,无肝细胞气球样变,Masson 染色显示无明显的窦周纤维化;至 8 周时肝细胞内脂肪空泡增多,肝小叶内散在的坏死灶,肝细胞气球样变,窦周纤维化,部分合并门脉周围纤维化;16 周时肝小叶内坏死灶较 8 周时略有减少,但肝细胞气球样变仍明显,Masson 染色显示间质纤维化明显,见桥接纤维化,部分可见假小叶形成(图3 ~ 5)( 图 1 ~ 5 见文后彩插 1)。
HE 染色光镜下观察沙鼠胰腺结构正常,外分泌腺腺泡结构清晰,未见炎症细胞渗出和纤维组织增生,胰岛散在分布,内结构清楚。模型组 4 周、8 周时未见明显异常,16 周时可见部分胰岛增大,胰岛内内分泌细胞增多(图 6)。
模型组沙鼠大体观察脾脏体积较正常组明显肿大,且随造模时间的延长而增大明显。HE 染色光镜下观察正常组沙鼠脾脏皮髓分界清楚,脾小体清晰可见。模型组 4 周、8 周皮髓分界清楚,脾小体缩小,红髓扩大,内可见散在泡沫样细胞;至 16 周脾小体明显缩小,红髓内被大量泡沫样细胞所代替而扩大(图 7)。
正常组及模型组沙鼠双肾大体观察大小均匀一致。HE 染色显微镜下观察发现皮髓分界清楚,皮质内肾小球清晰可见,内未见毛细血管内皮细胞、系膜细胞增生,未见基质增生,未见肾小管基底膜增生,略有毛细血管充血,肾小管可见少量浊肿变性(由于本实验未采用灌注固定,故处死取组织过程中可能会出现轻微的缺血缺氧变化,而肾小管对缺血缺氧特别敏感),间质内未见炎症细胞浸润,未见纤维细胞增多;模型组各时相点镜下未见明显改变(图 8)。
HE 染色光镜下观察正常组沙鼠小肠结构正常,粘膜与粘膜下层向管腔内凸起形成皱襞,粘膜表面大量突起的肠绒毛,绒毛表面可见单层柱状上皮,间有杯状细胞,绒毛间的上皮向固有层凹陷形成肠腺,肌层由内环行和外纵行二层平滑肌组成,外膜为一层纤维膜。模型组各时相点小肠粘膜镜下未见明显改变(图 9)(图 6 ~9 见文后彩插 2)。
3 讨论
高脂饮食给机体带来的损伤一直是诸多学者关注的热点,大量研究证明,高脂饮食可导致血脂紊乱和肥胖,从而诱导机体免疫功能紊乱、血清炎症介质、细胞因子失衡以及细胞表面受体表达异常,而这些与机体炎症反应密切相关。它产生危害主要通过 2 条途径:一是脂质在组织内蓄积所导致的细胞毒性;二是高脂饮食引发血脂紊乱介导的炎症反应和自身免疫反应[2].本次研究发现高脂饮食可对沙鼠产生多种病理生理学影响。
高脂饮食对沙鼠血脂的影响十分明显,随造模时间的增加,沙鼠高脂血症逐渐严重,TG、CHOL、HDL、LDL 水平均越来越高,尤其是 LDL 水平在 16周时是 4 周、8 周时的 4 ~ 5 倍。本研究还观察到,随造模时间延长,血清 TG 的水平也逐渐增高,同时出现高 CHOL 血症和高 TG 血症,这与我们以往观察到给大鼠高脂饮食早期(4 周)血清 TG 有增高而长期喂养(8 周、12 周)后血清 TG 往往不高甚至降低[3]的表现不同;提示沙鼠对膳食脂质的血脂变化模式可能与人类的反应模式更接近,可能更适用于高脂血症研究的模型选择。
高脂饮食可造成沙鼠肝组织大量脂质沉积,本研究显示造模 4 周时肝细胞脂肪变已超过 66% 达到重度;8 周时在脂肪变的基础上,肝组织炎症、坏死,肝细胞气球样变及间质纤维化明显,16 周时间质纤维化加重,出现早期肝硬化表现,部分沙鼠肝组织有假小叶形成;同时这些变化伴随着肝功能的改变,高脂喂养使沙鼠 ALT、AST 及 TBil 或早或晚较正常组均显著升高,且 16 周时模型组 ALB 及 A/G 较前期(4 周与 8 周) 出现了明显下降,ALB 全部由肝脏合成,这提示肝脏的合成功能受到了影响,可见高脂饮食沙鼠肝细胞损伤的发生,是非酒精性脂 肪 性 肝 病 ( non-alcoholic fatty liver disease,NAFLD)的典型表现。NAFLD 被认为是代谢综合征在肝脏的一种表现[4],大多数 NAFLD 患者不表现出任何症状,随着疾病的进展可出现肝脏脂肪变性、非 酒 精 性 脂 肪 性 肝 炎 ( non-alcoholicsteatohepatitis,NASH)、肝硬化、肝细胞肝癌等[5].
本研究的沙鼠模型涵盖了 NAFLD 疾病谱从非酒精性脂肪肝到肝硬化的各个阶段,是 NAFLD 研究的良好模型。根据中华医学会肝脏病学分会的“非酒精性脂肪性肝病诊疗指南”中病理学诊断标准[6],本模型 16 周时肝纤维化分期为 S4(高度可疑或确诊肝硬化)的有 5 例,S3(桥接纤维化)3 例,Masson 染色可明显显示部分沙鼠肝脏出现了假小叶,且均伴有脾大,为肝硬化的典型表现,而我们在以往的研究采用单纯高脂饮食喂养大鼠仅可诱导明显的肝纤维化表现,且实验周期达 24 周[7],文献报道也尚未见单纯高脂饮食诱导的大、小鼠肝硬化模型,这说明沙鼠用于非酒精性脂肪性肝炎肝硬化的研究有着广泛的前景。另外,本实验还发现 16 周时沙鼠血尿酸水平明显升高,已有研究证明高尿酸血症和NAFLD 之间存在关系[8],因此沙鼠可能还是研究高脂饮食诱导的 NAFLD 与高尿酸血症的相关性的良好模型。高尿酸血症是嘌呤代谢障碍引起的代谢性疾病,和高脂血症具有相关性,目前已有酵母膏+ 乙胺丁醇灌胃建立的小鼠高尿酸血症模型[9]、高酵母饲料加腺嘌呤灌胃并适时给予氧嗪酸钾乳悬液皮下注射所复制的大鼠慢性高尿酸血症模型[10]、次黄嘌呤腹腔注射联合尿酸氧化酶抑制剂皮下注射复制的小鼠高尿酸血症模型[11]等,本研究单用高脂饮食喂养即使沙鼠血尿酸显著升高,这为高尿酸血症的动物模型复制提供了新方法,或许能为高尿酸血症的发病机制提供新的思路。
本实验还观察到模型组沙鼠在 16 周时血糖较1饮食喂养的大鼠会产生胰岛素抵抗,进一步导致血糖升高[12,13].但同样有研究观察到高脂饮食喂养12 周可使沙鼠血糖明显升高[14],因此高脂饮食对沙鼠血糖的影响尚待进一步研究。本研究观察到16 周时模型组沙鼠胰腺组织可见部分胰岛增大,胰岛内内分泌细胞增多,这表明沙鼠可能存在胰腺分泌胰岛素的异常,但血糖却反而降低,同时体重也未见明显增加,如果今后进一步实验能验证上述这一特点,或许说明沙鼠体内存在某一种机制能够防止长期高脂饮食诱导的糖尿病的发生,进一步研究这一现象或许能为以后糖尿病的治疗提供新的思路。
本研究通过 HE 染色光镜下未观察到胰腺明显的充血、水肿、坏死等病理改变,但血清淀粉酶水平在 16 周时较正常组显著增高。高脂血症是急性胰腺炎的常见病因之一,其机制目前尚未完全清楚,可能与其激活胰蛋白酶,消化胰腺腺泡引起胰腺的自身消化;或造成胰腺的微循环障碍,胰液分泌受阻等有关[15].进一步研究可以通过电镜观察胰腺超微结构,探讨单纯高脂饮食与血清淀粉酶升高及高脂血症性急性胰腺炎之间的关系,也可以通过延长高脂饮食喂养时间观察是否可以诱导出高脂血症性急性胰腺炎模型。
高脂饮食的喂养使模型组沙鼠逐渐出现肺胞膈增厚,炎症细胞渗出,肺泡腔消失,代以大量泡沫细胞及脂肪肉芽肿形成,说明高脂饮食会导致肺损伤,并介导炎症反应的发生。高脂饮食喂养的小鼠肺组织亦可观察到和本实验类似的病理学改变[2],已有学者在高脂饮食喂养的大鼠模型中观察到肺纤维化[16],但本模型未观察到明显的肺纤维化的发生。高脂饮食喂养的沙鼠在 16 周还出现了明显的心肌脂肪变性和心肌损伤,这说明该模型可能可以用于高脂血症相关的心肌损伤的研究。但本研究HE 染色光镜下未观察到肾组织和肠粘膜的病理改变,血清肌酐、尿素氮也未见异常。
本研究提示,高脂饮食可诱导良好高脂血症、非酒精性脂肪性肝炎肝硬化沙鼠模型,并且高脂饮食喂养的沙鼠可能是高脂血症相关的高尿酸血症、肺损伤及心肌损伤等的良好模型。
参考文献:
[1] 陈春明,赵文华,杨正雄,等。 中国慢性病控制中膳食关键因素的研究[J]. 中华流行病学杂志,2006,27(09): 739- 743.
[2] 龚雪,沈炼桔,刘丹,等。 细胞凋亡抑制因子 6(Api6)在高脂肺损伤中的作用研究[J]. 西南大学学报(自然科学版),2011,33(02):40 - 45.
[3] 温秀梅,陈芝芸,严茂祥,等。 大鼠非酒精性脂肪性肝炎形成中脂质代谢的变化[J]. 中华中医药学刊,2008,26(09):1987 - 1989.
[4]Dietrich P,Hellerbrand C. Non-alcoholic fatty liver disease,obesity and the metabolic syndrome[J]. Best Pract Res ClinGastroenterol,2014,28(4):637 - 653.
[5]Federico A,Zulli C,De Sio I,et al. Focus on emerging drugsfor the treatment of patients with non-alcoholic fatty liver disease[J]. World J Gastroenterol,2014,20(45):16841 - 16857.
[6] 中华医学会肝脏病学分会脂肪肝和酒精性肝病学组。 非酒精性脂肪性肝病诊疗指南[J]. 中华肝脏病杂志,2006,14(03):161 - 163.
[7] 娄国强,万虎,施军平,等。 高脂饮食诱导的脂肪性肝纤维化大鼠肝组织 TGFβ_1 和 CTGFmRNA 表达及其意义[J]. 医学研究杂志,2006,35 (12): 13 -17.
[8 ] 郭彩云,聂秀玲,孙丽荣,等。 高尿酸血症 / 痛风与非酒精性脂肪肝严重程度的相关研究[J]. 天津医科大学学报,2013,19 (06): 499 - 501.
[9 ] 董静,朱平,程康鹏,等。 小鼠高尿酸血症模型探讨[J]. 中国心血管杂志,2009,14(03): 237 -239.
内皮型一氧化氮合酶(eNOS)催化左旋精氨酸产生的一氧化氮(NO)有扩张血管、抑制平滑肌细胞增殖和抑制血小板聚集等作用,可调节血管张力、维持血管稳态,对心血管系统具有多重保护作用,是临床评定内皮功能的重要指标。高脂血症可降低常氧环境机体NO的生成与...