
在免疫组织化学染色中,部分抗原的修复要通过EDTA抗原修复液煮沸法进行。笔者采用不同修复时间的高压法通过EDTA抗原修复液对抗原进行修复,并 与 煮 沸 法 的 修 复 效 果 进 行 对 比,旨 在 探 讨EDTA抗原修复液合适修复时间的高压法在免疫组化中的应用价值。
1材料与方法
1.1标本来源本组标本取自2013年6月至2014年4月贵州航天医院收治的肿瘤患者20例,其中肺癌11例、前列腺癌3例、胃间质瘤2例、淋巴瘤2例、间皮瘤1例、子宫内膜间质肉瘤1例、乳腺癌1例;标本均经10%中性福尔马林固定,常规脱水、石蜡包埋,切片厚为4μm,且均经病理证实为抗原表达阳性的肿瘤标本。
1.2试剂和仪器
(1)试剂:包括TTF-1、CK5/6、P504S、CD117、CD2、Bcl-6、CR、CD10、CD31、CEA共10种 常 用 抗 体;EDTA抗 原 修 复 液 (0.01M,pH9.0);PBS缓冲液(0.01M,PH7.4);即用型快捷免疫组化MaxvisionTM试剂盒。(2)仪器:包括烤箱、电热高压锅、培养箱等。
1.3修复方法
(1)高压法:取EDTA抗原修复液1500ml放入电热高压锅中加热至沸腾后,将放置在耐高温塑料架上的切片放入EDTA抗原修复液中,拧紧锅盖继续加热至喷气,扣上压力阀,分别于加热2、5、7min后打开排气阀,待EDTA抗原修复液冷却至室温取出切片备用。(2)煮沸法:取EDTA抗原修复液1500ml放入高压锅中加热至沸腾后,将切片放入EDTA抗原修复液中,盖上锅盖(锅盖不拧紧、亦不扣压力阀)继续加热20min,待EDTA抗原修复液冷却至室温取出切片备用。
1.4免疫组化染色及结果判定
免疫组化染色步骤参照试剂盒操作说明进行,用PBS代替一抗作为阴性对照,每种抗体均用即用型抗体浓度进行实验。由2位病理医师采用双盲法对标本染色结果进行评价,标本细胞呈深棕黄色者为强阳性(+++)、呈浅棕黄色为弱阳性 (+)、介于二者之间者为阳性(++),无着色者为阴性(-);阳性细胞≥50%为Ⅲ级、<5%为I级、介于二者之间为Ⅱ级。免疫组化染色结果以“染色强度/阳性细胞级别”的形式表示。
2结果
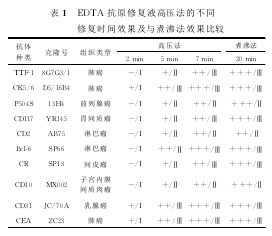
在EDTA抗原修复液高压法中,随着高压修复时间的增加,标本细胞染色强度和阳性细胞级别逐渐增加;当高压修复时间超过7min后,其染色效果与煮沸法相当。见表1.
3讨论
外检标本若采用10%中性福尔马林固定,常可导致组织中蛋白质分子内或分子间形成醛键,使部分蛋白抗原决定簇被隐藏起来,造成某些蛋白表达减弱或不表达、免疫组化染色效果欠佳。抗原修复正是针对这一现象进行的补救措施,其通过物理和(或)化学方法,不同程度地恢复抗原的原有空间结构,使被隐藏的抗原决定簇重新暴露出来,以达到理想的标记染色效果。抗原修复的方法较多,正确选择抗原修复方法是决定染色成败的主要因素之一[1].现已证实,高压法抗原修复因有封闭稳定的环境,能暴露出更多的抗原决定簇;但采用何种修复液还存在分歧,而且更多的实验人员主张采用碱性修复液[2,3].本实验应用高pH值(9.0)碱性EDTA修复液并通过高压法对抗原进行修复,实验结果显示,随着高压修复时间的增加,标本细胞着色程度逐渐增强、阳性细胞数逐渐增多,且到一定时间后能达到与煮沸法相当的修复效果,说明选择EDTA高压法对抗原进行修复是可行的、理想的,值得推广,其与王映梅等[4]研究的高压抗原修复直接法并应用EDTA抗原修复液对组织切片进行抗原修复的效果更好的结论相符合。
在EDTA抗原修复高压法中,加热到2min时,多数抗体不着色或色淡;加热到5min时,修复效果逐渐明显;加热到7min时,染色效果几乎与加热20min的煮沸法一致。因此笔者认为,EDTA抗原修复高压法的加热时间选择为7min修复效果较好,可以代替煮沸法使用,并可减少一半以上的操作时间;若采用间接法修复,则还可以与柠檬酸抗原修复液在一个高压锅内同时进行,能够更节约操作时间。但由于高温高压和碱性溶液的作用,掉片几率会有所增加,故操作中除应保证薄切片和足够烤片时间外,彻底清洁处理玻片也很重要,若用经过系列处理的厂家专用免疫组化染色玻片效果更好。
EDTA化 学 名 为 乙 二 胺 四 乙 酸,分 子 式 为C10H16N2O8,分子量292.24,易溶于碱性溶液,是一种螯合剂,可消 除福 尔马林固 定 产 生 的 不 利 因素[3],其在抗原修复中有肯定的作用,但详细的作用机制还需要深入研究。由于EDTA抗原修复液的pH值作用大于其所含有的化学成分,其在抗原修复中起至关重要的作用,因此,配制EDTA修复液时必须保证pH值准确在9.0,最好用电子pH计测定以确保准确性。
pH过低或过高可用0.1M Na(OH)2或0.1M HCI调节,每次用后更换新溶液,以保证染色质量。
总之,目前尚无一种抗原修复方法和修复液能适合各种抗体,故实践中需要不断探寻适宜抗原修复方法和修复液;但无论采用何种修复方法都应以准确的实验结果为最佳选择。抗原修复的研究还需要更多、更细致的实践经验积累。
参考文献:
[1]罗焕超,余琦,杨江辉,等.不同冷却方法对免疫组化检测结果的影响[J].标记免疫分析与临床,2009,16(4):259.
[2]袁士成,张鋆歆,陈妹琼,等.探索细胞免疫组化染色抗原修复方法的合理选择[J].诊断病理学杂志,2011,18(6):472-473.
[3]廖德贵,黄世章.不同的抗原修复方法对免疫组化染色结果的影响[J].临床医学工程,2009,16(3):62-63.
[4]王映梅,李培峰,刘一雄,等.高压抗原修复方法在免疫组化染色的应用比较[J].细胞与分子免疫学杂志,2012,28(1):1098-1099.
外泌体因其独特的优势, 成为近年来学者关注的重点, 但在软组织损伤修复领域的研究仍处于起步阶段。外泌体是一种新型细胞间通讯方式, 为精确和全面阐述软组织损伤后修复分子机制和精准治疗靶点指明了新研究方向, 对优化软组织相关疾病的诊治、预防具有重要的临...