摘 要: 运用实验生态学和组织学方法研究了单环刺螠的性比、性腺指数、繁殖力、胚胎与胚后发育等繁殖生物学特征,并采用正交实验法分析了单环刺螠受精率和孵化率的最佳环境条件,为单环刺螠的人工增养殖提供科学依据。结果显示,单环刺螠雌雄比例为1∶1.17,雄性略多于雌性。成熟卵径为(145.16±1.70)×(141.27±1.94)μm,处于第1次成熟分裂前期。绝对繁殖力为111 800~720 488(449 684±265 905)粒,相对繁殖力为2 214~12 702(6 849±4 854)粒,怀卵量与体质量呈显着正相关(R=0.683,P<0.05)。生物学最小型体长约7 cm,体质量为11.21 g。精子密度为(5.88±0.52)×109个/mL,雄体平均精子数为(2.41±0.73)×1010个/只。雌性性腺指数在繁殖季节4—5月份呈现2个峰值,表明为分批产卵类型。在盐度25、水温15℃的条件下,胚胎发育经20~24 h孵化。组织学研究表明,单环刺螠为间黄卵,进行不等全裂,且有螺旋卵裂的特征,形成偏极囊胚,原肠作用方式为外包和内陷。胚后发育经担轮幼虫(孵化后1~10 d)、体节幼虫(11~20 d)、蠕虫状幼虫(21~30 d)发育为幼螠。正交实验结果表明,单环刺螠受精率的最佳环境条件为:温度25℃、盐度35、pH 8~9;孵化率的最佳环境条件为:温度15℃、盐度25、pH 8~9。
关键词: 单环刺螠; 繁殖生物学; 环境条件;
Abstract: The reproductive biology of Urechis unicinctus was studied by the method of experimental ecology and histology, including the sex ratio, gonadosomatic index (GSI), fecundity, embryonic and postembryonal development. The optimal environmental conditions for fertility and hatching rate of U. unicinctus were also assessed by orthogonal experiments in order to provide reliable protocols for the artificial culture of U. unicinctus. The sexual ratio between the female and male was 1:1.17 and the males were slightly more than females. The mature oocyte remained at the prophase of the first maturation division with the diameter of (145.16±1.70) μm × (141.27±1.94) μm. The absolute fecundity ranging from 111 800 to 720 488 (449 684±265 905), while the relative fecundity ranging from 2 214 to 12 702 (6 849±4 854), and positive correlation between fecundity and weight were recorded. The biological minimum was about 7 cm of length and 11.21 g of weight. The sperm density was (5.88±0.52) × 109/mL, and the average number of sperm produced by each male was (2.41±0.73) × 1010. Two peaks of female GSI were observed in the breeding season from April to May, which suggested the type of spawn of U. unicinctus was in batches. The trochophore was hatched after 20-24 h of embryo development under the condition of salinity 25 and temperature 15 °C. According the histological observation, the oocyte of U. unicinctus was a type of mesopodium that developed into hemipolar blastocyst by unequal cleavage and spiral cleavage, and then the gastrulation was formed via outsourcing and invagination of cell migration. The postembryonal development after hatching included three stages: trochophore (1-10 d), somatic larva (11-20 d) and worm larva (21-30 d). The results of orthogonal experiments showed that the highest fertility and hatching rate was obtained under the conditions of temperature of 25 °C, the salinity of 35, and pH 8~9, and temperature of 15 °C, the salinity of 25, and pH 8~9, respectively.
Keyword: Urechis unicinctus; reproductive biology; environmental factors;
单环刺螠(Urechis unicinctus)俗称海肠,属螠虫动物门(Echiuroidea)、刺螠科(Urechidae),主要分布于俄罗斯、日本、韩国和中国黄渤海沿岸。其肉味鲜美、营养丰富,体内存在多种生物活性肽,具有免疫调节、抗肿瘤等功能,并且对海水中硫化物有较强的耐受与解毒能力,可对调节水质、缓解海洋污染起到积极作用,因此具有较大的开发和利用价值[1,2,3]。随着单环刺螠天然资源量的日趋减少,对其繁殖生物学及人工增养殖技术的研究日益受到重视。有关单环刺螠精巢发育周期及精子发生[4]、生殖腺的发生及卵巢发育周期[5]、精子结构以及和环境因子的关系[6]、受精过程[7]等方面已有报道,但目前尚缺乏性比、繁殖力以及环境对繁育的影响等基础数据。本研究运用实验生态学和组织学方法对单环刺螠的性比、性腺指数、繁殖力、胚胎与胚后发育等繁殖生物学特征进行了分析,并采用正交实验法筛选出适宜单环刺螠受精率和孵化率的温度、盐度及pH 3个主要环境因子的最佳条件,以期为单环刺螠的生殖生理及人工繁育技术的深入研究提供理论基础。

1 、材料与方法
1.1、 实验材料
实验用单环刺螠于2017年4—5月采集自山东省莱州湾,每周采集1次,每次采集样品50只以上,记录雌雄比例,测量其收缩状态的体长和从水中取出时的体质量。所采集样品体长5.5~21.3 cm,体质量12.7~60.1 g。
1.2 、实验方法
样品处理 每次从样品中随机取出雌、雄体各10只,性别判断通过观察肾管颜色,黄色为雌性,白色为雄性。用电子天平测其体质量、肾管重,计算性腺指数(gonadosomatic index,GSI):
GSI(%)=肾管重(g)/体质量(g)×100%。
随机取成熟雌、雄体各9只,分别剪取肾管前、中、后段,每段各制作1张生殖细胞水封片,用Nikon E1000显微镜测量卵径,每张水封片测量50个卵子,用血球计数板计数精子和卵子个数,进而计算精子密度和繁殖力(n=9):绝对繁殖力=1g卵子数量×成熟期肾管质量;相对繁殖力=绝对怀卵量/成熟期雌体质量。
取成熟生殖细胞进行人工授精,受精卵洗卵3次后转入70 cm×50 cm×40 cm水族缸中进行培养,观察胚胎与胚后发育过程。培养期间自然水温15~25°C,培养密度(20±5)个/mL,盐度25 ± 1, pH 8.0 ± 0.1,自然光照,连续充气,孵化48 h后日投喂2次单胞藻[金藻(Isochrysis galbana)和新月菱形藻(Nitzschia closterium)]。至孵化后15 d,投放经60目筛绢过滤、消毒漂洗后的细沙作为附着基,厚度约5 cm。每天取样显微镜观察、拍照。
分别取成熟卵和卵裂期、囊胚期、原肠期等各期胚胎,用Bouin氏液固定,石蜡包埋,切片厚6~7 μm,苏木精—伊红(H.E)染色,显微镜观察、拍照。
环境因子对精子受精率和孵化率影响的正交实验设计 本实验采用温度、盐度及pH3个主要境因子。温度取10°C、15°C、20°C、25°C和30°C 5个梯度;盐度取15、20、25、30和35共5个梯度;pH取6、7、8、9和10共5个梯度,采用L25(56)的正交表进行实验。取25个500 mL烧杯,按照正交表分别设置25组水环境,每个烧杯加水量均为300 mL。取1只成熟雌体的肾管,剪开肾管上皮释放出卵子,分别取300粒卵于25个烧杯中,再按精卵比为10: 1比例加入1只雄体的精子,连续充气,于精卵混合后4 h到达卵裂晚期,此时受精卵可见多个分裂球,用300目筛绢网过滤出胚胎,显微镜观察,计算受精率。重复上述实验步骤,于精卵混合后24 h,用300目筛绢网滤出已孵化幼虫和未孵化胚胎,显微镜观察,计算孵化率。实验重复3次,计算平均值。受精率和孵化率公式:
受精率(%)=受精卵数/取样卵总数×100%
孵化率(%)=孵化个数/取样卵总数×100%
1.3、 数据处理
实验数据用“平均值±标准差”表示。采用SPSS 18.0软件进行数据处理,并进行t检验或单因子方差分析(One-way ANOVA),LSD多重比较和Duncan氏检验。显着水平设为P<0.05。
各因素同一水平之和(T值)的计算:温度所对应的T1值是正交表第1列数字“1”所对应的实验结果之和,T2值是正交表第1列数字“2”所对应的实验结果之和,以此类推,可计算出其他T值。各因素同一水平的平均值(`X值)的计算:温度所对应的`X1值为(T1值/正交表第1列数字“1”的重复次数),`X2值为(T2值/正交表第1列数字“2”的重复次数),以此类推,可计算出其他`X值。极差(R值)能表明因素的主次顺序,即R值越大,该因子的水平变化对结果的影响越大,该因子就越重要。温度因子所对应的R值=温度因子所对应的`X1、`X2、`X3、`X4和`X5中最大值减去最小值,同理可得出盐度和pH因子的R值。
2 、结果
2.1、 性比、卵径和繁殖力
对采集的446只单环刺螠样本进行雌雄性比的统计分析,除去性别难以分辨的32只,单环刺螠的雌雄比为1∶1.17,与1∶1不存在显着性差异(卡方检验,P>0.05)。
成熟卵径为(145.16±1.70)×(141.27±1.94)μm。绝对繁殖力为111 800~720 488(449 684±265 905)粒,相对繁殖力为2 214~12 702(6 849±4 854)粒,怀卵量与体质量呈显着正相关(R=0.683,P<0.05)。在所测的191只成熟雌体中,生物学最小型体长约7 cm,体质量为11.21 g。精子密度为(5.88±0.52)×109个/ mL,雄体平均精子数为(2.41±0.73)×1010个/只。
2.2、 性腺指数
从单环刺螠性腺指数(GSI)变化趋势来看,进入4月中旬后性腺指数迅速升高,表明随着水温的逐渐升高发育加快。GSI至4月下旬达到峰值后显着下降,表明其该时间段出现集中排放。随后GSI有所回升,至5月中旬出现第2个峰值后又明显降低,表明在一个繁殖期内,单环刺螠有2次集中排放精卵的现象(图1)。
图1 单环刺螠性腺指数变化
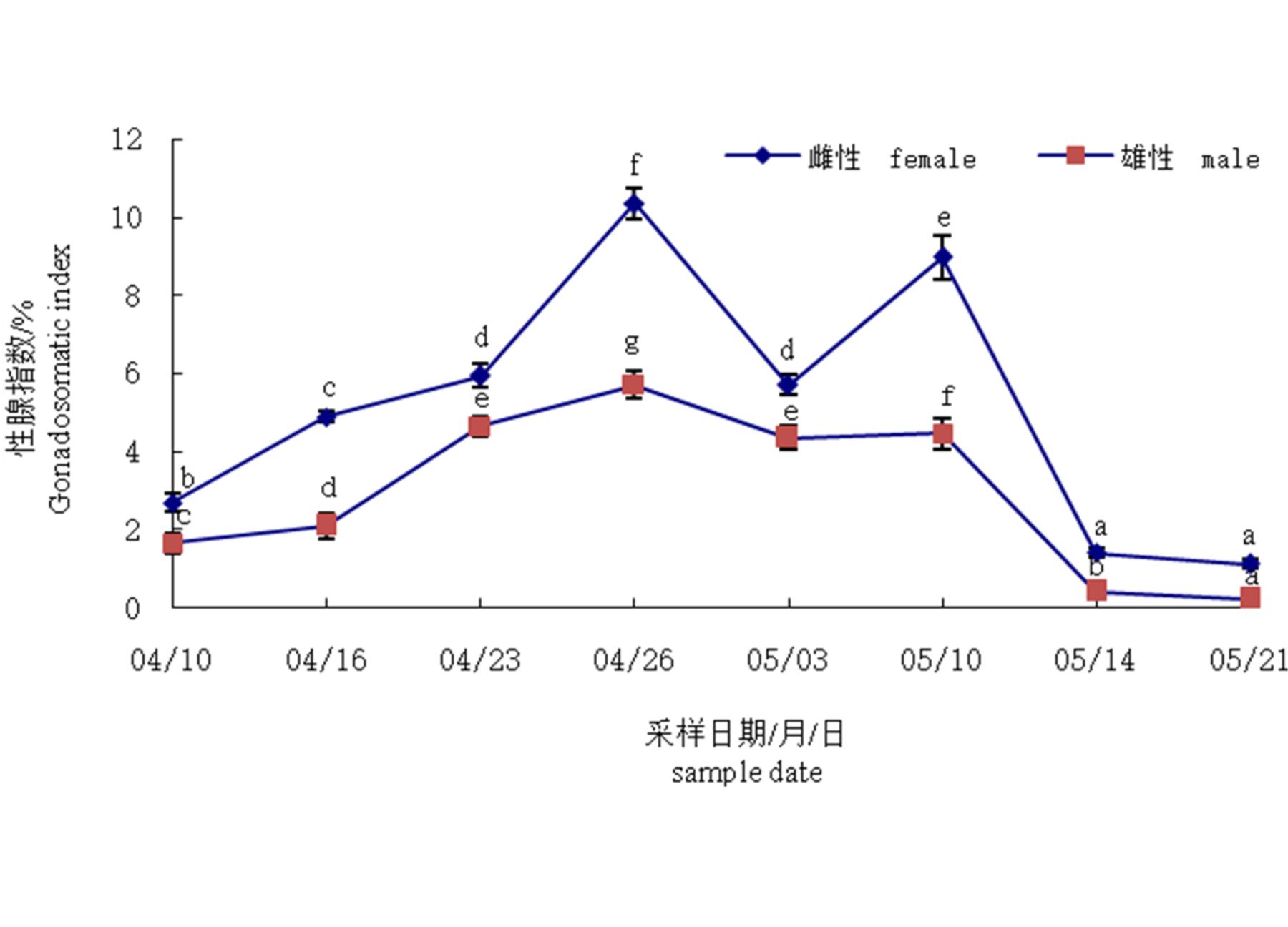
Fig. 1 Changes of gonadosomatic index (GSI) of U. unicinctus
图中不同小写字母表示同一性别不同0时间取材组间差异显着(P<0.05)The lower case letters in the figure denote significant differences (P<0.05) among the groups of the same sex at the different samling time
2.3、 胚胎与胚后发育
单环刺螠成熟卵处于第1次成熟分裂前期,胞质内卵黄颗粒明显,生发泡完整(图版I-1)。在盐度25、水温15℃的条件下,精卵混合后约0.5 h受精膜举起,形成围卵周隙,此时卵径(含卵膜)约164.04 μm×159.13 μm(图版I-2)。单环刺螠胚胎发育过程可分为卵裂期、囊胚期、原肠期、膜内担轮幼虫期等阶段。
受精后约1 h排出第一极体(图版I-3),1.5 h 排出第二极体,第一极体分裂成第三、四极体,形成共3个极体(图版I-4),2 h发育至2细胞期,有些分裂球大小相近,有些则大小差异较明显(图版I-5),以后每0.5~1 h分裂1次,分裂球数量逐渐增多(图版I-6、7)。分裂球有明显大小之分,且其排列有螺旋卵裂的特征。受精后5~6 h发育至囊胚期(图版I-8),7~8 h进入原肠期,可见内陷(图版I-9)和外包(图版I-10),原肠后期胚胎表面长出纤毛(图版I-11)。受精后约18 h形成膜内担轮幼虫,形状如大小悬殊的两个半球相接,逐渐在卵膜内转动,此时胚体约145.78 μm×115.83 μm(图版I-12)。
组织学研究结果表明,单环刺螠为间黄卵,卵黄颗粒分布不均匀,植物性半球卵黄颗粒较多且粗大(图版I-13)。进行不等全裂,动物性半球分裂球小,而植物性半球的分裂球含卵黄多、体积较大(图版I-14)。形成偏极囊胚,囊胚腔偏于动物极(图版I-15)。原肠作用方式为植物极分裂球向囊胚腔内陷,同时动物性半球的分裂球往植物极方向外包(图版I-16)。
胚后发育经担轮幼虫(孵化后1~10 d)、体节幼虫(11~20 d)、蠕虫状幼虫(21~30 d)发育为幼螠。受精后约20~24 h孵化为早期担轮幼虫,大小约150.15 μm×127.36 μm,体呈梨形,可分为上、下两个半球,中间具1条纤毛环,上半球较大、为体前端,可摄食并带动着下半球浮游于水中(图版II-1)。孵化约6 d后发育为后期担轮幼虫,大小约267.23 μm×211.85 μm,仍呈梨形,摄食量增大(图版II-2)。孵化约10 d后,下半球变长并出现分节,发育为体节幼虫,大小约388.34 μm×268.25 μm,体前端仍呈半球状,依靠纤毛环浮游(图版II-3)。孵化约20 d后,体前端变小,体形呈长桶装,发育为蠕虫状幼虫,消化管变粗并出现弯折,后端出现1对肛门囊,纤毛环逐渐消失,由浮游转为底栖,体长约519.11 μm,体宽约247.98 μm(图版II-4,5)。孵化约30 d后发育为幼螠,体前端呈管状的吻伸缩频繁,消化道增长,分段明显,前端体腔内出现肾管,具潜泥沙习性,体长约1 145.10 μm,体宽约275.12 μm(图版II-6)。
2.4、 环境因子对精子受精率和孵化率的影响
从正交实验结果(表1)可见,在本实验的25个组合中,受精率以第20号处理温度4、盐度5、pH3(25℃、盐度35、pH 8)最高,可达(99.02%±0.81%);孵化率以第8号处理温度2、盐度3、pH4(15℃、盐度25、pH 9)最高,为(93.73%±2.06%),和由T值计算所得结果不同(表2)。
表1 单环刺螠受精率和孵化率正交实验结果

注:表中带括号的数字代表影响因子的不同水平Notes: The number with parentheses denote the different levels of the factors of effect
正交实验数据T值分析结果显示,单环刺螠受精率最高的环境条件为温度4、盐度5、pH4,即温度25℃、盐度35、pH 9,孵化率最高的环境条件为温度2、盐度3、pH3,即温度15℃、盐度25、pH 9(表2)。影响受精率的3个因子中,以盐度的R值最大,所以盐度是受精率的主要影响因子,温度和pH的影响程度相对较小。而孵化率的R值从高到低依次为温度>盐度>pH,表明对孵化率的影响程度最大的环境因子为温度。
正交实验的验证性实验:按照温度4、盐度5、 pH 4和温度4、盐度5、pH 3两种组合进行受精率的测定实验,温度4、盐度5、pH 4的受精率为(99.18%±0.97%),温度4、盐度5、pH 3的受精率为(98.85%±0.78%),二者差异不显着(P>0.05)。表明单环刺螠受精率的最佳环境因子组合:温度25℃、盐度35、pH 8~9。
按照温度2盐度3pH 3和温度2盐度3pH4两种组合进行孵化率的测定实验,温度2、盐度3、pH3的孵化率为(94.79%±1.93%),温度2盐度3pH4的孵化率为(93.54%±1.54%),二者无显着性差异(P>0.05)。表明单环刺螠孵化率的最佳环境因子组合:温度15℃、盐度25、pH 8~9。
表2 单环刺螠受精率和孵化率正交实验分析

3 、讨论
3.1、 单环刺螠繁殖特征
单环刺螠一年之中有春秋两个繁殖盛期,与美洲刺螠(U. caupo)[8]、疣吻沙蚕(Tylorrhynchus heterochaetus)[9]、栉孔扇贝(Chlamys farreri)[10]等一致。根据定期采样观察,发现以春季繁殖期个体怀卵量较大,结合生产实际需要,所以本实验重点研究春季繁殖期。随着春季水温的回升,单环刺螠性腺指数逐渐升高,并分别于4月下旬和5月中旬有两次急剧下降的现象,表明单环刺螠为分批产卵类型,且有集中排放精卵的行为。
繁殖力反映了该物种个体及种群的繁殖潜能,与物种的产卵模式、栖息环境、营养状况等密切相关[11,12]。单环刺螠的繁育方式为体外受精、体外发育,精子和卵子排放于水中完成受精作用及胚胎发育过程,受环境影响较大,常因环境因子的剧烈变化导致死亡或者被其他动物吞食,因此较大的产卵量才能保障种族的延续。单环刺螠绝对繁殖力约45万粒,高于多齿围沙蚕(Perinereis nuntia)的(1.4~1.8)万粒[13]和方格星虫(Sipunculus nudus)的(4~5)万粒[14]。据李诺等[15]报道,单环刺螠个体怀卵量可达300~500万粒,显着高于本实验结果,可能与其取材以及计算误差有关。Collins等[16]发现枪乌贼(Loligo forbesi)成熟期个体越大、繁殖力越高。本研究结果显示单环刺螠怀卵量与体质量呈显着正相关,因此在人工繁育选择亲本时应考虑个体大小。
Arp 等[17]调查发现分布于美国加州的美洲刺螠雌雄比例为1∶1.22,与单环刺螠雌雄比例(1∶1.17)相近,两者均呈现群体中雄性个体多于雌性的现象。该现象亦见于其他一些海洋动物,如疣吻沙蚕的雌雄比例为1:1.5[9],日本刺沙蚕(Neanthes japonica)的雌雄比例为1∶2[18]。据陈健[19]报道,单齿螺(Monodonta labio)雄体比例随壳高增长呈逐渐增加,至壳高25 mm以上的个体雌雄比为1∶2。这可能是由于海洋水体巨大,体外受精的物种需要大量的精子才能保证精卵相遇的机会。本实验检测出单环刺螠精子密度为(5.88±0.52)×109 个/mL,与牛从从等[6]的研究结果(4.2±0.2)×109个/mL相近。李诺等[15]报道单环刺螠的生物学最小型体长约7 cm、体质量约20 g,本研究结果与之相比,体长一致,体质量(11.21 g)较低。因刺螠由于呼吸需要机体不停地伸缩变化,故体长不易测量,以体质量作为计量指标较为准确。
单环刺螠近亲物种如方格星虫[14]、可口革囊星虫(Phascolosoma esulenta)[20]以及泥蚶(Tegillarca granosa)[21]、菲律宾蛤仔(Ruditapes philippinarum)[22]等双壳类和中国明对虾(Fenneropenaeus chinensis)[23]、三疣梭子蟹(Portunus trituberculatus)[24]等甲壳类的成熟卵处于第一次成熟分裂中期,此时卵细胞内生发泡核膜解体、形成纺锤体。这类动物的卵母细胞在繁殖季节常会停滞于第一次成熟分裂前期,经自然海区的温度、盐度的剧烈变化(如大潮)或人工诱导方式才进一步到达分裂中期,获得受精能力[25]。单环刺螠成熟卵处于第一次成熟分裂前期,其细胞学特征为核膜完整、生发泡明显,与双齿围沙蚕(Preinereis aibuhitensis)[26]、岩虫(Marphysa sanguinea)[27]和四角蛤蜊(Mactra veneriformis)[28]等一致,所以在繁殖季节无须经过人工诱导,通过解剖法即可获得成熟卵用于育苗。
3.2 、单环刺螠的胚胎与胚后发育
动物卵子的特征直接影响到其胚胎发育过程。单环刺螠卵子类型为间黄卵,卵黄含量比较多、分布不均匀,因此进行不等全裂,动物性半球分裂球含卵黄少、体积小,而植物性半球的分裂球含卵黄多、体积较大,致使囊胚腔偏于动物极,形成偏极囊胚。单环刺螠的不等全裂与可口革囊星虫卵裂规律[20]一致,其卵裂过程中出现螺旋卵裂的特征与疣吻沙蚕[29]以及大部分贝类[30]相同,这可能与其分类地位相近有关。囊胚腔较大的种类如波纹巴非蛤(Paphia undulata)[31]的原肠作用方式为内陷,形成实心囊胚的种类如疣吻沙蚕[29]没有囊胚腔,则采取外包的原肠作用方式,单环刺螠囊胚腔较小,内陷空间有限,所以加以外包同时进行以完成内、外胚层的分区。李诺等[15]将单环刺螠胚胎发育分为卵裂、囊胚和原肠胚3个阶段,本研究发现单环刺螠胚胎发育后期,胚体形成两个大小不等的半球相连接,并且逐渐在卵膜内转动,特征明显,故增加了膜内担轮幼虫这个分期,有利于在育苗生产中观察判断。
在盐度25、水温15℃的条件下,单环刺螠胚胎发育约需20~24 h,时间较短,孵化时机体结构简单,所以胚后发育历经复杂的变态才能发育为幼体。康庆浩等[32]将单环刺螠幼虫发育过程分为担轮幼虫期、2体节期、7体节期、13体节期等时期;陈宗涛等[33]将担轮幼虫分为早、中、晚三期,再加上体节幼虫期;本研究结合幼虫形态特征及生活习性将胚后发育过程分为担轮幼虫(孵化后1~10 d)、体节幼虫(11~20 d)、蠕虫状幼虫(21~30 d),与李诺等[15]分期方法一致。本实验中,单环刺螠在自然水温(15~25°C)条件下,孵化后约经30 d发育至体长约1 mm的幼螠,还需一个月培育至体长1 cm左右投放至池塘中养殖。两个月的育苗生产周期较长、成本高,如何缩短幼体培育期、提高生产效率是亟待解决的问题。
单环刺螠为滤食性,对食物成分没有选择性,只要水体中悬浮颗粒大小合适即可摄食。育苗中多以金藻、新月菱形藻等单胞藻作为饵料,较为单一,因此对饵料配比进行优化、研制人工配合饵料是提高幼体生长速度的一条途径。本实验中,以细沙作为底质幼虫附着顺利,而养殖池塘中多为泥沙混合底质或泥底质,单环刺螠幼虫对于底质的要求和适应能力有待于进一步研究。
3.3、 环境因子对单环刺螠繁殖的影响
单环刺螠在自然海区中的繁殖期为4—5月和9—10月[5],此期间水温15~25°C,因此在人工强化培育亲体时不宜超过15°C。从GSI变化规律来看单环刺螠有集中排放的现象,一般发生在大潮期或降雨后,海区理化因子变化剧烈对亲体排放是天然的刺激诱导。在育苗生产中,除了可用解剖法获得单环刺螠受精卵外,也可用降温处理的方法人工诱导亲体排放精卵[34]。
王力勇等[35]采用单因子实验方法分析了环境因子对单环刺螠孵化率的影响规律,得出较为适宜的环境条件为温度15~21°C、盐度27.2、pH 8.02。本研究的正交实验结果显示,孵化率的最佳环境条件为温度15℃、盐度25、pH 8~9,与前者研究结果相近。牛从从等[6]报道单环刺螠精子适宜的盐度为20~30(最佳盐度为25),适宜的pH为7~9(最佳pH为8)。本实验所得出的单环刺螠受精率的最佳环境条件为温度25℃、盐度35、pH 8~9,可见较高的温度和盐度有利于受精作用的完成,但从自然海水的盐度以及精子活力、孵化率等综合分析,以盐度25、pH 8左右为单环刺螠适宜的繁殖环境。温度越高,精子新陈代谢越快、寿命越短,而且本实验结果显示盐度是受精率的主要影响因子,无需以升温的方式提高受精率。在胚后发育期,适温范围内,随着培育温度的升高,发育时间会缩短[36]。因此进一步研究单环刺螠的生物学零度和各发育阶段的有效积温,有助于在育苗生产中通过温度调节的方式调控生产周期。
图版Ⅰ 单环刺螠胚胎发育活体及切片光镜观察

Plate Ⅰ Viviperception and histological observation of the embryo development of U. unicinctus by light microscopic
1.成熟卵;2. 受精卵,示受精膜举起及围卵黄周隙形成(↑);3. 排出第一极体;4. 排出第二极体,示3个极体(↑);5. 2细胞期;6. 4细胞期;7. 16细胞期;8. 囊胚期;9. 原肠早期,示植物极内陷(↑);10. 原肠中期,示动物性半球外包;11. 原肠晚期,示纤毛(↑);12. 膜内担轮幼虫;13. 成熟卵纵切(H.E染色);14. 卵裂期纵切(H.E染色);15. 囊胚期(H.E染色);16. 原肠期纵切(H.E染色),示植物极内陷(↑)。AP. 动物极;BB. 大分裂球;Bc. 囊胚腔Ci. 纤毛;Eb. 外包;FM. 受精膜;Ig. 内陷;Nu. 细胞核;PB. 极体;PL. 围卵黄周隙;SB. 小分裂球;VP. 植物极;YG. 卵黄颗粒1.mature oocyte; 2. fertilized egg, showing the fertilization membrane lift and the perivitelline lacunae formation (↑); 3. first polar body; 4. second polar body, showing three polar bodies (↑); 5. 2-cell period ; 6. 4-cell period; 7. 16-cell period; 8. blastula stage; 9. early gastrula stage, showing the vegetal pole invagination (↑); 10. middle gastrula stage,showing the animal pole epiboly (↑); 11. later gastrula stage showing the cilium (↑); 12. intramembrane trochophore; 13. longitudinal section of mature oocyte (H.E) ; 14. longitudinal section of cleavage stage (H.E) ; 15. blastula stage (H.E) ; 16. longitudinal section of gastrula stage (H.E), showing the vegetal pole invagination (↑). AP. Animal pole; BB. big blastomere; Bc. blastular cavity; Ci. cilium; Eb. epiboly; FM. fertilization; Ig. invagination; Nu. nuclues; PB. polar body; PL. perivitelline lacunae; SB. Small blastomere; VP. Vegetal pole; YG. Yolk granule
图版II 单环刺螠幼体发育光镜观察

Fig. II Light microscopic observation of the paedomorphosis of Urechis unicinctus
1. 担轮幼虫前期,示纤毛环(↑);2. 担轮幼虫后期 ;3. 体节幼虫,示纤毛环(↑);4. 蠕虫状幼虫早期,示消化道(↑);5. 蠕虫状幼虫后期;6. 幼螠,示吻(↑)。As. 肛门囊;CR. 纤毛环;DG. 消化道;KT. 肾管;Li. 吻1. protrochophora, showing ciliary ring (↑); 2. late stage of the trochophore; 3. sectorial larva, showing ciliary ring (↑); 4. early stage of the wormlike larva, showing digestive tract (↑); 5. late stage of the wormlike larva; 6. juveniles, showing lips (↑). As. Anal sac; CR. Ciliary ring; DG. digestive tract; KT. Kidney tube; Li. Lips
参考文献
[1] 杨桂文, 安利国, 孙忠军. 单环刺螠营养成分分析[J]. 海洋科学, 1999(6): 13-14.
[2] 赵欢, 韩宝芹, 刘万顺, 等. 单环刺螠多肽抗肿瘤及对小鼠免疫功能的调节作用[J]. 中国天然药物, 2008, 6(4): 302-306.
[3] Ma Y B, Zhang Z F, Shao M Y, et al. Sulfide: Quinone oxidoreductase from echiuran worm Urechis unicinctus[J]. Marine Biotechnology, 2011, 13(1): 93-107.
[4] 王航宁, 邵明瑜, 张志峰. 单环刺螠精巢年周期发育及精子发生[J]. 中国水产科学, 2011, 18(5): 1189-1195.
[5] 李昀, 王航宁, 邵明瑜, 等. 单环刺螠生殖腺的发生及雌体的生殖周期[J]. 中国海洋大学学报, 2012, 42(6): 81-84.
[6] 牛从从, 张志峰, 邵明瑜. 单环刺螠虫精子生物学特性和环境因子的关系[J]. 中国水产科学, 2005, 12(5): 556-561.
[7] 董英萍, 张志峰, 邵明瑜. 单环刺螠受精过程的细胞学观察[J]. 中国水产科学, 2011, 18(4): 760-765.
[8] Suer A L. Growth and spawning of Urechis caupo (Echiura) in Bodega Harbor, California[J]. Marine Biology, 1984, 78(3): 275-284.
[9] 陈兴汉. 疣吻沙蚕繁殖生物学探讨[J]. 海洋与渔业, 2014(8): 64-66.
[10] 王如才. 海水贝类养殖学[M]. 青岛: 青岛海洋大学出版社, 1993.
[11] Sykes A V, Domingues P M, Andrade J P. Effects of using live grass shrimp (Palaemonetes varians) as the only source of food for the culture of cuttlefish, Sepia officinalis (Linnaeus, 1758)[J]. Aquaculture International, 2006, 14(6): 551-568.
[12] Laptikhovsky V V, Nigmatullin C M. Egg size, fecundity, and spawning in females of the genus Illex (Cephalopoda: Ommastrephidae)[J]. ICES Journal of Marine Science, 1993, 50(4): 393-403.
[13] 杜荣斌, 刘红梅, 郑家声, 等. 人工养殖条件下多齿围沙蚕亲体培育和繁殖生物学的初步研究[J]. 海洋科学, 2009, 33(11): 37-43.
[14] 兰国宝, 阎冰. 方格星虫繁殖生物学研究[J]. 水产学报, 2002, 26(6): 503-509.
[15] 李诺, 宋淑莲, 唐永政. 单环刺螠[J]. 生物学通报, 1998, 33(8): 12-14.
[16] Collins M A, Burnell G M, Rodhouse P G. Reproductive strategies of male and female Loligo forbesi (Cephalopoda: Loliginidae)[J]. Journal of the Marine Biological Association of the United Kingdom, 1995, 75(3): 621-634.
[17] Arp A J, Hansen B M, Julian D. Burrow environment and coelomic fluid characteristics of the echiuran worm Urechis caupo from populations at three sites in northern California[J]. Marine Biology, 1992, 113(4): 613-623.
[18] 张志南, 孙文林, 于子山, 等. 日本刺沙蚕大规模移植的生态学研究[J]. 海洋与湖沼, 1993, 24(5): 520-526.
[19] 陈健. 舟山沿海单齿螺和锈凹螺生物学特性研究[D]. 舟山: 浙江海洋学院, 2013.
[20] 竺俊全, 王武, 应雪萍, 等. 可口革囊星虫受精过程及早期卵裂的细胞学变化[J]. 动物学报, 2008, 54(2): 290-298.
[21] 孙慧玲, 方建光, 王清印, 等. 泥蚶受精过程的细胞学荧光显微观察[J]. 水产学报, 2000, 24(2): 104-107.
[22] 毕克, 包振民, 黄晓婷, 等. 菲律宾蛤仔受精及早期胚胎发育过程的细胞学观察[J]. 水产学报, 2004, 28(6): 623-627.
[23] 康现江, 王所安, 堵南山, 等. 中国对虾受精过程中精卵核的细胞学变化[J]. 动物学报, 2001, 47(2): 182-186.
[24] 朱冬发, 王春琳, 余红卫, 等. 三疣梭子蟹(Portunus trituberculatus)卵子发生、激活与早期卵裂的细胞学观察[J]. 海洋与湖沼, 2005, 36(5): 423-429.
[25] Stricker S A, Smythe T L. 5-HT causes an increase in cAMP that stimulates, rather than inhibits, oocyte maturation in marine nemertean worms[J]. Development, 2001, 128(8): 1415-1427.
[26] 范广钻, 郑佩玉, 钟惠英, 等. 双齿围沙蚕Preinereis aibuhitensis Grube雌性生殖腺发育的组织学研究[J]. 浙江水产学院学报, 1983, 2(2): 105-113, 4.
[27] 于海志, 朱丽岩, 郑家声. 岩虫的性腺发育和生殖周期[J]. 中国水产科学, 2005, 12(6): 669-672.
[28] 柯巧珍, 李琪, 闫红伟, 等. 山东北部沿海四角蛤蜊性腺发育年周期研究[J]. 中国海洋大学学报, 2012, 42(11): 28-34.
[29] 段薛辉, 刘文生, 许爱娱, 等. 疣吻沙蚕胚胎发育观察及盐度对其孵化的影响[J]. 南方水产科学, 2017, 13(4): 115-121.
[30] Aranda-Burgos J A, Da Costa F, Nóvoa S, et al. Embryonic and larval development of Ruditapes decussatus (Bivalvia: Veneridae): A study of the shell differentiation process[J]. Journal of Molluscan Studies, 2014, 80(1): 8-16.
[31] 徐小伟, 张鹏飞, 黄妙琴, 等. 波纹巴非蛤早期发育的扫描电镜观察[J]. 福建水产, 2015, 37(4): 263-269.
[32] 康庆浩, 郑家声, 金在敏. 单环刺螠(Urechis unicinctus)的人工苗种生产研究Ⅰ. 水温对胚胎发育及幼体培育的影响[J]. 青岛海洋大学学报, 2002, 32(2): 273-278.
[33] 陈宗涛, 张志峰, 牛从从, 等. 单环刺螠虫变态前幼虫发育的同工酶及酶学研究[J]. 中国水产科学, 2005, 12(3): 233-238.
[34] 许星鸿, 霍伟, 孟霄, 等. 单环刺螠人工育苗及养殖技术[J]. 科学养鱼, 2016(2): 44-45.
[35] 王力勇, 胡丽萍, 姜黎明, 等. 单环刺螠的人工苗种生产研究Ⅰ. 环境因子对单环刺螠受精与孵化的影响[J]. 中国渔业质量与标准, 2017, 7(4): 37-44.
[36] 吴杨平, 陈爱华, 姚国兴, 等. 大竹蛏胚胎发生及稚贝发育基本特征[J]. 动物学杂志, 2012, 47(4): 74-81.