摘 要: 目的:观察并分析婴儿胆汁淤积性肝病(ICH)肠道菌群特征。方法:收集武汉儿童医院符合ICH标准的患儿及健康儿童粪便标本20例。所有标本均进行16S rRNA高通量测序后,通过α多样性、LEfSe进行差异分析,比较ICH组和健康对照组儿童肠道菌群的构成、粪菌丰度和差异性等特征差异。结果:ICH组患儿粪菌丰度(Chao1指数)较健康对照组显着降低(P<0.05),多样性(Shannon指数、Simpson指数)差异无统计学意义(P>0.05)。LEfSe软件分析提示,在粪菌门水平方面,ICH组患儿粪菌放线菌门(Actinobacteria)丰度较健康对照组患儿显着降低(LDA>4,P<0.05)。粪菌属水平方面,ICH组患儿粪菌中肠球菌属(Enterococcus)、链球菌属(Streptococcus)、肠杆菌属(Enterobacter)丰度均较健康对照组患儿显着增加(LDA>4,P<0.05),而双歧杆菌属(Bifidobacterium)丰度较健康对照组显着降低(LDA>4,P<0.05)。结论:ICH患儿发生了肠道菌群紊乱,表现为肠道菌群丰度下降,有益共生菌(双歧杆菌属)减少,而机会致病菌(肠球菌属、链球菌属、肠杆菌属)增多。
关键词: 婴儿胆汁淤积性肝病; 肠道菌群; 高通量测序;
Abstract: Objective:To observe and analyze the characteristics of gut microbiota in children with infantile cholestatic hepatopathy(ICH).Methods:Fecal specimens of 20 children who met ICH standard and healthy children were collected in Wuhan Children's Hospital. After 16 S rRNA high-throughput sequencing of all specimens, the composition, abundance and difference of gut microbiota between the two groups were compared by alpha persity, LDA effect size analysis.Results:The abundance of the gut microbiota was lower significantly in ICH group(Chao1 index,P<0.05). But there was no significant difference in persity.In particular, Actinobacteria(LDA>4,P<0.05), Bifidobacterium(LDA>4,P<0.05) were significantly decreased in ICH, while Enterococcus(LDA>4,P<0.05), Streptococcus(LDA>4,P<0.05), and Enterobacter(LDA>4,P<0.05)were significantly increased.Conclusion:Dysbiosis of gut microbiota occurred in children with infantile cholestatic hepatopathy, and showed that benefical symbiotic bacteria decreased, pathogenic bacteria increased.
Keyword: infantile cholestatic hepatopathies; gut microbiota; high-throughput sequencing;
婴儿胆汁淤积性肝病(ICH )是婴儿肝病中就诊和入院治疗的首要原因[1],也是中国儿童终末期肝病肝移植的主要 适应症[2],是婴儿期致死或致残的重要原因 。肝脏与肠道,在胚胎阶段均起源前肠,通过门静脉相互关联,是解剖上的“远亲”,功能上的“近邻”。肠道菌群是调节肝脏生理、病理功能的重要参与者[3]。本研究拟通过细菌16S rRNA高通量测序,初步探索ICH患儿肠道菌群特征,现报道如下。

1、 资料与方法
1.1 、一般资料
选取2018年7月至2019年7月武汉儿童医院收治的10例ICH患儿为研究对象,并选取健康婴儿10例作为对照。两组儿童间的性别和年龄(88.3±39.85)vs(72.7±27.11)d均差异无统计学意义。本研究经过医院伦理委员会审查和批准,家长知情并签署知情同意书。
1.2 、纳入排除标准
ICH的诊断标准[4,5]:①1岁以内发病;②直接胆红素(DBil)>17 μmol/L(1 mg/dl);血丙氨酸氨基转移酶(ALT)和(或)天冬氨酸氨基转移酶(AST)增高;③临床伴有黄疸、粪便颜色变浅或白陶土样便、尿色加深、肝脏质地变硬或肿大(肋下可触及>2.0 cm)。ICH组患儿纳入标准:①符合ICH的诊断标准[4,5];②近1个月内未接受微生态制剂或抗生素治疗。排除标准:①不符合纳入标准;②其母孕期及哺乳期有长期用药及益生菌制剂应用史。健康对照组纳入标准:①足月健康儿;②年龄1岁以内;③体格检查及生化指标均正常;④近期无感染性腹泻、肠炎等病史;⑤近4周无抗生素及益生菌制剂等应用史。健康对照组的排除标准与ICH组一致。
1.3、 研究方法
将粪便标本送至天一辉远公司进行高通量16SrRNA基因测序技术分析,其分析技术方法如下:①无菌器皿收集ICH患儿和健康儿童的新鲜粪便,分装至灭菌冻存管后储存到-80℃冰箱备用。②用QIAamp DNA Stool Mini Kit试剂盒提取粪便样本DNA。③PCR扩增及产物纯化:标准细菌16SrRNA基因V4区的PCR扩增。引物信息:520F(5-AYTGGGYDTAAAGNG-3) 802R(5-TACNVGGGTATCTAATCC-3)。④文库制备与库检:采用标准的Illumina Miseq PE250文库构建及测序流程。⑤测序及分析:Miseq上机测序,将所有分离的高质量样本序列做聚类分析,选取同源性≥97%的序列作为一个操作分类单位(OTU)。然后,以单个样本中获取的最低序列数作为OTU丰度的参照标准,通过QIIME2分析α多样性。LEfSe差异分析(LEfSe)采用Python LEfSe包进行(http://huttenhower.sph.harvard.edu.forest.naihes.cn/galaxy)。
1.4 、统计学方法
采用SPSS 19.0软件进行数据分析。计量资料用x?±s表示 ,正态分布且方差相等的连续变量采用t检验,否则使用秩和检验。计数资料选用χ2检验。P<0.05表示差异有统计学意义 。
2 、结果
2.1、 两组患儿粪菌Alpha多样性分析
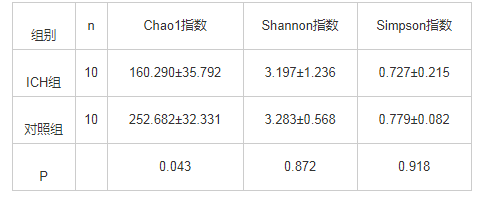
ICH组患儿粪菌丰度显着低于对照组,两组间粪菌多样性差异无统计学意义,见表 1。
表1 两组儿童粪菌 Alpha多样性比较
2.2 、两组患儿粪菌物种构成及丰度差异情况
2.2.1、 两组患儿粪菌门水平结构差异
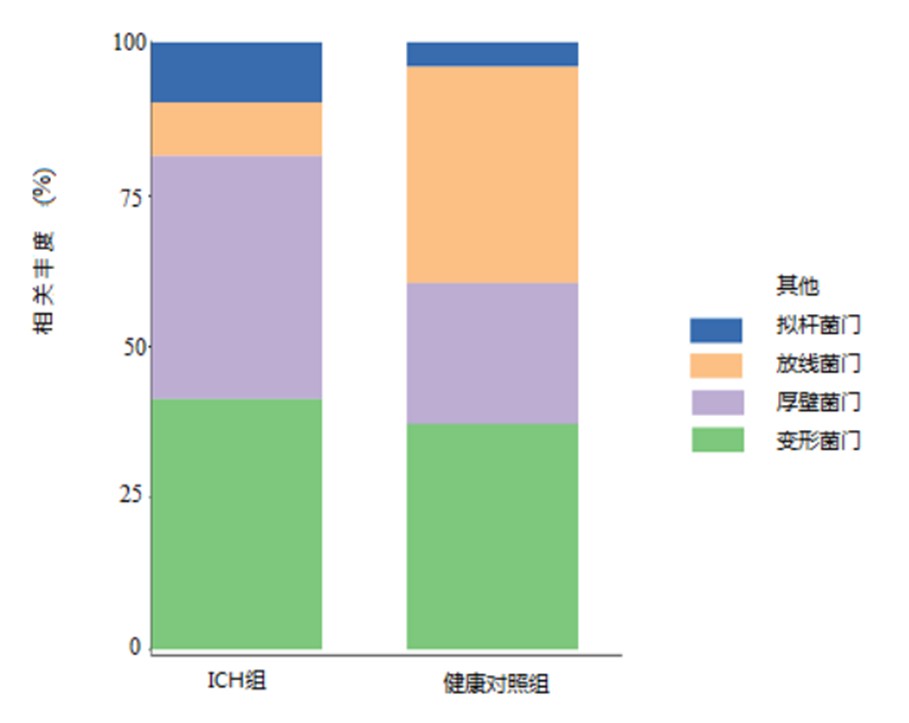
在门水平上共检测到23个菌门,所测到的菌门中99.95%以上由变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)构成。其中放线菌门、变形菌门和厚壁菌门是健康对照组粪群的三大主要菌门,三者共占粪菌的99.77%。变形菌门和厚壁菌门是ICH组中最具优势的两大门类,其所占比例达 81.48%(见图1 )。
图1 两组儿童粪菌间门水平结构差异
2.2.2 、两组患儿粪菌属水平结构差异
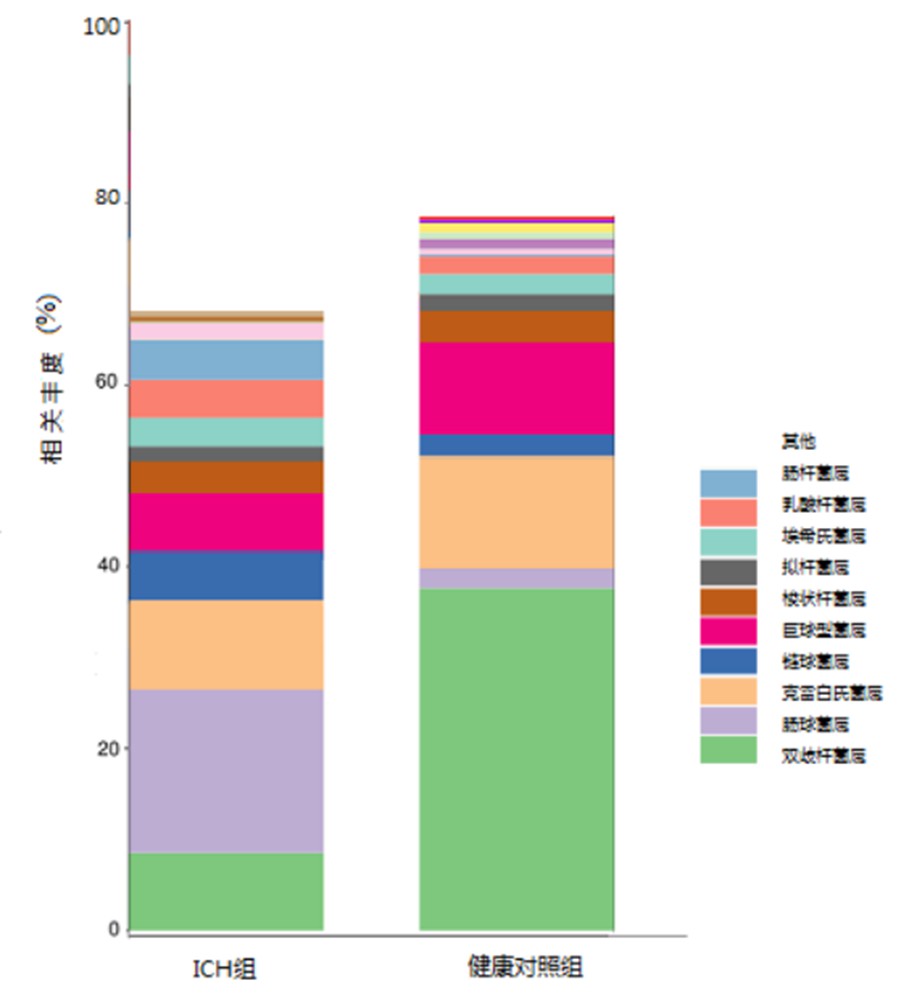
在属水平上共测得284个属,前10位的菌属为双歧杆菌属(Bifidobacterium)、肠球菌属(Enterococcus)、克雷白氏杆菌属(Klebsiella)、链球菌属(Streptococcus)、巨球型菌属(Megasphaera)、梭状杆菌属(Clostridium)、拟杆菌属(Bacteroides)、埃希氏菌属(Escherichia)、乳酸杆菌属(Lactobacillus)、肠杆菌属(Enterobacter)。与健康对照组儿童比较,ICH组患儿粪菌中双歧杆菌属、肠杆菌属、肠球菌属、链球菌属存在差异 (见图 2) 。
图2 两组儿童粪菌间属水平结构差异
2.3、 两组患儿粪菌间LEfSe差异性分析
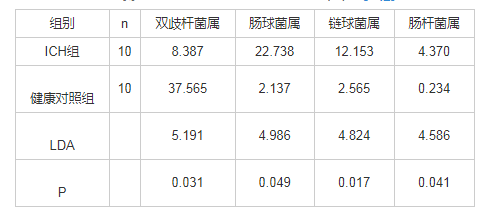
在粪菌门水平上,与健康对照组比较,ICH组患儿粪菌中放线菌门丰度较低,存在统计学差异(LDA>4,P<0.05),见表2。在粪菌属水平上,与健康对照组比较,ICH组患儿粪菌中双歧杆菌属丰度较低,存在统计学差异(LDA>4,P<0.05)。而肠球菌属、链球菌属、肠杆菌属丰度均较高,差异有统计学意义(均LDA>4,P<0.05),见表3。
表2 两组患儿粪菌间相对丰度较高菌门的比较 (%)
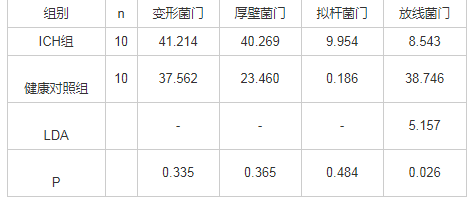
表3 两组患儿粪菌间丰度存在显着改变的菌属比较 (%)
3 、讨论
肝脏与肠道之间通过门脉循环形成紧密的解剖、功能双向联通网络。在ICH的发生和发展过程中,肠道菌群通过调节新陈代谢、免疫反应、胆汁酸代谢发挥着重要的作用[6]。有研究表明[7],肠道菌群可以直接参与到ICH的发病机制中,因此研究肠道菌群具有重要价值。
本研究采用16S rRNA高通量测序技术分析两组患儿肠道粪菌分布情况,能弥补传统的微生物体外培养导致的敏感性差、准确率低等不足,可较全面地研究ICH患儿肠道菌群的变化。结果显示,与健康对照组相比,ICH组患儿肠道粪菌多样性无明显变化,但门属水平粪菌丰度存在不同程度改变。在门水平上,ICH组患儿粪菌中放线菌门丰度显着降低。变形菌门、厚壁菌门和拟杆菌门丰度增高,但差异无统计学意义。在属水平上,ICH组患儿粪菌中双歧杆菌属丰度显着降低,肠球菌属、链球菌属、肠杆菌属丰度显着增高。该结果表明ICH患儿肠腔正常优势菌属(双歧杆菌属)受抑制,而条件致病菌属(肠球菌属、链球菌属及肠杆菌属)过度生长。Wang等[8]发现定植于肠道黏膜上皮细胞表面的双歧杆菌属,不仅能在定植区形成物理性菌膜屏障,而且能上调上皮细胞间紧密连接蛋白的表达,发挥肠道屏障功能,从而抑制潜在致病菌过度增长。ICH患儿肠道粪菌双歧杆菌属丰度减少伴多种条件致病菌属增长,存在肠道菌群失衡,这一结论与江铃等[9]采用一代测序技术研究结论基本一致,但本研究分析了肠道菌群在门、属不同水平的异同,所得结果相对全面准确。在成人常见的胆汁淤积型肝病原发性硬化性胆管炎(PSC)患者中也发现存在肠道菌群失衡。Rossen等[10]发现 PSC患者肠道梭菌目丰度降低,可能通过影响胆汁酸代谢及肠道微环境参与PSC发病。Sabino等[11]发现PSC患者粪便肠球菌、梭菌属及乳杆菌丰度明显增加。Torres等[12]发现PSC患者Blautia及Barnesiellaceae明显增加,主要是梭菌目发生改变。尽管与成人胆汁淤积型肝病患者肠道菌群“种和属”层面上的研究结果存在着不同,但不可否认ICH婴幼儿期患儿肠道菌群也发生了紊乱。研究证实肠道微生态紊乱能导致肠道致病菌释放大量内毒素等各种毒素,严重损伤肠道屏障结构和功能,诱导大量促炎细胞因子释放,促进慢性肝病的发生发展[13],因此调节肠道菌群的平衡可能成为辅助治疗ICH的新靶点 。
综上所述,本研究通过高通量测序技术明确了ICH存在肠道菌群紊乱,表现为肠道菌群物种的丰度降低,有益菌大量减少,条件致病菌增多,为后期ICH微生态学研究提供了部分依据。 至于其肠道菌群中是否存在标志性差异菌种,以及调控其菌群失衡对改善临床疗效方面作用如何,有待后期进一步大样本研究。
参考文献
[1]刘艳,黄志华.婴儿胆汁淤积性肝病的诊断与治疗[J].临床肝胆病杂志,2015,31(8):1218-1220.
[2] 中华医学会器官移植学分会,中国医师协会器官移植医师分会.中国儿童肝移植临床诊疗指南(2015版)[J].临床肝胆病杂志,2016,32(7):1235-1244.
[3]王芳昭,崔茜如,曾雨浓,等.肠道菌群-肝脏疾病的重要参与者[J].南方医科大学学报,2020,40(4):595-600.
[4]Moyer V,Freese DK,Whitington PF,et al.Guideline for the evaluation of cholestatic jaundice in infants:recommendations of the north American society for pediatric gastroenterology,hepatology and nutrit-ion[J].Pediatr Gastroenterol Nutr,2004,39 (2):115-128.
[5]董永绥.婴儿胆汁淤积性肝病研究进展及展望[J].中国实用儿科杂志,2013,28(4):241-245.
[6]朱琳,邢卉春.肠道菌群与胆汁淤积性肝病[J].中华肝病杂志,2019,27(5):325-329.
[7]Tabibian JH,Hara SP,Trussoni CE,et al.Absence of the intestinal microbiota exacerbates hepatobiliary disease in a murine model of primary sclerosing cholangitis[J].Hepatology,2016,63(1):185-196.
[8] Wang H,Gong J,Wang W,et al.Are there any different effects of bifidobacterium,lactobacillus and streptococcus on intestinal sensation,barrier function and intestinal immunity in PI-IBS mouse model[J].PLo S One,2014,9(3):e90153.
[9]江玲,单庆文,王琳琳,等.婴儿肠道菌群与分娩方式、喂养方式及胆汁淤积性肝病的关系[J].实用儿科临床杂志,2012,27(7):498-501.
[10] Rossen NG,Fuentes S,Boonstra K,et al.The mucosa associated microbiota of PSC patients is characterized by low persity and low abundance of uncultured Clostridiales II[J].J Crohns Colitis,2015,9(4):342-348.
[11] Sabino J,Vieira-Silva S,Machiels K,et al.Primary sclerosing cholangitis is characterised by intestinal dysbiosis independent from IBD[J].Gut,2016,65(10):1681-1689.
[12]Torres J,Bao X,Goel A,et al.The features of mucosa-associated microbiota in primary sclerosing cholangitis[J].Aliment Pharmacol Ther,2016,43(7):790-801.
[13]Li Y,Tang R,Leung PSC,et al.Bile acids and intestinal microbiota in autoimmune cholestatic liver diseases[J].Autoimmun Rev,2017,16(9):885-896.