
射频消融术是临床治疗局灶性房性心动过速( Fa-calatrial atrial tachycardia,FAT) 的有效方法,但由于儿童 FAT 起源部位变异度较大,常规标测方法空间结构难以定位,增加了治疗的不确定性[1]。三维标测系统( Three dimensional mapping system,CARTO) 用以指导成人 FAT 射频消融治疗已取得显着成效,但在儿童FAT 治疗中应用的报道较少。本研究对 58 例 FAT 患儿在 CARTO 指导下行射频消融治疗,探讨其可行性及安全性,现报道如下。
1 资料与方法
1. 1 入选标准与排除标准: 入选标准: ①符合《儿科学》中相关诊断标准[2],有明显临床症状,经心电图、心脏超声、体格检查等确诊; ②经心理及药物治疗无效或无法耐受长期药物治疗者; ③纽约心功能分级( NY-HA)Ⅰ - Ⅱ级; ④家属签署知情同意书。排除标准: 合并严重的器质性心脏病。
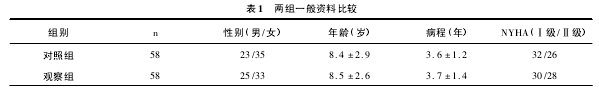
1. 2 临床资料: 选取 2011 年 1 月至 2014 年 1 月在本院治疗的 FAT 患儿 116 例。将 116 例患 者 采 用SPSS17. 0 产生的随机数字表随机分为两组,每组 58例,两组一般资料比较差异无统计学意义( P >0. 05) ,具有可比性,见表 1。
1. 3 方法: 两组术前均停用抗心律失常药物超过 5 个半衰期。对照组在 X 线透视下进行射频消融,观察组在 CARTO 标测指导下进行射频消融,具体操作如下:
1. 3. 1 电生理检查: 将电极导管放置在冠状静脉窦、希氏束、右心室尖及高位右房上; 程序刺激以诱发房速,根据房速最早心房电激动点结合体表心电图 P 波形态判断点激动起源部位。
1. 3. 2 CARTO 标测: 激动顺序标测采用 CARTO XP系统( 美国 Bio - sense Webster 公司生产) 。以冠状静脉窦远端作为参考电极,调整好感兴趣窗,一般将心动过速周长的 90%设置为房速时电激动采集窗口,在房速发生时构建左心房或右心房的三维解剖及激动顺序模型; 依次标测上腔静脉、下腔静脉、冠状静脉窦、希氏束、三尖瓣环、房间隔、心房等碎裂电位,或重点标测双电位区域。在标测中如电激动从最早激动点离心性传导,心房内总激动时间短于心动过速周长则可判定为FAT。如果激动顺序为为围绕一个中心点向四周放射样传导,消融靶点为最早激动点; 如果激动顺序为最早激动点与最晚激动点首尾相连,消融靶点为关键性峡部。
1. 3. 3 射频消融术: 在 CARTO 标测下确定好消融靶点后进行消融。将温度控制在 43℃ -45℃范围内; 功率设置为 30 -35W; 每次放电 30 -60s,放电 10s 内终止房速为有效靶点,继续巩固放电 30s。
1. 4 观察指标: 在治疗过程中记录 X 线曝光量、曝光时间及手术时间; 术后第 1、2、7、14d 定期做心电图检查以平价治疗效果; 随后随访 6 -12 个月,每 2 个月随访一次 24hHolter 以观察心律失常发作情况及房速复发情况。
1. 5 消融成功判断标准: 术后 30min - 1h 内行心房刺激、顺序刺激以及静脉滴注盐酸异丙肾上腺素等,仍无法再次诱发房速; 术后患者不服用任何抗心律失常药物无房速发作。
1. 6 统计学方法: 采用 SPSS17. 0 软件包对数据行统计学分析,计量资料用( x珋 ± s) 表示,采用 t 检验; 计数资料采用 χ2检验,P <0. 05 为差异有统计学意义。
2 结 果
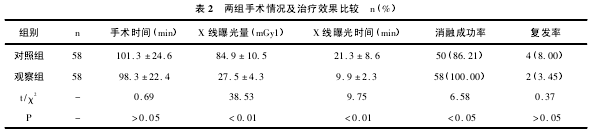
两组手术时间比较差异无统计学意义( P > 0.05) ; 观察组消融成功率高于对照组的( P < 0. 05) ; 观察组 X 线曝光时间短于对照组的( P < 0. 01) ; 曝光量小于对照组的( P <0. 01) ; 观察组成功消融患者术后 6个月内有 2 例复发 FAT 心律失常,对照组有 4 例复发,两组复发率比较差异无统计学意义( P >0. 05) ,见表 2。
3 讨 论
局灶性房性心动过速的电生理特征为电激动起源于心房小面积的异位灶,以此向其周围心房组织传导[3]。FAT 可发生于儿童各年龄段,但有关儿童 FAT的流行病学资料极为有限,加之小儿组织器官尚未发育完全,临床目前尚缺乏无争议且具有理论依据的治疗指南。
射频消融术是临床治疗房速的有效方法,近年研究发现其在儿童 FAT 治疗中安全可靠,但其疗效不仅取决于手术技术,还取决于术中的标测方法。在 CAR-TO 标测系统出现之前,常规的标测手段是在心动过速发作时采用大头导管交替标测以寻找房速的最早激动点,即俗称的“蛙跳法”[4]。该手段对右房的 FAT 标测快速、准确,但由于左房结构复杂,常常无法准确标测消融靶点。Hanumandla 等[5]研究报道,对 FAT 患者在常规标测方法下进行射频消融的成功率仅为 75% -90% 。本研究中,对照组消融成功率仅为 86. 21% ,而且消融不成功者多为左房 FAT,与文献报道基本相符,证实常规标测方法在一定程度上影响射频消融疗效。
CARTO 系统是目前最为先进的电生理标测与导航系统之一,其通过体表的三对电极产生三维正交电场,这些电极导管所采集的电信号可作出三维定位,进而构造出心腔的三维几何图形,能引导导管在感兴趣区域进行精细标测,提高消融靶点定位的准确性[6]。
房速从发病机制而言主要分为局灶性及大折返性,局灶性在 CARTO 系统构建的三维图像及顺序模型中主要表现为电激动围绕一个中心点呈离心性传导,而该中心点往往是 FAT 的最早激动点,可作为消融靶点[7]。叶钜亨等[8]研究报道,在 CARTO 引导下射频消融成功率可达 95. 7%。本研究中,观察组射频消融成功率为 100%,高于对照组的 86. 21%,与文献报道基本相符,证实 CARTO 系统对儿童 FAT 的标测更为准确,为消融靶点的定位提供可靠依据。左心房的结构较为复杂,消融靶点较难定位。CARTO 的顺序模型往往表现为整个房间隔均为红色,这时候穿刺房间隔后重点标测即可准确定位最早激动点,方便、精准。X线多体位投照是射频消融术完成的必备过程,但长时间的 X 线暴露会对身体造成一定伤害[9]。由于儿童FAT 起源部位变异度较大,与 CARTO 相比,常规标测方法空间结构难以定位或定位耗时较长,X 线曝光量及照射时间较长。孙朝阳等[10]研究报道,CARTO 引导下射频消融,X 线曝光量较常规标测手段减少 30%- 50% ,而曝光时间可缩短 50% 以上。本研究中,观察组 X 线曝光量小于对照组,而曝光时间也显着短于对照组( P <0. 01) ,提示 CARTO 可减少 X 线对患者造成的损害。
参考文献:
[1] Torok RD,Wei B,Kanter RJ,et al. Thoracoscopic resectionof the left atrial appendage after failed focal atrial tachycardiaablation[J]. Ann Thorac Surg,2014,97( 4) : 1322 - 1327.
[2] 王卫平. 儿科学[M]. 第 8 版. 北京: 人民卫生出版社,2013. 102.
[3] 刘育,等. 局灶性房性心动过速动物模型[A]. 2012 全国心律失常的现代诊疗新进展专题会议论文集[C]. 2012.115.
[4] 李起栋,廖凯,方石虎,等. 常规电生理标测射频导管消融术治疗局灶性右心房房性心动过速[J]. 重庆医学,2012,41( 7) : 709 - 711.
[5] Hanumandla A,Kaur D,Shah M,et al. Epicardial ablationof focal atrial tachycardia arising from left atrial appendage inchildren[J]. Indian Pacing Electrophysiol J,2014,14 ( 4) :199 - 202.
[6] 凌亚萍,曾国兵,林凤云. 71 例阵发性房性心动过速的动态心电图分析与探讨[J]. 现代电生理学杂志,2013,20( 4) :218 -220.
窒息是围生期新生儿的主要死亡原因,国内有关报道其发生率占活产儿的5%~10%,病死率占活产儿死亡的30%左右[1]。新生儿持续肺动脉高压是由多种原因引起的新生儿出生后肺循环压力持续增高,使胎儿型循环过渡到正常成人型循环的过程发生障碍,导致动脉导管...