
钯作为催化剂,常用于合成结构复杂的化合物,在制药工业中有着极其重要的应用。 然而,大量的钯残留在产物中也会造成潜在的污染。 如通过水、上层土壤等途径进入动植物体内,并经由食物链放大富集进入人体并与DNA及其它生物大分子结合,极低浓度就能破坏人体正常的生理活动。
如何有效地对钯进行检测受到越来越多关注。传统的重金属检测方法主要有AAS法、ICP-AES法和X射线荧光法等。 在实际应用中,建立一种方便快捷、对钯有高灵敏度且选择性专一的检测方法就显得尤为重要。近年来,基于离子诱导产生的荧光变化机理检测金属离子的荧光探针技术备受关注,此类方法具有诸多优点:灵敏度和选择专一性较好, 测定时间短, 样品不需要复杂的提纯, 预处理简单且成本低。
菲因其分子结构内存在大型π-π共轭体系,容易吸收能量而跃迁到激发态并发出荧光。当分子中的9位H被Br取代后,虽然由于重原子效应而导致荧光强度减弱,但也因在分子内引入Br原子,而具有一些新的特性。
我们通过实验首次发现溴代菲(BrP)中的Br具有一定的配位活性,可与Pd2+反应生成稳定的配合物,配合物的荧光强度较之溴代菲显著增强,在此基础上,我们研究了将溴代菲作为探针对Pd2+进行检测。
1 实验部分
1.1 仪器与试剂
LS-55发光光谱仪(PerkinElmer),扫描速度为300 nm/min,入射和出射狭缝均为 10 nm;Lambda35紫外光谱仪(PerkinElmer);电子分析天平(美国Ohaus)。9-溴菲(99.7%,百灵威),硝酸钯、硝酸、无水乙醇等(分析纯,北京化工厂),去离子超纯水(Milli-Q Academic Millipore, USA),水样取自自来水。
1.2 实验方法
称取9-BrP 0.257 g,用无水乙醇溶解、定容,配成浓度为1×10-2mol/L的9-BrP储备溶液。移取一定量9-BrP 储备溶液稀释、配制成预定浓度溶液,测定其荧光光谱。
向一定浓度的9-BrP溶液中加入1×10-2mol/L的Pd(NO3)2溶液,配制9-BrP-Pd2+二元溶液,测定其荧光、紫外吸收光谱。平行配制一系列该溶液并控制其中乙醇含量,通过定时恒温,放置等方法来考察乙醇含量、温度、反应时间对体系荧光特性的影响。
控制9-BrP浓度,配制Pd2+浓度递增的一系列9-BrP-Pd2+溶液,测定荧光光谱,绘制工作曲线。向一定量自来水水样中加入 9-BrP 以测定 Pd2+含量,并进行Pd2+加标回收测定。
2 结果与讨论
2.1 9-BrP激发与发射光谱
由于9-BrP分子存在重原子效应,其内源荧光较弱。图1中,9-BrP在水溶液中最大激发波长为247 nm(a),最大发射波长为364 nm(b)。当向溶液中加入Pd2+后,体系的特征荧光发射光谱无明显变化,但荧光强度显著增大(c)。【图1】
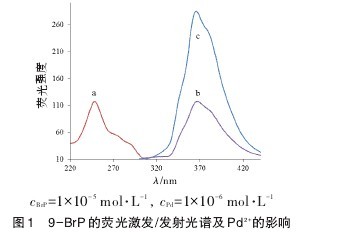
据此我们推测9-BrP和Pd2+发生反应,其机理可能为:Pd2+与取代基Br发生配位结合反应,减弱了Br原子对菲环的吸电子效应,因而配合物的荧光特性有显著提高。另外,配合物形成后,荧光光谱并未发生位移也表明反应对菲环的分子结构形态未造成影响。
2.2 紫外吸收光谱分析
通过紫外吸收光谱表征了 9-BrP 与 Pd2+的反应。由图2可见,二元体系的吸收光谱与9-BrP及Pd2+都有较大差异,9-BrP与Pd2+的最大吸收波长分别位于298和302 nm,而二元体系在276和294nm处出现显著增强的吸收,表明9-BrP与Pd2+生成了稳定的配合物。同时,随着加入的Pd2+浓度增大,体系的吸收进一步增强。【图2】
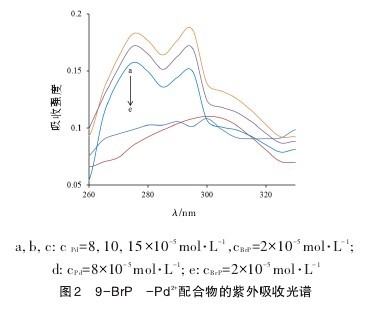
2.3 荧光法探究配位机理
当金属离子同某些配体共存时,可以明显观察到荧光强度的变化,这一现象的存在,有可能用来研究金属离子与配体的结合情态。设金属离子P与配体M结合时有n个相互独立且等同的结合位置。【1-2】

式中[Mt]是配体总浓度,[Mb]是结合在金属离子上的配体浓度,[Pt]为金属离子的总浓度,生成物MnP的浓度可表示为[Mb/n],以及游离配体浓度[M]=[Mt] - [Mb],游离金属离子浓度[P] = [Pt] - [Mb/n],ΔF = F - FD(F是在金属离子溶液中加入配体后体系的荧光强度,FD是自由金属离子的荧光强度,FA是自由配体的荧光强度)。对于9-BrP-Pd2+配合物,我们根据荧光加强理论公式(2),由所测得的实验数据来计算变数([nPt]-[Mb])-1以及对应的线性函数(ΔF-FA)-1,将二者作双倒数图(图3),由斜率可得生成常数KA=2.812×10-4。当结合位置数n=3时,可得到良好的线性关系(r=0.998 3)。【图3】
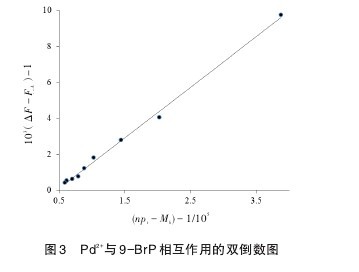
2.4 9-BrP-Pd2+的反应条件
9-BrP具有有机溶解性,与Pd2+的反应进程受温度、放置时间等因素影响较为显著。由图4可见,将溶液临时配制以及常温放置1 h后,9-BrP与Pd2+之间配合反应不充分,其荧光强度比较弱(c、d);而将溶液于333K下恒温放置1 h后,其荧光强度显著增大(a),这是由于较高反应温度能加速反应速率;当溶液中乙醇体积含量为20%,其荧光强度明显降低(b),表明较低浓度的9-BrP在水溶液中溶解分散性良好,再加入乙醇并不能起到使其增溶的作用,反而可能对9-BrP 的荧光造成碰撞猝灭。因此,将9-BrP-Pd2+溶液于333 K恒温1 h待冷却后进行测定即为最优反应条件。【图4】
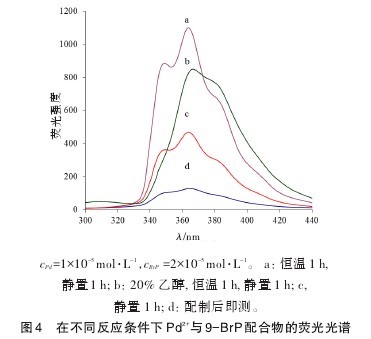
2.5 最低检出限与标准曲线
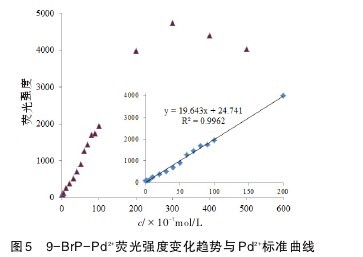
本实验采用直接进样法,不断降低被测物浓度寻找最低检出限。结果表明,逐渐降低9-BrP浓度至(8×10-7mol/L)其荧光强度S/N接近3∶1时,加入Pd2+浓度为4.7×10-8mol/L,体系荧光强度提高5%,此浓度即为Pd2+的最低检出限。选择9-BrP浓度为1×10-5mol/L时,测定并绘制Pd2+浓度标准曲线。图5可见在1×10-7~2×10-5mol/L范围内,配合物体系荧光强度与浓度表现出良好的线性关系(r2=0.996 2)。但是,当Pd2+浓度大于此范围时,荧光强度逐渐降低。造成此现象的原因为配合物对荧光的自吸收。【图5】
2.6 水样测定及加标回收试验
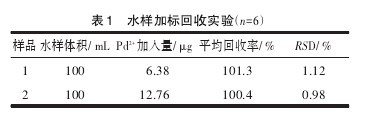
实验检验了水体中常见离子(S2-, Cl-, SO42-, K+,Ca2+, Na+, Mg2+, Al3+和Cu2+等)对9-BrP-Pd2+二元体系荧光特性的影响,结果表明上述离子均不构成明显干扰,无须分离和掩蔽。向自来水水样中加入9-BrP,于333 K下恒温1 h待冷却后,进行Pd2+的2组加标回收试验。结果表明所取自来水样中未检出Pd2+,且加标回收试验(表1)显示该测定方法较为理想。【表1】
3 结论
本文首次发现Pd2+对9-BrP具有显著的荧光增敏效应,紫外吸收光谱法研究表明二者发生稳定的配位反应。 荧光增敏理论公式能较为准确的描述二者之间结合情态。将Pd2+与9-BrP之间的反应用于测定水样中Pd2+离子浓度,由标准曲线可见本方法在较大的Pd2+浓度范围内具有良好线性。对自来水中Pd2+的加标回收实验结果也证明该方法具有可行性,有望为相关研究与应用提供有价值的参考信息。
参考文献
[1]Chen X, Engle K M, Wang D H, et al. Palladium(II)-catalyzed CH activation/CC cross-coupling reactions: versatility and practicality[J]. Angew Chem Int Ed, 2009, 48: 5094 - 5115.
[2]宋慧平, 李鑫钢, 孙津生, 等. 生物吸附-磁分离法处理含Pd(II) /Al( III)的废液 [J]. 化学工程, 2008, 36 (10): 5 - 8.
[3]Wataha J C Hanks C T. Biological effects of palladium and risk of using palladium in dental casting alloys [J]. J Oral Reha, 1996, 25(5): 309 - 320.
分析化学作为化学学科的一个重要分支,它对化学各学科的发展起着重要作用,随着医药、化工、生物工程、食品保健等产业的飞速发展,仪器分析的应用日益广泛,在卫生检验、医学检验、新药开发、食品保...
产品质量分析不仅针对成品,而是涵盖产品生产的全过程,即从原料的选择到进入生产线生产再到产品出厂都需要严格的质量监督检验,只有这样才能保证产品的质量和消费者的使用安全。在进行产品质量分析时,要严格按照相关标准,研究分析产品的每一项质量特性,...