摘 要: 目的 研究使用脂质体转染时目的基因大小对转染效率影响。方法 将大小差异显着的目的基因连接到同一载体,脂质体转染法分别将上述两种目的基因转染至FRT细胞,转染完成24 h后,应用倒置荧光显微镜和流式细胞仪分析转染效率,检测目的基因的大小对转染效率的影响。结果 转染效率均随着脂质体用量增加而上升,无论脂质体浓度如何选择,两种真核表达载体的转染效率均有显着性差异,且目的基因越大,转染效率越低。结论 目的基因与转染效率成反比。
关键词: FRT细胞; pcDNA3.1; 脂质体; 转染; 目的基因大小;
Abstract: Objective To study the effect of target gene size on the efficiency of liposome transfection. Methods The target genes with significant difference in size were connected to the same vector,and the two target genes were transfected into FRT cells by liposome transfection method.After 24 hours of transfection,the transfection efficiency was analyzed by inverted fluorescence microscope and flow cytometry,and the effect of the size of the target gene on the transfection efficiency was detected. Results The transfection efficiency of the two eukaryotic expression vectors increased with the increase of the dosage of liposome.No matter how the concentration of liposome was chosen,the transfection efficiency of the two eukaryotic expression vectors was significantly different,and the larger the target gene,the lower the transfection efficiency. Conclusion The target gene is inversely proportional to the transfection efficiency.
Keyword: FRT cell; pcDNA3.1; liposome; transfection; target gene size;
目的基因导入并表达于真核细胞是确定目的基因生物学活性的必要方法之一,目前常用的目的基因导入方法有电穿孔、病毒介导转染和脂质体转染等[1]。其中,脂质体转染因操作简单且不需要特殊仪器设备而被广泛接受[2]。转染时,不管实际使用的目的基因如何,转染试剂说明书给出的方法都是相同的。但是实际操作时,不同的目的基因转染时的效率不同,而转染效率越高,后续获得阳性克隆的概率越大。因此,本实验研究使用脂质体转染时目的基因大小对转染效率影响,从而为后续的转染实验提供改进措施。
1、 材料和方法
1.1、 主要试剂与仪器
真核表达载体ANO1-EGFP/pcDNA3.1和YFP/pcDNA3.1由本实验室前期构建并完成转化;所用引物由南京诺唯赞公司合成;Lipofectamine 3000脂质体购自Invitrogen公司;质粒提取试剂盒购自北京全式金公司;F-12Ham’s营养培养基购自Sigma公司;血清购自GEMINI公司;FRT细胞由本实验室保存。
Accuri C6(美国BD);倒置荧光显微镜(日本Nikon);CO2培养箱(美国Thermo);超纯水机(美国Millipore);凝胶成像仪(美国Biorad);Nanodrop 2000(美国Thermo)。

1.2、 质粒提取与质量检测
取已转化完成的大肠杆菌接入50 mL的2×YT培养基,过夜培养,按照质粒小提取试剂盒说明书裂解细菌提取质粒。提取完成后,用Nanodrop 2000检测质粒的浓度和纯度,按照Lipofectamine 3000试剂要求,取浓度在500~5000 mg/L的质粒备用。
1.3 、转染及转染效率检测
转染使用细胞为FRT细胞,转染前12 h消化细胞至24孔板,保证转染时细胞密度达到70%~90%。消化后细胞分为两组,每组4个孔,一组转染YFP/pcDNA3.1,另一组转染ANO1-EGFP/pcDNA 3.1。脂质体每个孔用量按梯度设置为3、4、5、6 μL,两种质粒每个孔的用量均为1.5 μg。按照说明书混合完转染试剂和质粒后,室温孵育20 min。孵育时用PBS溶液清洗细胞,去除残留的血清。清洗完成后,每个孔中加入450 μL F12完全培养液。脂质体-质粒混合溶液孵育完成后,向每个孔逐滴加入50 μL混合溶液,摇匀后放入CO2培养箱37 ℃孵育48 h。48 h后检测细胞是否表达目的基因,先在荧光显微镜下观察细胞表达荧光情况,充分消化细胞,利用流式细胞仪检测表达荧光的细胞数量和细胞总数的比值,实验重复3次,数据取平均值。
1.4、 统计学分析
采用SPPSS13.0统计软件进行统计学分析,使用GraphPad Prism 5软件进行作图。
2、 结 果
2.1、 质粒提质量检测结果
质粒使用Nanodrop 2000(美国Thermo)进行检测,质粒在260 nm处有最高峰,YFP/pcDNA3.1浓度为1 853.4 mg/L,A260/A280为1.84,A260/A230为2.04;ANO1-EGFP/pcDNA3.1浓度为1 103.1 mg/L,A260/A280为1.84,A260/A230为2.01。OD260/OD280=1.8~2.0时,即可说明无蛋白质污染,OD260/OD230=2.0~2.2时,即可说明无醇和盐的残留,则ANO1-EGFP/pcDNA3.1和YFP/pcDNA3.1均可认为是纯品且浓度符合实验要求。
2.2、 倒置荧光显微镜观测转染结果
转染48 h后用荧光显微镜观察,可见转染了ANO1的部分FRT细胞膜上有绿色荧光,见图1a,转染了YFP的部分FRT细胞浆中表达绿色荧光,见图1b。结果表明,两种真核表达载体均转染成功。
图 1 倒置荧光显微镜观测转染结果
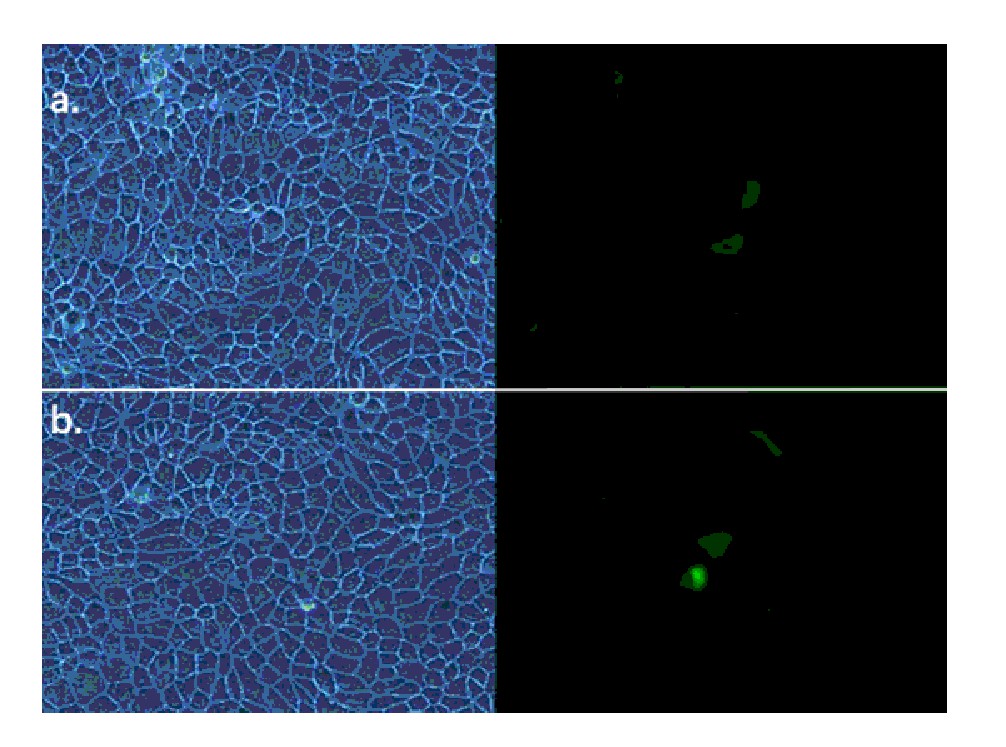
a.ANO1在FRT中的表达;b.YFP在FRT细胞中的表达
2.3、 流式细胞仪检测转染效率
荧光显微镜初步判断转染是否成功及对比转染效率后用流式细胞仪检测,用空白组(未转染的FRT细胞)设门,清空背景和碎片干扰,并确定未转染细胞本底表达荧光的发射光范围。再分别对三次转染结果进行检测,检测结果显示,YFP和ANO1-GFP在质粒用量为1.5 μg脂质体用量为3、4、5、6 μL时,转染效率依次上升;每一个浓度梯度,YFP的转染效率均大于ANO1-GFP的转染效率。结果见图2。
三次检测结果取算数平均数,YFP在质粒用量为1.5 μg脂质体用量为3、4、5、6 μL时,转染效率分别为9.0%、9.7%、11.2%、11.8%;ANO1在质粒用量为1.5 μg脂质体用量为3、4、5、6 μL时,转染效率分别为7.6%、8.7%、9.3%、10.8%。经统计学分析,数据具有统计学意义。证实脂质体用量越大,转染效率越高,且目的基因大小影响用脂质体转染时的效率,目的基因越大,转染效率越低。
3、 讨 论
脂质体转染因操作简单且不需要特殊仪器设备而被广泛接受[3],目的基因的大小被认为对转染效率有较明显的影响[4]。转染时,不管实际使用的载体如何,转染试剂说明书给出的方法都是相同的,但是实际操作时,不同的目的基因转染时的效率不同。而转染效率越高,后续获得阳性克隆的概率越大。本研究选用连接在相同载体上启动子相同而目的基因大小不等的两种真核表达载体ANO1-EGFP/pcDNA3.1和YFP/pcDNA3.1,梯度设置脂质体用量,选取易于转染的FRT细胞进行研究。ANO1-EGFP/pcDNA3.1和YFP/pcDNA3.1均表达荧光,便于实验的观察和检测。构建的载体中,ANO1大小为2871 bp,EGFP大小为720 bp,YFP大小为720 bp[5,6],可以知道ANO1-EGFP大小显着大于YFP,在相同实验条件下检测得YFP的转染效率高于ANO1-EGFP的转染效率。因此,本研究证实,无论脂质体用量如何,目的基因大小影响用脂质体转染时的效率,且目的基因越大,转染效率越低。研究结果对于今后脂质体转染工作具有指导作用,脂质体转染试剂说明书并没有考虑到目的基因的大小,而不同大小的目的基因使用脂质体转染时结果差异较大。而转染效率越高,后续的实验结果也会更好[7],并且瞬时转染的转染效率越高,后续筛选时获得阳性克隆的概率越大。所以在不损伤细胞的情况下,目的基因较大时,脂质体用量可以适当增加。后续研究可以针对不同的细胞对脂质体转染是否有影响,以及确定多大量的脂质体会对细胞产生毒害作用。
图2 流式细胞仪检测转染效率
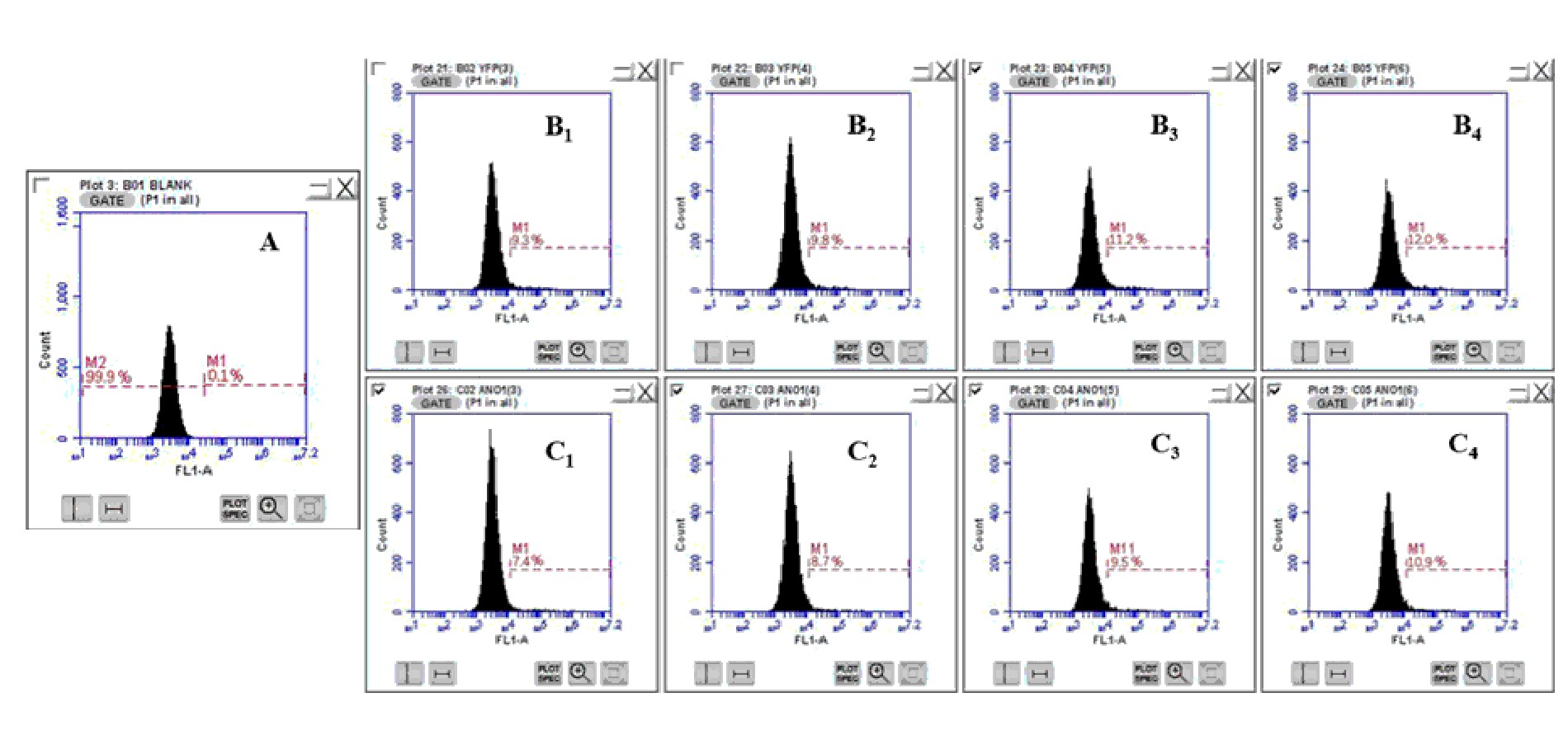
A:空白对照;B1~B4:YFP转染效率检测(脂质体用量B1~B4:3、4、5、6μL);C1~C4:ANO1转染效率检测(脂质体用量从C1~C4:3、4、5、6μL)
参考文献
[1] BENNS J M,KIM S W.Tailoring new gene delivery designs for specific targets[J].J Drug Target,2000,8(1):1-12.
[2] CHEN X,TAN X R,LI S J,et al.LncRNA NEAT1 promotes hepatic lipid accumulation via regulating miR-146a-5p/ROCK1 in nonalcoholic fatty liver disease[J].Life Sci,2019,235:116829.
[3] ACAR D D,STROOBANTS V J E,FAVOREEL H,et al.Identification of peptide domains involved in the subcellular localization of the feline coronavirus 3b protein[J].J Gen Virol,2019,100(10):1417-1430.
[4] ORYAN A,ALEMZADEH E,ZAREI M.Basic concepts,current evidence,and future potential for gene therapy in managing cutaneous wounds [J].Biotechnol Lett,2019,41(8/9):889-898.
[5] 郝峰,王皓,许会静,等.anoctamin 1在中国仓鼠卵巢细胞中的表达及其离子通道特性[J].吉林大学学报(医学版),2014,40(6):1226-1231.
[6] 郑锴,朱杭飞,王长文,等.YFP-H148Q/I152L在FRT细胞中的表达及其对碘离子敏感特性的研究[J].中国兽医杂志,2015,51(10):11-13.
[7] 方芳,陈忠航,张宸豪,等.诱导K562细胞分化对EDAG基因表达的影响[J].吉林医药学院学报,2005,26(4):195-197.