
神经元是构成大脑神经系统网络功能的基本单位,不同神经元之间相互作用的集合构成了有各种高级功能的复杂神经网络,原钙粘蛋白可能在复杂神经网络形成中起到关键作用。神经元细胞膜表面蛋白的选择性表达能够产生单个神经元表面分子的多样性,该多样性能够使神经元联系具有特异性,即自我识别或自我回避。原钙粘蛋白家族作为钙粘蛋白超家族中的成员,是一类依赖钙离子的细胞表面粘着蛋白,在神经发育中扮演重要作用。原钙粘蛋白基因家族包含3 个紧密相连的基因簇:Pcdhα 簇 、Pcdhβ 簇和Pcdhγ 簇,在哺乳动物中高度保守。人类Pcdhγ基因簇由 22 个可变第一个外显子和下游 3 个恒定的外显子组成,单个可变第一个外显子剪接到下游 3 个恒定的外显子可产生 1 种信使 RNA 分子,不同的神经细胞对可变第一个外显子上游启动子的选择性表达产生了神经元表面的分子多样性。
DNA 调 节 元 件 与 DNA 酶 超 敏 位 点 HSs(DNase I hypersensitive sites)密不可分,因为 HSs区域有调节因子结合,导致核小体重建或缺失,继而该区域的 DNA 序列容易被 DNA 酶降解。真核生物的基因组在调节因子介导的远距离相互作用下形成复杂而高度有序的染色质结构。绝缘子CTCF(CCCTC-binding factor)在其中扮演着组织者的角色。先前研究发现 Pcdhγ 每个可变第一个外显子的启动子(除 γc4、γc5 外)都含 1 个保守序列元件,即 CTCF 结合位点,且 CTCF 可以影响 Pcdhγ 启动子的活性。染色质免疫共沉淀结合二代测序技术揭示了两个候选的调控元件,即 HS7L 和 HS5-1aL,但其调控功能还有待确认。本研究通过分子克隆、荧光素酶报告基因和基因沉默试验,证实了 HS7L 和 HS5-1aL 对Pcdhγ 启动子活性的增强作用,并探讨了绝缘子CTCF 对 Pcdhγ 基因表达的影响。
1 材料和方法
1.1 细胞株
人胚胎肾细胞系 293T、人神经母细胞瘤细胞系 SK-N-SH 购自上海细胞库。
1.2 主要试剂
萤火虫荧光素酶报告载体 pGL3-Control(E1741)和 pGL3-basic(E1751)、海肾荧光素酶内参载体 pRL-TK(E2241)、pGEM誖-T Easy VectorSystem(IA1360)、双荧光素酶检测试剂盒(E2940)和反转录试剂盒(A3500) 购自美国 Promega 公司;FastStart Universal SYBR Green Master 试剂(04913914001) 购 自 瑞 士 罗 氏 公 司 ;Lipofec-tamineTM2000(11668-019)购自美国 Invitrogen 公司;KOD-Plus(KOD-201)购自日本 TOYOBO 公司;限制性内切酶 KpnⅠ (R0142S)、HindⅢ(R0104S)、EcoR Ⅰ (R0101S)、Sac Ⅰ(R0156V)、XbaⅠ(R0145S)、SalⅠ(R0138S)和 T4 DNA 连接酶(M0202L)购自美国 New England Biolabs 公司;基因组 DNA 纯化试剂盒 (A1120) 购自美国Promega 公司;FBS(10099 -141)、DMEM(10313 -021)购自美国 Gibco 公司。
1.3 仪器
PCR 仪(美国 Applied Biosystems 公司),Ep-pendorf 5415D 离心机(德国 Eppendorf 公司),电泳系统(美国 Bio-Rad 公司),CO2细胞培养箱(美国 Thermo 公司),Synergy 2 多功能酶标仪(美国BioTek 公司),ChemiDoc XRS+ 系统 (美国 Bio-Rad 公司)。
1.4 方法
1.4.1 序列比对分析人基因组 DNA 序列信息从 网站获取。序列同源分析结果通过 Vista 软件得出。
1.4.2 荧光素酶报告系统中质粒的构建
经 PCR (pGL3F 和 pGL3R 为引物)将 EcoRⅠ、XhoⅠ、MluⅠ和 SacⅠ酶切位点序列引入 pGL3-Basic 质粒。以从 HEC-1-B 细胞系中提取的人基因组 DNA 为模板,使用表 1 所列引物,通过 PCR扩增 γa9(γa9F 和 γa9R)、γa10(γa10F 和 γa10R)、γb3 (γb3F 和 γb3R)、γb7 (γb7F 和 γb7R)、γc3(γc3F 和 γc3R)、γb1(γb1F 和 γb1R)的启动子序列以及 HS7L(HS7LF 和 HS7LR)和 HS5-1aL(HS5-1aLF 和 HS5-1aLR)调控元件序列。将 PCR 扩增的各启动子序列经 KpnⅠ和 HindⅢ双酶切后,插入 pGL3-Basic 载体的 KpnⅠ和 HindⅢ酶切位点之间,即获得 pGL3-γa9-luc、pGL3-γa10-luc、pGL3-γb3-luc、pGL3-γb7 -luc、pGL3 -γc3 -luc 和pGL3-γb1-luc 质粒。将 HS7L 或 HS5-1aL 元件分别插入 pGL3-γa9-luc、pGL3-γa10 -luc、pGL3-γb3-luc、pGL3-γb7-luc 和 pGL3-γc3-luc 质粒的EcoRⅠ和 SalⅠ限制性内切酶识别位点之间,即获得 pGL3-γa9-luc-HS7L/HS5-1aL、pGL3-γa10-luc -HS7L/HS5 -1aL、pGL3 -γb3 -luc -HS7L/HS5 -1aL、pGL3-γb7-luc-HS7L/HS5-1aL 和 pGL3-γc3-luc-HS7L/HS5-1aL 质粒。上述克隆均经 Sanger 测序确定其正确性。【表1】

1.4.3 双荧光素酶报告基因活性测定
双荧光素酶报告基因活性测定采用美国Promega 公司 Dual-Glo 荧光素酶报告基因检测系统。293T 细胞的培养使用含 10%胎牛血清的DMEM 高糖培养液(含 100 kU/L 青霉素和 100 kU/L链霉素)。以 293T 细胞转染为例,转染前细胞按照 3×104个/孔接种于 96 孔板。转染使用 Lipo-fectamine 2000 试剂,每孔转染 37 fmol 质粒 DNA(不足 200 ng 用 pGEM-T Easy 质粒补齐),10 ng内参 pRL-TK 与 25 μL DMEM 无血清培养基混合,记为 A 液;然后,将 0.4 μL 脂质体与 25 μL DMEM无血清培养基混合,记为 B 液,室温放置 5 min。
最后,将 A 液和 B 液 1:1 混合,室温放置 20 min后,加入 96 孔板中。293T 细胞转染 48 h 后,弃去培养液,每孔加入 50 μL 裂解液,萤火虫荧光素酶底物反应 10 min 后,吸取 40 μL 孔细胞转移至白色不透光 96 孔板中,在 Synergy 2 多功能酶标仪中测得每个孔的萤火虫荧光素酶发光值。然后往孔内加入 20 μL 孔萤火虫荧光素酶的淬灭剂以及海肾荧光素酶的底物,反应 10 min,再测得每个孔的海肾荧光素酶的发光值。数据表述为萤火虫荧光素酶/海肾荧光素酶的数值。每个实验至少重复 3 次。SK-N-SH 细胞中的双荧光素酶报告基因活性测定试验与此类似,不再赘述。
1.4.4 慢病毒包装与感染
采用Lipofectamine2000试剂,将CTCF shRNA质粒或 GFP shRNA 质粒与包装质粒 pPax2 和pMD2.G共转染293T细胞,转染18h后更换病毒收集培养基(含 10%胎牛血清,11 g/L BSA,100 kU/L 青霉素和 100 kU/L 链霉素)分别于转染后 42 h 和 66 h收集含病毒颗粒上清,经离心、过滤后分装存放于-80 ℃冰箱。SK-N-SH 细胞感染时添加 8 μg/mLpolybrene (Sigma),感染第 3 d 后添加 2 μg/mLPuromycin (Sigma),每 2 d 更换一次培养液。
1.4.5 实时定量 PCR
细胞经 TRIzol 试剂裂解并提取 RNA,取 1 μgRNA,经美国 Promega 公司 AMV 试剂逆转录,实时定量 PCR 检测采用瑞士 Roche 公司 FastStartUniversal SYBR Green Master 试剂在 ABI 7500 定量 PCR 仪中进行。实时定量 PCR 引物采用Primer 5 引物设计软件设计,GAPDH 基因作为内参(引物见表 2)。【表2】

1.4.6 蛋白免疫印迹
蛋白免疫印迹实验采用 Millipore CTCF 抗体作为一抗,经 4 ℃孵育过夜后,与羊抗兔二抗孵育1 h,图像采集使用 ChemiDoc XRS+ 系统 (Bio-Rad)。
1.4.7 统计学处理
采用 SPSS 软件进行 t 检验分析,n=3,t 值检验后,*P<0.05 为有显着性差异;**P<0.01 为有极显着性差异。
2 结果
2.1 调控元件 HS7L 和 HS5-1aL 的序列保守性分析
基因组调控元件(如增强子和基因座控制区)在不同的物种中具有高度保守性。本文对人和鼠的 Pcdhγ基因簇下游序列进行了 Vista 分析。图1 中,横坐标代表序列在基因组中的位置,纵坐标代表人与鼠的序列相似性程度。可见,人与鼠的Pcdhγ基因簇除了外显子的序列保守外,内含子及基因间序列同样具有高度的序列相似性。DNA 酶超敏位点 HS16、HS5-1bL/HS17、HS18、HS19-20能够顺式激活 Pcdhβ 基因簇的表达,且这些位点的缺失能够非均一地部分降低 Pcdhγ 亚型的表达。【图1】

调控元件 HS7L 和 HS5-1aL 作为候选的增强子可能具有调控 Pcdhγ 基因表达的作用。
2.2 HS7L 对 Pcdhγ 启动子活性的影响
为研究 HS7L 是否影响 Pcdhγ 的启动子活性,将克隆并测序正确的重组质粒(图 2 左)与pGEM-T Easy 载体,内参载体质粒 pRL-TK 瞬时转染 293T 细胞后,再分别测出萤光虫荧光素酶和海肾荧光素酶的活性,用二者的比值大小衡量Pcdhγ 启动子活性强弱。实验结果显示:阴性对照质粒中加入 HS7L 序列后显着提高了 γa9、γa10、γb3、γb7 和 γc3 的启动子活性(图 2 右)。该结果表明,DNA 超敏位点 HS7L 具有增强 Pcdhγ 启动子活性的作用。【图2】
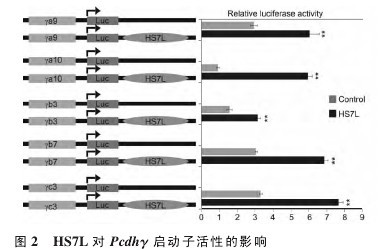
2.3 HS5-1aL 对 Pcdhγ 启动子活性的影响为
了探究 HS5-1aL 对 Pcdhγ 的启动子活性的影响,构建双荧光素酶报告系统(图 3 左)并转染 293T 细胞,检测双荧光素酶的活性。结果显示HS5-1aL 对 γa10 有显着的增强作用,但对其他启动子无显着影响(图 3 右)。该结果表明,DNA 超敏位点 HS5-1aL 具有增强部分 Pcdhγ 启动子活性的作用。【图3】

2.4 CTCF 基因沉默对 Pcdhγ 基因表达和启动子活性的影响
以慢病毒作为载体,通过 shRNA 下调 CTCF后,从 SK-N-SH 细胞中提取蛋白进行蛋白免疫印迹检测,结果显示该 shRNA 能够有效降低CTCF 蛋白表达(图 4A)。CTCF 分别下调 5 d 和 9 d后,从 SK-N-SH 细胞中提取总 RNA,经反转录进行实时定量 PCR 分析,发现 γb1 基因表达在下调第 5 d 增加,在下调第 9 d 降低(图 4B),γc3 无显着性变化(图 4C)。CTCF 下调 5 d 后瞬时转染含γb1 或 γc3 启动子的双荧光素酶报告基因质粒,发现 γb1 启动子活性显着降低,γc3 无显着性变化(图 4D)。该结果表明,CTCF 对于维持 γb1 基因表达和启动子活性至关重要,调控元件 HS7L 和HS5-1aL 以及已报道的其他下游调控元件可能通过 CTCF 介导的增强子-启动子相互作用调控Pcdhγ 表达。【图4】

3 讨论
人脑中包含超过 1 000 亿个神经元细胞,这些细胞之间互相联系形成约 150 万亿个特异的突触连接,原钙粘蛋白基因簇可能在大脑复杂神经元连接中起到重要作用。如此庞大的相互作用网络需要大量的细胞表面分子用以“自我识别”,使神经元能够“自我回避”。最近研究发现,Pcdh 在实现神经元的“自我回避”中发挥至关重要的作用,Pcdh 是目前脊椎动物中唯一被发现参与该功能的基因。Pcdh 能够通过启动子选择性表达产生巨大的分子多样性,该启动子的选择被认为是通过增强子-启动子的相互作用得以实现的。但是目前,Pcdh 的增强子调控元件还未被完全确定。
本文对 Pcdhγ 的增强子调控元件的研究对于探索Pcdhγ 如何实现多样性表达的分子机制至关重要。
已有的研究鉴定了 Pcdhγ 下游调控元件HS16、HS5-1bL/HS17、HS18 和 HS19-20,但是基因敲除这些元件几乎完全沉默 Pcdhβ 基因,只能非均一地部分降低 Pcdhγ 基因的表达。我们实验室先前发现 Pcdhγ 下游调控元件 HS7L 和 HS5-1aL 具有增强子特性,即富集RNA 聚合酶Ⅱ。因此,有必要进一步对该两个调控元件做进一步研究。报告基因是现代分子生物学中用于分析顺式元件与反式作用因子相互作用关系的一种重要工具。本研究通过分子克隆,将调控元件 HS7L 和HS5-1aL 分别克隆至包含 γa9、γa10、γb3、γb7 和γc3 启动子的荧光素酶报告基因的下游。通过荧光素酶报告基因试验检测其对该 5 种 Pcdhγ 启动子活性的影响,发现 HS7L 对 5 种启动子活性都具有增强作用,而 HS5-1aL 仅对 γa10 启动子活性具有增强作用。这些结果表明,DNA 超敏位点 HS7L和 HS5-1aL 具有增强 Pcdhγ 启动子活性的作用。
CTCF 是真核生物中进化上高度保守的锌指蛋白,具有转录激活、抑制、绝缘子、印迹、X 染色体失活、介导形成高度有序的染色质构象以及招募 RNA 聚合酶的功能。先前报道发现:除了αc2、β1、γc4、γc5 之外,原钙粘蛋白其他基因的启动子都包含一个 CTCF 识别位点。CTCF 通过结合原钙粘蛋白 α 基因簇中的启动子和增强子,介导二者的相互作用,形成基因表达中枢,从而实现启动子的选择。因此,CTCF 可能也通过介导增强子-启动子相互作用调控 Pcdhγ 表达。本研究通过基因沉默转录因子 CTCF,发现下调 CTCF 不仅降低 γb1 基因表达且能够显着降低 γb1 启动子报告基因活性。该结果表明,CTCF 对于维持 γb1基因表达和启动子活性至关重要,调控元件 HS7L和 HS5-1aL 以及已报道的其他下游调控元件可能通过 CTCF 介导的增强子-启动子相互作用调控 Pcdhγ 表达。该结果为进一步研究 Pcdhγ 基因表达调控机制奠定了基础。