
酸性蛋白酶(acidprotease)是指具有较低最适pH值的蛋白酶,其最适pH值在2.5~5.0之间,在此酸性环境下将蛋白质进行水解,通过内外酶切作用将蛋白质水解为小肽和氨基酸[1].酸性蛋白酶广泛应用于酒类、食醋及酱油的酿造等方面[2-8].
游离态酶稳定性较差、易失活、不能反复使用,通过固定化酶(immobilizedenzyme)技术可以克服游离酶应用的局限性,把酶束缚在一定空间中或水不溶性载体上,既能限制酶分子的自由流动,又能使酶发挥催化作用[9].
海藻酸钠(sodiumalginate,SA)因其温和的凝胶型和无毒性,使它成为最广泛的固定化材料之一[10-12].以SA作为固定化载体材料存在的缺点是其机械强度不够大,这可以通过选择适当的增硬剂来解决[13].阿拉伯胶、卡拉胶、黄原胶均具有良好的机械强度、高内聚力、高稳定性、成膜性等优点,广泛运用于食品加工、医药等领域,与SA复合使用可以增加固定化载体的硬度。
目前已有将无机载体或SA等单一天然胶体作为固定化载体材料进行固定化酸性蛋白酶研究的报道[14-17],而将复合天然高分子胶体作为固定化酸性蛋白酶载体的研究则鲜有报道。本实验使用SA分别与3 种天然高分子胶体复合制备固定化酶载体吸附酸性蛋白酶,研究复合凝胶浓度、凝胶比例、CaCl2浓度、固化时间、给酶量、吸附时间、酶液pH值等因素对复合胶体固定化酸性蛋白酶酶活回收率的影响。选择出最优载体进行固定化酸性蛋白酶的制备,对固定化酶的酶学性质进行研究,拟为固定化酸性蛋白酶的实际应用提供理论依据。
1 材料与方法
1.1 材料与试剂
食品级酸性蛋白酶(酶活力100000U/g) 苏柯汉生物工程有限公司;食品级海藻酸钠 青岛迈潮海洋科技发展有限公司;食品级阿拉伯胶 艾纳提化工科技有限公司;食品级卡拉胶 福建省绿麒食品胶体有限公司;食品级黄原胶 淄博中轩生化有限公司;其他试剂均为分析纯。
1.2 方法
1.2.1 游离酸性蛋白酶活力的测定
酸性蛋白酶活力的测定采用Folin-酚法(GB/T23527-2009《蛋白酶制剂》)。酸性蛋白酶活力定义为单位质量的酸性蛋白酶在40 ℃、pH 3.0的条件下,1 min内酶解酪蛋白产生1μg酪氨酸为1 个酶活力单位(U)。
1.2.2 固定化酸性蛋白酶活力的测定
取一定质量的固定化酶测定其酶活力,测定方法与游离酸性蛋白酶的测定方法相同。
1.2.3 相对酶活力及酶活回收率的计算
设定同组酶活力最高的相对酶活力为100%,以同组最高酶活力为参照,计算出的比值为相对酶活力。【1】

1.2.4 固定化酸性蛋白酶的制备方法
以载体溶液总体积30 mL计,设定复合凝胶质量浓度1.8g/100mL,SA与各胶体质量比为1∶1,称取适量的阿拉伯胶、卡拉胶、黄原胶,分别和SA于60 ℃以下热水中溶解,混合均匀,超声波快速消泡至复合凝胶中无气泡,使用10 mL注射器以约1 滴/s的速率,将复合凝胶滴到质量浓度为4.0g/100mL的CaCl2溶液中,在4 ℃冰箱中固化1.5 h,用纱布滤出载体颗粒,并用缓冲液冲洗3~5 次除去表面的CaCl2.用滤纸吸干表面水分,放入pH 3.0,给酶量1760U/g的酶液中进行吸附,吸附0.5 h后用纱布滤出载体颗粒,用缓冲液清洗,并用滤纸吸干表面的水分。制成的球状颗粒,即所得的固定化酶,在0~4 ℃条件下保存。
1.2.5 酸性蛋白酶固定化条件的优化设计
1.2.5.1 单因素试验复合凝胶质量浓度对固定化酶活力的影响测定:复合凝胶质量浓度设定在0.6~2.8g/100mL,每隔0.2g/100mL进行测定,其他因素按照1.2.4节方法制备固定化酶,测定其酶活力。
凝胶比例对固定化酶活力的影响测定:取复合凝胶质量浓度为各复合凝胶最适条件,海藻酸钠与各胶体质量比例设定为2∶1、3∶1、4∶1、5∶1、6∶1,其他因素按照1.2.4节方法制备固定化酶,测定其酶活力。
CaCl2质量浓度对固定化酶活力的影响测定:取各已测指标的最适条件,CaCl2质量浓度设定为2.0、3.0、4.0、5.0、6.0、7.0g/100mL,其他因素按照1.2.4节方法固定化制备酶,测定其酶活力。
固化时间对固定化酶活力的影响测定:取各已测指标的最适条件,固化时间设定为0.5、1.0、1.5、2.0、2.5、3.0 h,其他因素按照1.2.4节方法制备固定化酶,测定其酶活力。
吸附时间对固定化酶活力的影响测定:取复合凝胶质量浓度、复合凝胶质量比、CaCl2质量浓度、固化时间最适条件,吸附时间设定为1.0、1.5、2.0、2.5、3.0 h,其他因素按照1.2.4节方法制备固定化酶,测定其酶活力。
酶液pH值对固定化酶活力的影响:取复合凝胶质量浓度、复合凝胶质量比、CaCl2质量浓度、固化时间、吸附时间均为各复合凝胶最适条件,酶液pH值设定为2.5、3.0、3.5、4.0、4.5,其他因素按照1.2.4节方法制备固定化酶,测定其酶活力。
给酶量对固定化酶活力的影响测定:取复合凝胶质量浓度、复合凝胶质量比、CaCl2质量浓度、固化时间、吸附时间、酶液pH值最适条件,给酶量设定为1 100、1 320、1 540、1 760、1 980、2 200、2420U/g,按照1.2.4节方法制备固定化酶,测定其酶活力。
1.2.5.2 正交试验优化固定化工艺在单因素试验的基础上,选出对固定化过程影响较大的3 个因素,每个因素设定3 个水平,以酶活回收率作为评价指标,采用L9(33)正交表对固定化条件进行优化试验。
1.2.6 固定化酸性蛋白酶酶学性质的研究
1.2.6.1 固定化酶的最适反应pH值测定取一定量的固定化酶及游离酶,以质量分数为1%酪蛋白为底物,不同pH值缓冲液中,30 ℃保温振荡反应10 min,测定其酶活力。
1.2.6.2 固定化酶的最适作用温度测定取一定量的固定化酶及游离酶,以1%酪蛋白为底物,不同温度条件下,pH 3.0缓冲液中保温振荡反应10 min,测定其酶活力。
1.2.6.3 固定化酶的热稳定性测定取一定量的固定化酶及游离酶在无底物的条件下,pH 3.0的缓冲液中,在不同温度条件下加热处理30 min后,迅速冷却。45 ℃条件下,测定其酶活力。
1.2.6.4 固定化酶的动力学性质以米氏常数Km来表示。取一定量的固定化酶及游离酶,在不同底物质量浓度条件下,于45 ℃、pH 3.0缓冲液中保温振荡反应10 min,测定其酶活力,采用双倒数作图法计算米氏常数Km值。
1.2.7 固定化酶操作半衰期的计算
固定化酶的操作稳定性是最影响使用的关键因素。
固定化酶的操作稳定性通常用半衰期表示,即固定化酶活力下降为初始酶活力一半所经历的连续工作时间。设定酶活力损失同时间成指数关系,半衰期公式可表达为:【2】

2 结果与分析
2.1 载体选择及固定化条件单因素试验结果
2.1.1 复合凝胶质量浓度对固定化酶活力的影响【3】

由图1可知,3 种载体固定化酶活力随着复合凝胶质量浓度的增大均呈现先增大后降低的趋势,这是由于当质量浓度过大时载体表面孔隙紧密,不利于酶的吸附。
质量浓度为2.0g/100mL的SA-卡拉胶复合凝胶制成的固定化酶酶活力最高。
2.1.2 复合凝胶质量比对固定化酶活力的影响【4】
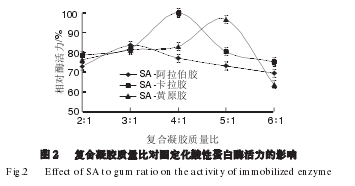
由图2可知,3 种载体固定化酶活力随着复合凝胶质量比的增大均呈现先增大后降低的趋势,质量比例为4∶1的SA-卡拉胶复合凝胶制成的固定化酶活力最高。
2.1.3 CaCl2质量浓度对固定化酶活力的影响【5】
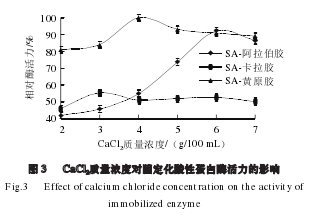
由图3可知,3 种载体固定化酶活力随着CaCl2质量浓度的增大均呈现先增大后降低的趋势,这是因为SA与CaCl2的作用是由离子强度所决定,离子强度越强,与SA的作用越明显;但是当强度过大时,蛋白酶的活力会受到离子强度的影响而降低。质量浓度为4.0g/100mL的SA-黄原胶复合凝胶制成的固定化酶活力最高。
2.1.4 固化时间对固定化酶活力的影响【6】

由图4可知,固化时间对SA-阿拉伯胶、SA-黄原胶为载体的固定化酶活力影响较大,固化时间为2.5 h的SA-黄原胶复合凝胶制成的固定化酶活力最高。
2.1.5 吸附时间对固定化酶活力的影响【7】

由图5可知,吸附时间对SA-卡拉胶、SA-黄原胶为载体的2 种固定化酶活力影响较小,吸附时间为2.5 h的SA-黄原胶复合凝胶制成的固定化酶活力最高。
2.1.6 酶液pH值对固定化酶活力的影响【8】

由图6可知,3 种载体固定化酶活力随着酶液pH值的增大均呈现先增大后降低的趋势,酶液pH值为3.5的SA-黄原胶复合凝胶制成的固定化酶活力最高。
2.1.7 给酶量对固定化酶活力的影响【9】

由图7可知,3 种载体固定化酶活力随着给酶量的增大均呈现先增大后降低的趋势,这是由于一定质量的载体可吸附的酶量有限,当载体的吸附酶量达到饱和后继续增加给酶量反而会影响酶的继续吸附效果。
给酶量为2200U/g的SA-黄原胶复合凝胶制成的固定化酶活力最高。
2.1.8 正交试验优化固定化工艺条件
在单因素试验的基础上,选出对固定化过程影响较大的3 个因素,每个因素设定3 个水平,以酶活回收率作为评价指标,采用L9(33)正交表对固定化条件进行优化试验。SA-阿拉伯胶正交试验选择因素为复合凝胶质量比、CaCl21择因素为复合凝胶质量浓度、复合凝胶质量比、CaCl2质量浓度,SA-黄原胶正交试验选择因素为复合凝胶质量比、CaCl2质量浓度、固化时间。由表1~3可知,在以酶活回收率为评价指标时,3 种复合载体的固定化酶活回收率理论最优水平分别为A1B2C2、D2A1B3、A3B3C2,影响因素的主次顺序分别为B>A>C、D>B>A、C>A>B.3 种载体固定化酶的实际酶活回收率最优水平分别为A1B2C2、D2A1B3、A3B2C3,以SA-阿拉伯胶、SA-卡拉胶为载体的固定化酶的理论优水平与实际优水平一致,其酶活回收率分别为65.34%、48.23%;以SA-黄原胶为载体的固定化酶的理论优水平与实际优水平不一致,因此,通过验证实验验证理论最优组合和实际最优组合中最好的组合以确定最佳固定化条件,验证实验结果为理论最优组合A3B3C2酶活回收率为74.12%,实际最优组合A3B2C3酶活回收率为73.07%,确定SA-黄原胶的最佳固化条件为A3B3C2,其酶活回收率为74.12%.综上,SA-黄原胶的复合凝胶为3 种复合凝胶中固定化酸性蛋白酶的最佳载体,其酶活回收率最高。所以选择SA-黄原胶复合凝胶为载体材料进行酸性蛋白酶固定化的研究。
2.2 SA-黄原胶为载体的固定化酸性蛋白酶的酶学性质
2.2.1 固定化酸性蛋白酶的最适反应pH值由图8可知,pH值对固定化酸性蛋白酶及游离酶活性均有较大影响,两者的活力均随着pH值的升高呈现先增加后减小的趋势,在pH 3.0时达到最大值。
2.2.2 固定化酸性蛋白酶的最适作用温度由图9可知,温度对酸性蛋白酶的活力有着显着影响。随着温度的升高,酸性蛋白酶活力随之增加,但是温度的不断升高亦会使酶蛋白逐渐变性,导致酶活力下降。在温度为45 ℃时,游离酶与固定化酶活力均达到最高,且固定化酶相对活力略高于游离酶。2.2.3 固定化酸性蛋白酶的热稳定性由图10可知,在低于40 ℃时,两种酶的相对活力下降低为缓慢,高于40 ℃后两种酶活力降低较为明显,而固定化酶活力降低较游离酶缓慢,表明固定化酸性蛋白酶的热稳定性明显高于游离酶。
2.2.4 固定化酸性蛋白酶的动力学性质由图11可知,固定化酶Km值为18.93mg/mL,大于游离酶Km值(9.98mg/mL),表明固定化酶的底物亲和力小于游离酶。
2.2.5 固定化酶的操作半衰期操作半衰期是评价固定化酶是否具有实用性的重要指标,称取适量固定化酶测其初始酶活力,同时称取相同质量的固定化酶,以1%酪蛋白为底物进行反应,做2 组重复,每隔2d进行一次测定,根据1.2.7节计算该固定化酶的操作半衰期为17.28d.
固定化酶在经过使用后,酶活力有所下降,这是因为酶经过几次使用后,某些酶与载体连接不够紧密,固定在载体表面的酶有部分脱落,但相对游离酶只能使用一次而言,固定化酶的使用效率明显提高。
3 结论与讨论
目前,将固定化技术应用于酸性蛋白酶的研究报道并不多见。Ganesh Kumar等[14]用无机载体活性炭进行酸性蛋白酶的固定化实验。赵赣[15]、贾莉[16]等使用包埋法将酸性蛋白酶进行固定,苗敬芝等[17]使用包埋-交联法将酸性蛋白酶与木瓜蛋白酶进行共固定。蛋白质属于大分子物质,而使用包埋法制备的固定化酶载体会影响酶与大分子底物的接触效果,所以经包埋法所制成的固定化蛋白酶很难对底物蛋白质起到较好作用[18-19].本实验选用吸附法进行酸性蛋白酶的固定化实验,所制得的固定化酸性蛋白酶酶活回收率高于包埋法。
本实验采用的是物理吸附法,而任琦[20]研究磁性微球吸附牛血清蛋白时得出化学法吸附的PMMA-co-PGMA-CHO微球相较物理方法吸附的PSt-co-PAMPS微球吸附量更大且对蛋白质的影响更小的结论,因此,可以选择化学吸附法对酸性蛋白酶进行进一步固定化研究。此外,对传统吸附法进行部分改进或者将吸附法与其他传统方法进行联合使用也是固定化蛋白酶方法的发展趋势[21].
本实验的载体选择了3 种天然胶体即阿拉伯胶、卡拉胶、黄原胶与SA混合进行复合凝胶的制备,而每种胶体的物理特性都会有很大差异,因此3 种胶体可能具有一定局限性,在以后的酸性蛋白酶固定化实验研究中可以选择更多更广的食品级天然胶体与SA进行复合凝胶的制备来选择最佳固定化酸性蛋白酶的载体。
酶的本质是蛋白质,其性质取决于酶蛋白本身特有的高级结构和活性中心基团。固定化过程中所涉及的物理、化学、生物因素以及载体本身都可能引起酶活性中心基团的改变。同时载体的存在也会产生一定的空间位阻和屏蔽作用,这些都有利于酶分子抵御外界环境的变化,因此经固定化处理的酶稳定性通常会较游离酶有所提高[22-23].
本实验结果表明,以SA-黄原胶为复合载体所制备的固定化酸性蛋白酶相对酶活力最大,为最佳固定化载体材料。其最佳工艺条件为:复合凝胶质量浓度为2.0g/100mL、SA与黄原胶质量比例为6∶1、CaCl2质量浓度5.0g/100mL、固定化时间为2.5 h、吸附时间为2.5 h、酶液pH值为3.5、给酶量2200U/g.固定化酸性蛋白酶酶学性质的研究结果表明:固定化酶的最适pH值为3.0,最适温度为45 ℃,其热稳定性明显优于游离酶,操作半衰期为17.28d.通过扩大实验可以把固定化酸性蛋白酶应用于酒类、食醋及酱油的酿造等方面。
参考文献:
[1] 张秀江, 胡虹, 范国歌, 等。 酸性蛋白酶高产菌株选育及酶学性质的研究[J]. 河南科学, 2012, 30(3): 327-332.
[2] 方春玉, 周健, 邓静, 等。 泸型大曲黑曲霉产酸性蛋白酶条件的优化及其酶学性质的研究[J]. 食品与发酵科技, 2011, 47(2): 13-31.
[3] 黄河。 酒用酸性蛋白酶在酒精浓醪发酵中的应用[J]. 酿酒科技,2010(10): 72-74.
[4] 李树森。 酸性蛋白酶在酒精生产中的应用[J]. 酿酒, 2013, 41(3): 84-86.
[5] 张志刚, 吴生文, 陈飞。 大曲酶系在白酒生产中的研究现状及发展方向[J]. 中国酿造, 2011, 30(1): 13-16.
[6] 赖樱花, 成坚, 李勇波, 等。 酸性蛋白酶对黄酒常规质量指标的影响[J].食品科技, 2012, 37(3): 135-138.
[7] 徐德峰。 高活力酸性蛋白酶曲霉融合子的选育及其在酱油发酵中的初步应用[D]. 广州: 华南理工大学, 2010: 119-139.
[8] 刘鑫, 李佳, 刘克武。 黑曲霉酸性蛋白酶在食醋酿造中的催化效应[J].化学研究与应用, 2004, 16(4): 482-484.
[9] 吕淑霞, 任大明, 唐咏。 基础生物化学[M]. 北京: 中国农业出版社,2003: 119-126.
[10] DEGROOTAR,NEUFELDRJ.Encapsulationofureaseinalginatebeadsandprotectionfromα-chymotrypsinwithchitosanmembranes[J].EnzymeandMicrobialTechnology,2001,29(6/7):321-327.
[11] 雷生姣, 潘思轶。 交联海藻酸钠固定化柚(皮)苷酶[J]. 食品工业科技,2014, 35(1): 232-236.
[12] CHEIRSILPB,JEAMJOUNKHAWP,H-KITTIKUNA.Optimizinganalginateimmobilizedlipaseformonoacylglycerolproductionbytheglycerolysisreaction[J].JournalofMolecularCatalysisB:Enzymatic,2009, 59(1/3): 206-211.
[13] 曹树祥, 黎苇。 固定化酶制备方法研究进展[J]. 化工环保, 1999,19(5): 273-277.