
半滑舌鳎(Cynoglossus semilaevis Günther)属鲽形目, 舌鳎科, 舌鳎属, 俗称牛舌头、鳎目、鳎米, 为温水性近海底层鱼类, 在我国沿海均有分布, 尤以渤海、黄海为多[1, 2], 是一种高档的经济海产品, 其肉质鲜美, 深受消费者喜爱.半滑舌鳎育苗生产主要依靠轮虫、卤虫等生物饵料, 其转饵期间会出现大规模死亡, 主要原因可能是生物饵料营养不平衡,仔稚鱼消化系统尚未发育成熟, 对饵料的消化吸收能力差等原因.
在仔稚鱼个体发育的早期, 消化系统尚未发育成熟, 尤其是对蛋白质的消化能力比较低, 无法通过对蛋白质的消化吸收来满足自身对氨基酸的需求[3, 4].仔稚鱼早期阶段就可以检测到多种消化酶的活性[5, 6].仔稚鱼可以通过摄取的食物来调节体内消化酶的分泌水平[7].因此推断在仔稚鱼的饲料中添加一定水平的晶体氨基酸, 将有利于促进仔稚鱼消化酶的分泌, 并提高对营养物质消化吸收的能力.
不同的消化酶活力变化可以反映出仔稚鱼消化系统的发育状况, 而且还可以根据仔稚鱼体内消化酶活性的变化来判断其对饵料的吸收情况.氨基酸代谢酶活性往往是作为鱼体内氨基酸代谢水平的指示器,可以反映出鱼体内氨基酸的代谢情况[8-11].对仔稚鱼消化酶和代谢酶活力的研究, 有助于深入了解海水仔稚鱼的生长、摄食、消化功能的发育和完善, 并对仔稚鱼人工微颗粒饲料的选择具有重要的意义.
本实验通过研究人工微颗粒饲料中晶体氨基酸替代鱼粉蛋白对半滑舌鳎稚鱼的消化酶和代谢酶活力的影响, 进一步探讨晶体氨基酸对鱼粉的最适替代量, 对优化饲料成本, 保持鱼类良好的生长性能和提高饲料蛋白利用率具有重要意义.
1 材料与方法
1.1 实验鱼苗与养殖方法
实验在山东省海阳市黄海水产有限公司进行.实验用鱼苗为该场人工繁育的35日龄半滑舌鳎鱼苗,平均体重为(0.094±0.02) g.实验开始时挑选外观正常、体格均匀、健壮的鱼苗2700尾, 随机分成18组,每组150尾, 分别放于循环水系统中.实验期间, 水温控制在24-25℃, pH在7.8-8.0, 盐度在29‰-30‰.每桶内设1个充气石, 循环水系统.桶内水表面的光强度在白天维持在7.9 W/m2左右.每日用自制虹吸器吸底2次, 以及时清除池底残饵, 死苗用捞网及时捞出, 称量计数.
半滑舌鳎鱼苗自15-30日龄投喂卤虫无节幼体,自30-35日龄用卤虫无节幼体和微颗粒饲料联合投喂,其间逐渐减少卤虫的投喂量.35日龄后停止投喂卤虫无节幼体, 每天手工投喂微颗粒饲料5次(7:00、10:00、15:00、19:00和22:00), 饱食投喂, 养殖周期28d.
1.2 实验设计与实验饲料
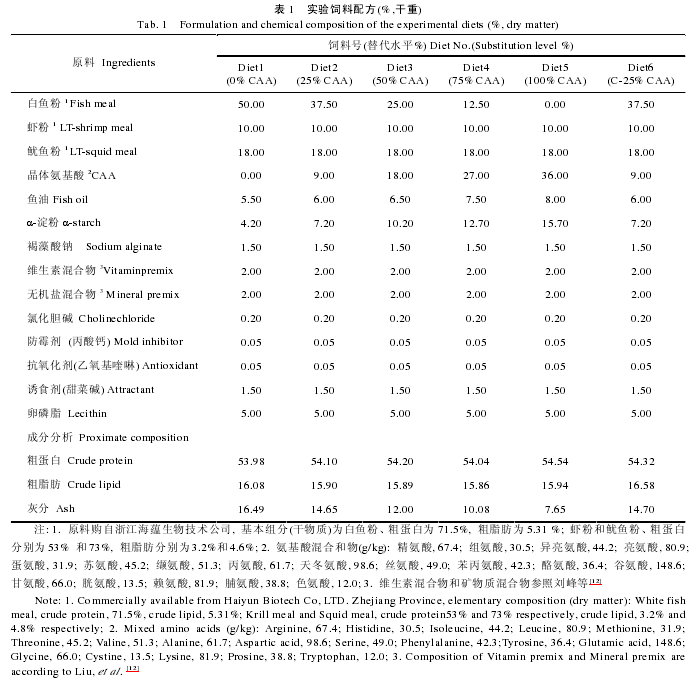
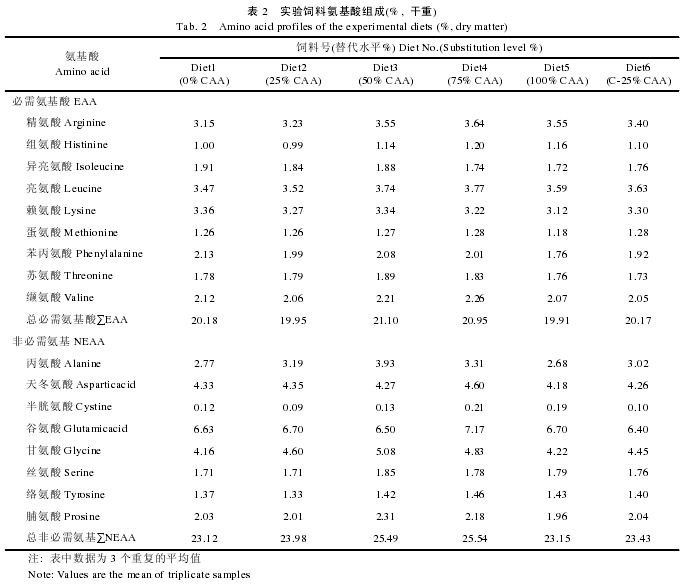
实验饲料配制参照刘峰等[12]的方法.以晶体氨基酸混合物梯度替代 0%、25%、50%、75%和 100%鱼粉蛋白(0%CAA、25%CAA、50%CAA、75%CAA 和100%CAA), 其中 25%替代水平下设计不包被晶体氨基酸混合物和包被晶体氨基酸混合物(C-25%CAA)两个对比处理组(表 1).饲料氨基酸组成见表 2.晶体氨基酸混合物中氨基酸组成模式参照所用白鱼粉的氨基酸组成, 包膜晶体氨基酸组(C-25%CAA 组)氨基酸以棕榈酸甘油酯包被, 包被方法参照 López-Alvarado[13]的方法.饲料保存于–20℃以备用.
1.3 取样与分析方法
实验结束(63日龄)时, 停食24h后取样, 全部鱼苗用2 mL和5 mL离心管液氮冷冻保存以备进行酶活力分析.饲料常规成分分析测定方法参照AOAC[14],样品置于105℃烘箱中至恒重, 水分的含量由烘干前后样品的质量变化量计算而得; 粗蛋白采用凯氏定氮仪(Kjeltec-2300, Sweden)测定样品而得; 粗脂肪采用索氏抽提仪(B-801, Switherland)测定; 灰分采用灼烧法测定.用于氨基酸成分分析的样品均经冷冻干燥至恒重, 取0.02 g左右样品用 6 mol/L 盐酸在110℃下消化22h以上, 过滤至50 mL容量瓶中并用超纯水(Milli-Q system)定容后混合均匀, 取2 mL溶液至 5 mL玻璃瓶中并放置于真空干燥箱(VD23, Germany)干燥, 干燥完后加2 mL超纯水溶解残留物后至瓶内液体全部蒸发, 重复3次, 然后加2 mL loading-buffer溶解残留物, pH为2.0-2.5.上清液用氨基酸自动分析仪(Biochrom 30, GE, England)通过柱后衍生法测定氨基酸组成.
分析消化酶活力时, 按照Ribeiro, et al.的方法, 于0℃的冰上, 在解剖镜下将消化道在食道与幽门括约肌的连接处切开获得胰段和肠段, 胰段部分包括胰腺、胃和肝脏.胰蛋白酶活力的分析按照Holm, et al.的方法, 用Nα–Benzoyl–DL–arginine–p–nitroanilide (BAPNA, B–4875, Sigma)作底物.淀粉酶活力按照Métais和Bieth[17]的方法测定.碱性磷酸酶和亮氨酸氨肽酶酶活力按照Bessey, et al.[18]和Maroux, et al.[19]的方法测定.肠道刷状缘的分离按照Cahu, et al.[20]的方法, 将肠段用50 mmol/L甘露醇和2 mmol/L Tris混合溶液匀浆, 然后加入0.1 mol/L的CaCl2溶液, 9000 g离心10min, 取上清液, 340000 g离心20min.最后用配制好的0.1 mol/L KCl, 5 mmol/LTris-Hepes 和1 mmol/L DTT 混合溶液溶解沉淀,即分离出肠上皮刷状缘.谷草转氨酶(AST/GOT)和谷丙转氨酶(GPT/ALT)采用赖氏法测定.活力用比活力表示(mU/mg protein).蛋白浓度的测定参照Bradford[21]的方法, 用牛血清蛋白(BSA, A–2153,Sigma)作底物.测定时先将样品用5倍体积(v/w)的0℃蒸馏水匀浆, 用紫外可见分光光度计(Shimadzu,UV–2401PC)进行分析.
1.4 统计方法
采用 SPSS 17.0 对所有数据进行单因素方差(ANOVA) 分析 , 若各处理组之间差异达到显着(P<0.05), 则进行 Tukey 多重比较.分析结果均用"平均值±标准误"表示.
2 结果
2.1 晶体氨基酸替代鱼粉蛋白对半滑舌鳎稚鱼的消化酶活力的影响.
在不包膜条件下, 各处理组的胰段胰蛋白酶活力随替代水平的升高显着下降, 包膜处理组(C-25%CAA 处 理 组 )(22.36 mU/mg protein) 与 全 鱼 粉 组(22.17 mU/mg protein)无显着差异(P>0.05), 但显着高于其余各组(P<0.05).肠段胰蛋白酶活力与胰段胰蛋 白 酶 活 力 呈 相 似 的 变 化 趋 势 , 包 膜 处 理 组(C-25%CAA 处理组)(24.16 mU/mg protein)与全鱼粉组(24.92 mU/mg protein)无显着差异(P>0.05), 但显着高于其他各组(P<0.05), 100%CAA 处理组(11.11 mU/mg protein)显着低于其余各组(P<0.05).
肠段胰蛋白酶活力与胰段胰蛋白酶活力比值随氨基酸替代水平的升高显着下降, 鱼粉组显着高于 75%和 100%处理组(P<0.05), 但与 25%处理组、包膜处理组(C-25%处理组)和 50%处理组无显着差异(P>0.05)(表 3).
胰段淀粉酶活力, 随着氨基酸替代水平的升高,呈 上 升 的 趋 势 . 包 膜 处 理 组 (C-25%CAA 处 理组)(1.04 U/mg protein)与全鱼粉组(1.05 U/mg protein)无 显 着 差 异 (P>0.05), 但 显 着 低 于 其 他 各 组(P<0.05).肠段淀粉酶活力, 随氨基酸替代水平的升高也呈上升的趋势.包膜处理组(C-25%CAA 处理组)(1.22 U/mg protein)显着低于 100%处理组(2.56U/mg protein)(P<0.05)(表 3).
肠刷状缘亮氨酸氨肽酶(LA)活力随替代水平的升 高 显 着 下 降 , 包 膜 处 理 组 (C-25%CAA 处 理组)(782.30 mU/mg protein)与全鱼粉组(782.40 mU/mg protein)无显着差异(P>0.05), 显着高于其余各组(P<0.05).肠 LA 活力与刷状缘 LA 有相似的变化趋势, 25%处理组(80.29 mU/mg protein)、包膜处理组(C-25%CAA 处理组)(95.18 mU/mg protein)与全鱼粉组(95.09 mU/mg protein)无显着差异(P>0.05), 显着高于其他各组(P<0.05).在不包膜条件下, 肠刷状缘碱性磷酸酶(AP)活力随氨基酸替代水平的升高显着下降.25%处理组(932.37 U/mg protein)、包膜处理组(C-25%CAA 处理组)(1053.66 U/mg protein)与全鱼粉组(1014.25 U/mg protein)无显着差异(P>0.05).肠 AP 活力与刷状缘 AP 活力有相似的变化趋势.包膜处理组(C-25%CAA 处理组) (122.69 U/mg protein)与全鱼粉组(118.06 U/mg protein)无显着差异(P>0.05),显着高于其余各组(P<0.05)(表 3略).
2.2 晶体氨基酸替代鱼粉蛋白对半滑舌鳎稚鱼的代谢酶活力的影响
各处理组谷丙转氨酶(GPT/ALT)和谷草转氨酶(AST/GOT)活力均随替代水平的升高显着上升.GPT活力在全鱼粉组(27.68 U/mg protein)最低, 与 25%处理组(33.30 U/mg protein)和包膜处理组(C-25% CAA处理组)(28.30 U/mg protein)无显着差异(P>0.05), 但显着低于 50%、75%和 100%处理组(P<0.05).GOT活力也在全鱼粉组(27.75 U/mg protein)最低, 但与25% 处 理 组 (32.75 U/mg protein) 和 包 膜 处 理 组(C-25% CAA 处理组)(29.50 U/mg protein)无显着差异(P>0.05), 显着低于 50%、75%和 100%处理组(P<0.05)(表 3).
3 讨论
在仔稚鱼发育过程中, 胰腺外分泌能力的大小体现了仔稚鱼消化系统的成熟与否[22].一般认为,肠 段 胰 蛋 白 酶 活 力 与 胰 段 胰 蛋 白 酶 活 力 比 值(Trypsin(I) / Trypsin(P))的大小是反映胰腺外分泌能力高低的指标[19], 本实验中鱼粉组的肠段胰蛋白酶活力与胰段胰蛋白酶活力比值显着高于 75%和100%处理组, 但与 25%处理组、包膜处理组(C-25%处理组)和 50%处理组无显着差异.这说明替代水平低于 50%时, 半滑舌鳎稚鱼的胰腺外分泌功能不受影响.另外, 淀粉酶也可以作为衡量胰腺外分泌发育成熟与否的指标[23].淀粉酶活力在仔稚鱼的发育中随着胰腺外分泌的发育而下降[20], 因此, 可以认为淀粉酶活力的下降在一定程度上反映了仔稚鱼消化系统趋于成熟.本实验淀粉酶活力随着氨基酸替代水平的升高显着上升, 包膜处理组(C-25%处理组)与鱼粉组无显着差异.这表明适宜的氨基酸替代水平有助于稚鱼胰腺外分泌功能的发育.但也有研究发现, 淀粉酶活力可能受食物中淀粉的诱导影响[20].
王重刚等[24]研究发现, 用不同饵料投喂真鲷 (Pa-grosomus major) 稚鱼时, 淀粉酶活性与饵料中淀粉含量呈正相关的关系.本实验中, 随着氨基酸替代水平的升高, 饲料中淀粉含量也逐渐升高, 这可能也与淀粉酶活力升高有一定的关系.仔稚鱼发育过程中另一个重要方面就是肠道刷状缘消化酶的分泌与其功能的完善[22, 25-28].碱性磷酸酶(AP)和亮氨酸氨肽酶(LA)存在于鱼类前肠上皮细胞和刷状缘上, 可以作为评价脊椎动物幼体肠道吸收营养物质能力的指标, 且两者活力的高低可以反映出肠道刷状缘细胞的发育程度[29, 30].Galaviz等[31]在尖吻鲈(Atractoscion nobilis)仔稚鱼上研究发现, 亮氨酸氨肽酶(LA)随着个体发育的逐渐成熟呈升高的趋势, 最后趋于平稳.本实验的结果显示, 稚鱼的亮氨酸氨肽酶在肠和刷状缘均呈现相似的趋势,说明半滑舌鳎稚鱼肠道已发育完全, 而亮氨酸氨肽酶活力随替代水平升高显着降低, 包膜氨基酸处理组(C-25% CAA 处理组)与全鱼粉组无显着差异, 显着高于不包膜 25% CAA 处理组, 表明饲料中的营养物质影响了稚鱼的肠道发育水平.碱性磷酸酶也具有相同的趋势, 而且实验中较高的氨基酸替代水平碱性磷酸酶活力下降, 也可以推断出稚鱼对营养的吸收不良[20].本实验在 25%替代水平下, 包膜组的消化酶活力显着高于不包膜组, 说明氨基酸经包膜处理后有利于稚鱼肠道对营养物质的吸收.将晶体氨基酸用耐消化的壁材包被起来, 其在肠道中的释放速度可能会达到与完整蛋白中氨基酸相似的释放速度[32].同时, 包被处理也可以减少晶体氨基酸在养殖水环境中的溶失.
谷 丙 转 氨 酶 (GPT/ALT)和 谷 草 转 氨 酶 (AST/GOT)是广泛存在于动物组织线粒体中的氨基转移酶, 在机体蛋白质代谢中起重要作用, 氨基酸代谢增强会导致转氨酶活性升高.从两种氨基酸代谢酶的结果来看, 谷丙转氨酶(GPT/ALT)和谷草转氨酶(AST/GOT) 活力均随替代水平的升高显着上升 ,50%、75%和 100%处理组显着高于 25%处理组、包膜处理组和鱼粉组.适宜的氨基酸替代水平可以有利于氨基酸的代谢和鱼体蛋白质的合成, 而过高的氨基酸替代水平将加速氨基酸的氧化代谢, 不利于蛋白质在鱼体内的沉积.主要原因可能为过高的氨基酸水平导致了晶体氨基酸的高效吸收, 进而引起氨基酸的过度分解代谢从而降低其利用率[33], 而且晶体氨基酸与蛋白结合态氨基酸吸收速率不同步亦将造成氨基酸的不平衡, 影响到氨基酸库中其他氨基酸的利用效率, 并因而降低蛋白质的合成效率[34],当氨基酸组成不平衡时, 被氧化的氨基酸就会增加,大量的氨基酸被脱去氨基, 进入三羧酸循环被氧化供能, 或转化成糖和脂肪[35, 36], 从而影响蛋白质在鱼体内的沉积.
综上所述, 饲料中晶体氨基酸显着影响了半滑舌鳎稚鱼的消化酶和代谢酶活力, 且在 25%的替代水平下, 与未包膜组相比, 包膜处理组能显着促进半滑舌鳎稚鱼的消化系统的发育, 因此推断在半滑舌鳎稚鱼微颗粒饲料中添加适量的包膜氨基酸替代鱼粉蛋白是可行的.本研究认为在不降低蛋白利用的前提下, 晶体氨基酸替代鱼粉蛋白的比例可能要小于 25%, 即小于饲料干重的 9%, 具体适宜替代比例仍有待进一步研究.
参考文献:
[1] Li S Z, Wang H M. Fauna Sinica Ostichthyes Pleuronectiforms [M]. Beijing: Science Press. 1995, 68 [李四忠, 王惠民. 中国动物志硬骨鱼纲鲽形日. 北京: 科学出版社.1995, 68]
[2] Wan R J, Jang Y W, Zhuang Z M. Morphological anddevelopmental characters at the early stages of the tonguefish Cynoglossus semilaevis [J]. Acta Zoologica Sinica, 2004,50(1): 91-102 [万瑞景, 姜言伟, 庄志猛. 半滑舌鳎早期形态及发育特征. 动物学报, 2004, 50(1): 91-102]
[3] Carvalho A P, Sa R, Oliva-Teles A, et al. Solubility andpeptide profile affect the utilization of dietary protein bycommon carp (Cyprinus carpio) during early larval stages [J].Aquaculture, 2004, 234(1-4), 319-333
[4] R nnestad I, Concei o L E C, Arag o C, et al. Assimilationand catabolism of dispensable and indispensable free aminoacids in post-larval Senegal sole (Solea senegalensis) [J].Comparative Biochemistry and Physiology, 2001, 130C(4),461-466
[5] Zambonino-Infante J L, Cahu C. Development and responseto a diet change of some digestive enzymes in sea bass(Dicentrarchus labrax) larvae [J]. Fish PhysiologyBiochemistry, 1994, 12(5): 399-408
[6] Ji H, Sun H T, Tian J J, et al. Digestive enzyme activityduring early larval development of the paddlefish Polyodonspathula [J]. Acta Hydrobiologica Sinica, 2012, 36(3): 1-9[吉红, 孙海涛, 田晶晶, 等. 匙吻鲟仔稚鱼消化酶发育的研究. 水生生物学报, 2012, 36(3): 1-9]
[7] Zambonino-Infante J L, Cahu C L. Influence of diet onpepsin and some pancreatic enzymes in sea bass(Dicentrarchus labrax) larvae [J]. Comparative Biochemistryand Physiology, 1994, 109A(2): 209-212
[8] Moyano F J, Cardenete G, De la Higuera M. Nutritive andmetabolic utilization of proteins with high glutamic acidcontent by the rainbow trout (Oncorhynchus mykiss) [J].Comparative Biochemistry and Physiology, 1991, 100A(3):759-762
[9] Fournier V, Gouillou-Coustans M F, Metailler R, et al.Excess dietary arginine affects urea excretion but does notimprove nitrogen utilisation in rainbow trout Oncorhynchusmykiss and turbot Psetta maxima [J]. Aquaculture, 2003,217(1-4): 559-576
[10] Gomez-Requeni P, Mingarro M, Kirchner S, et al. Effects ofdietary amino acid profile on growth performance, keymetabolic enzymes and somatotropic axis responsiveness ofgilthead seabream (Sparus aurata) [J]. Aquaculture, 2003,220(1-4): 749-767
[11] Peres H, Oliva-Teles A. The effect of dietary proteinreplacement by crystalline amino acid on growth andnitrogen utilization of turbot Scophthalmus maximusjuveniles [J] Aquaculture, 2005, 250(3-4): 755-764
[12] Liu F, Mai K S, Ai Q H, et al. Effects of dietary fish proteinhydrolysate levels on growth, survival and body compositionof larvae in Pseudosciaena crocea [J]. Journal of Fishes ofChina, 2006, 304(4): 502-508 [刘峰, 麦康森, 艾庆辉, 等.鱼肉水解蛋白对大黄鱼稚鱼存活、生长以及体组成的影响.水产学报, 2006, 304(4): 502-508]
[13] López-Alvarado J, Langdon C J, Teshima S I, et al. Effectsof coating and encapsulation of crystalline amino acids onleaching in larval feeds [J]. Aquaculture, 1994, 122(4):335-346
[14] Williams S. AOAC (Association of Official AnalyticalChemists). Official Methods of Analysis, 16thedn.Association of Official Analytical Chemists [M]. Arlington:VA USA. 1995, 1298
[15] Ribeiro L, Zambonino-Infante J L, Cahu C, et al. Digestiveenzymes profile of Solea senegalensis post larvae fedArtemia and a compound diet [J]. Fish Physiology andBiochemistry, 2002, 27(1-2): 61-69
[16] Holm H, Hanssen L E, Krogdahl A, et al. High and lowinhibitor soybean meals affect human duodenal proteinaseactivity differently: in vivo comparison with bovine serumalbumin [J]. Nutrition, 1988, 118(4): 515-520
[17] Métais P, Bieth J. Determination de I'α-amylase par unemicrotechnique [J]. Annales Biologie Clinique, 1968, 26:133-142
[18] Bessey O A, Lowry O H, Brock M J. Rapid coloric methodfor determination of alkaline phosphatase in five cubicmillimeters of serum [J]. Biological Chemistry, 1946, 164:321-329