摘 要: 【目的】优化小豆皂苷提取方法和适用于超高效液相色谱-电喷雾质谱联用的小豆皂苷检测方法。【方法】以小豆品种‘京农6号’为材料,采用索氏提取法和超声波辅助浸泡法两种提取方法提取小豆皂苷,利用超高效液相色谱-电喷雾质谱联用检测小豆籽粒中6种小豆皂苷的相对含量。【结果】使用80%乙醇作为提取液、物料比1∶20、40℃、40 KHz超声提取90 min,提取效率较索氏提取法平均效率约高10%。采用C18柱(2.1 mm×50 mm,1.8μm),流动相0.1%甲酸/水(A)和乙腈(B),简化洗脱条件为10%乙腈至100%乙腈5 min线性梯度洗脱,柱温25℃,流速0.4 mL/min;电离电压3 500 V、源温度350℃电喷雾电离、氮气35 psi、气体流速10 L/min,在5 min中内可快速完成6种小豆皂苷检测。【结论】超声波辅助浸泡法可提高小豆皂苷提取率,缩短提取时间,减少溶剂用量;对超高效液相色谱-电喷雾质谱联用检测小豆皂苷的洗脱梯度进行优化,快速检测小豆皂苷。
关键词: 小豆皂苷; 提取方法; 超高效液相色谱-电喷雾质谱;
Abstract: 【Objective】 Optimization of extraction and assay method for adzuki bean saponins by Ultra Performance Liquid Chromatography-Electrospray Ionization Mass Spectrometric. 【Methods】 Azukisaponins were extracted from Jingnong 6 variety of adzuki bean by Soxhlet extraction and Ultrasonic-assisted extraction. The relative content of six azukisaponins in adzuki bean seed were assayed by Ultra Performance Liquid Chromatography-Electrospray Ionization Mass Spectrometric method. 【Results】 Using 80% aqueous ethanol as the extracting solution, 20∶1 as the efficiency ratio of solvent to the seed powder, 40 ℃ and 40 KHz ultrasonic extraction for 90 min, the total azukisaponins was 10% higher than that of Soxhlet extraction. The mobile phase of Agilent C18 column(2.1 mm×50 mm,1.8 μm) was 0.1% aqueous formic acid(A) and acetonitrile(B). The simplified elution conditions were linear gradient elution from 10% acetonitrile to 100% acetonitrile for 5 min. The column temperature was 25 ℃, and the flow rate was 0.4 mL/min. The instrument was operated at an ionization voltage of +3500 V and source temperature of 350 ℃. Nitrogen was used as nebulizer gas at 35 psi and drying gas at a flow rate of 10 L/min, within 5 min to complete the separation and detection of six azukisaponins. 【Conclusion】 Ultrasonic-assisted extraction method can increase the extraction rate, reduce time and solvent. The gradient elution of azukisaponins by Ultra Performance Liquid Chromatography-electrospray Ionization Mass Spectrometric method were optimized, and azukisaponins are rapidly assayed.
Keyword: azukisaponins; extraction method; ultra performance liquid chromatograph mass spectrometer;
小豆(Adzuki bean,Vigna angularis),俗称红小豆、赤豆、赤小豆,起源于中国,栽培历史悠久[1]。全球有30多个国家种植小豆,中国的栽培面积和总产量居世界首位[2,3]。小豆营养丰富,含有三萜、多酚、类黄酮等生物活性物质。三萜类化合物对植物生长发育和抗逆有重要作用,植物中已发现20 000多种三萜类化合物[4,5];三萜还具有抗血小板、抗肿瘤、抗病毒、降低胆固醇、消炎及作为免疫佐剂等生理活性,在医药卫生和保健方面有着较大的应用潜力,近年来成为国内外生物和医药研究领域关注的热点之一[6,7]。

小豆中的三萜皂苷是祛湿、消肿、抗炎的主要活性成分[8]。已报道小豆中有10种小豆皂苷[9,10,11];其中的4种皂苷因含有2,3-二氢-3,5-二羟基-6-甲基-4H-吡喃-4-酮基团(2,3-dihydro-2,5-dihydroxy-6-methyl-4H-pyran-4-one,DDMP),易受热分解难以提取分离[10],所以相关研究极少。已分离的6种小豆皂苷均属于齐墩果烷型的三萜化合物,分别是小豆皂苷I(Azukisaponin I)、小豆皂苷II(Azukisaponin II)、小豆皂苷III(Azukisaponin III)、小豆皂苷IV(Azukisaponin IV)、小豆皂苷V(Azukisaponin V)和小豆皂苷VI(Azukisaponin VI)[9];它们的总提取物对胰脂肪酶活性有抑制作用,并且抑制α-葡萄糖酶活性的能力高于大豆、绿豆、豇豆、利马豆、豌豆、蚕豆和小扁豆[12]。
小豆皂苷提取方法有索氏提取法和浸泡法[8,12,13],但均溶剂消耗大、工艺复杂、成本高、无法满足多材料样本的提取。有报道超声波辅助浸泡法具有效率高、时间短、成本低廉、操作方便等优点[14],该方法已应用于小扁豆、大豆、羽扇豆和葫芦巴的总皂苷提取[15],但在小豆中未见相关应用。本试验首次把超声波辅助浸泡法应用于小豆皂苷提取,并对索氏提取法和超声波辅助浸泡法的提取效率进行比较。
由于小豆皂苷I、小豆皂苷II、小豆皂苷III、小豆皂苷IV、小豆皂苷V和小豆皂苷VI这6种小豆皂苷没有标准品出售,无法分别检测,闫婕等以齐墩果酸为标准品,采用紫外分光光度法测定小豆总皂苷含量[8],但由于这6种小豆皂苷的结构相似,紫外吸收波段相近,紫外分光光度法无法对其逐一定量分析。已有用液质联用检测小豆皂苷[13],但仍未见用超高效液质联用仪测定小豆皂苷的报道。本试验参考液质联用测定方法,开拓超高效液质联用检测小豆皂苷,优化洗脱梯度和条件,提高检测效率。小豆皂苷的提取、标准品制备和超高效液质联用检测方法的优化,将为小豆种质资源中小豆皂苷成分含量测定、小豆皂苷高含量种质资源的筛选及育种应用、小豆皂苷代谢途径优异基因发掘利用、小豆皂苷药理研究提供高效实用的检测技术方法。
1 、材料与方法
1.1 、材 料
小豆品种‘京农6号’,由北京农学院选育。
1.2 、方 法
1.2.1 、磨粉
用高速万能粉碎机(YW-100,天津市泰斯特仪器有限公司)将‘京农6号’籽粒磨粉(1 200 r/min),过筛(150 μm),40 ℃烘干至恒重,备用。
1.2.2、 样品溶液的制备
称取 0.40 g豆粉置于10 mL试管中,加入 8 mL 90% 甲醇,40 ℃、40 KHz超声提取90 min(PS-60AD,深圳市科洁超声科技有限公司),提取液0.45 μm膜过滤后供检测分析。称取1.00 g豆粉放入滤纸包内,将滤纸包置于提取管中,向250 mL圆底烧瓶中加入100 mL甲醇回流提取3 次(每次1 h ),旋转蒸发仪(RE-2000E,上海霓玥仪器有限公司)旋转蒸发至干,用甲醇溶解并定容至20 mL,0.45 μm膜过滤供检测分析。
1.2.3、 色谱与质谱条件
测定仪器为三重四极杆液质联用仪(Agilent 1290-G6470),该系统配备Agilent ZORBAX RRHD Eclipse Plus C18柱2.1 mm×50 mm,1.8 μm, 流动相为0.1%甲酸/水(A)和乙腈(B)。简化洗脱条件为10% 乙腈至100% 乙腈 5 min线性梯度洗脱。柱温25 ℃,流速0.4 mL/min,进样量1 μL。电喷雾质谱(electrospray ionization-mass spectrometric,ESI-MS)分析,采用电离电压3 500 V,源温度350 ℃电喷雾电离;氮气35 psi,气体流速 10 L/min,负离子模式下对m/z760到m/z1140进行全扫描(MS2 scan)。在选择离子监测(SIM,Selected Ion Monitoring)检测方式下,检测两种提取方法所得提取物的分子离子。在碎片离子扫描(Product Ion Scan)方式下,检测提取物的碎片离子。
2、 结果与分析
2.1、 小豆皂苷分子离子定性分析
根据6种小豆皂苷的分子量,确认提取物中存在小豆皂苷I、小豆皂苷II、小豆皂苷III、小豆皂苷IV、小豆皂苷V和小豆皂苷VI,在小豆提取物的超高效液相色谱-电喷雾质谱(Ultra Performance Liquid Chromatography-electrospray Ionization Mass Spectrometric,UPLC-ESI-MS)的总离子色谱图中标记小豆皂苷的6个峰(图1)。简化洗脱条件后,5 min内完成检测,节省流动相并提高检测效率。
图1 小豆提取物的UPLC-ESI-MS总离子色谱图
Fig.1 UPLC-ESI-MS total ion chromatograms of adzuki bean total extract
注:1是小豆皂苷IV;2是小豆皂苷VI;3是小豆皂苷V;4是小豆皂苷II;5是小豆皂苷I;6是小豆皂苷III。
Note:1 is Azukisaponin IV; 2 is Azukisaponin VI; 3 is Azukisaponin V; 4 is Azukisaponin II; 5 is Azukisaponin I; 6 is Azukisaponin III.
2.2 、小豆皂苷碎片离子定性分析
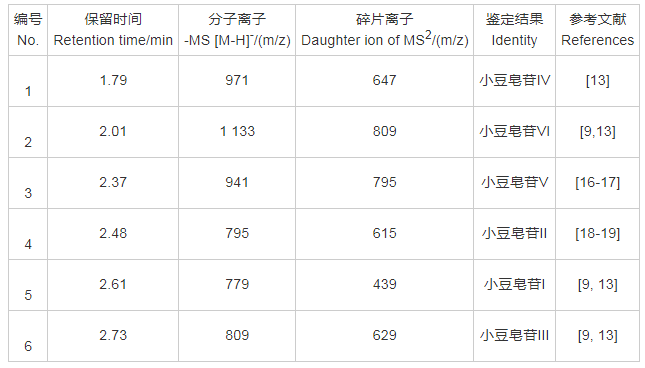
通过比较保留时间、UPLC-ESI-MS 鉴定(图1)和ESI-MS2(图2),峰1是小豆皂苷IV;峰2是小豆皂苷VI;峰3是小豆皂苷V;峰4是小豆皂苷II;峰5是小豆皂苷I;峰6是小豆皂苷III(表1)。
表1 小豆中鉴定6种小豆皂苷的UPLC-ESI-MS2数据
2.3 、两种提取方法的相对含量分析
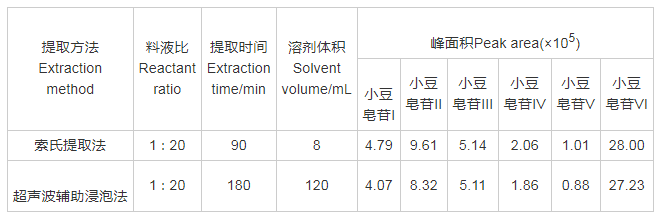
以选择离子监测方式检测的小豆皂苷积分面积为评价指标,超声波辅助浸泡法提取的6种小豆皂苷的得率优于索氏提取法,提取时间、提取液体积小于索氏提取法(表2)。采用超声波辅助浸泡法可提高小豆皂苷得率,缩短提取时间,节省溶剂。
表2 超声波辅助浸泡法与索氏提取法的比较(n=6)
3、 讨 论
索氏提取法具有得率高、准确等特点,但索氏提取法提取时间长和成本高,难以应用于大量样本的提取。本试验比较索氏提取法和超声波辅助浸泡法的得率,表明超声波辅助浸泡法提取的6种小豆皂苷的得率优于索氏提取法,且省时、成本低、操作方便,适合用于大规模种质资源样本的小豆皂苷制备提取。
图2 6种小豆皂苷质谱图
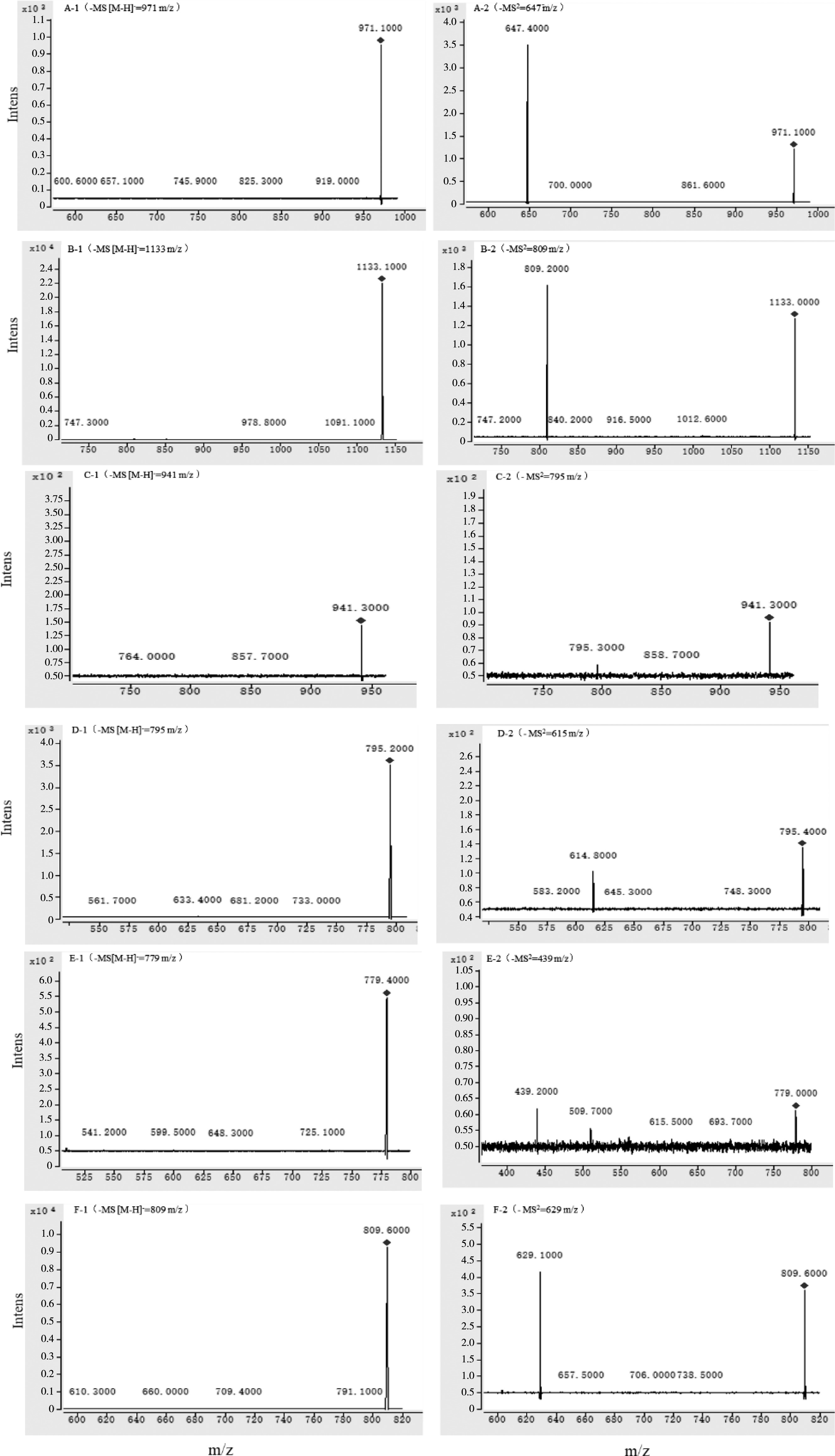
Fig.2 ESI (-) MS, MS2spectra of identified six azukisaponins in adzuki bean
近年,高效液相色谱法开始广泛用于三萜类化合物的定量和定性分析上[20]。Liu等使用Agilent 1100系列高效液相色谱仪检测9种小豆类黄酮和6种小豆皂苷,使用10 mmol/L乙酸铵和乙腈进行梯度洗脱。初始条件为10%乙腈 10 min,30 min 变为15%乙腈,45 min变为25%乙腈,55 min变为35%乙腈,60 min时45%乙腈, 70 min时55%乙腈。分析时间为90 min,其中小豆皂苷分析时间为25 min[13]。本试验使用Agilent 1290-G6470三重四极杆液质联用仪,简化洗脱条件为10% 乙腈至100% 乙腈10 min线性梯度洗脱,在5 min内完成对6种小豆皂苷的分离及测定,显着提高检测效率。
本试验建立小豆超声波辅助浸泡提取6种小豆皂苷的方法、确定超高效液质联用检测6种小豆皂苷的方法,为小豆皂苷提取、标样制备和检测提供高效技术方法,为进一步筛选小豆皂苷高含量的种质资源和生物强化育种利用以及相关产品的开发奠定基础。
参考文献
[1] 赵波,叶剑,金文林,曾潮武,吴宝美,濮绍京,潘金豹,万平.不同类型小豆种质SSR标记遗传多样性及性状关联分析[J].中国农业科学,2011,44(4):673-682
[2] Kramer C,Soltani N,Robinson DE,Swanton CJ,Sikkema PH.Control of Volunteer Adzuki Bean in Soybean[J].Agricultural Sciences,2012,3(4):501-509
[3] 李媛,赵波,王天奇,李奕松,王秀金,扎西措姆,杨凯,万平.野生小豆和栽培小豆种子表型性状分析[J].北京农学院学报,2017,32(4):8-13
[4] 谭政委.水稻2,3-氧化鲨烯环化酶基因OsOSC7的功能研究[D].北京:中国科学院大学,2016
[5] Shanmugam MK,Dai X,Kumar AP,Tan BK,Sethi G,Bishayee A.Oleanolic acid and its synthetic derivatives for the prevention and therapy of cancer:preclinical and clinical evidence[J].Cancer Letters,2014,346(2):206-216
[6] 陈颖,孙海燕,曹银萍.三萜皂苷生物合成途径研究进展[J].中国野生植物资源,2012,31(6):15-17
[7] 王志芳.皱皮木瓜中齐墩果酸和熊果酸测定、提取及抗肿瘤活性研究[D].武汉:华中农业大学,2006
[8] 闫婕,卫莹芳,龙飞,王化东,郭山山.不同产地赤小豆总三萜的含量测定及品质评价[J].时珍国医国药,2012(2):55-56
[9] Kitagawa I,Wang H,Saito M,Yoshikawa M.Saponin and sapogenol.XXXII.Chemical constituents of the seeds of Vigna angularis (Willd.) Ohwi et Ohashi.(2).Azukisaponins I,II,III,and IV[J].Chemical & Pharmaceutical Bulletin,1983,31(2):674-682
[10] Iida T,Yoshiki Y,Kahara T,Okubo K,Ohrui H.A saponin conjugated with 2,3-dihydro-2,5-dihydroxy-6-methyl-4H-pyran-4-one from Vigna angularis[J].Phytochemistry (Oxford),1997,45(7):1507-1509
[11] Iida T,Yoshiki Y,Okubo K,Ohrui H,Kinjo J,Nohara T.Triterpenoid saponins from Vigna angularis[J].Phytochemistry,1999,51(8):1055-1058
[12] Liu R.Anti-obesity effects of flavonoids and saponins from adzuki bean [D].Hong Kon:Hong Kong Baptist University,2014
[13] Liu R,Cai Z,Xu B.Characterization and quantification of flavonoids and saponins in adzuki bean (Vigna angularis L.) by HPLC-DAD-ESI-MSn analysis[J].Chemistry Central Journal,2017,11(1):93-110
[14] 赵强,刘喜纲.齐墩果酸提取分离纯化及含量测定的研究概述[J].天津药学,2017(6):68-71
[15] Navarro Del Hierro J,Herrera T,García-Risco MR,Fornari T,Reglero G,Martin D.Ultrasound-assisted extraction and bioaccessibility of saponins from edible seeds:Quinoa,lentil,fenugreek,soybean and lupin[J].Food Research International,2018,109:440-447
[16] Oshima Y,Ohsawa T,Hikino H.Structures of Dianosides G,H and I,Triterpenoid Saponins of Dianthus superbus var.longicalycinus Herbs[J].Planta Medica,1984,50(3):254-258
[17] Avunduk S,Mitaine-Offer AC,Alanku?-Cali?kan O,Miyamoto T,Senol SG,Lacaille-Dubois MA.Triterpene Glycosides from the Roots of Astragalus flavescens[J].Journal of Natural Products,2008,71(1):141-145
[18] Kinjo J,Hatakeyama M,Udayama M,Tsutanaga Y,Yamashita M,Nohara T,Yoshiki Y,Okubo K.HPLC Profile Analysis of Oleanene-Glucuronides in Several Edible Beans[J].Bioscience,Biotechnology,and Biochemistry,1998,62:429-433
[19] Sakamoto S,Kofuji S,Kuroyanagi M,Ueno A,Sekita S.Saponins fromTrifolium repens[J].Phytochemistry (Oxford),1992,31(5):1773-1777
[20] 李全斌,何开勇.齐墩果酸含量测定的研究进展[J].中国执业药师,2011,8(7):32-34