摘要:为进一步提高微小昆虫不同器官 (触角感器、口器感器、复眼及颜色较淡的部位如:肠道、腺体、唾液道、精子、卵母细胞等) 透射电镜样品制备效率, 对微小昆虫不同器官的透射电镜样品制样方法进行了改良。建立了简易的“纸巾包裹法”和“琼脂包埋法”.这两种方法具有简单快速、操作方便、易于掌握的优点, 并解决了大量样品在漂洗过程中易被吸管吸走、或黏附在吸管壁上被带走等“损耗”的问题, 与常规制样方法相比, 既节约了大量操作时间, 也保证了样品的数量和质量, 提高了微小昆虫生物样品制样的效率。
关键词:微小昆虫; 样品制备; 改良; 透射电子显微镜;
Improvement of the tiny insect sample preparation method for transmission electron microscope
Abstract:This study was aimed to improve the sample preparation efficiency for different organs (antenna sensilla, mouthpart sensilla, compound eyes and light-colored parts such as intestine, gland, saliva, sperm, oocytes, etc.) of tiny insects for transmission electron microscopy.The simple“paper towel wrapping method”and “agar embedding method”were established, which has the advantages of simplicity and rapidness, are easy to operate and master, and helps solve the problems of losing a large number of samples during rinsing as the samples were prone to being sucked by the drip pipe or attached to the drip pipe wall or taken away.Compared with the conventional sample preparation method, it not only saves a lot of operation time, but also ensures the quantity and quality of the sample.The simple new method improves the efficiency of sample preparation for the biological samples of tiny insects.
Keyword:tiny insect; sample preparation; improvement; transmission electron microscope;
电子显微镜广泛应用于材料科学、生命科学和临床病理诊断等领域, 是现代科学研究领域不可缺少的手段之一, 在生命科学研究领域的重要性和不可替代的地位更加显着。电子显微镜是研究生物组织、细胞及细胞器超微结构的常用工具, 也是科研工作者探索生物真实活动的手段之一。但由于生物电镜样品制备过程繁琐, 有时也难以获得高质量的样品, 影响了对样品结构的观察研究, 耗费了研究者大量的时间、精力和财力, 在一定程度上阻滞了科研的发展[1-8].特别是昆虫身体表面被覆高度骨化的外骨骼、角膜和角质层, 质地坚硬, 固定液和包埋剂均难以渗透, 对于用透射电镜研究其内部超微结构, 精确并清晰地观察身体内部组织细胞超微结构的变化是个巨大的挑战。首先, 要确保电镜固定液快速有效地进入微小的昆虫体内, 保护好其体内结构, 防止细胞结构溶解;其次, 要确保样品在脱水后包埋剂能很好地渗入组织结构中, 起到均匀地包埋支持作用;最后, 样品在处理完后包埋时, 对于特定部位尤其是触角、口器感器、复眼和肌肉等部位的取向定位也是需要解决的一个重要问题[9-25].常规透射电镜生物样品制备技术是进行生物样品超微结构研究中最基本, 也是最重要的步骤, 它的高效、高质量, 对获得高清晰、高质量的图片有着至关重要的影响;而且该步骤的不断改进对电镜技术的提高和应用起着重要的推动作用。
常规制备微小昆虫不同部位器官 (触角感器、口器感器、复眼及颜色较淡的部位如:肠道、腺体、唾液道、精子、卵母细胞等) 的透射电镜样品时总是耗时、费力, 多次漂洗过程中样品被吸管吸走、或黏附在吸管壁上被带走或者附着在离心管壁等“损耗”, 影响了透射电镜样品制备效率。作者经过摸索, 发现利用“纸巾包裹法”和“琼脂包埋法”不仅可以提高透射电镜样品制备效率, 而且具有操作方便、简单快速、易于掌握的优点。
1、材料与方法
1.1 样品
玉米黄呆蓟马Anaphothrips obscurus (Müller) 成虫 (实验室饲养10~15代) 由西北农林科技大学植物保护学院缨翅目分类实验室提供。成虫用盆栽的小麦或玉米幼苗在人工气候箱 (25℃±1℃, L∥D=14h∥10h, RH:75%±5%) 中饲养。榕母管蓟马Gynaikothrips ficorum (Marchal) 成虫采自广东省广州市榕树叶上。
1.2 试剂与仪器
无菌水、0.2 mol/L磷酸缓冲液、2.5%戊二醛溶液、2%锇酸 (OsO4) 、乙醇溶液 (10%, 30%, 50%, 70%, 80%, 90%, 95%, 100%) 、伦敦白胶、0.3 mL胶囊、2%醋酸双氧铀、4%柠檬酸铅、纸巾、琼脂、超净工作台、Nikon SMZ1500显微镜、Eppendorf Mix Mate涡旋振荡器、Eppendorf移液器、培养箱、培养皿、PCR管 (1.5mL和4mL) 、冷冻干燥仪VFD-21S、离子溅射仪MSP-1S、Leica EM UC7、扫描电镜Hitachi S-3400N、透射电子显微镜JEOL JEM-1230等。
1.3 试验方法
1.3.1 复眼和口器样品的制备方法
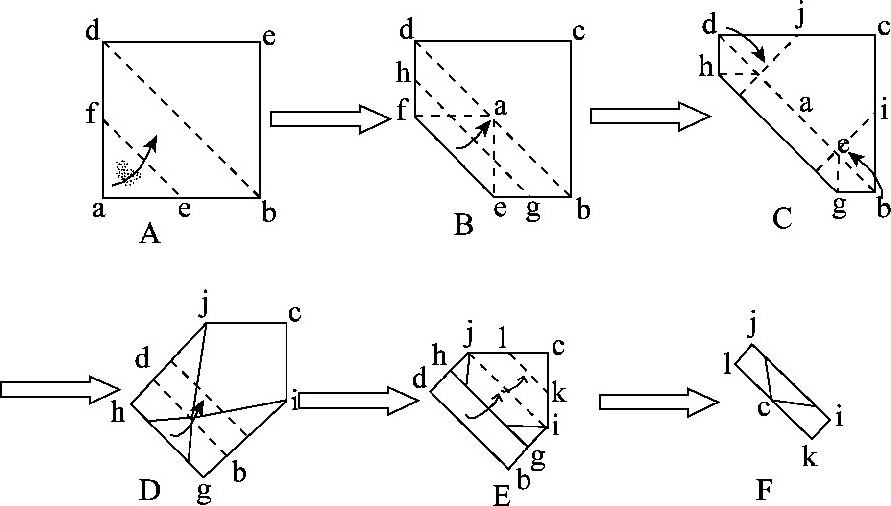
取玉米黄呆蓟马和榕母管蓟马雌成虫各10头直接放到预冷的2.5%戊二醛溶液中, 在Nikon SMZ1500光学显微镜下迅速将带有完整复眼或口器的头部切下, 立即放于培养皿内用预冷的2.5%戊二醛溶液浸湿的2cm×2cm正方形纸巾 (由3层, 21cm×21cm的泉林本色秸秆手帕纸剪成, 柔韧度好) 上 (图1) , 等全部取完样品, 如图所示沿ef向对角线bd处用电镜专用极细的尖头镊子向里折, 将样品完全盖住 (图1A) , 接着沿gh向对角线bd处再向里折 (图1B) , 将两侧的边也折起来 (图1C, D) , 再接着沿对角线bd依次向c处折 (图1E, F) , 最后将折叠好的样品迅速放入装有预冷的2.5%戊二醛溶液的4mL圆底离心管里, 抽真空约30min, 盖好盖子, 放到4℃下避光固定6h.固定后的样品用0.1mol/L, pH 7.2磷酸缓冲液漂洗6次, 再用锇酸 (OsO4) 固定液 (0.1mol/L, pH 7.2) 固定2h, 再用磷酸缓冲液漂洗6次后, 经不同梯度的乙醇溶液 (10%, 30%, 50%, 70%, 80%, 90%, 95%, 100%, 100%) 脱水, 然后样品依次经过不同体积比的乙醇-伦敦白胶混合物 (V乙醇:VLR-White=3∶1, 1∶1, 1∶3) 与两次纯伦敦白胶渗透。包埋时小心用细头镊子将纸巾慢慢打开, 最后露出样品, 逐一将样品放到胶囊内, 盖好盖子, 并压紧盖子, 将包埋好的样品放入烘箱中60℃聚合48h.聚合后的样品块在Leica EM UC7切片机上用钻石刀切成厚度约50~70nm的超薄切片, 依次用2%醋酸双氧铀染色10 min和4%柠檬酸铅染色8min, 最后在JEOL JEM-1230透射电子显微镜 (加速电压80kV) 下观察和拍照。
1.3.2 触角样品的制备方法
取玉米黄呆蓟马和榕母管蓟马雌虫各10头直接放进预冷的2.5%戊二醛溶液中, 在Nikon SMZ1500光学显微镜下迅速将带有完整触角的头部切下, 把触角的柄节、梗节、鞭节 (Ⅰ-Ⅵ) 分别迅速切下, 并立即放入装有几滴预冷的2.5%戊二醛溶液的1.5mL的尖底离心管中, 加入2~3滴40℃左右1.5%的琼脂, 4℃下避光冷凝20min, 用牙签贴着离心管壁把琼脂包裹着样品的凝胶块刮下来, 迅速放入装有3.8 mL预冷的2.5%戊二醛溶液的4mL圆底离心管中, 触角每节至少取6~7个琼脂包埋块, 4℃下避光固定6h.固定后的样品经磷酸缓冲液漂洗6次, 用锇酸 (OsO4) 固定液 (0.1 mol/L, pH7.2) 固定2h, 再用磷酸缓冲液漂洗6次后, 依次经不同浓度梯度的乙醇溶液 (10%、30%、50%、70%、80%、90%、95%、100%) 脱水。样品依次再经过不同体积比的乙醇-伦敦白胶混合物 (V乙醇:VLR-White=3∶1, 1∶1, 1∶3) 与两次纯伦敦白胶渗透。包埋时小心用牙签将琼脂包埋块逐一放到胶囊内, 盖好盖子, 并压紧盖子, 将包埋后的样品放入烘箱中60℃聚合48h.聚合后的样品块在Leica EMUC7切片机上用钻石刀切成厚度约50~70nm的超薄切片, 依次用2%醋酸双氧铀染色10min和4%柠檬酸铅染色8min, 最后在JEOL JEM-1230透射电子显微镜 (加速电压80kV) 下观察和拍照。
2、结果与分析
2.1 口器感器和复眼观察
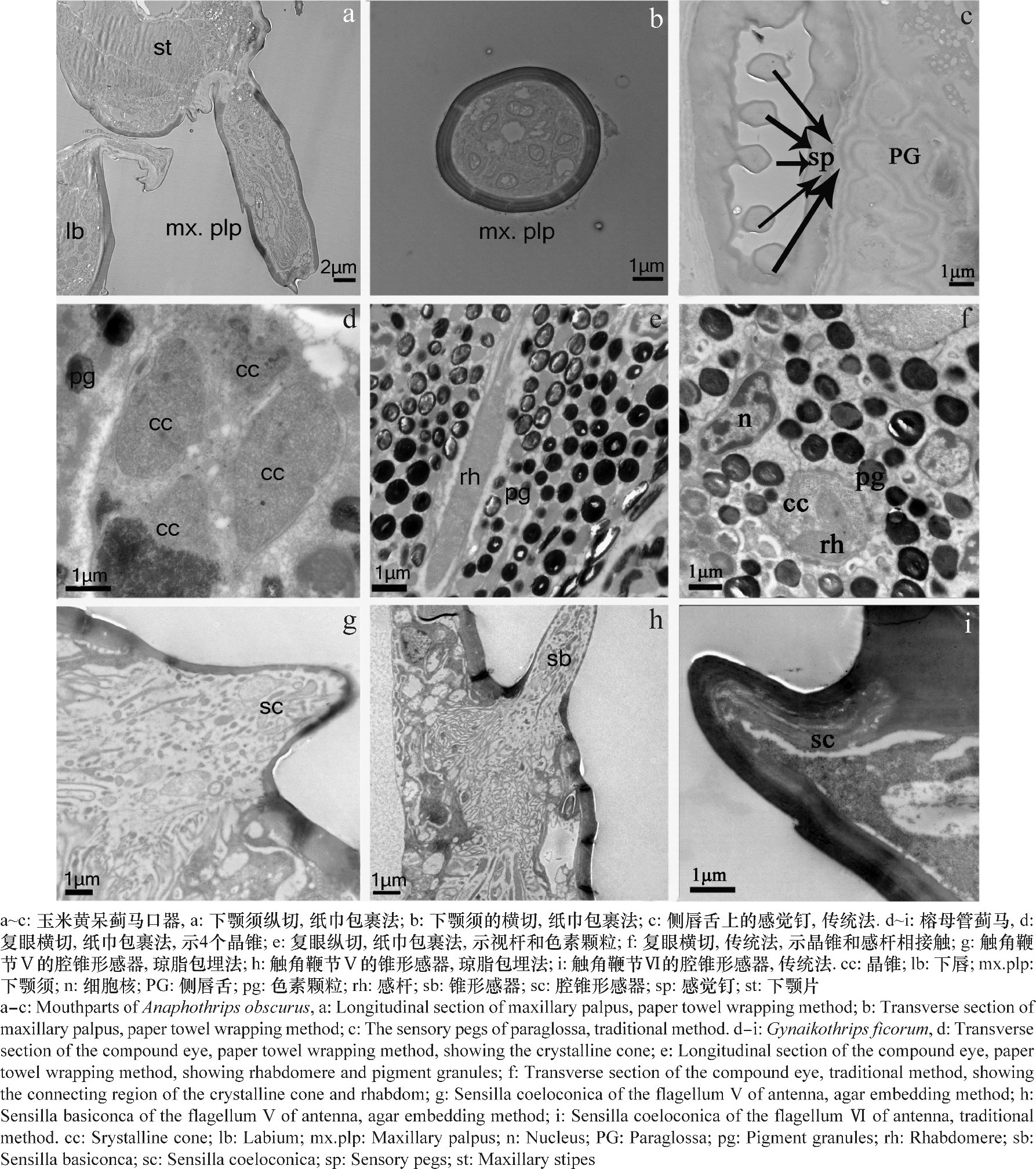
“纸巾包裹法”处理后的样品---玉米黄呆蓟马口器下颚须的纵切面 (图2a) 、横切面 (图2b) 和榕母管蓟马复眼横切面 (图2d) 和纵切面 (图2e) 及传统方法处理的样品---玉米黄呆蓟马口器侧唇舌的横切面 (图2c) 和榕母管蓟马复眼横切面 (图2f) , 所获得图片都显示:细胞结构完整, 口器感器的结构保存完好, 下颚须的6个神经树突鞘清晰可见 (图2b) , 视觉感器的4个晶锥 (cc) 清楚, 感杆 (rh) 的微绒毛大多与细胞长轴垂直, 信息丰富。但两种处理方法的图片在边缘局部区域会出现渗透不理想的现象, 这是由于昆虫体表骨骼化程度高或有坚韧的角质化层, 固定液和树脂难以渗透的原因造成的。
2.2 触角感器观察
从图2可见, “琼脂包埋法”处理后的样品---榕母管蓟马触角的纵切面 (图2g~h) 和传统方法处理的样品---榕母管蓟马触角的纵切面 (图2i) , 都能获得较好的图片, 亚细胞结构完好, 神经树突结构清晰 (图2g, h) .
3、讨论
结果表明, 改良方法和传统方法处理样品都能获得理想的效果。改良方法不仅具有操作方便、简单快速、易于掌握的优点, 而且还克服了大量样品在多次漂洗过程中“损耗”的缺点, 特别是对于珍贵的样品不但保证了样品的数量, 也获得了高质量的电镜图片。
获得高质量、高清晰电镜图片的关键因素是样品的固定效果良好及超薄切片的质量。一般植物材料用4%戊二醛溶液固定6h或锇酸固定2h;动物组织用2.5%戊二醛溶液固定4h或锇酸固定1h, 固定的时间也不宜过长, 一般不超过4h, 过长会造成组织变脆, 为切片带来困难[26-27].无水乙醇与LR-White伦敦白胶梯度渗透, 能使渗透效果均匀, 有利于制成高质量包埋块, 提高树脂的可切性。适当延长时间, 能提高样品的渗透效果。在包埋块制作过程中, 注意胶囊盖子一定要密封好, 盖子压实, 否则会由于伦敦白胶与空气接触而使样品变软, 切片后会出现刻痕和发散现象, 影响超微结构的观察。
“纸巾包裹法”在每次漂洗时需注意吸管或枪头的尖端不要扎破纸巾, 否则样品会从破洞中出来, 在每一步的清洗过程中仍会“损耗”.
“琼脂包埋法”可以准确定位, 例如昆虫触角的柄节、梗节、鞭节各节上的感觉器各不相同, 在超薄切片机上要想切到想要的部位, 非常困难, 利用“琼脂包埋法”可以准确地分节, 修块时易于定位, 准确地切到需要的部位。但需注意包埋样品的琼脂不能太厚, 如果过厚, 可以用新的双面刀片粗修, 使样品最多1mm2大小, 否则固定效果也会减弱。
参考文献
[1]杨勇骥, 汤莹, 叶煦亭, 等。医学生物电子显微镜技术[M].上海:第二军医大学出版社, 2012:77.
[2]张燕如, 任利利, 骆有庆。透射电镜树脂包埋块中昆虫感器的定位技术[J].应用昆虫学报, 2013, 50 (5) :1479-1483.
[3]谢家仪, 董光军, 刘振英。扫描电镜的微生物样品制备方法[J].电子显微学报, 2005, 24 (4) :440-440.
[4]李向党。游离细胞超快扫描电镜样品制备法[J].电子显微学报, 2001, 20 (4) :537-538.
[5]曲淑贤, 高船舟, 吕广艳, 等。悬浮细胞扫描电镜快速制样方法[J].医学信息, 2008, 21 (7) :1162-1163.
[6]路菊, 陶忠芬, 可金星。悬浮状物质的样品制备及扫描电镜观察[J].第三军医大学学报, 2007, 29 (4) :368-369.
[7]李培京。扫描电镜生物样品制备与观察[J].现代科学仪器, 2008 (3) :124-125.
[8]梁静南, 刘一苇。对扫描电镜观察微生物样品出现磷酸盐结晶现象的改良[J].电子显微学报, 2012, 31 (2) :194-195.
[9]KLOWDEN M J.Physiological systems in insect[M].Second Edition.Elsevier:Academic Press, 2007:552-553.
[10]许再福。普通昆虫学[M].北京:科学出版社, 2009:75-77.
[11]HEMING B S.Structure and function of the mouthparts in larvae of Haplothrips verbasci (Osborn) (Thysanoptera, Tubulifera, Phlaeothripidae) [J].Journal of Morphology, 1978, 156:1-38.
[12]HUNTER W B, ULLMAN D E.Analysis of mouthparts movements during feeding of Frankliniella occidentalis (Pergande) and F.schultzei Trybom (Thysanoptera:Thripidae) [J].International Journal of Insect Morphology&Embryology, 1989, 18:161-171.
[13]CHISHOLM I F, LEWIST.A new look at thrips (Thysanoptera) mouthparts, their action and effects of feeding on plant tissue[J].Bulletin of Entomological Research, 1984, 74:663-675.
[14]ULLMAN D E, MCLEAN D L.Anterior alimentary canal of the pear psylla, Psylla pyricola Foerster (Homoptera:Psyllidae) [J].Journal of Morphology, 1986, 189:89-98.
[15]HUNTER W B, ULLMAN DE.Anatomy and ultrastructure of the piercing-sucking mouthparts and paraglossal sensilla of Frankiniella occidentalis (Pergande) (Thysanoptera:Thripidae) [J].International Journal of Insect Morphology and Embryology, 1992, 21 (1) :17-35.
[16]FOSTER S, GOODMAN L J, DUCHETT J G.Ultrastructure of sensory receptors on the labium of the rice brown planthopper[J].Cell and Tissue Research, 1983, 230:353-56.
[17]孟春梅, 郑华, 李卫东, 等。果蝇的透射电镜制样方法研究[J].电子显微学报, 2016, 35 (4) :365-368.
[18]赵杰军, 陈晓鸣, 王自力, 等。白蜡虫若虫口器超微结构特征与生态适应性[J].动物学研究, 2012, 33 (5) :447-454.
[19]付丙鲜。灰飞虱触角感觉器的形态、神经结构与发育[D].杭州:浙江大学, 2012:1-110.
[20]陈柏林, 洛向玉, 王萃。玻璃刀制备木材超薄切片的研究[J].东北林业大学学报, 1996, 24 (3) :84-89.
[21]张善干, 马淑芳, 付宏兰, 等。马尾松毛虫雄蛾触角毛状感受器的细微结构[J].昆虫学报, 1995, 38 (1) :8-12.
[22]BUSCHBECK E K, FRIEDRICH M.Evolution of insect eyes:Tales of ancient heritage, deconstruction, reconstruction, remodeling, and recycling[J].Evolution:Education and Outreach, 2008, 1 (4) :448-462.
[23]CHEN Qingxiao, LI Tao, HUA Baozhen.Ultrastructure of the larval eye of the scorpionfly Panorpa dubia (Mecoptera:Panorpidae) with implications for the evolutionary origin of holometabolous larvae[J].Journal of Morphology, 2012, 273:561-571.
[24]CHEN Qingxiao, WEI Yao, HUA Baozhen.Ultrastructural comparison of the compound eyes of Sinopanorpaand Panorpa (Mecoptera:Panorpidae) [J].Micron, 2012, 43 (8) :893-901.
[25]FISCHER C, MAHNER M, WACHMANN E.The rhabdom structure in the ommatidia of the Heteroptera (Insecta) , and its phylogenetic significance[J].Zoomorphology, 2000, 120 (1) :1-13.
[26]李剑平。扫描电子显微镜对样品的要求及样品的制备[J].分析测试技术与仪器, 2007, 13 (1) :74-77.
[27]郝宏京, 毛同林, 李克斌。肌肉样品在制备过程中不同温度对其反差的影响[J].电子显微学报, 2002, 21 (5) :830-831.