血液内科论文第四篇:AML及MDS伴骨髓纤维化的预后积分系统应用效果
摘要:目的 评估骨髓纤维化、骨髓增生异常综合征相关预后系统对我国急性髓系白血病 (AML) 、骨髓增生异常综合征 (MDS) 伴骨髓纤维化的预后效力, 探讨AML/MDS伴骨髓纤维化预后因素。方法 回顾性分析134例AML及MDS伴骨髓纤维化患者病例资料, 采用PMF-IPSS、DIPSS、IPSS-Chinese、DIPSS-Chinese、MYSEC-PM、 MDS-IPSS、IPSS-R、WPSS对其进行预后分组及评估, 并分析预后因素。结果 PMF-IPSS、DIPSS、IPSS-Chinese、DIPSS-Chinese、MYSEC-PM、 MDS-IPSS、IPSS-R、WPSS均不能对AML/MDS伴骨髓纤维化患者进行准确预后, 在MDS-IPSS、WPSS基础上增加骨髓纤维化分级可改善其预后效力。有脾肿大 (P=0.015) 、有输血依赖 (P=0.008) 、纤维化分级≥2级 (P<0.001) 、CRP>5.0 mg/L (P=0.032) 是AML/MDS伴骨髓纤维化的不良预后因素。结论 目前缺乏AML/MDS伴骨髓纤维化的预后系统, 脾肿大、输血依赖、纤维化分级及CRP与其预后相关, 或许可为预后评估及治疗提供新的选择。
关键词:急性髓系白血病; 骨髓增生异常综合征; 骨髓纤维化; 预后积分系统;
Prognosis of Patients Diagnosed with Myeloid Malignancies with Myelofibrosis
LV Li-wei ZHAO Chun-ting CUI Bo-li SUN Ling-jie FEI Hai-rong LIU Xiao-dan WU Shao-ling YIN Xiang-cong LI Tian-lan GAO Shan-shan FENG Xian-qi WANG Wei ZHAO Hong-guo MENG Fan-jun GAO Yan
Department of Blood, The Affiliated Hospital of Qingdao University
Abstract:Objective To evaluate the prognostic efficacy of the prognostic score system devised for myeloid fibrosis and myelodysplastic syndrome for acute myeloid leukemia (AML) and myelodysplastic syndrome (MDS) with myelofibrosis, and to explore the risk factors of AML/MDS with myelofibrosis.Methods The clinical information and prognosis of 134 patients diagnosed with AML or MDS with myelofibrosis were analyzed retrospectively.All patients were categorized according to PMF-IPSS, DIPSS, IPSS-Chinese, DIPSS-Chinese, MYSEC-PM, MDS-IPSS, IPSS-R and WPSS.And the possible prognostic factors were statistically analyzed.Results PMF-IPSS, DIPSS, IPSS-Chinese, DIPSS-Chinese, MYSEC-PM, MDS-IPSS, IPSS-R, WPSS could not accurately predict the prognosis of patients diagnosed with AML/MDS with myelofibrosis.Increasing the classification of myelofibrosis can improve the prognostic efficacy of MDS-IPSS and WPSS.Splenomegaly (P=0.015) , transfusion-dependent (P=0.008) , fibrosis grade≥2 (P<0.001) , CRP>5.0 mg/L (P=0.032) had poor prognostic significance.Conclusion There is currently no prognostic system for AML/MDS with myelofibrosis.Splenomegaly, transfusion dependence, fibrosis grade, and CRP are associated with prognosis, providing new options for prognosis and treatment.
除原发性骨髓纤维化 (PMF) 外, 骨髓增生异常综合征 (MDS) [1]、白血病、淋巴瘤等[2]多种疾病可伴发骨髓纤维化。骨髓纤维化是疾病发生发展的关键环节, 明确其对原发病的影响有利于为患者提供更精准的个体化治疗。目前仍缺乏血液病伴骨髓纤维化的特定预后系统, 陈猛等[3]应用PMF国际预后积分系统 (PMF-IPSS) 、动态国际预后积分系统 (DIPSS) , 针对我国患者的改良IPSS (IPSS-Chinese) 和DIPSS (DIPSS-Chinese) 以及真红细胞增多症/原发性血小板增多症后骨髓纤维化 (post-PV/ET MF) 预后模型 (MYSEC-PM) 对55例postPV/ET-MF患者进行分组, 发现上述5种积分系统均不能对我国post PV/ET-MF患者进行准确预后。
表1 AML伴骨髓纤维化患者根据不同预后积分系统分组情况
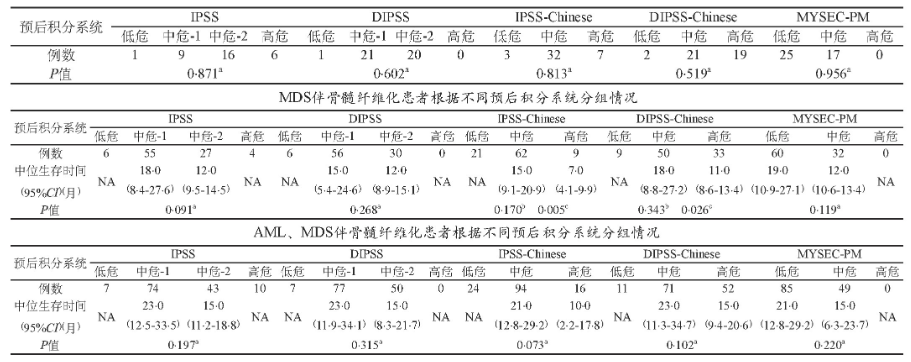
注:NA:数据不可用;IPSS:国际预后积分系统;DIPSS:动态国际预后积分系统;IPSS-Chinese:基于中国原发性骨髓纤维化患者的修订IPSS;DIPSS-Chinese:基于中国原发性骨髓纤维化患者的修订DIPSS;MYSEC-PM:继发性骨髓纤维化预后模型。a:同一预后积分系统中各组比较;b:低危组与中危组患者比较;c:中危组与高危组患者比较
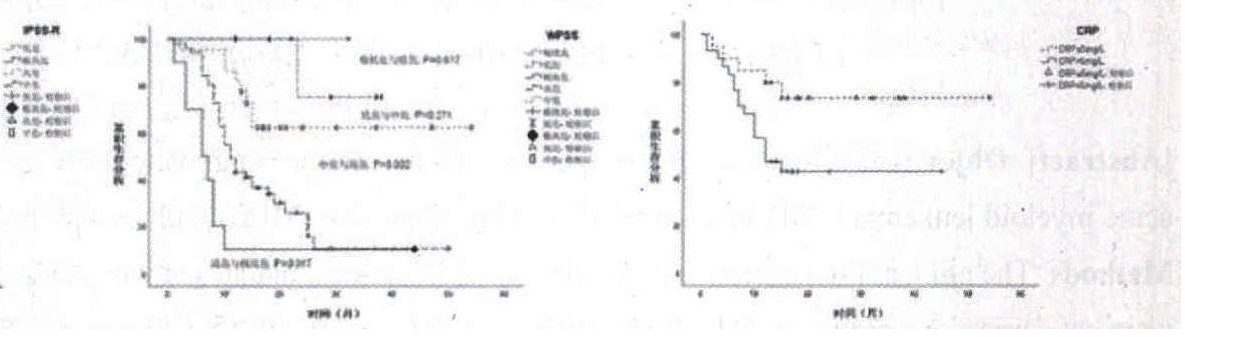
图1 MDS相关预后积分系统各组患者生存曲线
图2 CRP水平对血液病伴骨髓纤维化患者生存的影响
受上述研究启发, 我们回顾性分析了我院134例急性髓系白血病 (AML) 及MDS伴骨髓纤维化患者资料, 对PMF相关预后积分系统是否适用于我国AML/MDS伴骨髓纤维化患者进行分析, 评估MDS常用预后积分系统对MDS伴骨髓纤维化的预后效力, 并对AML/MDS合并骨髓纤维化预后影响因素进行了初步探讨。
1 材料与方法
1.1 患者资料:
收集2014年1月至2017年8月青岛大学附属医院血液科确诊的134例AML及MDS伴骨髓纤维化患者, 男88例 (65.7%) , 女46例 (34.3%) , 中位年龄56.5 (17~83) 岁。其中AML 42例 (31.3%) , MDS 92例 (68.7%) 。所有患者诊断均符合WHO 2008标准[4], 纤维化分级依照2005年欧洲纤维化分级共识标准[5]。
1.2 预后评估:
使用PMF-IPSS、DIPSS、IPSS-Chinese、DIPSS-Chinese、MYSEC-PM对AML/MDS伴骨髓纤维化患者进行预后分组, 使用MDS国际预后积分系统 (MDS-IPSS) 、修订国际预后积分系统 (IPSS-R) 、WHO分型预后积分系统 (WPSS) 对MDS伴骨髓纤维化患者进行预后分组, 评估各预后积分系统的预后效力。
1.3 其他研究参数:
年龄、性别、血栓史、输血依赖、肝脾肿大、外周血白细胞 (WBC) 计数、外周血血小板 (PLT) 计数、血红蛋白 (Hb) 、血清乳酸脱氢酶 (LDH) 水平、血清碱性磷酸酶 (ALP) 水平、C-反应蛋白 (CRP) 水平、骨髓纤维化分级。
1.4 随访:
所有患者随访至2018年8月31日。随访资料来源于患者门诊、住院病历资料、电话随访记录。总体生存时间:确诊骨髓纤维化至随访截止或死亡的时间。中位随访时间15 (1~54) 个月。
1.5 统计学处理:
应用SPSS25.0统计软件进行统计分析。计量资料用中位数表示;计数资料用例数和构成比表示;采用Kaplan-Meier和Cox多因素模型进行生存分析, 绘制生存曲线, 各组生存曲线比较应用Log-rank检验, P<0.05具有统计学差异。
2 结果
2.1 骨髓纤维化相关预后积分系统对AML/MDS伴骨髓纤维化患者预后评估结果:
IPSS、DIPSS、IPSS-Chinese、DIPSS-Chinese、MYSEC-PM均不能对AML、MDS伴骨髓纤维化的患者进行预后分组 (表1) 。
2.2 MDS相关预后积分系统对MDS伴骨髓纤维化患者预后评估结果:
MDS-IPSS、IPSS-R、WPSS预后评分系统均无法准确对MDS伴骨髓纤维化患者进行预后分组 (图1) 。
2.3 AML/MDS伴骨髓纤维化患者生存因素分析:
单因素分析结果显示, 性别 (P=0.045) 、有脾肿大 (P=0.002) 、有输血依赖 (P=0.001) 、纤维化≥2级 (P<0.001) 是影响AML/MDS伴骨髓纤维化患者的不良预后因素。将上述因素纳入Cox多因素分析, 结果显示, 有脾肿大 (P=0.015) 、有输血依赖 (P=0.008) 、纤维化分级≥2级 (P<0.001) 是影响AML/MDS伴骨髓纤维化患者预后的独立危险因素 (表2) 。
表2 AML及MDS伴骨髓纤维化患者Cox回归多因素分析结果

对检测CRP水平的50例AML及MDS伴骨髓纤维化患者进行单因素分析, 结果显示, CRP>5.0 mg/L是影响AML及MDS伴骨髓纤维化患者的不良预后因素 (P=0.032) (图2) 。
2.4 分别基于MDS-IPSS及WPSS预后积分系统增加骨髓纤维化分级预后指标, 对患者进行预后评估。
MDS-IPSS-MF:纤维化1级积0.5分, 纤维化≥2级积1分, 低危:0分, 中危-1:0.5~1分, 中危-2:1.5~2分, 高危:≥2.5分。中危-1组与中危-2组 (P<0.001) , 中危-2组与高危组 (P=0.001) 差异均有统计学意义, 无低危组患者。WPSS-MF:纤维化1级积1分, 纤维化≥2级积2分, 极低危:0分, 低危:1~2分, 中危:3~4分, 高危:5~6分, 极高危:7~8分。低危组与中危组 (P=0.009) 、中危组与高危组 (P=0.006) 、高危组与极高危组 (P=0.009) 差异均有统计学意义, 无极低危组患者。
3 讨论
对于原发性骨髓纤维化, 有多种包括临床特征、实验室指标及基因在内的预后积分系统, 如IPSS[6]、DIPSS[7]、IPSS-Chinese和DIPSS-Chinese[8]。但目前国内外针对血液病伴骨髓纤维化的预后系统仍较少, 仅有Passamonti等基于718例欧美post PV/ET-MF患者的研究制定的MYSEC-PM[9]。本研究分别采用上述5种预后积分系统对AML/MDS伴骨髓纤维化患者进行预后分组, 结果显示IPSS、DIPSS、IPSS-Chinese、DIPSS-Chinese均不能对其进行准确预后, 可能的原因: (1) AML、MDS伴骨髓纤维化与原发性骨髓纤维化在发病机制、临床特征方面存在差异, 疾病进程及预后因素不尽相同; (2) AML、MDS伴骨髓纤维化患者的预后, 是原发病与骨髓纤维化相互作用的结果; (3) 本研究纳入病例数有限且随访时间较短。本研究中MYSEC-PM亦不能对AML/MDS伴骨髓纤维化患者进行准确预后, 可能的原因: (1) AML、MDS与PV、ET虽同属于髓系恶性肿瘤, 但在发病机制、病理生理等方面存在差异; (2) 本研究随访时间较短, 且无高危患者; (3) 不同种族患者预后因素不全相同。因此, 基于PMF患者及欧美MPN患者提出的预后系统, 无法扩展至所有髓系恶性肿瘤伴骨髓纤维化患者的预后评估。
目前MDS-IPSS[10]、IPSS-R[11]及WPSS[12]广泛应用于MDS的预后评估, 本研究采用上述三种预后积分系统对MDS伴骨髓纤维化患者进行预后分组, 结果显示MDS-IPSS、IPSS-R、WPSS无法对MDS伴骨髓纤维化患者进行准确预后。可能的原因:骨髓纤维化影响了疾病的预后, 而上诉预后积分系统未将骨髓纤维化及其相关指标如肝脾肿大等纳入预后影响因素。多因素生存分析显示, 脾肿大、输血依赖、纤维化分级≥2级是影响AML/MDS伴骨髓纤维化预后的独立危险因素, 为对患者进行更准确的预后提供了理论依据。本研究例数仍然偏少, 骨髓纤维化是否对髓系恶性肿瘤均有不良影响仍需进一步扩大研究。
本研究将骨髓纤维化纳入MDS-IPSS及WPSS预后积分系统, 对MDS伴骨髓纤维化患者重新进行预后分组, 结果显示各组间均有统计学差异, 进一步提示骨髓纤维化分级是MDS的危险因素, 尤其对于传统预后积分系统分组下的低危患者, 纳入骨髓纤维化分级可能会使得预后分组更加准确, 有利于为患者提供更优化的个体化治疗, 提示临床工作中应重视血细胞下降不明显、染色体核型较好、原始细胞数无明显增高但合并高等级骨髓纤维化的患者。
炎性反应在骨髓纤维化的发展中的有着突出作用。有学者认为骨髓纤维化病理生理的各个方面都是骨髓感染或暴露于化学、毒物后的反应性改变[13]。这使得急性期炎性蛋白如C反应蛋白 (CRP) 得到关注。一项包括PMF、post-PV/ET MF共184例患者的研究, 发现纤维化患者高敏C反应蛋白 (hs-CRP) 水平要显著高于对照组[14]。本研究对进行CRP检测的50例AML/MDS伴骨髓纤维化患者进行单因素分析, 首次发现CRP也是AML/MDS伴骨髓纤维化的预后因素。提示在继发骨髓纤维化发生发展过程中, 炎性反应发挥了一定作用。综上所述, 有脾肿大、有输血依赖、纤维化分级≥2级是影响AML/MDS伴骨髓纤维化预后的独立危险因素, 目前国内外均缺乏适用于AML/MDS伴骨髓纤维化的预后系统, 仍需多中心、大样本的患者资料行进一步研究, 且能否建立适用于所有髓系恶性肿瘤伴骨髓纤维化的预后系统将成为一项新的挑战。本研究在国内首次发现CRP与AML/MDS伴骨髓纤维化预后相关, 为骨髓纤维化发病机制的研究及治疗提供了新的思路。
参考文献
[1]Marisavljevis D, Rolovic Z, Cemerikic V, et al.Myelofibrosis in primary myelodysplastic syndromes:clinical and biological significance[J].Med Oncol, 2004, 21 (4) :325-331.
[2]黄艳, 杨波, 孙嘉峰, 等.恶性血液病继发骨髓纤维化69例[J].白血病·淋巴瘤, 2012, 21 (7) :416-421.
[3]陈猛, 徐泽锋, 徐俊卿, 等.真性红细胞增多症和原发性血小板增多症后骨髓纤维化患者的预后研究[J].中华血液学杂志, 2016, 37 (10) :876-880.
[4]Swerdlow SH, Campo E, Harris NL, et al.WHO classification of tumours of haematopoietic and lymphoid tissues[M].4th ed.Lyon:International Agency for Research on Cancer (IARC) , 2008:32-281.
[5]Thiele J, Kvasnicka HM, Facchetti F, et al.European consensus on grading bone marrow fibrosis and assessment of cellularity[J].Haematologica, 2005, 90 (8) :1128-1132.
[6]Cervantes F, Dupriez B, Pereira A, et al.New prognostic scoring system for primary myelofibrosis based on a study of the International Working Group for Myelofibrosis Research and Treatment[J].Blood, 2009, 113 (13) :2895-2901.
[7]Passamonti F, Cervantes F, Vannucchi AM, et al.A dynamic prognostic model to predict survival in primary myelofibrosis:A study by the IWG-MRT (International Working Group for Myeloproliferative Neoplasms Research and Treatment) [J].Blood, 2010, 115 (9) :1703-1708.
[8]Xu Z, Gale RP, Zhang Y, et al.Unique features of primary myelofibrosis in Chinese[J].Blood, 2012, 119 (11) :2469-2473.
[9]Passamonti F, Alessandro V, Domenica C, et al.A New International Multicenter-Based Model to Predict Survival in Myelofibrosis Secondary to Polycythemia and Thrombocythemia:The Mysec Prognostic Model (MYSEC-PM) [J].Blood (ASH Annual Meeting Abstracts) , 2014, 124:1826.
[10]Greenberg P, Cox C, LeBeau MM, et al.International scoring system for evaluating prognosis in myelodysplastic syndromes[J].Blood, 1997, 89 (6) :2079-2088.
[11]Greenberg PL, Tuechler H, Schanz J, et al.Revised international prognostic scoring system for myelodysplastic syndromes[J].Blood, 2012, 120 (12) :2454-2465.
[12]Vardiman JW, Thiele J, Arber DA, et al.The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia:rationale and important changes[J].Blood, 2009, 114 (5) :937-951.
[13]Resende LS, Mendes RP, Bacchi MM, et al.Infiltrative myelopathy by paracoccidioidomycosis:A review and report of nine cases with emphasis on bone marrow morphology[J].Histopathology, 2006, 48 (4) :377-386.
[14]Barbui T, Carobbio A, Finazzi G, et al.Elevated C-reactive protein is associated with shortened leukemia-free survival in patients with myelofibrosis[J].Leukemia, 2013, 27 (10) :2084-2086.
点击查看>>血液内科论文(优秀范文8篇)其他文章