原标题:基于不同方法测定土壤酸性磷酸酶活性的比较
摘 要:土壤酸性磷酸酶与有机磷的矿化及植物的磷素营养关系最为密切。目前国内学者在测定酸性磷酸酶活性时主要参照关松荫《土壤酶及其研究法》中以磷酸苯二钠为基质的测定方法,而国外学者主要参照Dick《Methods of Soil Enzymology》中以对硝基苯磷酸二钠为基质的测定方法(PNPP)。但是,在以磷酸苯二钠为基质测定生成物的过程中,常出现显色程度不明显的问题;另外,采用不同基质测定酸性磷酸酶活性也造成了测定方法选择的困难。为合理选择土壤酸性磷酸酶活性的测定方法,本研究选用酸性、中性和碱性土壤各10个土样,分别采用以磷酸苯二钠为基质,且在显色阶段分别加入p H5.0醋酸盐缓冲液(DPP 1)和p H9.4硼酸盐缓冲液(DPP 2)的方法,以及PNPP方法测定土壤酸性磷酸酶活性。同时也研究了不同p H缓冲液和苯酚浓度对生成物显色反应的影响。结果表明:以磷酸苯二钠为基质、在显色反应阶段加入p H≤6的缓冲液时,苯酚和2,6-二溴苯醌氯亚胺不显色;当加入p H≥8的缓冲液时,两者之间显色且苯酚浓度和吸光值的Pearson相关系数极显着。这说明p H低是导致高苯酚浓度和2,6-二溴苯醌氯亚胺显色效果差的一个主要原因。此外,采用PNPP方法测定时,在酸性、中性和碱性土壤中, 10个样本酸性磷酸酶活性的变异系数分别较DPP 2增加了70.04%、42.44%和21.17%;极差分别是DPP 2的27.18倍、26.85倍和39.43倍。总之,如果选用磷酸苯二钠为基质测定土壤酸性磷酸酶活性,应在显色阶段加入碱性硼酸盐缓冲液;选用对硝基苯磷酸二钠为基质,是更为简单和灵敏的方法。
关键词:土壤 酸性磷酸酶活性 磷酸苯二钠 对硝基苯磷酸二钠 p H 显色
土壤磷为植物生长必需的营养元素之一,其中有机磷所占比例达15%~80%[1].由于有机磷不能被植物直接吸收利用,从而成为陆地生态系统一个主要的限制养分[2].磷酸酶可催化磷酸脂或磷酸酐的水解, 其活性的高低直接影响有机磷的分解转化及其生物有效性。其中酸性磷酸单酯酶与有机磷的矿化及植物的磷素营养关系最为密切[3-4],且在酸性土壤中占优势[5].
酶的提取比较困难,对磷酸酶活性的测定主要是根据一定量的基质在酶催化反应过程中生成物或剩余底物量间接测得[6-7].自Kroll等最早提出用磷酸苯酯作基质,以酚的释放量表示磷酸酶活性以来[6], 对土壤磷酸酶活性测定方法的改进主要围绕基质以及缓冲液的种类进行。已报道采用的基质包括天然的基质(主要是核酸)、β-萘基磷酸钠、β-甘油磷酸盐、磷酸苯二钠、对硝基酚磷酸钠和酚酞磷酸盐等[8-10].由于传统的分光比色测定方法成本低, 较荧光比色更具有普遍性。本研究主要关注适用于分光比色的磷酸酶基质。
在分光比色方法中,目前国际上大部分学者使用对硝基苯磷酸二钠为基质测定磷酸酶的活性, 且有研究表明该方法是最快速且准确的[9,11].有外文统计, 在磷酸酶的动力学特征研究中,有706个数据使用对硝基苯磷酸二钠为基质,而只有140个数据使用其他基质[12].此外,目前我国学者在研究中经常用到的基质是磷酸苯二钠[13].虽早期有研究表明,在p H 6.5条件下采用磷酸苯二钠测定磷酸酶活性时存在显色不稳定的问题[11,14], 但此测定方法已收录在一些参考书中[15-18].且目前在中国知网上可查阅到不少使用该基质的文献[19-20], 在Science Direct网也有个别文献[21-22].
由于以磷酸苯二钠为基质测定磷酸酶活性的原理是基于磷酸苯二钠经磷酸酶水解后形成的酚, 在碱性条件下与显色剂2,6-二溴苯醌氯亚胺反应, 在酚羟基的对位引入醌亚胺生色基而生成兰色的靛酚盐[23-24].目前国内部分参考书在描述土壤酸性磷酸酶活性的测定方法时提到在培养以及显色时均要加入醋酸盐缓冲液, 使苯酚与2,6-二溴苯醌氯亚胺在酸性条件下反应[16-18].但是《Methods in SoilBiology》中提到培养时加入醋酸盐缓冲液, 而显色时加入硼酸盐缓冲液, 使最终显色反应在碱性环境中进行[25].国内大部分学者所参考的关松荫的《土壤酶及其研究法》中, 在介绍土壤磷酸酶活性的测定方法时, 描述为测定酸性磷酸酶活性需采用酸性醋酸盐缓冲液培养, 而在显色过程中只提到加入缓冲液, 具体是硼酸盐缓冲液还是醋酸盐缓冲液, 并未具体说明[15].此外, 本文作者和其他学者前期相关工作表明, 在采用磷酸苯二钠为基质加醋酸盐缓冲液显色的过程中出现不显色而影响酶活性测定的现象。故本研究以测定酸性磷酸酶活性时,酸性条件下不利于苯酚与2,6-二溴苯醌氯亚胺显色为假设, 选用酸性、中性和碱性土壤来比较基于磷酸苯二钠为基质在不同酸碱缓冲液条件下的显色反应, 同时把基于磷酸苯二钠为基质测定酸性磷酸酶活性的方法与对硝基苯磷酸二钠为基质的测定方法进行灵敏性比较, 探讨基质对土壤酸性磷酸酶活性测定准确性和灵敏性的影响。研究结果可为土壤酸性磷酸酶活性的测定以及方法的选择提供依据, 对改善土壤磷素营养状况具有重要意义。
1 材料与方法
1.1供试土壤
在土壤生物指标的研究中, 不能仅根据土壤 p H的高低, 就简单地选择酸性磷酸酶或碱性磷酸酶单项指标, 在非酸性土壤中也可以利用酸性磷酸酶活性作为微生物活动和功能的指标。为研究不同类型的土壤对不同方法的敏感程度, 本研究选择 p H 在4~10 范围的 3 类土壤各 10 个土样来测定不同土样之间酸性磷酸酶活性的极差和变异系数。酸性土壤采自江西省分宜县大岗山地区, p H 为 4.32~4.46, 土壤类型是红壤, 植被类型是天然常绿阔叶林; 中性土壤采自北京八达岭林场, p H 为 6.26~7.35, 土壤类型是棕壤, 植被类型主要是油松(Pinus tabulaeformisCarr.); 碱性土壤采自海拔 4 200 m 以上的青海果洛藏族自治州玛多玛查理镇, p H 为 9.59~10.05, 土壤类型是草甸土, 植被类型以草原为主。
1.2土壤酸性磷酸酶活性的测定方法
以磷酸苯二钠(C6H5Na2O4P, CAS 编号 : 3279-54-7)为基质的测定方法依据中国学者广泛参考的《土壤酶及其研究法》的方法[15]略作修改, 采用两个方法进行酸性磷酸酶活性的测定: 一种是在显色时同书中介绍的加磷酸苯二钠溶液的方法一致, 加入酸性醋酸盐缓冲液(DPP 1); 另一种是显色时加入碱性硼酸盐缓冲液(DPP 2), 两种缓冲液的配制以及操作步骤参照书中所介绍的方法[15].
以对硝基苯磷酸二钠(C6H4NNa2O6P·6H2O, CAS编号: 4264-83-9)为基质的方法参照《Methods of SoilEnzymology》中介绍的方法(PNPP)[11].称取1.00 g土壤后以甲苯为抑制剂, 添加4 m L p H 6.5改进的通用的缓冲液[每升缓冲液中含有12.1 g三羟甲基氨基甲烷(C4H11NO3), 11.6 g 马来酸 (C4H4O4), 14.0 g 柠 檬 酸(C6H8O7), 6.3 g 硼 酸 (H3BO3) 和 19.52 g 氢 氧 化 钠(Na OH)], 和1 m L对硝基苯磷酸二钠基质溶液后于37℃下培养1 h.培养结束后, 添加Ca Cl2和Na OH溶液, 并将滤液于400 nm处比色测定。
按文献介绍的方法对照试验有所差异: DPP 1和DPP 2设立无基质对照和无土壤对照; PNPP设立后加基质对照。为消除空白差异对结果的影响, 本研究统一设立无基质对照和无土壤对照。经测定, DPP 1、DPP 2 和 PNPP 无土壤对照吸光值分别是 0.070、0.112和0.108.
1.3缓冲液p H和苯酚浓度对显色反应影响的测定
为了解不同p H缓冲液对不同浓度苯酚和2,6-二溴苯醌氯亚胺显色形成兰色靛酚盐的影响, 采用p H分别为4.0、6.0、8.0的醋酸盐缓冲液和p H 10.0的硼酸盐缓冲液测定苯酚浓度分别为0 μg·m L-1、1 μg·m L-1、2 μg·m L-1、3 μg·m L-1、4 μg·m L-1和6 μg·m L-1的吸光值。每个处理3次重复。
1.4数据统计分析
吸光值数据采用平均值±标准差表示。不同土样吸光值的差异, 采用SPSS 18.0进行LSD差异性检验。不同p H缓冲液下不同苯酚浓度的吸光值采用双因素交互作用分析。苯酚以及对硝基酚浓度与吸光值的关系采用Pearson相关分析。此外, 利用Matlab R2010b做图。
2 结果与分析
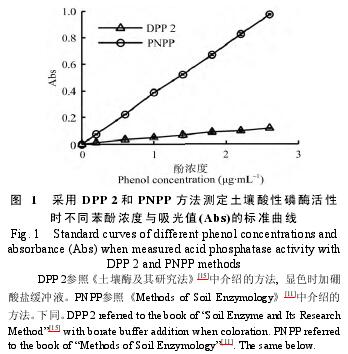
2.1不同方法的标准曲线
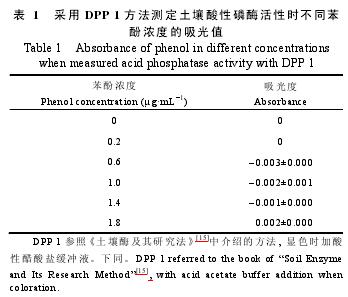
用DPP 1测定, 当苯酚浓度为1.8 μg·m L-1时, 吸光值达到最大值(0.002); 而苯酚浓度为0.6 μg·m L-1时, 吸光值达到最小值(-0.003)(表1)。经Pearson相关分析显示, 6个苯酚浓度与所测吸光值之间的相关系数为0.284, 相关性不显着。
图1显示, 随着苯酚浓度的增加, 吸光值逐渐增加。DPP 2测定时, 苯酚浓度与吸光值之间的Pearson相关系数为0.997; PNPP测定时, 对硝基酚浓度与所测吸光值之间的Pearson相关系数为1.000.均在0.01水平上显着相关。
2.2不同方法吸光值的比较
2.2.1酸性土壤中酸性磷酸酶活性的吸光值
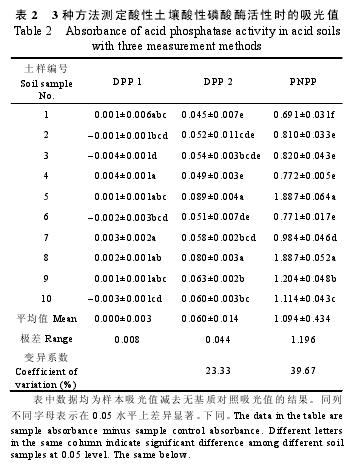
由于用DPP 1测定时苯酚浓度与吸光值之间的Pearson相关系数不显着, 也就无法得到满意的标准曲线, 即无法计算生成物苯酚的浓度。而在酸性磷酸酶活性的计算过程中需要用到苯酚浓度, 从而造成了酸性磷酸酶活性计算的困难。因此, 本研究统一采用吸光值指标进行不同土样之间的差异性比较。从表2中可知, 用DPP 1测定酸性磷酸酶活性时, 10个土样吸光值之间差异不大, 平均吸光值为0, 土样4最大值和土样3最小值之间仅相差0.008; 用DPP 2测定时, 吸光值介于0.089和0.045之间; 用PNPP测定时,吸光值介于1.887和0.691之间, 极差为1.196, 是DPP 2的27.18倍。此外, PNPP测定时, 10个土样吸光值之间的变异系数为39.67%, 较DPP 2增加70.04%.
如果只考虑无基质对照吸光值, 用DPP 1测定时, 10个土样的吸光值出现4个负值, 而用DPP 2和PNPP测定时, 不存在负值; 同时考虑无基质和无土壤对照, 用DPP 1和DPP 2测定所测土样结果全部为负值, 而用PNPP测定无负值。