摘 要: 目的 探讨降钙素基因相关肽(CGRP)在炎性调控中的作用,验证CGRP可通过活性氧簇-核苷酸结合低聚体结构域样受体3(ROS-NLRP3)信号通路抑制小鼠巨噬细胞炎性因子的分泌。方法 实验分为对照组、脂多糖(LPS)100 ng/ml组(LPS组)、CGRP10 ng/ml组(CGRP10组)、CGPR30 ng/ml组(CGRP30组)、CGRP100 ng/ml组(CGRP100组)和CGRP30 ng/ml+LPS100 ng/ml组(CGRP30+LPS组),作用12 h后,分别收集各组细胞的培养上清,免疫酶联吸附法(ELISA)检测上清液中白介素-1β(IL-1β和)肿瘤坏死因子-α(TNF-α)的蛋白表达。同时收集各组细胞,荧光定量反转录聚合酶连锁反应(qRT-PCR)检测炎症因子IL-1β、TNF-α和炎性复合体NLRP3 mRNA的表达水平。流式细胞术检测各组细胞内ROS水平,免疫印迹法检测ROS-NLRP3信号通路相关蛋白NLRP3、caspase-1、IL-1β和TNF-α的表达。结果 与对照组相比,LPS组细胞中IL-1β、TNF-α和NLRP3的mRNA表达水平增加,培养上清中IL-1β和TNF-α的蛋白表达水平增加,细胞内ROS水平增加,且细胞内NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平也增加;与LPS组相比,CGRP10组、CGRP30组、CGRP100组、CGRP30+LPS组细胞中IL-1β、TNF-α和NLRP3的mRNA表达水平降低,培养上清中IL-1β和TNF-α的蛋白表达水平降低,细胞内ROS水平降低,且细胞内NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平也降低,且所有指标中CGRP30组降低最明显。结论 CGRP可降低巨噬细胞内ROS和NLRP3的表达,使炎性因子IL-1β和TNF-α的释放减少,CGRP可能在降低局部炎症反应中发挥重要的调控作用。
关键词: CGRP; ROS-NLRP3; 小鼠; 巨噬细胞; 炎性因子;
Abstract: Objective To investigate the role of calcitonin gene related peptide (CGRP) in inflammation regulation, and to verify that CGRP can inhibit the secretion of inflammatory cytokines in mouse macrophages through reactive oxygen species-nucleotides binding oligomer domain like receptors 3(ROS-NLRP3) signaling pathway. Methods The experiment was divided into control group, lipopolysaccharide(LPS) 100 ng/ml group (LPS group),CGRP 10 ng/ml group (CGRP10 group), CGPR 30 ng/ml group (CGPR30 group),CGRP 100 ng/ml (CGRP100 group) and CGRP 30 ng/ml+LPS 100 ng/ml group (CGRP30+LPS group).After 12h,the supernatants of each group was collected and the expression of interleukin-1β (IL-1β) and tumor necrosis factor-α (TNF-α) were detected by enzyme linked immunosorbent assay (ELISA).The cells was collected at the same time ,and the expression levels of IL-1β,TNF-α and NLRP3 mRNA were detected by quantitative reverse transcription polymerase chain reaction (qRT-PCR).The levels of ROS in each group were detected by flow cytometry. The expression of ROS-NLRP3 signaling pathway associated protein NLRP3,caspase-1,IL-1β and TNF-α were detected by Western Blot. Results Compared with the control group, the expression levels of IL-1β,TNF-α and NLRP3 mRNA in cells in the LPS group were significantly increased, the levels of IL-1β and TNF-α protein in the cell supernatant were increased, the level of ROS in cells was increased, and the levels of NLRP3,caspase-1,IL-1β and TNF-α protein in cells were also increased. Compared with the LPS group, the expression levels of IL-1β,TNF-α and NLRP3 mRNA in cells were decreased in CGRP10 group,CGRP30 group,CGRP100 group and CGRP30+LPS group, and the levels of IL-1β and TNF-α protein in the cell supernatant were decreased, the level of ROS in cells was decreased, and the levels of NLRP3,caspase-1,IL-1β and TNF-α protein in cells were also decreased, and all the indexes in the CGRP30 group was decreased most significantly. Conclusion CGRP can inhibit the expressions of ROS and NLRP3 in macrophages, and it can reduce the release of inflammatory cytokines such as IL-1β and TNF-α.CGRP may play an important regulatory role in reducing local inflammatory response.
Keyword: CGRP; ROS-NLRP3; Mouse; Macrophages; Inflammatory factors;
降钙素基因相关肽(Calcitonin gene related peptide,CGRP)是由感觉神经元释放的一种肽类物质,[1]。已有研究证实CGRP具有显着的抗炎效果[2,3],通过抑制T淋巴细胞的增殖,抑制巨噬细胞产生促炎因子,调节炎症反应[4]。核苷酸结合低聚体结构域样受体3(Nucleotides binding oligomer domain like receptors 3,NLRP3)作为炎症反应中的炎症小体[5],主要在外周单核巨噬细胞和脑内小胶质细胞中表达[6]。活性氧簇(Reactive oxygen species,ROS)被认为是最重要的激活炎症小体NLRP3的因素[7,8]。NLRP3炎症小体在ROS激活后能够活化半胱氨酸蛋白酶-1(caspase-1),使炎症因子成熟并释放到胞外以发挥作用[9]。因此,我们推测CGRP可能作为调控者通过ROS使NLRP3活性降低,从而降低局部炎症反应。基于此,本研究对该推测进行验证。
1 材料与方法
1.1 实验试剂及仪器
大肠杆菌0111:B4的脂多糖(lipopolysaccharide,LPS)(美国Sigma公司),CGRP(南京肽业生物科技有限公司),兔抗NLRP3、caspase-1、白介素-1β(interleukin-1β,IL-1β)和肿瘤坏死因子-α(tumor necrosis factor-α)抗体(美国Santa公司),辣根过氧化物酶标记的羊抗兔二抗(武汉博士德生物科技有限公司),Trizol试剂(美国Invitrogen公司),TaqMan逆转录试剂盒(美国Life Technologies公司),小鼠源性IL-1β和TNF-α的免疫酶联吸附法(Enzyme linked immunosorbent assay,ELISA)检测试剂盒(美国EXCEL公司),荧光定量反转录聚合酶连锁反应(Quantitative reverse transcription polymerase chain reaction,qRT-PCR)试剂盒(美国GeneCopoeia公司),BioRad IQTM5 Multicolor实时荧光定量系统(美国BioRad公司),紫外可见分光光度计(美国Thermo公司,型号Nanodrop 2000),Multiskan MK 3酶标仪(美国Thermo),FACS Canto II流式细胞仪(美国BD),奥林巴斯荧光倒置显微镜Olympus IX71(日本Nikon公司,Image-Pro Plus7.0成像系统)。
1.2 细胞培养及处理方法
RAW264.7巨噬细胞(中国科学院上海细胞库,上海),所用培养液为含10%FBS(杭州四季青生物材料有限公司)、含100 U/mL青霉素和100 μg/mL 链霉素的双抗的α-MEM培养基(美国Gibco公司),于37 ℃、5%CO2孵箱中常规培养。当细胞生长至汇合度为80%-90%时换一次液,此时显微镜下观察到巨噬细胞生长形态正常,呈梭形,半贴壁生长,见图1。实验分为对照组、对照组、LPS100 ng/mL组(LPS组)、CGRP10ng/ml组(CGRP10组)、CGPR30 ng/ml组(CGRP30组)、CGRP100 ng/ml(CGRP100组)和CGRP30 ng/ml+LPS组(CGRP30+LPS组),加LPS或CGRP处理前将FBS含量降至0.5%。每组设3个平行样,并重复3次。RAW264.7细胞以5×104个/ml,接种于10 cm细胞培养皿中(总体积为10 mL),孵育24 h,经LPS和CGRP刺激后,收集细胞及培养上清用于后续实验。
图1 显微镜下巨噬细胞生长形态的代表性图片(放大倍数×100)

1.3 RNA提取和qRT-PCR检测
各加100μl的TRIzol裂解液到六孔板中,常温静置后加入氯仿140 ml,剧烈摇晃15 s,低温离心15 min,离心速度12000 r/min。取上层液体置于干净EP管中,加入异丙醇,混匀后室温放置10 min。继以转速7500 r/min,4 ℃离心5 min去上清。采用1 ml 75%乙醇洗涤沉淀,干燥后溶于30 μl无酶水,检测RNA浓度,剩余RNA放入冰箱保存备用。采用紫外可见分光光度计测定A260/A280比值,当比值在1.8~2.0之间时表示所提取的RNA可用于后续实验。以提取的细胞总RNA为模板,逆转录生成cDNA,以cDNA为模板,根 据 基 因 数 据 库 应 用 引 物 表 达 -2 软 件 设 计 引 物 序 列,CGRP (M34090)为 前 引 物:5′-GAGGCAGCTACAAGGTTCAGG-3′,后 引 物:5′-AG- GTGTTGGTGCTGGACACA-3′。 管 家 基 因 GAP- DH 作 内 对 照,前 引 物:5′-GGCCTTCCGTGTC- CTACC-3′,后 引 物:5′-CGGCATGTCAGATCCACA A C-3 ′ ) 。 PCR 反 应 体 系 1 0 μL ,开 始 5 0 ℃ 3 m i n ,然 后 9 5 ℃ 1 0 s 、6 0 ℃ 3 0 s 、7 2 ℃ 3 0 s 循 环 4 0 次 ,反 应结束后采用分离曲线法确定反应产物的特异性。 实 验 数 据 分 析 采 用 实 时 定 量 PCR 循 环 阈 值 CT (cycle threshold,CT )比 较 法 ,以 管 家 基 因 GAPDH 的 CT 为 内对照,mRNA 相对表达量为同一个样本 CGRP- mRNA 的 CT 值 与 GAPDH -mRNA 的 CT 值 之 比 。经实时荧光定量系统检测并记录实验结果。所有引物均由Invitrogen公司合成,其中GAPDH为内参,2-ΔΔCT用于计算相对表达量,ΔΔCT =(CTgene -CTGAPDH)target-(CTgene -CTGAPDH)control。每个样品设置三个复孔,反应体系为20 μl。
1.4 ELISA实验
收集细胞培养上清,上清液中IL-1β和TNF-α的表达根据ELISA检测试剂盒的说明书进行检测。按说明书的要求准备样品并将其加入试剂盒配套的96孔板中,随后加IL-1β和TNF-α抗体孵育。用洗涤液洗净,加显色底物及酶结合工作液、加终止液并混匀。最后在酶标仪上检测450 nm处的吸光度值并记录。据此绘制标准曲线,根据标准曲线计算并记录样品中IL-1β和TNF-α的浓度。
1.5 蛋白提取和蛋白质印迹分析
提取各组细胞总蛋白采用PBS缓冲液冲洗2次,加入1 ml的RIPA蛋白裂解液,充分接触后刮下细胞,摇动30 min使细胞完全裂解,12000 r/min离心5min后收集上清液,BCA法测定各组细胞的蛋白浓度。分别取30 μg样本进行SDS-PAGE凝胶电泳实验,将蛋白转移至PVDF膜上,5%BSA室温封闭1-2小时,加入1:10000的兔抗人NLRP3、caspase-1、IL-1β、TNF-α及1:1000兔抗人β-actin抗体,TBST洗膜三次,每次10 min,加入1:1000的羊抗兔二抗,室温孵育1 h。加入ECL发光剂后保存条带图片。以目的蛋白的条带的灰度值和内参β-actin的蛋白灰度值比值来确定目的蛋白的相对表达水平,每组实验设置三个复孔。
1.6 流式细胞术检测ROS水平
将RAW264.7细胞接种于24孔细胞培养板中,按实验分组分别给予不同浓度的CGRP或LPS处理。在无血清培养基中培养24 h后去除培养基,消化离心收集细胞放入EP管,PBS洗一遍,用无血清培养液按1000:1配DCFH-DA,每个样本加1 ml工作液重悬。将EP管放入培养箱,孵育30 min,每隔3-5 min颠倒混匀一次,离心收集细胞,PBS洗3遍,弃上清,1 ml PBS重悬后上机检测(FACScan,BD,美国)(激发光为氩离子激光,488 nm)。最后流式细胞仪上检测、FlowJo软件(TreeStar)上分析并绘制曲线。各组所检测的活细胞数均大于等于104个。
1.7 统计学方法
采用SPSS 19.0软件进行统计学分析,实验结果主要为计量资料,均通过正态性检验,以均数±标准差的形式表示,多组间比较实施单因素方差分析+多重比较LSD-t检验。检验水准ɑ=0.05。
2 结果
2.1 qRT-PCR检测IL-1β、TNF-α和NLRP3的mRNA表达水平
6组IL-1β、TNF-α、NLRP3的mRNA表达水平整体比较,差异有统计学意义(F=26.649,11.439,17.502,P=0.000,0.000,0.000)。与对照组水平相比,LPS组IL-1β、TNF-α、NLRP3的mRNA表达水平增加,差异有统计学意义(t=4.675,2.631,3.121,P=0.001,0.022,0.009);与LPS组相比,CGRP10组、CGRP30组、CGRP100组、CGRP30+LPS组的IL-1β、TNF-α和NLRP3的mRNA表达水平均降低(IL-1β:t=8.483,10.591,7.363,6.335,P=0.000,0.000,0.000,0.000,TNF-α:t=4.369,6.767,5.726,3.955,P=0.001,0.000,0.000,0.002,NLRP3:t=6.374,8.640,5.546,4.335,P=0.000,0.000,0.000,0.001),且CGRP30组最低。如表1、图2所示。
表1 CGRP对细胞中IL-1β、TNF-α和NLPR的mRNA表达水平的影响(x?x?±s)
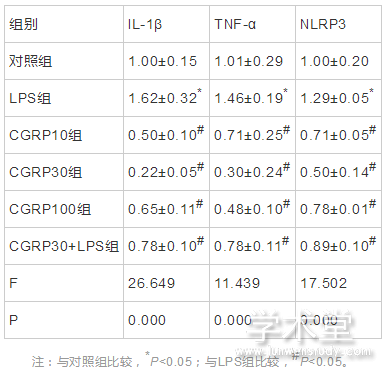
图2 CGRP对细胞中IL-1β、TNF-α和NLPR的mRNA表达水平的影响
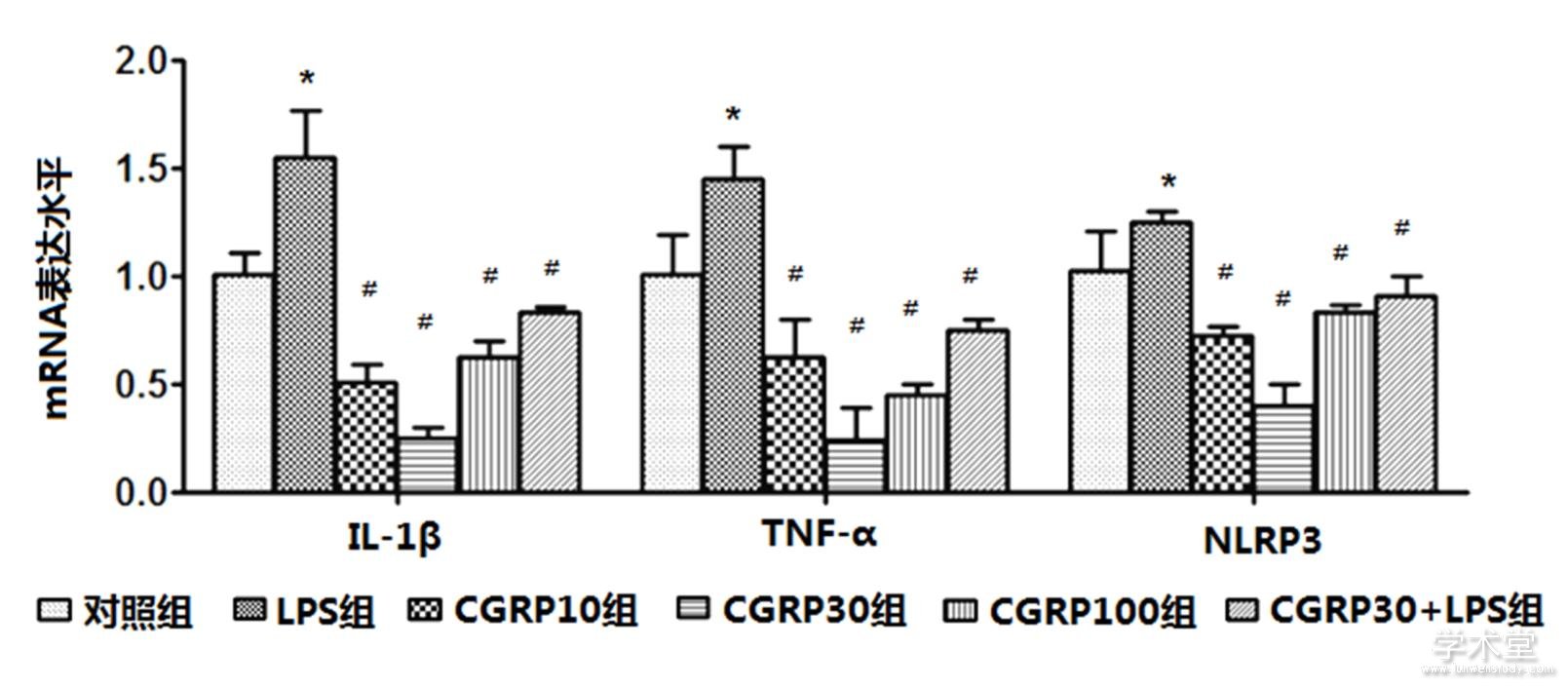
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
2.2 ELISA检测IL-1β和TNF-α的蛋白表达
6组IL-1β和TNF-α的蛋白表达水平整体比较,差异有统计学意义(F=14.564,30.796,P=0.000,0.000)。与对照组水平相比,LPS组IL-1β和TNF-α的蛋白表达水平增加,差异有统计学意义(t=5.351,7.886,P=0.000,0.000),与LPS组相比,CGRP10组、CGRP30组、CGRP100组、CGRP30+LPS组的IL-1β和TNF-α的蛋白表达水平均降低(IL-1β:t=6.464,7.172,5.495,2.642,P=0.000,0.000,0.000,0.021,TNF-α:t=9.563,10.542,8.133,4.315,P=0.000,0.000,0.000,0.001),且CGRP30组最低。如表2、图3所示。
表2 CGRP对细胞培养上清中IL-1β和TNF-α的蛋白表达水平的影响(x?x?±s,pg/ml)
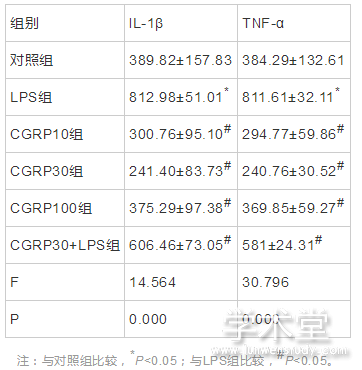
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
图3 CGRP对细胞培养上清中IL-1β和TNF-α的蛋白表达水平的影响
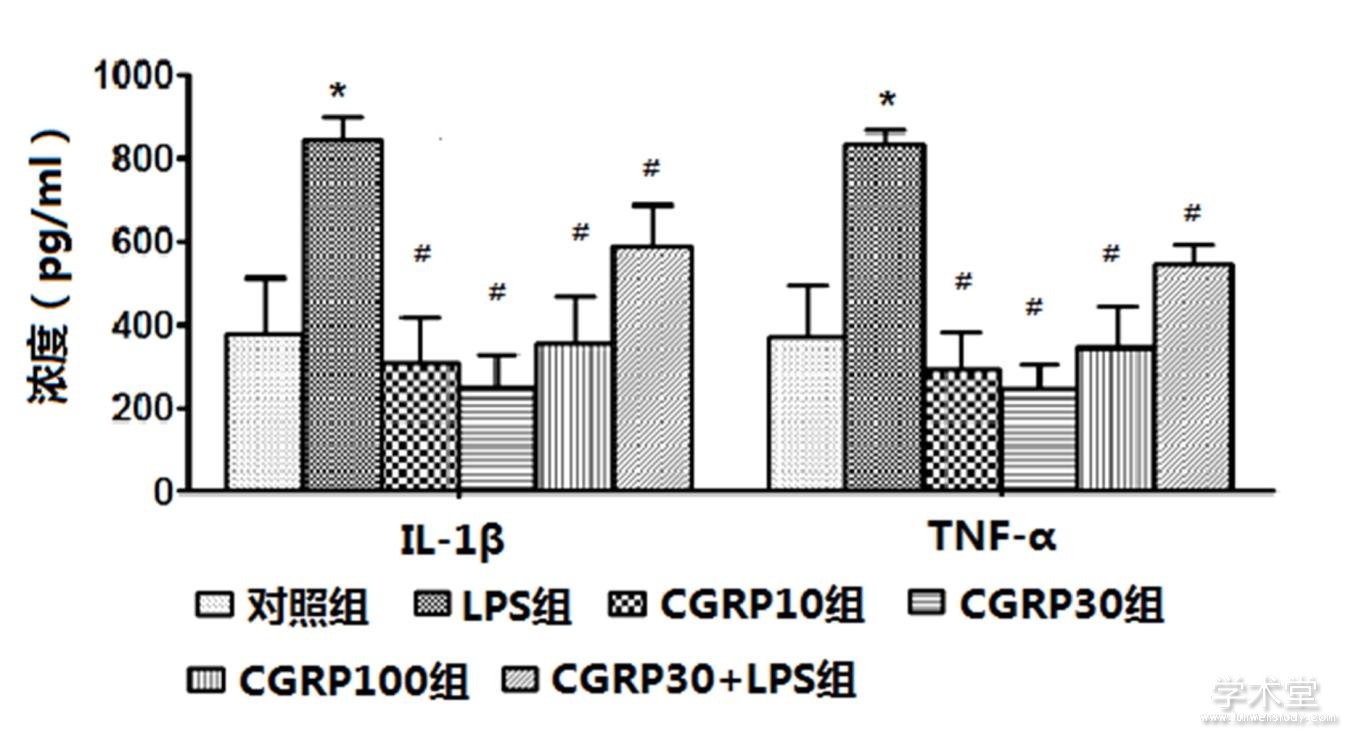
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
2.3 流式细胞术检测细胞内ROS水平
6组ROS水平整体比较,差异有统计学意义(F=52.623,P=0.000)。与对照组相比,LPS组ROS水平增加,差异有统计学意义(t=5.368,P=0.000),与LPS组相比,CGRP10组、CGRP30组、CGRP100组、CGRP30+LPS组的ROS水平均降低(t=8.496,14.197,6.741,5.593,P=0.000,0.000,0.000,0.000),且CGRP30组最低。如表3、图4所示。
表3 CGRP对细胞内ROS的水平的影响(x?x?±s,%)
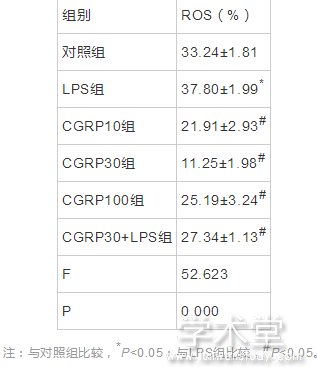
注:与对照组比较,*P<0.05;与LPS组比较,#P<0.05。
图4 CGRP对细胞内ROS的水平的影响
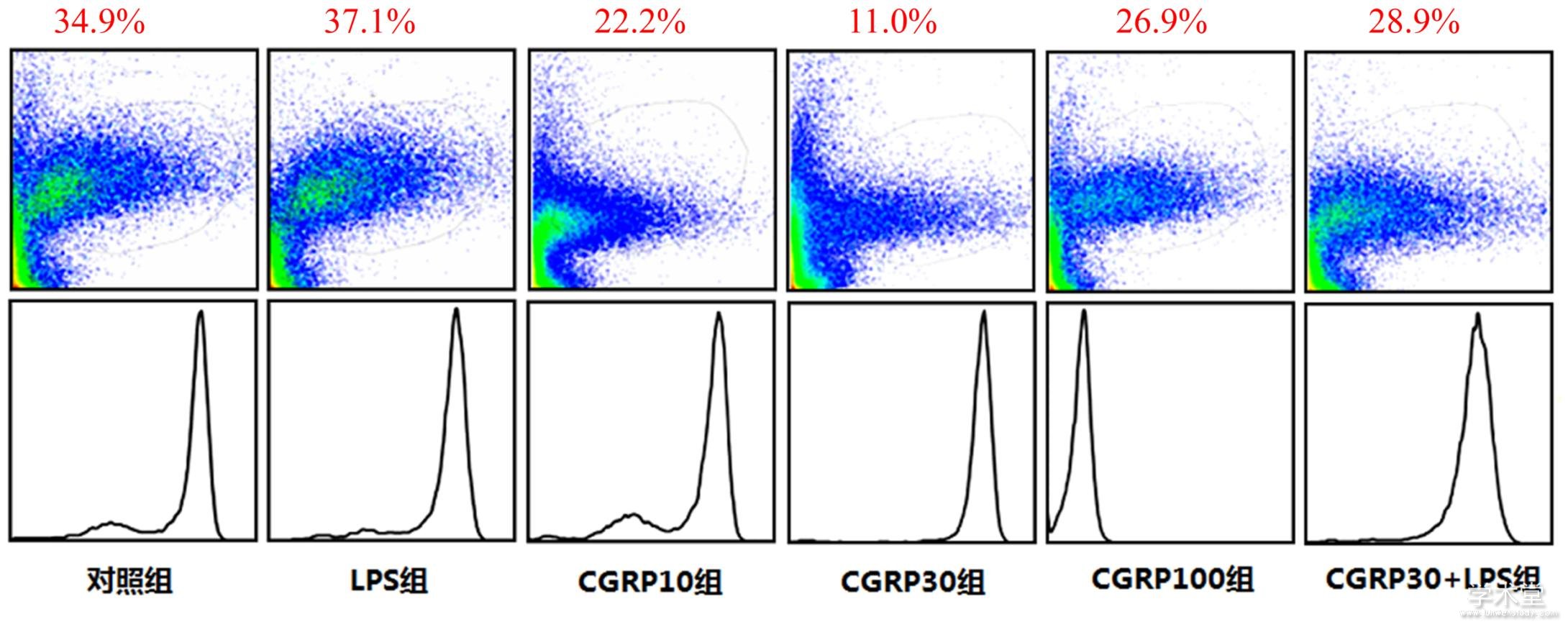
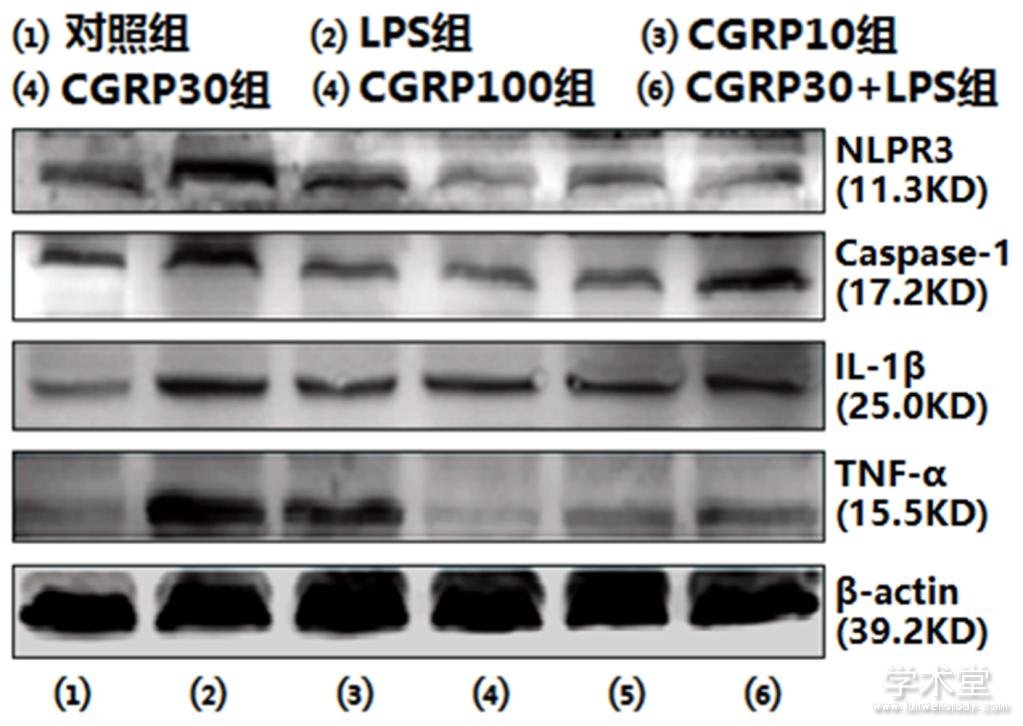
2.4 免疫印迹法检测ROS-NLRP3信号通路相关蛋白的表达
6组NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平整体比较,差异有统计学意义(F=58.374,62.779,127.711,114.531,P=0.000,0.000,0.000,0.000)。与对照组NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平相比,LPS组的NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平均增加(t=13.557,13.815,23.863,18.779,P=0.000,0.000,0.000,0.000),与LPS组相比,CGRP10组、CGRP30组、CGRP100组、CGRP30+LPS组的NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平均降低(NLRP3:t=9.164,14.692,12.729,11.964,P=0.000,0.000,0.000,0.000,caspase-1:t=10.047,15.045,13.952,12.454,P=0.000,0.000,0.000,0.000,IL-1β:t=10.173 ,14.920,9.185,7.321,P=0.000,0.000,0.000,0.000,TNF-α:t=10.958,19.548,18.140,17.222,P=0.000,0.000,0.000,0.000),且CGRP30组最低。如表4、图5所示。
表4 CGRP对细胞内NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达水平的影响(x?x?±s)
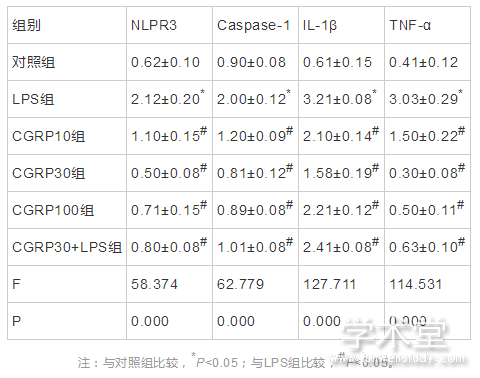
图5 细胞内NLRP3、caspase-1、IL-1β和TNF-α的蛋白表达
3 讨论
炎症反应常常是由于抗原或异物的入侵、感染等引起的,该过程中会释放多种生物活性物质[10]。脑损伤时巨噬细胞和中性粒细胞常在发生损伤部位的聚集,另外血浆蛋白也会在损伤部位产生免疫反应[11]。炎症反应也可引发多种包括无病原体感染的肥胖、心血管疾病、糖尿病或癌症等。炎症反应是可产生于机体各组织、器官的常见临床病理过程,是机体与致炎因子进行抗争的规律反应[12]。以炎症反应常发生的骨折愈合过程为例,在骨折愈合的血肿机化期,大量炎症细胞浸润,开始吞噬和清除坏死组织,同时骨折处的骨外膜增殖出成骨细胞使血肿机化[13]。巨噬细胞是主要免疫细胞之一,NLRP3是感官病原体和危险信号的多蛋白复合物。免疫细胞中的NLRP3活化可激活半胱天冬氨酸酶(Caspase-1),进一步诱导IL-1β和TNF-α等下游炎症因子的加工与释放。而T细胞、NF-κB和MAPK等信号通路均可被成熟的IL-1β活化,启动先天性免疫应答,从而清除病原体。即在宿主先天性免疫反应中NLRP3活化发挥了极其重要的作用[14,15]。
NLRP3炎症复合体能被多种激活剂所激活,而活性氧ROS则是激活NLRP3的关键。已有研究表明线粒体内ROS是调控NLRP3活化的关键,ROS生成过程若发生自吞噬抑制,则NLRP3激活被抑制,自吞噬过程被抑制或发生障碍则NLRP3被激活。此外,炎症细胞同时分泌的大量细胞因子,如TNF-α、IL-1β、白介素-6、白介素-8和转化生长因子-β等,刺激成纤维细胞增殖分化、胶原蛋白及血管生成[16]。而促炎因子如IL-1β、TNF-α的过表达可显着延长炎症期及创面愈合的时间[17]。因此寻找抑制ROS-NLRP3通路的分子将可能抑制促炎因子IL-1β和TNF-α等的释放,从而为临床上各种炎症反应的治疗提供新的思路。
CGRP为典型的神经肽类,在加速骨折愈合中扮演着关键的角色,其对骨细胞有促进作用[18]。本研究分别以不同浓度的CGRP处理小鼠来源的巨噬细胞RAW264.7,检测CGRP对NLRP3炎症复合体及其下游通路相关的炎症因子活化的影响。通过与对照组或LPS组的比较,比较出细胞或培养上清中NLRP3、IL-1β、TNF-α或ROS水平变化,验证了CGRP可抑制细胞内及细胞上清中炎症复合体NLRP3的mRNA及蛋白表达水平,及抑制ROS-NLRP3通路下游相关的炎症因子或蛋白IL-1β、TNF-α和caspase-1的mRNA和蛋白表达,且抑制细胞内ROS的水平的变化过程。以上研究结果与李翔等人的研究相一致,即巨噬细胞中CGRP也可通过调控细胞内ROS使NLRP3的活性降低,从而使ROS-NLRP3信号通路下游的IL-1β和TNF-α等炎症因子的释放减少,下游通路相关蛋白caspase-1的表达降低,从而可能在降低局部炎症反应中起到重要作用[19,20]。
综上所述,本研究初步阐明CGRP对NLRP3炎症小体及下游炎症因子激活的调节作用,该研究可能为如何降低炎症反应(如加快骨折愈合、伤口愈合等)提供新的临床治疗思路。
参考文献:
[1] IYENGAR S,OSSIPOV MH,JOHNSON KW.The role of calcitonin gene-related peptide in peripheral and central pain mechanisms including migraine[J].Pain,2017,158(4):543-559.
[2]刘丽辉,石亮,王岩,等.CGRP对UUO小鼠肾组织间质纤维化与炎性因子表达的干预作用[J].河北医药,2017,39(4):540-544.
[3] NOORI NM,TEIMOURI A,SHAHRAMIAN I.Comparison between brain natriuretic peptide and calcitonin gene-related peptide in children with dilated cardiomyopathy and controls[J].Niger Med J,2017,58(1):37-43.
[4]王芳,周祥群,付洁.降钙素基因相关肽对脂多糖诱导血管平滑肌细胞TLR4/NK-κB及炎症因子表达的影响[J].中国现代医学杂志,2017,27(21):12-17.
[5] LEBRETON F,BERISHVILI E,PARNAUD G,et al.NLRP3 inflammasome is expressed and regulated in human islets[J].Cell Death Dis,2018,9(7):726.
[6] LANG T,LEE JPW,ELGASS K,et al.Macrophage migration inhibitory factor is required for NLRP3 inflammasome activation[J].Nat Commun,2018,9(1):2223.
[7] ZOU HH,YANG PP,HUANG TL,et al.Author Correction:PLK2 Plays an Essential Role in High D-Glucose-Induced Apoptosis,ROS Generation and Inflammation in Podocytes[J].Sci Rep,2018,8(1):4237.
[8]郑健豪,钟继红,曹海军,等.雷公藤多苷通过 NOXs-ROS-NLRP3炎症小体信号通路抑制结肠炎症[J].中国病理生理杂志,2016,32(9):1653-1659.
[9]黄晨恺,甘达凯,张望,等.熊果酸对肝纤维化大鼠NOX2/ROS/NLRP3炎性小体活化的影响[J].基础医学与临床,2018,38(4):485-491.
[10] ATTAR A,MARZBAN P,MOAREF A,et al.The association of plasma high-sensitivity C-reactive protein level with rheumatic heart disease:The possible role of inflammation[J].Indian Heart J,2018,70(3):346-349.
[11] ERT?RK A,MENTZ S,STOUT EE,et al.Interfering with the Chronic Immune Response Rescues Chronic Degeneration After Traumatic Brain Injury[J].J Neurosci,2016,36(38):9962-9975.
[12]解晓蕊,李晓莉,杨朴,等.尼可地尔联合阿托伐他汀对冠状动脉慢血流患者炎症反应、血管内皮功能的影响及安全性分析[J].现代生物医学进展,2017,17(34):6705-6708,6726.
[13] SCHNEIDER PS,SANDMAN E,MARTINEAU PA.Osteoimmunology: Effects of Standard Orthopaedic Interventions on Inflammatory Response and Early Fracture Healing[J].J Am Acad Orthop Surg,2018,26(10):343-352.
[14] TANG P,ZHU R,JI WP,et al.The NLRP3/Caspase-1/Interleukin-1β Axis Is Active in Human Lumbar Cartilaginous Endplate Degeneration[J].Clin Orthop Relat Res,2016,474(8):1818-1826.
[15] WANG Z,MENG S,CAO L,et al.Critical role of NLRP3-caspase-1 pathway in age-dependent isoflurane-induced microglial inflammatory response and cognitive impairment[J].J Neuroinflammation,2018,15(1):109.
[16] 张涵,马晶,张云凌,等.肺炎支原体经ROS激活NLRP3炎性体诱导RAW264.7细胞分泌IL-1β[J].中国病理生理杂志,2015,31(12):2244-2248.
[17] CHO N,RAZIPOUR SE,MCCAIN ML.Featured Article: TGF-β1 dominates xtracellular matrix rigidity for inducing differentiation of human cardiac fibroblasts to myofibroblasts[J].Exp Biol Med (Maywood),2018,243(7):601-612.
[18] TANG P,DUAN C,WANG Z,et al.NPY and CGRP Inhibitor Influence on ERK Pathway and Macrophage Aggregation during Fracture Healing[J].Cell Physiol Biochem,2017,41(4):1457-1467.
[19] AUBDOOL AA,THAKORE P,ARGUNHAN F,et al.A Novel α-Calcitonin Gene-Related Peptide Analogue Protects Against End-Organ Damage in Experimental Hypertension,Cardiac Hypertrophy, and Heart Failure[J].Circulation,2017,136(4):367-383.
[20]李翔,何跃平,刘胜,等.幽门螺杆菌经ROS通路激活NLRP3炎症复合体诱导THP-1细胞分泌IL-1β和IL-18[J].中国免疫学杂志,2015,31(3):308-313.
降钙素基因相关肽是一种由37个氨基酸残基组成的神经肽,属于降钙素基因相关肽家族[1].它是和降钙素(Calcitonin,CT)在不同组织中由同一基因在进行基因重组后形成,在心脏和神经系统中主要转录表达成CGRP,而在甲状腺主要转录表达成CT.人类的CGRP有和两...
皮肤损伤创面治疗是临床常见问题,如患者伴有免疫功能低下及糖尿病等疾病,伤口通常较难愈合,如何促进创面愈合并提高愈合质量一直是研究的热点。创伤修复是由多种细胞、细胞因子参与、且相互作用的复杂过程,胶原蛋白作为细胞外基质重要组成成分可促进多种细胞...
蛴螬为金龟子科昆虫朝鲜黑金龟子及同属近缘昆虫的干燥幼虫, 在江苏、安徽、山东和东北等地均有分布, 神农本草经记载其具有破瘀、止痛和解毒的作用。...
哺乳动物卵透明带(zonapellucida,ZP)是覆盖于卵母细胞及着床前受精卵外的一层糖蛋白基质。小鼠卵透明带和人类的相似,由ZP1、ZP2、ZP3三种糖蛋白组成。传统观点认为,ZP3是第一精子受体和顶体反应的诱导物,ZP2是第二精子受体参与精卵识别过程,能与顶...
探讨添加富硒酵母的油菜花粉对小鼠免疫功能的影响, 以期为制定提高缺硒地区人群免疫功能的措施提供参考。...