摘 要: 目的 探讨合成型Apelin-13对人脐带源间充质干细胞 (human umbilical cord derived mesenchymal stem cell, HUCMSC) 与单核巨噬细胞THP-1共培养体系中巨噬细胞极化的影响。方法 单核巨噬系细胞THP-1, 复苏培养后用佛波酯 (phorbol ester, PMA) +脂多糖 (lipopolysaccharides, LPS) +重组人干扰素-γ (interferon-γ, IFN-γ) 诱导为M1型巨噬细胞, 分为空白对照组和低、中、高浓度组, 与HUCMSC共培养后分别用质量浓度为0、100、500、1 000μg/L的Apelin-13进行干预。干预48 h, 应用倒置显微镜观察细胞形态;收集M1型巨噬细胞及共培养体系中上层小室内的贴壁巨噬细胞, 应用流式细胞术检测细胞膜蛋白CD86及CD206表达;采用ELISA法检测上清液中白细胞介素 (interleukin, IL) -4、IL-6、IL-10、IL-1β、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 、转化生长因子-β1 (transforming growth factor-β1, TGF-β1) 表达。结果 Apelin-13干预48 h, THP-1细胞形态由棒状、放射状、树枝状转变为圆形、类圆形, 黏附性增强, 细胞内颗粒增多, 且随Apelin-13浓度增高细胞形态变化明显;低、中、高浓度组细胞表面膜蛋白CD86阳性表达率[ (5.633±0.153) %、 (3.040±0.529) %、 (2.860±0.531) %]低于空白对照组[ (16.710±0.103) %], CD206阳性表达率[ (93.633±0.351) %、 (94.100±0.266) %、 (97.402±0.265) %]高于空白对照组[ (73.220±1.307) %] (P<0.05) ;中、高浓度组CD86阳性表达率低于低浓度组 (P<0.05) , 中浓度组与高浓度组比较差异无统计学意义 (P>0.05) ;高浓度组CD206阳性表达率高于低、中浓度组 (P<0.05) , 低浓度组与中浓度组比较差异无统计学意义 (P>0.05) 。低、中、高浓度组IL-6 (1.006±0.007、0.682±0.004、0.346±0.004) 、IL-1β (1.468±0.033、0.919±0.014、0.908±0.018) 、TNF-α (0.880±0.004、0.285±0.005、0.278±0.005) 吸光度 (optical density, OD) 值低于空白对照组 (1.417±0.005、1.907±0.004、1.301±0.006) (P<0.05) , IL-4 (0.101±0.004、0.155±0.003、0.248±0.005) 、IL-10 (0.117±0.004、0.154±0.002、0.188±0.002) 、TGF-β1 (0.173±0.006、0.179±0.003、0.322±0.005) OD值高于空白对照组 (0.075±0.002、0.088±0.001、0.073±0.001) (P<0.05) ;中、高浓度组IL-6、IL-1β、TNF-αOD值低于低浓度组 (P<0.05) , IL-4、IL-10 OD值高于低浓度组 (P<0.05) ;高浓度组TGF-β1 OD值高于低浓度组 (P<0.05) ;高浓度组IL-6 OD值低于中浓度组 (P<0.05) , IL-4、IL-10、TGF-β1 OD值高于中浓度组 (P<0.05) , IL-1β、TNF-αOD值与中浓度组比较差异无统计学意义 (P>0.05) 。结论 Apelin-13可促进HUCMSC与THP-1细胞共培养体系中巨噬细胞极化, 增加IL-4、IL-10、TGF-β1等抗炎细胞因子分泌, 且呈浓度依赖性。
关键词: 巨噬细胞极化; 人脐带源间充质干细胞; Apelin-13; THP-1细胞;
Abstract: Objective To study the effect of apelin-13 on macrophage polarization in the co-culture systems of human umbilical cord derived mesenchymal stem cell (HUCMSC) and human macrophage THP-1. Methods M1-type macrophages were induced by phorbol ester (PMA) + lipopolysaccharides (LPS) + recombinant human interferon-γ (IFN-γ) after resuscitation culture of mononuclear cell line (THP-1) cells, and were divided into blank control group, and low-, medium-and high-concentration groups, which were treated with apelin-13 at 0, 100, 500 and 1 000 μg/L after co-cultured with HUCMSC. After intervention for 48 h, the cell morphology was observed by inverted microscope. M1-type macrophages and adhered macrophages in the upper chamber of the co-culture system were collected. The expressions of cell membrane protein CD86 and CD206 were detected by flow cytometry. The levels of interleukin (IL) -4, IL-6, IL-10, IL-1β, tumor necrosis factor-α (TNF-α) and transforming growth factor-β1 (TGF-β1) in the culture supernatant were deteced by ELISA technique. Results Compared with blank control group, 48 h after intervention with apelin-13, THP-1 changed from rod-like, radial and dendritic shape to round and quasi-circular shape, which became more obvious with the increase of apelin-13 concentration, at the same time, the adhesion became strong and number of the intracellular granules increased. The positive rate of CD86 was significantly lower in low-, medium-and high-concentration groups ( (5.633±0.153) %, (3.040±0.529) %, (2.860±0.531) %) than that in blank control group ( (16.710±0.103) %) , lower in medium-and high-concentration groups than that in low-concentration group (P<0.05) , and showed no difference between medium-and high-concentration groups (P>0.05) .The positive rate of CD206 was significantly higher in low-, medium-and high-concentration groups ( (93.633±0.351) %, (94.100±0.266) %, (97.402±0.265) %) than that in blank control group ( (73.220±1.307) %) (P<0.05) , higher in high-concentration group than that in low-and medium-concentration groups (P<0.05) , and showed no difference between low-and medium-concentration groups (P>0.05) .The optical density (OD) values of IL-6 (1.006±0.007, 0.682±0.004, 0.346±0.004) , IL-1β (1.468±0.033, 0.919±0.014, 0.908±0.018) and TNF-α (0.880±0.004, 0.285±0.005, 0.278±0.005) in low-, medium-and high-concentration groups than those in blank control group (1.417±0.005, 1.907±0.004, 1.301±0.006) (P<0.05) , and the OD values of IL-4 (0.101±0.004, 0.155±0.003, 0.248±0.005) , IL-10 (0.117±0.004, 0.154±0.002, 0.188±0.002) and TGF-β1 (0.173±0.006, 0.179±0.003, 0.322±0.005) were significantly higher than those in blank control group (0.075±0.002, 0.088±0.001, 0.073±0.001) (P<0.05) .The OD values of IL-6, IL-1βand TNF-αwere significantly lower and OD values of IL-4 and IL-10 were significantly higher in medium-and high-concentration groups than those in low-concentration group (P<0.05) .The OD value of TGF-β1 was significantly higher in high-concentration group than that in low-concentration group (P<0.05) .The OD value of IL-6 was significantly lower, and OD values of IL-4, IL-10 and TGF-β1 were significantly higher in high-concentration group than those in medium-concentration group (P<0.05) .There were no significant differences in the OD values of IL-1βand TNF-αbetween high-and medium-concentration groups (P>0.05) .Conclusion Apelin-13 can promote the macrophages polarization and the secretion of anti-inflammatory cytokines such as IL-4, IL-10 and TGF-β1 in the co-culture system, which is concentration-dependent with apelin-13.
Keyword: macrophage polarization; human umbilical cord derived mesenchymal stem cell; apelin-13; THP-1;
人脐带源间充质干细胞 (human umbilical cord derived mesenchymal stem cell, HUCMSC) 增殖能力强, 制备方便, 是干细胞治疗的新型细胞, 在类风湿性关节炎、卒中、先天性角膜疾病等治疗中具有广阔前景[1], 其免疫调节的作用已被证实[2,3]。单核/巨噬细胞包括M1、M2型, M1型主要表达促炎细胞因子如白细胞介素 (interleukin, IL) -1 、IL-6、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 及细胞表面标志物CD86等;M2型为选择性激活亚型, 主要表达抗炎细胞因子IL-10、细胞表面标志物CD206等[4,5]。
Apelin是G蛋白耦联受体APJ的内源性配体, 广泛存在于机体多种器官, 与血管紧张素Ⅱ (angiotensin Ⅱ, Ang Ⅱ) 有31%同源性, 具有扩张血管, 正性肌力, 减少抗利尿激素释放, 降低血压, 调节垂体激素释放, 调节生物节律和抑制人类免疫缺陷病毒侵入等多种生物学效应。合成型Apelin是新型合成多肽药物, 在缺氧/无血清条件下能够增强间充质干细胞 (mesenchymal stem cells, MSCs) 抗凋亡能力及其血管化, 上调血管内皮生长因子表达, 促进MSCs的存活及有益细胞因子的分泌[6]。本研究探讨合成型Apelin-13对HUCMSC与单核巨噬细胞THP-1共培养体系中巨噬细胞极化的影响, 报道如下。
1 、材料与方法
1.1、 一般材料
单核巨噬细胞THP-1 (中国科学院干细胞库) ;HUCMSC (郑州大学人民医院眼科研究所赠与) ;DMEM/F12培养基、RPMI-1640培养基、胰蛋白酶、PBS (中国北京索莱宝有限公司) ;体积分数10%胎牛血清 (美国Gibco公司) ;鞘液 (中国鑫科医疗器械有限公司) ;佛波酯 (phorbol ester, PMA) 、脂多糖 (lipopolysaccharides, LPS) (美国Sigma公司) ;重组人干扰素-γ (interferon-γ, IFN-γ) (美国Peprotech公司) ;合成型Apelin-13 (美国Cayman公司) ;FITC CD86 和 PE CD206 抗体 (捷克EXBIO公司) ;转化生长因子- β1 (transforming growth factor-β1, TGF-β1) 、IL-1β、TNF-α、IL-6、IL-10、IL-4 ELISA检测试剂盒 (深圳欣博盛生物科技有限公司) ;FACS Calibur流式细胞仪 (美国BD公司) ;酶联免疫检测仪 (美国Bio-Rad公司) ;倒置显微镜 (日本Olympus公司) 。
1.2、 方法
1.2.1、 THP-1体外诱导
THP-1复苏后离心收集, 加入含体积分数10%胎牛血清的RPMI-1640培养基5 mL, 调整细胞密度为 (2~2.5) ×105/mL, 转移至25 cm×25 cm×25 cm细胞培养瓶中, 置于37 ℃、体积分数5%CO2饱和湿度培养箱中培养, 根据细胞生长情况每2~3 d换液1次, 直接分瓶传代。取培养至3~4代的THP-1细胞, 室温离心后去除培养上清, 加入含体积分数10%胎牛血清的RPMI-1640培养基重悬细胞, 用50 μg/L PMA进行诱导刺激, 接种在6孔板中培养48 h, 获得未分化巨噬细胞 (M0) [5]。参照文献[7]方法, 将6孔板内M0细胞进一步用20 μg/L IFN-γ和200 μg/L LPS刺激培养48 h, 诱导为分化型巨噬细胞。倒置显微镜下观察诱导前、后细胞形态变化, 流式细胞仪鉴定细胞表型为M1型巨噬细胞后, 分为空白对照组和低、中、高浓度组进行下一步实验。
1.2.2、 HUCMSC与M1型巨噬细胞共培养体系建立
取生长状态良好的M1型巨噬细胞, 胰蛋白酶处理后以5×104个/孔接种于12孔Transwell共培养板上层小孔中。贴壁生长6 h后, 取胰蛋白酶处理后的HUCMSC, 以5×105个/孔接种于12孔Transwell共培养板下层小孔中。空白对照组, 低、中、高浓度组分别加入质量浓度为0、100、500、1 000 μg/L的Apelin-13, 置于37 ℃、体积分数5%CO2饱和湿度培养箱中干预48 h。
1.2.3 、细胞膜蛋白CD86、CD206表达检测
分别收集经 PMA+IFN-γ+LPS刺激48 h的贴壁M1型巨噬细胞, Transwell共培养板上层小室的贴壁巨噬细胞, 调整浓度至1×106/mL, PBS清洗5 min, 50 μL鞘液重悬, 加入PE CD206 及FITC CD86, 避光室温孵育30 min;鞘液清洗2次, 每次5 min;500 μL鞘液再次重悬后用流式细胞仪检测。未与抗体作用的巨噬细胞作为流式细胞检测的阴性对照。
1.2.4、 细胞因子检测
分别收集空白对照组及低、中、高浓度组共培养体系中上层小室的培养上清。按ELISA试剂盒操作说明书, 取出实验所需板条, 空白孔加标准品和标本通用稀释液, 其余相应孔内加不同浓度标准品和各组标本 (100 μL/孔, 各孔均设双孔检测) , 用封板胶纸封住反应孔, 37 ℃孵育90 min;用洗涤液洗板5次, 每次30 s, 空白孔分别加入生物素标记人IL-6、TNF-α、IL-4、IL-10、TGF-β1、IL-1β抗体稀释液, 其余孔加生物素化抗体工作液 (100 μL/孔) , 37 ℃孵育60 min;用洗涤液洗板5次, 每次30 s, 空白孔加酶结合物稀释液, 其余孔加酶结合物工作液 (100 μL/孔) , 37 ℃避光孵育30 min; 用洗涤液洗板5次, 每次30 s, 加入显色底物TMB 100 μL/孔, 37 ℃避光孵育15 min; 加入终止液100 μL/孔, 酶标仪测定450 nm波长处吸光度 (optical density, OD) 值。
1.3 、统计学处理
应用Origin8.5软件或SPSS 19.0软件进行统计分析, 计量资料以均数±标准差(X???±s)(X?±s)表示, 2组间比较采用t检验, 多组间比较采用单因素方差分析和LSD检验, 检验水准α=0.05。
2、 结 果
2.1 诱导后M1型巨噬细胞形态
THP-1细胞呈类圆形, 悬浮生长 (图1a) ;经PMA+IFN-γ+LPS诱导后, 细胞形态逐渐不规则, 胞体增大, 细胞表面伸出伪足, 呈树突状、梭状及放射状, 诱导6 h逐渐贴壁, 24 h基本贴壁, 48 h后完全贴壁生长为M1型巨噬细胞 (图1b) 。流式细胞仪检测显示M1型巨噬细胞比例>92%, 适用于后续试验。
图1 THP-1细胞和M1型巨噬细胞形态图 (倒置显微镜, ×100)
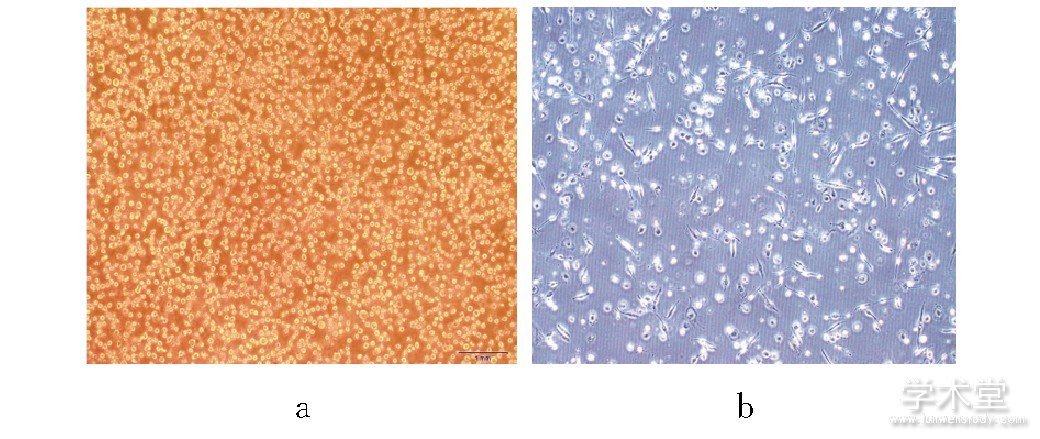
注:a为诱导前THP-1细胞;b为PMA+IFN-γ+LPS诱导48 h后的M1型巨噬细胞。
2.2 、4组Apelin-13干预48h巨噬细胞形态
Apelin-13干预48 h, 细胞形态由棒状、放射状以及树枝状转变为圆形、类圆形, 黏附性增强, 细胞内颗粒增多, 随Apelin-13浓度增高细胞形态变化越明显。见图2。
图2 4组Apelin-13干预48h细胞形态图 (倒置显微镜, ×200)
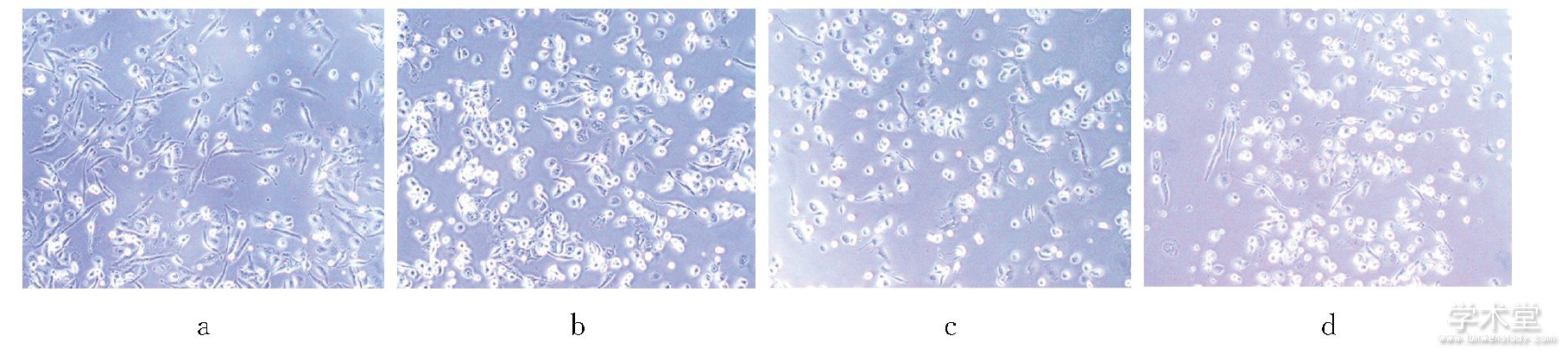
注:a为空白对照组;b为低浓度组;c为中浓度组;d为高浓度组。
2.3、 4组细胞膜蛋白CD86、CD206阳性表达率比较
Apelin-13干预48 h, 低、中、高浓度组细胞表面膜蛋白CD86阳性表达率低于空白对照组, CD206阳性表达率高于空白对照组 (P<0.05) ;中、高浓度组CD86阳性表达率低于低浓度组 (P<0.05) , 中浓度组与高浓度组比较差异无统计学意义 (P>0.05) ;高浓度组CD206阳性表达率高于低、中浓度组 (P<0.05) , 低浓度组与中浓度组比较差异无统计学意义 (P>0.05) 。见表1。
表1 4组细胞膜蛋白CD86、 CD206阳性表达率比较

注:a与空白对照组比较, P<0.05;b与低浓度组比较, P<0.05;c与中浓度组比较, P<0.05。
2.4、 4组细胞因子表达比较
Apelin-13干预48 h, 低、中、高浓度组IL-6、IL-1β、TNF-α OD值低于空白对照组 (P<0.05) , IL-4、IL-10、TGF-β1 OD值高于空白对照组 (P<0.05) ;中、高浓度组IL-6、IL-1β、TNF-α OD值低于低浓度组, IL-4、IL-10 OD值高于低浓度组 (P<0.05) ;高浓度组TGF-β1 OD值高于低浓度组 (P<0.05) ;高浓度组IL-6 OD值低于中浓度组, IL-4、IL-10、TGF-β1 OD值高于中浓度组 (P<0.05) , IL-1β、TNF-α OD值与中浓度组比较差异无统计学意义 (P>0.05) 。见表2。
表2 4组细胞因子表达比较
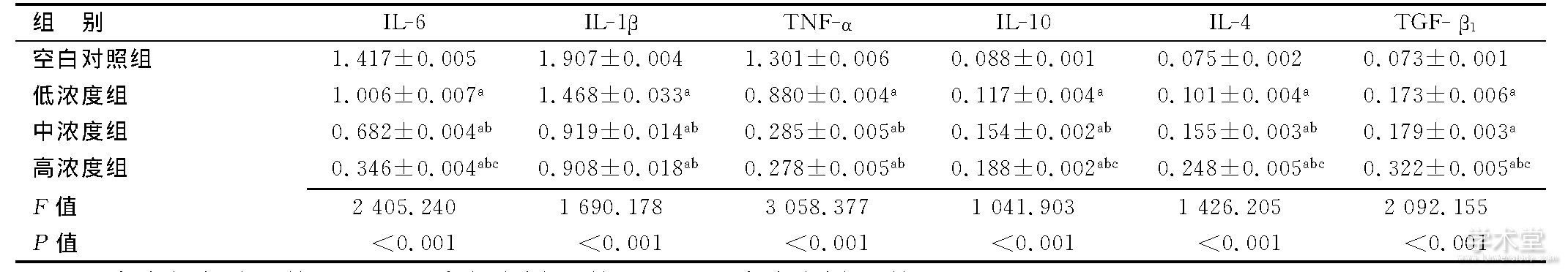
注:a与空白对照组比较, P<0.05;b与低浓度组比较, P<0.05;c与中浓度组比较, P<0.05。
3、 讨 论
单核-巨噬细胞系统是机体重要的免疫防御系统, M1型巨噬细胞通过分泌促炎细胞因子以及趋化因子参与正向免疫, 发挥免疫监视功能;M2型巨噬细胞通过分泌抑制性细胞因子对免疫应答进行负向调节[8]。MSCs可调节参与机体固有免疫和特异性免疫的多种细胞, 促进单核-巨噬细胞系统巨噬细胞向M2型分化[9]。研究结果[10]证实, HUCMSC也可通过调节一氧化氮合酶和前列腺素E2水平促进小鼠巨噬细胞从M1型分化为M2型。
本研究结果显示, Apelin-13干预48 h, 巨噬细胞形态转变为圆形、类圆形, 黏附性增强, 细胞内颗粒增多, 随Apelin-13浓度增高细胞形态变化逐渐明显;低、中、高浓度组细胞表面膜蛋白CD86阳性表达率低于空白对照组, CD206阳性表达率高于空白对照组, 中、高浓度组CD86阳性表达率低于低浓度组, 高浓度组CD206阳性表达率高于低、中浓度组, 说明Apelin-13可抑制M1型巨噬细胞活性, 促进M1型巨噬细胞向M2型巨噬细胞分化。文献[11]报道, Apelin-13可抑制巨噬细胞来源的脂蛋白脂肪酶活性, 减少脂质积累, 抑制促炎细胞因子如IL-6、IL-1β、TNF-α等分泌。研究结果[12]显示, Apelin-13可通过调节核因子-κB/JNK信号通路抑制炎性反应, 在缺氧条件下保护小鼠巨噬细胞免受凋亡, 并可增强细胞迁移能力。本研究结果显示, Apelin-13干预48 h, 低、中、高浓度组IL-6、IL-1β、TNF-α OD值低于空白对照组, IL-4、IL-10、TGF-β1 OD值高于空白对照组;中、高浓度组IL-6、IL-1β、TNF-α OD值低于低浓度组, IL-4、IL-10 OD值高于低浓度组;高浓度组TGF-β1 OD值高于低浓度组, IL-6 OD值低于中浓度组, IL-4、IL-10、TGF-β1 OD值高于中浓度组, 说明Apelin-13可促进HUCMSC与THP-1共培养体系中巨噬细胞由M1型向M2型分化, 抑制M1型巨噬细胞分泌促炎细胞因子, 促进抗炎细胞因子分泌, 且细胞因子分泌与Apelin-13浓度呈剂量依赖性, 与文献[11,12]报道相符。
有文献[13]报道, 在心脏反应性纤维化期间应用Apelin可防止心肌结构重塑和心功能不全。本研究为心肌损伤后心肌细胞修复的临床研究提供了新的思路, 具有一定的理论意义。但Apelin-13在体内是否可促进M1型巨噬细胞向M2型分化, 需进一步进行研究。此外, 本研究未进行拮抗实验, 不能证实Apelin-13的作用与Apelin/APJ系统直接相关。
参考文献:
[1] QIAN L, HUANG Y, SPENCER I C, et al.In vivo reprogramming of murine cardiac fibroblasts into induced cardiomyocytes[J].Nature, 2012, 485 (7400) :593-598.
[2] ZHU J, LIU Q, JIANG Y, et al.Enhanced angiogenesis promoted by human umbilical mesenchymal stem cell transplantation in stroked mouse is Notch1 signaling associated[J].Neuroscience, 2015, 290:288-299.
[3] 张艺凡, 胡方方, 秦方圆, 等.人脐带间充质干细胞与肿瘤治疗研究进展[J].中华实用诊断与治疗杂志, 2017, 31 (4) :403-406.
[4] MURRAY P J, ALLEN J E, BISWAS S K, et al.Macrophage activation and polarization:nomenclature and experimental guidelines[J].Immunity, 2014, 41 (1) :14-20.
[5] LV R, BAO Q, LI Y, et al.Regulation of M1 type and M2 type macrophage polarization in RAW264.7 cells by Galectin 9[J].Mol Med Rep, 2017, 16 (6) :9111-9119.
[6] HOU J, ZHONG T, GUO T, et al.Apelin promotes mesenchymal stem cells survival and vascularization under hypoxic-ischemic condition in vitro involving the upregulation of vascular endothelial growth factor[J].Exp Mol Pathol, 2017, 102 (2) :203-209
[7] MARTINEZ F O, GORDON S, LOCATI M, et al.Transcriptional profiling of the human monocyte-to-macrophage differentiation and polarization:new molecules and patterns of gene expression[J].J Immunol, 2006, 177 (10) :7303.
[8] TUGAL D, LIAO X, JAIN M K.Transcriptional control of macrophage polarization[J].Arterioscler Thromb Vasc Biol, 2013, 33 (6) :1135-1144.
[9] 尹学红, 庞春燕, 白力, 等.脂肪间充质干细胞促进M1型巨噬细胞向M2型巨噬细胞转化[J].细胞与分子免疫学杂志, 2016, 32 (3) :332-338.
[10] YIN Y, HAO H, CHENG Y, et al.The homing of human umbilical cord-derived mesenchymal stem cells and the subsequent modulation of macrophage polarization in type 2 diabetic mice[J].Int Immunopharmacol, 2018, 60:235-245
[11] ZHANG X, YE Q, GONG D, et al.Apelin-13 inhibits lipoprotein lipase expression via the APJ/PKCα/miR-361-5p signaling pathway in THP-1 macrophage-derived foam cells[J].Acta Biochim Biophys Sin (Shanghai) , 2017, 49 (6) :530-540.
[12] YANG F, BAI Y, JIANG Y, et al.Effects of Apelin on RAW264.7 cells under both normal and hypoxic conditions[J].Peptides, 2015, 69:133-143.
[13] PCHEJETSKI D, FOUSSAL C, ALFARANO C, et al.Apelin prevents cardiac fibroblast activation and collagen production through inhibition of sphingosine kinase[J].Eur Heart J, 2012, 33 (18) :2360-2369.