摘 要: 病毒感染激活宿主细胞先天性免疫信号通路级联反应,通过产生干扰素、抗病毒蛋白等来限制病毒复制和防止感染。Viperin是一种在物种间相对保守、参与先天性免疫的内质网相关抗病毒蛋白,通过与病毒蛋白、某些细胞内蛋白的相互作用调节信号转导过程,发挥抑制多种病毒增殖的广谱抗病毒作用。目前,对Viperin蛋白发挥抗病毒和免疫调节作用的功能域、作为自由基SAM酶家族成员发挥作用的机制有了新的认识,但对Viperin能够在不同病毒感染细胞内发挥广泛作用的确切机制仍不是很清楚。论文就Viperin的基本生物学特性、发挥不同抗病毒机制的研究进展进行综述。
关键词: 抗病毒蛋白; Viperin; 宿主细胞蛋白; 相互作用;
Abstract: Viral infection of the cell is able to initiate a signaling cascade of events that ultimately attempts to limit viral replication and prevent escalating infection through expression of interferons and antiviral proteins.Viperin is an endoplasmic reticulum ER-associated protein that is relatively conserved among species and participates in innate immunity.It regulates signal transduction through interaction with viral proteins and certain intracellular proteins,and exerts a wide range of inhibition on proliferation of various viruses,which is spectrum antiviral effect.At present,there is a new understanding of the functional domain of Viperin protein that exerts antiviral and immunomodulatory effects,and the mechanism of function as a member of the free radical SAM enzyme family,but the exact mechanism for Viperin to play a wide range of roles in different virus-infected cells is still unclear.This article reviewed the basic biological characteristics of Viperin and the research progress on different antiviral mechanisms.
Keyword: antiviral protein; Viperin; host cell protein; interaction;
地球上大多数生物都生存在微生物环境中,周边环境中充斥着各种各样的细菌与病毒,因此生物机体需要拥有完善的系统化的防御机制来抵抗细菌与病毒的侵扰,免疫系统在机体的防御机制中起到了重要作用。当病毒感染机体后,它会利用宿主的新陈代谢机制来完成病毒自身的复制与组装,然后释放到其他细胞当中[1]。机体自身的免疫系统通常分为先天性免疫病和获得性免疫两种。尽管杀伤性T细胞和产生抗体的B细胞在一段时间后可以对病原体产生适应性反应,但是先天性免疫对病毒感染能够做出最快速的反应,它是机体抵抗病原体的第一道防线。
病毒感染细胞能够激发免疫信号级联反应,通过释放多种细胞因子,来限制病毒复制和防止感染的不断升级。干扰素作为重要的细胞因子之一,能结合细胞表面特异性受体,诱导各种干扰素刺激基因(IFN-stimulated genes,ISG)的表达,它们大多数都具有抗病毒活性,因此又被称为先天性免疫因子[2]。Viperin(Virus inhibitory protein,endoplasmic reticulum associated interferon inducible)便是其中的一员,研究发现宿主抗病毒蛋白Viperin在这个过程中发挥重要作用,它不仅具有限制多种病毒感染的能力,还表现出对Ⅰ型干扰素分泌的调节作用及调节许多转录因子的结合位点[3]。Viperin似乎具有调节细胞内状态及干扰病毒蛋白,从而创造不利病毒复制的环境的能力[4]。本文对Viperin的生物学特性、亚细胞定位及表达调控、其抗病作用等方面的研究进展进行综述。
1、先天性免疫与干扰素刺激基因
机体发生病毒感染时,细胞可以通过模式识别受体(PRRs)识别入侵的病毒,激活细胞内多条信号通路并释放多种细胞因子[5]。作为最为重要的细胞因子之一的干扰素(interferon,IFN),在抗病毒反应中发挥着关键作用[6]。有3种类型的干扰素,分别为Ⅰ型干扰素(IFN-α、β、ω、ε、κ)、Ⅱ型干扰素(IFN-γ)和Ⅲ型干扰素(IFN-λ1、λ2、λ3)[7]。在抗病毒免疫反应中,Ⅰ型干扰素是发挥作用的最主要干扰素,是病毒感染细胞,或者细胞受核酸、细菌内毒素和促细胞分裂素等物质刺激后,细胞内自身分泌的具有广谱抗病毒活性的细胞因子[5]。
Ⅰ型IFN包括由白细胞产生的IFN-α、由成纤维细胞合成的IFN-β、胎盘细胞合成的IFN-ε[8,9]、角质形成细胞合成的IFN-κ[9]、IFN-ω由白细胞产生并表现出与IFN-α类似的活性[9],IFN-τ和IFN-ζ由T和B淋巴细胞合成并分泌,但它们的功能仍不清楚。当病毒、细菌、真菌及寄生虫感染人体后,细胞主要产生的Ⅰ型干扰素为IFN-α和IFN-β。
IFN-α和IFN-β在调节先天免疫反应中有重要作用,特别是调节巨噬细胞和树突细胞的功能[9]。此外,它们还影响适应性免疫应答,调节T淋巴细胞(主要是CD4+T和CD8+T细胞)的功能[9],影响Th淋巴细胞分化以及Tc、NK和B细胞的活化。同时,Ⅰ型IFN还影响细胞凋亡并促进炎症反应的发生[9]。
通过激活与病毒复制周期相互蛋白基因的转录,IFN-α和IFN-β可在感染和未感染的细胞以及旁观者细胞中诱导抗病毒免疫来发挥多效性[9]。此外,IFN-β可以与IFN-α互相协调增强抗病毒效果,且其抗病毒活性强于IFN-γ[9]。
当病毒入侵细胞后,会激活细胞内的多种信号通路,从而诱导干扰素的产生,Ⅰ型IFN产生后会与细胞表面的特异性受体结合,通过信号级联反应激活下游300多种干扰素刺激基因(IFN-stimulated genes,ISG)的转录[10],其中有很多基因编码产物都被发现能够显着限制病毒的复制,参与到多种抗病毒过程中,包括病毒抗原的呈递、细胞凋亡以及病毒复制与组装[11]。这些具有抗病毒活性的干扰素刺激基因编码产物,又被称为先天性免疫因子,随着对宿主抗病毒反应机制的了解逐步增多,依然有大量的干扰素刺激基因未被发现和研究[12]。目前只对小部分干扰素刺激基因有了相关研究报道,例如蛋白激酶R(PKR),GTP酶MX1(抗黏病毒1),核糖核酸酶L(RNaseL),ISG15(IFN激活蛋白为15ku),IFIT(干扰素诱导蛋白与tetratricopeptide重复)、Viperin蛋白等[2]。
2、Viperin的生物学特性
Viperin全称为与内质网相关联的干扰素刺激的病毒抑制性蛋白,又称为RSAD2(radical SAM domain-containing 2)或cig5(Cytomegalovirus inducible gene 5)。1997年首次在人类巨细胞病毒感染原代包皮成纤维细胞中得到了2个转录分析结果升高的片段,将这2个片段分别命名为cig5和cig33[13]。2001年,从经过IFN-γ诱导后的人巨噬细胞中克隆出一段cDNA序列,该段DNA序列包含一个由1 083个碱基组成的开放阅读框,通过与之前发现的cig5、cig33进行比对后,发现它们具有极高的同源性,被命名为Viperin[14]。Viperin作为干扰素刺激基因被发现,在鱼类、爬行动物及各种哺乳动物中广泛存在[2]。
Viperin基因含有1083个核苷酸,可编码361个氨基酸[15],不同的物种间略有差异,整体保守性较高[16]。Viperin蛋白的大小约为42ku,大致由3个较为明显的结构域组成[13]。N端的α螺旋结构域、C末端的保守结构域以及中间的S-腺苷甲硫氨酸酶结构域(SAM域)(图1)。N端的1-42位氨基酸构成两亲性α螺旋结构,在14-42位氨基酸存在亮氨酸拉链结构,在不同物种中这一区域的序列差异性较大,能够定位于细胞的内质网(endoplasmic reticulum,ER)表面和脂滴(lipid droplets)上[17]。中间部分从71到182位氨基酸含有4个相对保守的模块(M1、M2、M3、M4),M1模块中包含了保守的CxxxCxxC序列,能够与铁硫簇结合从而起到催化作用,为S-腺苷甲硫氨酸酶超家族,催化减少S-腺苷甲硫氨酸向5′脱氧腺苷的转化。因此Viperin还有一个名称为RSAD2[18]。虽然目前研究认为Viperin蛋白不具有特定的酶活性,但在Viperin发挥抗病毒功能时,如在对抗丙型肝炎病毒(HCV)和人巨细胞病毒(HCMV)的感染中,该模块具有重要作用[7]。高度保守的C末端结构域大约由218-361位的氨基酸构成,目前关于该结构域的研究较少[13],已知其对于Viperin蛋白的二聚很重要,还可能介导底物与酶之间的识别以及蛋白与蛋白之间的互作相关。例如,在361位的氨基酸色氨酸残基,被证明在抗HCV的感染当中是必要的[2]。
图1 Viperin蛋白结构图

Fig.1 The protein structure of Viperin
为了解不同物质间Viperin的同源性,将序列进行了比对,构建了系统进化树。物种的Viperin序列从GenBank获得,使用MEGA 5.0软件的邻接法产生无根系统树,用1 000次重复进行分析。结果表明,人Viperin与猩猩Viperin(Pan troglodytes和Gorilla)具有较高的氨基酸序列同源性,但与家禽(Gallus gallus和Anas platyrhynchos)和鱼类(Danio rerio和Cyprinus carpio)的同源性相对较低。猪Viperin与牛和绵羊有共同祖先(图2)。
3、Viperin的诱导表达及亚细胞定位
Viperin通常在多种类型的正常健康细胞中较低水平自身表达,但是在干扰素、双链DNA、双链RNA、脂多糖以及Poly(I:C)刺激或者多种病毒的诱导下,Viperin的表达水平会显着上升[19]。如图3所示,Viperin的诱导表达包括两条主要途径。仙台病毒、伪狂犬病病毒以及辛德毕斯病毒都能够诱导干扰素刺激基因的产生。它们在进入宿主细胞后,首先被模式识别受体(PRRs),如Toll样受体TLR3和TLR4,视黄酸诱导基因(RIG-Ⅰ)以及细胞溶质DNA传感器识别,激活干扰素调节因子IRF3和IRF7,进而激活IFN-β的表达,产生的IFN-β通过自分泌或者旁分泌途径结合到细胞表面的Ⅰ型干扰素受体,进而合成复合物ISGF3,结合到Viperin启动子上从而激活Viperin的表达[20]。除此之外,还有一些病毒,例如水疱性口炎病毒、人巨细胞病毒,它们的病毒颗粒在进入细胞后,病毒的dsRNA会刺激RLRs,进而与线粒体抗病毒信号蛋白(MAVS)相互作用,从而激活IRF1和IRF3的产生,进而诱导Viperin的表达[19]。
图2 不同物种Viperin的系统进化树
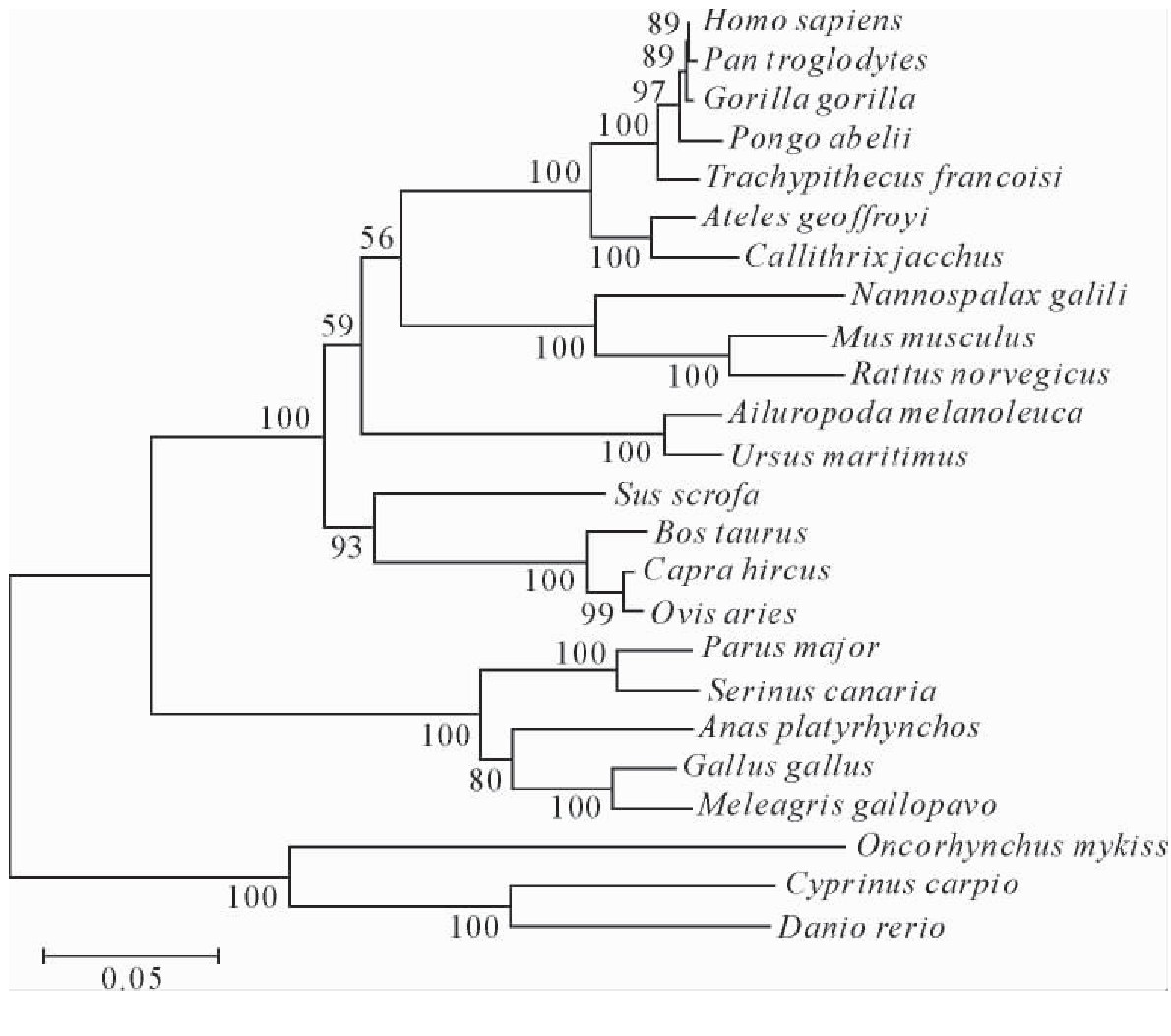
Fig.2 Viperin phylogenetic tree of a range of species
图3 Viperin的诱导表达途径
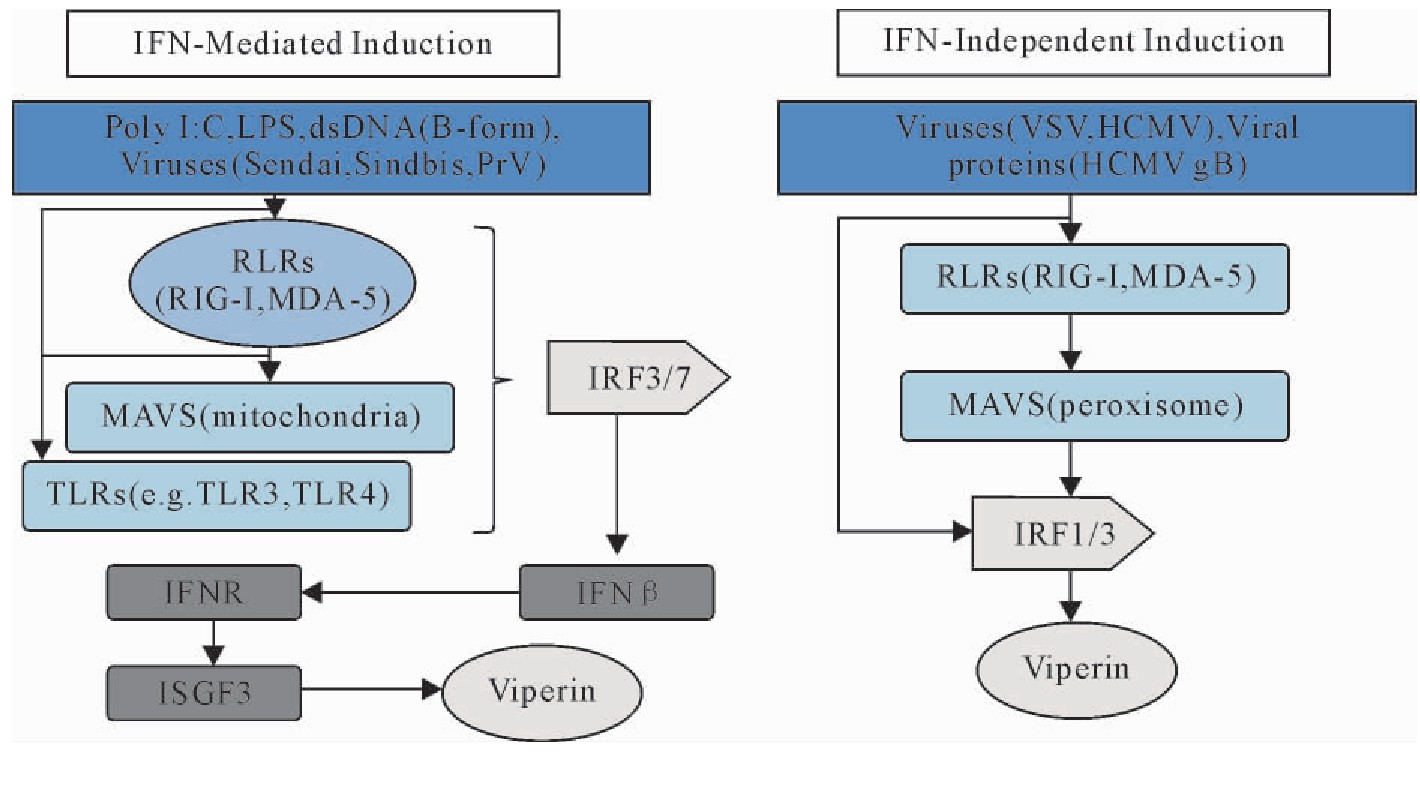
Fig.3 Inducible expression pathway of Viperin
有报道指出,Viperin可以形成同源二聚体,过表达之后会使内质网结晶化,形成格状结构并破坏内质网本身的结构[13]。有人因此作出了一种假设模型,即Viperin通过C端结构域和N端的α螺旋结构域形成二聚体,介导内质网结晶化,形成一种独特的结构[16]。已有研究表明,Viperin能够定位在脂滴上,脂滴是一种起源于内质网的细胞器,能够储存蛋白质和脂质,参与到蛋白质的降解和脂质的运输等过程当中。同时脂滴已经被证明是HCV和登革病毒(DENV)在细胞中的复制场所。Viperin N端的双亲性α螺旋结构能够帮助Viperin锚定到脂滴上[13]。
4 、Viperin的表达调控
敲除掉Viperin基因的小鼠影响了其免疫反应,表现为细胞受体介导的NF-κB、AP-1的活性降低以及Th2反应的延迟。在其他使用人类单核树突细胞的研究中,发现Viperin在Ⅱ型树突细胞中的表达水平比在Ⅰ型树突细胞中的更高,具有诱导原始T细胞向Th1和Th2细胞分化的能力。REIZIS B等报道了浆细胞样树突状细胞(pDCs)中Viperin在Ⅰ型干扰素的产生中扮演了重要角色。pDCs是起源于骨髓的免疫细胞,能够针对非自身核苷酸快速反应产生大量干扰素。pDCs有快速产生干扰素的能力主要是因为能够持续性表达内源性的Toll样受体TLR7和TLR9[21]。这2个受体分别能够识别单链RNA和未甲基化的CpG DNA,IRF7则通过IRAK1和IKKα激活。与IRF1,IRF3一样,IRF7也属于干扰素转录调节因子家族。TLR7/9激活并结合到IRAK1和TRAF6后,Viperin可以被大量诱导表达,该过程涉及TLR信号通路。在pDCs中,Viperin的诱导对于经由TLR7/9产生Ⅰ型干扰素是必要的,Viperin基因缺失小鼠在TLR7/9刺激之后并不产生干扰素。Viperin蛋白N端的α螺旋对于Ⅰ型干扰素的产生很重要,不过并不与IRAK1和TRAF6相联合,表明IRAK1和TRAF6的激活依赖于Viperin合适的亚细胞定位。Viperin对于IRAK1和TRAF6在脂滴中的招募是重要的,随后才会激活IRF7。总之,在pDCs中,Viperin的诱导依赖于TLR7和TLR9信号通路,IRAK1和TRAF6又依赖Viperin招募到脂滴,之后IRF7被激活,从而诱导Ⅰ型干扰素的表达[22]。
5、 Viperin的抗病毒作用
目前已有报道显示,Viperin在多种DNA病毒和RNA病毒中具有抗病毒功能,包括虫媒病毒[丙型肝炎病毒(HCV),西尼罗河病毒(WNV),登革病毒(DENV)],甲病毒属(辛德毕斯病毒),正黏病毒(甲型流感病毒),副黏病毒(仙台病毒),疱疹病毒[人巨细胞病毒(HCMV)],棒状病毒[水疱性口炎病毒(VSV)],逆转录病毒[人类免疫缺陷病毒1型(HIV-1)]等[23]。这些能够被Viperin拮抗的病毒种类繁多,各自存在着不同的增殖机制,所以很难系统概括Viperin的抗病毒机制(表1)。
表1 Viperin的抗病毒作用及关键结构域

将辛德毕斯病毒和Viperin蛋白同时皮下注射给新生小鼠,同时设置只注射病毒的新生小鼠的对照组,结果显示病毒的毒力出现了明显下降。另有数据显示,当将小鼠的viperin基因敲除掉后,小鼠会变得更加容易感染西尼罗病毒;在干扰了viperin基因表达的星形胶质细胞中,HIV-1的增殖水平明显上升[24],表明Viperin可以在中枢神经系统的先天性免疫反应中发挥其特有的功能。
在人类纤维母细胞中过表达Viperin后,病毒蛋白Gb、pp28、pp65的表达量明显下降,首次证明了Viperin在HCMV感染中具有抗病毒功能[13]。Viperin通过阻止病毒颗粒的释放来抑制甲型流感病毒和HIV-1的扩散。在HeLa细胞中过表达人类或鼠类的Viperin都展现出了对病毒出芽的抑制效果。Viperin还被发现能够与法尼基二磷酸合酶FPPS结合,影响胆固醇和甾醇前体甲羟戊酸合成途径,从而破坏了脂筏的结构,增加了膜的流动性。同时,在HEK293细胞中,Viperin能够利用它的SAM结构域抑制HIV-1的释放[24]。
Viperin能够抑制HCV的非结构蛋白NS5A的表达,阻止其复合体在脂滴的形成,从而抑制HCV增殖[25]。Viperin的C端结构域能够与DENV的NS3蛋白结合互作,这一过程虽然并不定位在脂滴上,但依然能够发挥抑制病毒增殖的作用[26]。Viperin的SAM域的酶活性能够抑制TBEV的RNA的合成,从而起到对该病毒的抑制作用[27]。Viperin的α螺旋结构域不仅能抑制囊膜蛋白的表达,破坏内质网结构,阻碍病毒颗粒的组装,还能通过抑制马传染性贫血病毒(EIAV)受体的表达,从而阻止病毒的入胞[28]。
总之,Viperin的广谱性抗病毒活性已被证实(图4),在不同病毒感染中的作用靶点以及机制等仍需要进一步探索。
图4 Viperin的部分抗病毒功能[29]
![图4 Viperin的部分抗病毒功能[29]](http://www.xueshut.com/uploads/allimg/210324/36-210324101554605.jpg)
Fig.4 Partial antiviral functions of Viperin
6、 展望
根据生物进化的“红皇后假说”,Viperin在宿主与病毒的长期相互作用中,在哺乳动物和低等脊椎动物中高度保守,特别是Viperin的SAM结构域和C端在发挥抗病毒作用的同时,还表现出了高度保守性[13],说明在物种进化过程中,该蛋白在与多种病毒相互作用的压力下,仍然保持了其结构与功能的稳定性,可以推测Viperin可能存在更多的潜在生物学功能。自2001年作为一种干扰素刺激基因被发现及其被鉴定为是对HCMV有效的宿主抗病毒蛋白以来,对于Viperin的生物化学和细胞生物学特性的了解正在逐步加深,但在很大程度上,它的精确作用机制仍然尚未定义。不同病毒在其复制周期中会采用不同的复制机制并利用不同的细胞器来完成复制,针对不同的病毒,Viperin会以不同的方式来抑制病毒的复制,同时它还具有调节先天性免疫信号的能力,但这其中仍然存在很多问题,例如Viperin在未感染细胞中是否具有其他功能?Viperin与内质网、脂滴或线粒体相关的生物学作用是什么?由于有很多病毒可以不通过产生干扰素而直接诱导Viperin的产生,因此可以推测病毒是否会通过劫持Viperin来增加该病毒的感染性,针对这些问题的研究所获得的信息将有助于进一步阐明Viperin的生化特性和抗病毒活性,这对于Viperin在抗病毒及先天性免疫中所扮演角色的认识具有重要意义。
参考文献
[1]FENWICK M K,LI Y,CRESSWELL P,et al.Structural studies of viperin,an antiviral radical SAM enzyme[J].Proc Natl Acad Sci U S A,2017,114(26):6806-6811.
[2]唐海波.Viperin抑制狂犬病病毒机理的探索研究[D].广西南宁:广西大学,2015.
[3]袁玉康.Viperin的泛素化及其蛋白水平的调控机制[D].江苏苏州:苏州大学,2018.
[4]SEO J Y,YANEVA R,HINSON E R,et al.Human cytomegalovirus directly induces the antiviral protein viperin to enhance infectivity[J].Science,2011,332(6033):1093-1097.
[5]BIOLATTI M,GUGLIESI F,DELLOSTE V,et al.Modulation of the innate immune response by human cytomegalovirus[J].Infect Genet Evol,2018,64:105-114.
[6]LINDQVIST R,UPADHYAY A,OVERBY A K.Tick-borne flaviviruses and the typeⅠinterferon response[J].Viruses,2018,10(7):E340.
[7]HONARMAND EBRAHIMI K.A unifying view of the broadspectrum antiviral activity of RSAD2(viperin)based on its radical-SAM chemistry[J].Metallomics,2018,10(4):539-552.
[8]IVASHKIV L B,DONLIN L T.Regulation of type I interferon responses[J].Nature Rev Immunol,2014,14(1):36-49.
[9]DURBIN R K,KOTENKO S V,DURBIN J E.Interferon induction and function at the mucosal surface[J].Immunol Rev,2013,255(1):25-39.
[10]FANG J,WANG H,BAI J,et al.Monkey Viperin restricts porcine reproductive and respiratory syndrome virus replication[J].PLoS One,2016,11(5):e0156513.
[11]MCMAHON H T,GALLOP J L.Membrane curvature and mechanisms of dynamic cell membrane remodelling[J].Nature,2005,438(7068):590-596.
[12]SCHNEIDER W M,CHEVILLOTTE M D,RICE C M.Interferon-stimulated genes:a complex web of host defenses[J].Annu Rev Immunol,2014,32:513-545.
[13]朱春辉,汤艳东,徐方,等.抗病毒免疫因子Viperin的研究进展[J]病毒学报,2015,31(1):91-96.
[14]方剑玉,白娟,郭小参,等.猪源Viperin蛋白抑制猪繁殖与呼吸综合征病毒感染MARC-145细胞[J].病毒学报,2017,33(2):216-223.
[15]方剑玉,朱文豪,李海利,等.猪源Viperin基因的克隆,原核表达以及抗体的制备[J].华北农学报,2018(5):16-22.
[16]孙立霈,陈舜,汪铭书,等.干扰素刺激基因viperin所编码蛋白的结构与抗病毒功能的研究进展[J].中国预防兽医学报,2017,39(5):42242-42246.
[17]LINDQVIST R,OVERBY A K.The role of Viperin in antiflavivirus responses[J].DNA Cell Biol,2018,37(9):725-7230.
[18]CHAKRAVARTI A,SELVADURAI K,SHAHOEI R,et al.Reconstitution and substrate specificity for isopentenyl pyrophosphate of the antiviral radical SAM enzyme viperin[J].JBiol Chem,2018,293(36):14122-14133.
[19]王波,吴英,方玉莹,等.病毒拟似物Poly(I:C)诱导人卵巢颗粒细胞病毒反应蛋白viperin表达[J].基础医学与临床,2018,38(8):1069-1073.
[20]DUKHOVNY A,SHLOMAI A,SKLAN E H.The antiviral protein Viperin suppresses T7promoter dependent RNA synthesis-possible implications for its antiviral activity[J].Sci Rep,2018,8(1):8100.
[21]REIZIS B,BUNIN A,GHOSH H S,et al.Plasmacytoid dendritic cells:recent progress and open questions[J].Annu Rev Immunol,2011,29:163-183.
[22]SAITOH T,SATOH T,YAMAMOTO N,et al.Antiviral protein Viperin promotes Toll-like receptor 7-and Toll-like receptor 9-mediated type I interferon production in plasmacytoid dendritic cells[J].Immunity,2011,34(3):352-363.
[23]方剑玉,朱文豪,郭小参,等.表达猪Viperin蛋白重组腺病毒的构建及其对PRRSV复制的抑制作用[J].河南农业科学,2017,46(9):126-131.
[24]NASR N,MADDOCKS S,TURVILLE S G,et al.HIV-1infection of human macrophages directly induces viperin which inhibits viral production[J].Blood,2012,120(4):778-788.
[25]WANG S,WU X,PAN T,et al.Viperin inhibits hepatitis Cvirus replication by interfering with binding of NS5Ato host protein hVAP-33[J].J Gen Virol,2012,93(Pt 1):83-92.
[26]HELBIG K J,CARR J M,CALVERT J K,et al.Viperin is induced following dengue virus type-2(DENV-2)infection and has anti-viral actions requiring the C-terminal end of viperin[J].PLoS Negl Trop Dis,2013,7(4):e2178.
[27]李文良,毛立,邓加武,等.抗病毒蛋白Viperin抑制猪瘟病毒在PK-15细胞上的复制[J].2018,49(1):139-146.
[28]TANG Y D,NA L,ZHU C H,et al.Equine viperin restricts equine infectious anemia virus replication by inhibiting the production and/or release of viral Gag,Env,and receptor via distortion of the endoplasmic reticulum[J].J Virol,2014,88(21):12296-122310.