
肝脏是损伤后能够快速再生的实质性器官,但是这种再生能力并不是无限的。在许多疾病条件下,由于各种病理因素的影响,其再生能力并不能完全代偿肝细胞及肝功能的缺失,这使得移植仍是治疗爆发性肝衰竭及末期慢性肝病的最终选择,在肝源愈发短缺的今天研究肝再生非常必要。
1 肝再生过程
肝再生过程是一个复杂的过程,不仅生成的结构复杂,而且参与再生的细胞类型多样。肝再生过程中,肝细胞是首先进行分裂的细胞类型,在各种因子的刺激下,细胞表达多种与再生有关的基因,由 G0 期进入分裂期,通常在 2 ~ 3 d内就能完成 1 ~ 2 次细胞分裂周期。随后,肝星状细胞、Kupffer 细胞和胆囊上皮细胞先后进入细胞分裂周期。同时,血管内皮细胞增殖,出现血管再生,有助于重建肝脏的血管结构。另外,肝脏受损会激活肝祖细胞( hepatic progenitor cell,HPC) ,后者能够分化为肝细胞或胆管上皮细胞。当肝细胞启动再生过程受阻或肝脏损伤严重时,肝脏肝细胞库将被激活,生成卵原细胞。生理状态下卵原细胞数量极少,但是一旦被激活,这些位于门脉周围的卵圆细胞将大量增殖。动物研究证实,部分肝切除后约 22 d,卵原细胞生成的肝细胞和胆管上皮细胞将逐渐恢复原有的肝组织质量。肝再生的过程受到多种因素的影响,其中 Notch 信号通路几乎涉及所有细胞的增殖和分化活动,因此 Notch 信号通路在肝再生中的作用近年来受到越来越多的重视。
2 Notch 信号通路
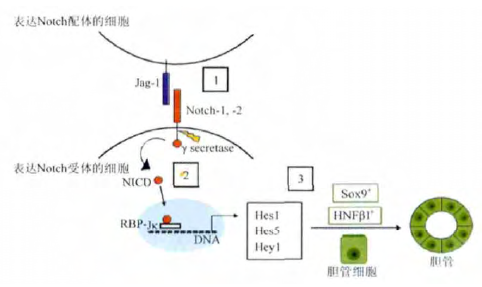
Notch 指果蝇翅缘缺口( notch) 表型,由现代遗传学的奠基人之一 Morgan 在果蝇的大规模突变研究中首先鉴定。现代分子生物学研究表明,果蝇 Notch 为一个相对分子质量( Mr) 约 300 000 的单次 1 型跨膜受体蛋白,由 2 条链通过二硫键连接组成。Notch 信号转导通路由受体、配体和 DNA 结合蛋白 3 部分组成。Notch 信号从分泌到释放出 Notch 胞内段共发生 3 次裂解,分别被称为 S1、S2 和 S3 裂解,在发生 S1裂解后形成的异源二聚体,共有 4 个类型( Notch 1 ~ 4) ,Notch 的配体( Delta 家族蛋白) 共有 5 类,分别为 Dll-1、Dll-3、Dll-4,Jagged-1 和 Jagged-2,也属于跨膜蛋白。Notch 受体与配体结合后,首先由肿瘤坏死因子α 转化酶/去整合素-金属蛋白酶( tumor necrosis factor-α converting enzyme/a disintegrin andmetalloprotease,TACE / ADAM) 催化产生 S2 裂解,形成的含有羧基末 端 的 产 物 Notch 细 胞 外 残 端 ( Notch extracellulartruncation,NEXT) 在 γ 分泌酶( γ-secretase) 作用下发生 S3 裂解,从而释放出 Notch 胞内段 ( Notch intracellular domain,NICD)。NICD 含有多个功能结构域: 从近膜处依次为重组信号序列结合蛋白 Jkappa ( recombination signal sequence-binding protein Jkappa,RBP-J ) 相关分子 ( RBP-J associationmolecule,RAM) 结构域,CDC10 / ankyrin 重复序列,转录激活结构域以及脯氨酸-谷氨酸-丝氨酸-苏氨酸 ( proline-glutamate-serine-threonine,PEST) 结构域等。RAM 结构域介导 NICD与转录因子RBP-J/Su( H) 的结合,而 CDC10/ankyrin 重复序列和转录激活结构域与 NICD 的转录激活作用有关。Notch 信号的下游靶点包括碱性螺旋-环螺旋( basic helix-loop helix,bHLH) 蛋白,如发状分裂相关增强子 1 ( hairy and enhancer ofsplit-1,HES-1) 和 HES-5,后者能够通过拮抗其他 bHLH 因子等方式阻碍细胞特异性分化效应基因的表达,最终影响细胞的分化、增殖和凋亡,此为 RBP-J 依赖型信号通路。而另有学者提出的RBP-J非依赖型信号通路目前并没有清楚的研究。
3 Notch 信号通路与肝再生
多个研究都证实 Notch 信号通路不仅参与肝脏生成,而且在肝再生中具有重要作用( 图1) 。首先,Notch 信号直接参与肝再生。在肝脏中植入 2-乙酰胺基氟( 2-acetylaminofluorine,2AAF) ,而后再进行70% 的部分肝切除( partialhepatectomy,PH) ,制备 2AAF-PH 模型。利用该模型,研究者发现 2AAF-PH 后11 d,肝脏出现卵圆细胞,同时伴有 Notch-1 表达的增高。如果使用 γ 分泌酶抑制 Notch 信号,卵圆细胞的分化将受到抑制,而且生成的肝细胞功能也受到影响。Wakabayashi等发现小鼠部分肝切除后 3 h,即可出现 Notch1 转录的增高,人为降低 Notch1 的表达后肝再生的能力下降。Khler等以及 Wang 等的研究也证实 Notch 通路在肝再生中具有重要作用。此外,Notch 裂解后的胞外段能通过反式内吞的方式进入肝细胞,从而提高肝细胞内的 Notch 含量。人体和动物研究都证实 Notch 信号在胆管板重塑过程中胆道发育中也具有重要作用。其次,Notch 信号参与肝再生后的重塑。研究发现,Notch 信号通过改变肝富集转录因子的表达控制肝母细胞及成熟肝细胞向胆管细胞的转分化,肝脏间充质细胞表达的 Jagged-1 配体能够使周围肝母细胞中的胆囊特异性标记物( 如 Sox-9 和 HNF1β 等) 上调,通过表达 NICD 抑制肝祖细胞向肝细胞方向分化能使这些细胞产生典型的胆管上皮细胞,使用 Notch 信号抑制剂能抑制肝祖细胞形成胆囊细胞表型。临床发现,当发生胆管疾病时 HPC 和反应性胆管细胞中的 Notch 信号发生活化,如果完全抑制 Notch信号,将不会产生向胆道细胞分化的 HPC,如果 Notch 通路被部分阻断,仍有可能产生向胆道细胞分化的 HPC,但是不足以形成完整的胆道。另外,肝脏血管内皮细胞也表达Notch 受体,后者在肝再生过程中参与肝脏微循环的重塑。
Notch 的 4 种受体在肝脏中都有表达,Notch-1 和 Notch-2主要表达于胆管细胞和 HPC,当胆道受损时表达量明显增高,Notch-3 和 Notch-4 主要参与间充质细胞的生物学活性,内皮细胞中也有表达。当肝脏受损后,胆道周围血管内皮细胞上的 Notch 受体( 主要是 Notch-2 和 Notch-3) 表达明显增高,可能与异常的新生血管生成有关。Notch 信号的 4 种受体对肝细胞功能的影响有何不同,Ortica 等首次对此进行了研究。结果发现 Notch 信号通路对未分化状态下的 HPC 增殖有重要作用,其中 Notch1、2、4 受体对其增殖有促进作用,而Notch3 受体有抑制作用。这些结果表明,Notch 信号的表达会随着损伤类型的不同而出现不同的改变,并与 Wnt 或Hedgehog 等其他信号相互配合,以恢复肝脏的形态和功能。
肝血窦内皮细胞( liver sinusoidal endothelial cells,LSEC)是肝血窦表面内层特有的内皮细胞,除了参与调节微循环和新陈代谢之外,还通过与肝细胞之间复杂联系支持肝脏的发育和再生。小鼠部分肝切除模型显示,在肝再生中,一方面肝细胞增殖形成无血管的实质岛,通过血管内皮细胞生长因子( vascular endothelial growth factor,VEGF) 等吸引 LSEC,另一方面,LSEC 可以通过 VEGF 受体 1( vascular endothelialgrowth factor receptor1,VEGFR1 ) 信号对肝细胞产生保护作用,而且这种作用与血管生成无关。研究证实,RBP-J 介导的 Notch 信号通路能通过调节 LSEC 影响肝脏再生。在Wang 等的研究中,他们使用 RBP-J 敲除小鼠模型进行研究,发现 RBP-J 缺失会使得肝脏出现类静脉闭塞表现( 肝血窦内类纤维物质堆积,Disse 间隙水肿和肝细胞凋亡增多) ,肝血窦结构异常,由于 VEGFR1 表达降低,尽管 LSEC 的增值增加,但无法为肝细胞提供肝细胞生长因子 ( hepatocytegrowth factor,HGF) 等营养因子,因而导致上述病理改变。
由此可见,Notch/RBP-J 信号通路对肝脏再生的影响可能部分归功于 LSEC 中的 VEGFR1-HGF 信号。VEGFR 对 LSEC 和肝细胞都有调节作用,VEGFR2 参与调节 LSEC 的增殖信号,而 VEGFR1 抑制 VEGFR2,并且介导肝细胞白细胞介素 6( interleukin-6,IL-6) 和 HGF 的产生。
另一方面,近期有研究显示 RBP-J 介导的 Notch 信号通路对 2 种不同种群的内皮祖细胞( endothelial progenitor cells,EPC) [早期 EPC( early endothelial progenitor cells,EEPC) 和后期 EPC( endothelial outgrowth cells,EOC) ]具有不同的调节作用,从而影响肝再生。在研究中显示,RBP-J 的缺失会影响EEPC 的归巢,对 PH 后的小鼠进行 EEPC 灌注,结果发现EEPC 对 PH 诱导的肝再生有较好的作用。EEPC 和 EOC 对PH 诱导的肝再生有不同影响,EEPC 能够促进肝细胞增殖,减少肝细胞凋亡,EEPC 的这些功能受到 Notch-RBP-J 信号通路的调节。
4 肝再生中 Jagged-1 途径的研究
肝脏中的 Notch 配体只有 Jagged-1 和 Dll-4,正常情况下Jagged-1 表达于 HPC 和胆管细胞以及门静脉基质的平滑肌细胞,在胆管板成熟过程中,间充质细胞通过 Jagged-1 与表达Notch 的肝母细胞相互协调。在胆道发育过程中,肝门间充质细胞表达 Jagged-1,与肝母细胞上的 Notch-2 受体相互作用,后者激活与胆道发育有关的基因,抑制与肝细胞分化有关基因,从而促进胆道发育。若 Jagged-1 基因或 Notch-2基因发生突变,将引起肝脏核因子 1β( hepatic nuclear factor1β,HNF1β) 缺乏,导致胆道细胞无反应及肝胆细胞无法聚集,影响胆道的修复,从而形成 Alagille 综合征( Alagillesyndrome,AGS) ,临床表现为严重的胆管发育不良和胆汁淤积以及多种肝外表现。肝脏受损后 Jagged-1 的表达明显增高,是激活 Notch 信号的主要配体。Khler 等在对小鼠进行部分肝切除后发现 4 d 内 Notch1 和 Jagged-1 均在肝细胞中正向调节,NICD 的核迁移在 15 min 内增加并达到峰值早期激活了 Notch 通路,HES-1 的表达在 30 ~ 60 min 升高并在60 min时达到峰值。还发现肝细胞同时表达 Notch 和 Jagged两种蛋白,二者可能通过近分泌环路机制激活某些下游通路,也可能影响肝细胞附近的其他细胞。在肝细胞的 Jagged 配体刺激下,部分肝切除 72 ~ 144 h 后肝血窦内皮细胞开始进入新生的肝组织内。徐洪雨等通过研究也证实在肝脏被部分切除后,Notch/Jagged 信号通路可以促进胆管的形成和结构维持,有助于新生血管的形成及肝细胞的增殖。体外研究发现,Jagged-1 是肝细胞的有丝分裂原,在部分肝切除 2 d内如果沉默 Notch 和 Jagged-1,则将明显抑制肝切除后第2 ~4天肝细胞的增殖。在对 Notch 靶向基因调节研究显示,Notch 激活后 HES-1 的表达早期即升高,并在 60 min 达到峰值,12 h 恢复正常水平,HES-5 在 1 ~ 6 h 有轻微升高,在12 ~ 48 h之间会减少 85% 。如果选择性沉默 Notch-1 基因,则肝细胞的再生能力将受到影响。EPC 在人体内参与了血管生成和促进组织再生,并与肝再生之间有较为密切的关系,而在 Notch 信号通路中 Jagged-1 对 EPC 的调节起到了核心作用。有研究显示小鼠部分肝切除后的肝再生过程中 Jagged-1蛋白有较为明显的变化,而 Jagged-2 蛋白几乎找不到。因此,Notch 的 Jagged-1 途径一方面通过促进肝细胞的有丝分裂和增殖促进肝再生,另一方面则很有可能通过对 EPC 的调节从而促进肝再生。
5 小结与展望
肝再生在解决肝脏疾病方面极具潜力并日益受到重视,其与 Notch 信号通路有密切的关系。Jagged-1 途径通过增加肝细胞的有丝分裂和增殖,对 EPC 的正向调节从而促进肝再生,RBP-J 途径则因调节 LSEC 以及通过 CXCR4 表达调节EEPC 动员迁移促进肝再生。然而,这一方面的研究目前仍正处于起步阶段,EPC 在血管发生及组织再生中的具体分子机制不明,Notch 通路如何调节 CXCR4 的分子机制仍未阐明,各方面研究未够深入。因此,在未来的研究中,随着研究的逐步深入,肝再生中 Notch 信号通路的完整分子机制必会展现,并尽快进入临床应用从而获得更大的价值和收益。
参考文献:
[1]DeLeve LD. Liver sinusoidal endothelial cells and liver regeneration[J]. J Clin Invest,2013,123( 5) : 1861 -1866.
[2]Fiorotto R,Raizner A,Morell CM,et al. Notch signaling regulatestubular morphogenesis dur-ing repair from biliary damage in mice[J]. J Hepatol,2013,59( 1) : 124 -130.
[3]Newsome PN,Hussain MA,Theise ND. Hepatic oval cells: Helpingredefine a paradigm in stem cell biology[J]. Curr Top Dev Biol,2004,61: 1 - 28.
[4]Greenwald I,Kovall R. Notch signaling: genetics and structure[J/OL].Worm Book,2013: 1 - 28.
[5]梁 洁,韩 骅. Notch 信号通路与血管发育[J]. 细胞与分子免疫学杂志,2008,24( 12) : 1225 -1227.
[6]Baker NE. Patterning signals and proliferation in Drosophila imaginaldiscs[J]. Curr Opin Genet Dev,2007,17( 4) : 287 - 293.
[7]Darwiche H,Oh SH,Steiger-Luther NC,et al. Inhibition of Notchsignaling affects hepatic oval cell response in rat model of 2AAF-PH[J/OL]. Hepat Med,2011,3: 89 -98.
[8]Wakabayashi N,Shin S,Slocum SL,et al. Regulation of notch1 signaling bynrf2: implications for tissue regeneration[J / OL]. Sci Signal,2010,3( 130) : ra52.
[9]Khler C,Bell AW,Bowen WC,et al. Expression of Notch-1 andits ligand jagged-1 in rat liver during liver regeneration [J].Hepatology,2004,39( 4) : 1056 - 1065.
[10]Wang L,Wang CM,Hou LH,et al. Disruption of the transcriptionfactor recombination signal-binding protein-Jkappa ( RBP-J) leads toveno-occlusive disease and interfered liver regeneration in mice[J].Hepatology,2009,49( 1) : 268 - 277.
[11] Parks AL,Klueg KM,Stout JR,et al. Ligand endocytosis drivesreceptor dissociation and activation in the Notch pathway [J].Development,2000,127( 7) : 1373 - 1385.
[12]Zong Y,Stanger BZ. Molecular mechanisms of bile duct development[J]. Int J Biochem Cell Biol,2011,43( 2) : 257 -264.
[13]Zong Y,Panikkar A,Xu J,et al. Notch signaling controls liverdevelopment by regulating biliary differentiation[J]. Development,2009,136( 10) : 1727 - 1739.
[14]Yanger K,Zong Y,Maggs LR,et al. Robust cellular reprogrammingoccurs spontaneously during liver regeneration [J]. Genes Dev,2013,27( 7) : 719 - 724.
[15] Boulter L,Govaere O,Bird TG,et al. Macrophage-derived Wntopposes Notch signaling to specify hepatic progenitor cell fate inchronic liverdisease[J]. Nat Med,2012,18( 4) : 572 - 579.
[16]D’Amore PA,Ng YS. Won’t you be my neighbor? Local induction ofarteriogenesis[J]. Cell,2002,110( 3) : 289 - 292.
[17]Ortica S,Tarantino N,Aulner N,et al. The 4 Notch receptors playdistinct and antagonistic roles in the proliferation and hepatocyticdifferentiation of liver progenitors[J]. FASEB J,2013 Oct 21.[Epub ahead of print]
[18]Diehl AM. Neighborhood watch orchestrates liver regeneration[J].Nat Med,2012,18( 4) : 497 - 499.
[19]Fausto N,Campbell JS,Riehle KJ. Liver regeneration[J]. Hepatol,2006,43( 2 Suppl 1) : S45 - S53.
[20]LeCouter J,Moritz DR,Li B,et al. Angiogenesis-independent endothelialprotection of liver: role of VEGFR-1[J]. Science,2003,299( 5608) :890 - 893.
[21]Chen JY,Feng L,Zhang HL,et al. Differential regulation of bonemarrow-derived endothelial progenitor cells and endothelial outgrowthcells by the Notch signaling pathway[J / OA]. PLoS One,2012,7( 10) : e43643.
[22]Morell CM,Fiorotto R,Fabris L,et al. Notch signalling beyond liverdevelopment: Emerging concepts in liver repair and oncogenesis[J].Clin Res Hepatol Gastroenterol,2013,37( 5) : 447 - 454.
[23] Lemaigre F,Zaret KS. Liver development update: new embryomodels,cell lineage control,and morphogenesis[J]. Curr OpinGenet Dev,2004,14( 5) : 582 - 590.
[24]Fabris L,Cadamuro M,Guido M,et al. Analysis of liver repairmechanisms in Alagille syndrome and biliary atresia reveals a role fornotch signaling[J]. Am J Pathol,2007,171( 2) : 641 - 653.
[25]Ross MA,Sander CM,Kleeb TB,et al. Spatiotem-poral expressionof angiogenesis growth factor receptors during the revascularization ofregenerating rat liver[J]. Hepatology,2001,34( 6) : 1135 - 1148.
[26]徐洪雨,李宝杰,王瑞峰,等. 肝部分切除后肝再生中 Notch/Jagged 信号及 TNF 和 IL-1 的表达[J]. 中华肝胆外科杂志,2008,14( 10) : 732 - 734.
[27] Croquelois A,Blindenbacher A,Terracciano L,et al. Inducibleinactivation of Notch1 causes nodular regenerative hyperplasia in mice[J]. Hepatology,2005,41( 3) : 487 -496.
[28] Xie J,Wang W,Si JW,et al. Notch signaling regulates CXCR4expression and the migration of mesenchymal stem cells[J]. CellImmunol,2013,281( 1) : 68 - 75.

