引言
引言
川西獐牙菜(Swertia mussotii Franch.)属龙胆科獐牙菜属植物,我国境内主要分布于四川西北部、西藏、青海西南部和云南等地区[1,2],是藏族民间常用的单方草药,藏医药传统用药“藏茵陈”的代表品种[3].主要用于治疗消化不良、胆囊炎,各型肝炎等症[4-7].目前,对于川西獐牙菜及提取物中药理活性成分的检测多为獐牙菜苦苷、龙胆苦苷等裂环烯醚萜类化合物,芒果苷等口山酮类化合物,齐墩果酸等三萜类化合物以及当药黄素等黄酮物质等[8-10].
以多组分整体用药的中医和藏医理论来说,对于其中单个或多个目标成分的检测和控制并不能全面的反映原药材的质量及提取工艺的稳定性。而近年来被应用于药材分析研究[11,12]的红外光谱,具有快速、高效、样品用量少、操作简单、宏观整体特征性强等特点[13-15],在系统控制监测方面逐渐显示出其优势。以藏药材川西獐牙菜为研究对象,利用红外光谱的宏观指纹特性,对川西獐牙菜及其不同溶剂提取物进行系统的分析和比较,以期为传统用药的合理性和以现代监控手段分析传统藏药的思路提供依据。
1、实验部分
1.1试剂与仪器。
实验中所用川西獐牙菜为2012年8月于青海省玉树州采集。经中国科学院西北高原生物研究所卢学峰博士鉴定,为川西獐牙菜(Swertia mussotii Franch.)。甲醇,无水乙醇,正丁醇,乙酸乙酯,氯仿均为分析纯(天津市富宇精细化工有限公司)。
Spectrum One傅里叶变换红外光谱仪(美国PerkinElmer公司);Millipore超纯水器(美国Millipore公司)。
1.2样品制备。
采集的川西獐牙菜样品自然阴干后粉碎备用。称取粉碎后的川西獐牙菜150g,加入10倍体积提取溶液浸泡过夜后加热回流提取,回流发生开始计时,第一次提取2h后,将提取液移出;再加入6倍体积提取溶液提取1h,相同方法提取第三次,合并三次提取液,利用负压回收提取溶液,获得提取物。各提取物样品真空减压干燥后经溴化钾压片制样扫描,测定其红外光谱。
1.3提取物红外光谱检测条件。
Spectrum One型傅里叶变换红外光谱仪光谱范围:4 000~400cm-1;DTGS检测器,分辨率4cm-1;扫描次数16次;扫描时实时扣除水和CO2的干扰。
1.4数据处理。
采用Perkin-Elmer公司Spectrum 06.3.5操作软件计算3 000~800cm-1区域内不同红外光谱之间的相关系数。同时利用Origin软件获得二阶导数红外光谱。三级鉴定将药材及提取物的溴化钾压片放在变温池内,通过程序控制升温,从50~120℃每隔10℃进行原位实时扫描红外光谱,获得动态光谱集,采用清华大学分析中心红外光谱组自行设计的二维相关分析软件获得二维相关红外光谱。
2、结果与讨论
根据上述提取流程,用水、50%乙醇、75%乙醇、无水乙醇、正丁醇、乙酸乙酯、氯仿和石油醚等不同溶液分别提取川西獐牙菜,计算各提取溶液的提取率,并对提取物中龙胆苦苷、獐牙菜苦苷,芒果苷和齐墩果酸的含量进行HPLC检测发现,水提取川西獐牙菜和乙醇提取川西獐牙菜的提取率相对较高,随着提取溶液极性的逐渐降低,提取率也逐渐降低,二者呈现正相关性。不同溶剂提取物中,除獐牙菜苦苷之外,龙胆苦苷,芒果苷和齐墩果酸的含量均以75%乙醇提取物中最高,极性最小的氯仿所提取的混合物中,四种指标成分的含量均为最低。同时,不同提取物中,龙胆苦苷的含量明显高于其他三种指标成分。因此,实验中选择含量相对较高的龙胆苦苷作为指标成分进行红外光谱的对照。
2.1川西獐牙菜原药材及不同提取物红外光谱分析及对比。
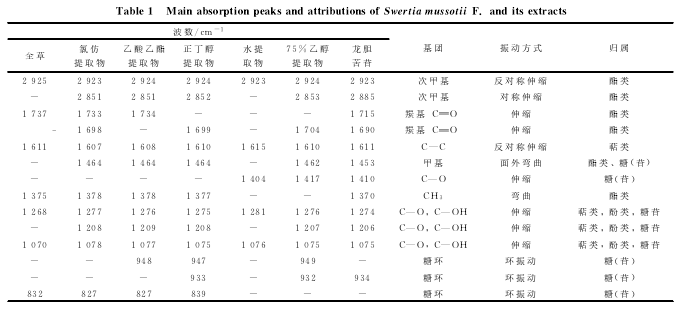
2.1.1 川西獐牙菜原药材及不同提取物红外光谱分析。
由表1和图1可以看出,川西獐牙菜氯仿提取物和乙酸乙酯提取物中主要含有酯类和萜类化合物,二者红外谱图较为相似。川西獐牙菜水提物和75%乙醇提取物的红外谱图相似,含有较多的糖(苷)类成分;同时,在75%乙醇提取物的红外光谱中2 853和1 704cm-1处吸收峰的增强,说明较水提取物而言,75%乙醇提取物中酯类化合物含量增加。
指标成分龙胆苦苷在1 611和1 075cm-1处有两个主要特征峰,和川西獐牙菜及不同溶剂提取物红外光谱中这两个波数处的峰对应明显。此外,随着氯仿、乙酸乙酯、正丁醇、水和75%乙醇提取物中龙胆苦苷含量的逐渐增加,提取物和龙胆苦苷红外光谱中所对应的两个特征峰的强度逐渐增加,不同溶剂提取物红外光谱与龙胆苦苷红外光谱在3 000~800cm-1区域内的相关系数也逐渐增大,依次为0.682 0,0.710 3,0.811 9,0.809 9,0.849 6.
利用指标成分含量高低和红外光谱中特征峰强度大小的对应关系,可以扩大红外光谱技术在藏药中的应用,以克服目前藏药研究中藏药成分复杂而标准品短缺的不足,推动以复方组合综合作用为特点的藏药的研究。
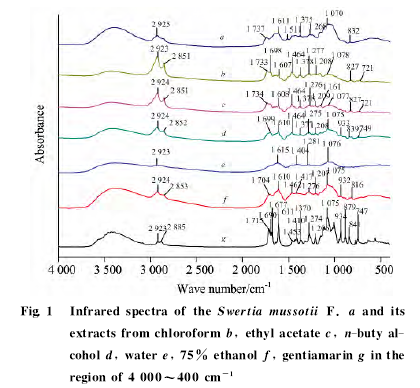
2.1.2 川西獐牙菜原药材及不同提取物二阶导数红外光谱分析。
川西獐牙菜及不同提取物的二阶导数红外光谱中(图2),龙胆苦苷1 075cm-1处的峰被细分为1 085,1 073,1 053cm-1等多个吸收峰,原药材及不同溶液提取物中,相对应的1 075cm-1处的峰也被细分为1 106/1 104,1 091,1 080,1 077/1 078,1 079/1 080,1 065,1 049cm-1等多个吸收峰;龙胆苦苷1 611cm-1处的峰没有重叠峰,原药材及不同溶液提取物中,相对应的1 610cm-1处的峰被细分为1 642,1 632,1 622,1 613/1 611,1 609/1 607,1 580cm-1等多个吸收峰。二阶导数红外光谱图谱中峰的位置更加清楚,可为主体成分的分析提供更进一步的参考。同时,根据上述五种提取物红外光谱的分析可以发现,以红外光谱中特征峰的有无和出峰位置,可以很明显的判断出提取物所用溶液的极性大小。
2.2川西獐牙菜不同浓度乙醇提取物红外光谱的三级鉴别。
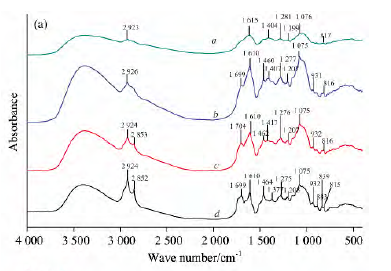
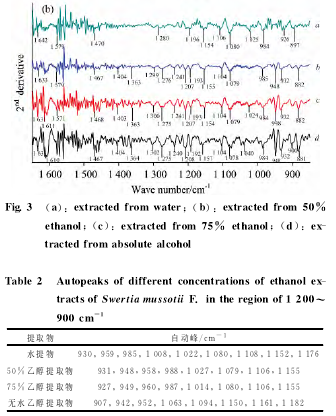
图3所示为川西獐牙菜不同浓度乙醇提取物红外光谱(a)和二阶导数红外光谱(b)。川西獐牙菜不同浓度乙醇提取物的红外光谱中,在2 926,1 610,1 464,1 277,1 075cm-1等处都有特征峰出现,但随着乙醇浓度的增加,这些特征峰的相对强度增加。另外,2853cm-1亚甲基C-H对称伸缩振动吸收峰,1704/1 699cm-1附近的羰基C O伸缩振动吸收峰以及1 300~950cm-1区域内C-O伸缩振动吸收峰的出现或逐渐增强,说明随着乙醇浓度的增加,提取物中的酯类和萜类化合物逐渐增多,提取物的组成偏差也逐渐增大。
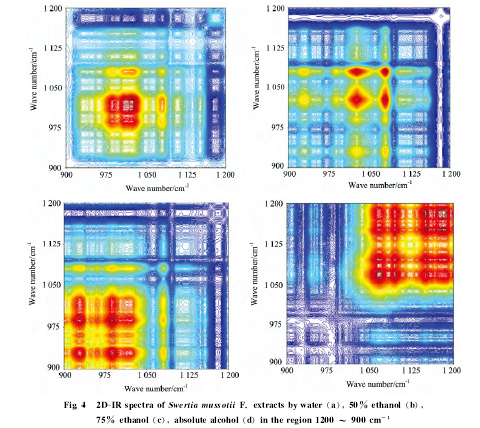
二维红外相关光谱是利用施加于样品的微扰以改变样品分子内或分子间的相互作用,影响分子各基团的振动频率与振动耦合作用,使传统光谱在第二维上展开,获得普通红外光谱及其导数谱所不能获得的许多新信息,提高谱图的分辨率,从而鉴别高度相似的样本。以热为诱因的二维红外相关谱,反应在升温过程中,被测样本中各组分有关基团的分子振动对热响应的行为。实验选取1 200~900cm-1区域,对川西獐牙菜不同浓度乙醇提取物进行分析比较。
由图4和表2可知,川西獐牙菜水提物的自动峰有9个,较强峰在1 008和1 022cm-1,50%乙醇提取物的自动峰有8个,较强峰在1 027和1 079cm-1,75%乙醇提取物的自动峰有8个,较强峰在927和987cm-1,无水乙醇提取物的自动峰有8个,较强峰在1 150和1 182cm-1.
图3和图4比较显示,由红外光谱和二阶导数光谱比对可知,川西獐牙菜不同浓度乙醇提取物的谱图之间没有明显的差异,但二维红外光谱中,不同浓度乙醇的提取物之间均存在差异,因此,可以通过二维红外光谱图对川西獐牙菜不同浓度乙醇提取物进行鉴别。二维红外光谱对类似物高分辨率的这一特点,可以将其应用于藏药繁多的炮制工艺过程中,以保证炮制品的可重复性以及质量的可监控性。
3、结 论
利用红外光谱三级鉴定方法对川西獐牙菜原药材和提取物的分析可知,随着指标成分含量的逐渐增加,红外光谱中相关特征峰的强度会相应增强,红外光谱图可以反应分析对象中主要成分含量的变化趋势。另外,较低浓度乙醇的川西獐牙菜提取物和水提物的红外光谱较为接近,同时,提取率和提取物中各指标成分的含量也相对较高,说明传统药物水煎液的合理性以及目前传统药多由水或者低浓度的乙醇提取的科学性。利用红外光谱从整体上观察谱图的特征,二阶导数光谱和二维红外光谱进行局部谱图解析,找出特征峰,分析产生药效的主体成分信息,可为更进一步的分析其药用成分提取方法和药理药效产生原因提供分析基础。
References
[1]HE Ting-nong,LIU Shang-wu,WU Qing-ru(何廷农,刘尚武,吴庆如)。Flora of China(Vol.62)(中国植物志,第62卷)。Beijing:Science Press(北京:科学出版社),1988.400.
[2]YANG Yong-chang(杨永昌)。Northwest Institute of Plateau Biology,Chinese Academy of Sciences(中国科学院西北高原生物研究所)。Tibetan Chronicles(藏药志)。Xining:Qinghai People's Publishing House(西宁:青海人民出版社)。1991.
[3]MA Yu-hua,JI Lan-ju,JI Wen-he,et al(马玉花,纪兰菊,吉文鹤,等)。Acta Botanica Boreali-Occidentalia Sinica(西北植物学报),2005,25(2):393.
[4]The Institute of Medicinal Plant Development,Chinese Academy of Medical Sciences(中国医学科学院药用植物资源开发研究所)。Chinese Medicine Record,Volume 4(中药志,第4册)。Beijing:People's Medical Publishing House(北京:人民卫生出版社),1988.342.
[5]ZOU Han-yan,ZHOU Han-xin(邹寒雁,周翰信)。Study of Qinghai traditional Chinese Medicine Resources Development and Utilization(青海中药资源开发及利用研究)。Beijing:The Oriental Press(北京:东方出版社),1990.40.
[6]XU Min(徐敏)。Journal of Xi'an Jiaotong University·Medical Sciences(西安交通大学学报·医学版),2008,29(5):583.
[7]HAN Qing,WEI Li-xin,DU Yu-zhi(韩青,魏立新,杜玉枝)。Chinese Traditional Patent Medicine(中成药),2009,31(6):936.
[8]MA Li-na,TIAN Cheng-wang,ZHANG Tie-jun,et al(马丽娜,田成旺,张铁军,等)。Chinese Traditional and Herbal Drugs(中草药),2008,39(5):790.
[9]LI Dong-mei,XIAO Huai,LIU Guang-ming(李冬梅,肖怀,刘光明)。Journal of Dali University(大理学院学报),2007,6(2):77.
[10]FAN Shu-qing,ZHOU Song,LU Zhi-qiang(范叔清,周松,卢志强,等)。Modern Journal of Integrated Traditional Chinese andWestern Medicine(现代中西医结合杂志),2012,21(2):227.
[11]ZHANG Yan-ling,XIA Yuan,CHAO Ge-tu,et al(张艳玲,夏远,朝格图,等)。Spectroscopy and Spectral Analysis(光谱学与光谱分析),2012,32(12):3225.
[12]XIE Jing-xi,CHANG Jun-biao,WANG Xu-ming(谢晶曦,常俊标,王绪明)。The Infrared Spectroscopy in Organic Chemistry andMedicinal Chemistry(红外光谱在有机化学和药物化学中的应用)。Beijing:Science Press(北京:科学出版社),2001.41.
[13]Sun Suqin,Chen Jianbo,Zhou Qun,et al.Plant Medical,2010,76(17):1987.
[14]Sun Suqin,Zhou Qun,Chen Jianbo.Infrared Spectroscopy for Complex Mixtrures Applications in Food and Traditional ChineseMedicine.Beijing:Chemical Industry Press,2011.9.
[15]SUN Su-qin,ZHOU Qun,CHEN Jian-bo(孙素琴,周群,陈建波)。Analysis and Identification of the Traditional Chinese Medicine byInfrared Spectroscopy(中药红外光谱分析与鉴定)。Beijing:Chemical Industry Press(北京:化学工业出版社),2010.4.