摘 要: 金属有机骨架(Metal- Organic Frameworks, MOFs)是一类由金属结点和有机配体配位组装而成的晶体材料. 金属有机骨架具有孔隙度大、孔径和尺寸可调、生物相容性好、成分可调、表面可修饰等优越性能,在肿瘤治疗领域具有重要的应用潜力. 本文首先介绍了金属有机骨架用于小分子药物、生物大分子药物等药物的递送体系的构建方法. 随后,我们总结了近年来MOFs药物递送体系在肿瘤的化学治疗、光动力学治疗、放射性治疗、免疫治疗、光热治疗等方面的应用进展. 最后,本文总结了MOFs在肿瘤治疗方面的进展和特点, 并展望了MOFs 在肿瘤治疗领域的研究挑战和应用前景.
关键词: 金属有机骨架; 药物递送; 化疗; 光动力学治疗; MOF-蛋白复合物;
Abstract: Cancer is a serious threat to human health and life safety. The number of cancer patients has been increasing worldwide. Therefore, it is of great significance to develop efficient cancer treatment methods. Currently, the main clinical methods for cancer therapy include surgery, radiotherapy, chemotherapy, immunotherapy, and so on. In recent decades, nanomaterials-based cancer treatment methods have shown great potential and value in radiotherapy, chemotherapy and immunotherapy. Metal-organic framework (MOFs) is a kind of material composed of metal nodes and organic ligands. The metal-organic frameworks have many advantages, such as large porosity, adjustable aperture and size, good biocompatibility, adjustable composition and surface modification, which make it promising in the field of cancer therapy. In this review, the methods for constructing MOFs-based drug delivery system (DDS) were first introduced. In particular, small molecule drugs can be efficiently loaded into metal-organic frameworks using non-covalent penetration, covalent cross-linking, and so on. At the same time, biomacromolecules-MOF system could be constructed based on the methods such as pore-penetrating and de novo approach. MOF-enzyme complex is more resistant to hush circumstances or protein inactivating agents than naked enzyme. Moreover, the metal-organic framework itself can be designed to be highly efficient nano-drug by using pharmaceutically active organic molecules or metal ions as ligands or metal ions. General surface modification methods were also reviewed due to their important roles for improving the solubility and stability of MOF-based DDS. In this reviewer, recent numerous researches on the cancer therapy of MOF-based DDS have been summarized. According to the type of treatment methods, the applications of MOF-based DDS in chemotherapy, photodynamic therapy, biomacromolecules-MOF based therapy, and other combined therapies (such as radiotherapy, and immunotherapy) for cancer were introduced, respectively. Finally, we summarized the advantages and challenges of MOFs in cancer therapy, and prospected the opportunities and development of this research field.
Keyword: Metal-organic frameworks; drug delivery; chemotherapeutics; photodynamic therapy; MOF-proteins complex;
癌症(恶性肿瘤)正在严重威胁着人类的健康,因此发展高效的肿瘤治疗方法具有重大的研究意义[1,2,3]. 目前,临床应用的肿瘤治疗方法主要有手术、化学治疗、放射性治疗等. 这些治疗方法能够在一定程度上减缓一些肿瘤的生长和转移,从而延长患者的寿命,但是存在治疗周期长、毒副作用明显、肿瘤可能复发等问题.
近几十年来,利用纳米材料优异的光、电、磁学性质及纳米尺寸效应等特点[4,5,6],基于纳米材料的纳米药物制剂在疾病治疗方面展现出无可比拟的优势. 纳米级金属有机骨架(Metal-Organic Frameworks, MOFs)是一类由金属结点和有机配体配位组装而成的晶体材料,具有比表面积大、孔径和尺寸可调、生物相容性好、成分可调、表面可修饰等优点,被广泛应用于催化、气体吸附、能源储存和转化等领域,并作为优异的药物递送系统设计平台在肿瘤治疗领域具有非常巨大的潜力[7,8].

本文首先介绍了纳米级金属有机骨架用于小分子药物、生物大分子药物等药物的递送体系的构建方法[9,10],然后总结了近年来MOFs药物递送体系在肿瘤的化学治疗、光动力学治疗、放射性治疗、免疫治疗、光热治疗[11,12,13]等方面的应用进展. 本文旨在归纳基于MOFs的药物递送系统在肿瘤治疗方面的特点和进展,并对MOFs的研究挑战和应用前景进行展望.
1、 基于MOF的药物递送体系的构建
多孔材料由于能够包裹药物分子并将其递送到细胞中,同时可通过扩散、材料降解等途径实现药物分子的释放,因此被广泛应用于药物载体系统的设计中[14]. 金属有机骨架具有合适的孔体积、大孔隙度、好的生物相容性等优良特征,能够实现药物分子的负载和递送. 根据药物的种类,该部分内容从小分子药物、生物大分子药物和MOF药物三个方面进行介绍.
1.1、 小分子药物
临床上用于肿瘤治疗的小分子药物包括:氟尿嘧啶、巯嘌呤、甲氨蝶呤等. 它们通常被制成口服液或者注射液. 这些小分子药物容易被机体代谢,导致药物利用率低,因此需要更大的药物剂量. 此外,这些药物没有肿瘤特异性,会导致严重的毒副作用. 基于金属有机骨架的小分子药物递送体系可以在一定程度上解决上述问题.
非共价浸润法是金属有机骨架负载小分子药物的一种常见方式. 该法主要利用金属有机骨架的大孔隙和尺寸、化学稳定性好等优点,将MOF浸润在药物分子溶液中,使得小分子药物包裹在其孔隙中,再用溶剂去除多余的游离小分子药物. 这种方法要求小分子药物的尺寸与MOF的孔径相符,并且两者之间具有较强的亲和性[15]. 其中,与药物分子具有相互作用的特定金属位点和有机官能团可以提高药物的运载效率. 例如,Serre等人利用这种方法成功地将布洛芬包裹到MIL(Materials of Institut Lavoisier)-100/ 101里(图1a),每个大孔和小孔的负载量分别为92和56个药物分子,从而实现高效的药物运载[16];Liu等人将五氟尿嘧啶包裹到ZIF(Zeolitic Imidazolate Framework)[17]里,负载效率达到51%.
然而,非共价浸润法不适用于那些与金属有机骨架没有强相互作用的药物分子. 幸好,这类分子可以通过共价交联的手段结合在金属有机骨架上,从而构建高效的药物递送体系. 这一方法要求金属有机骨架和药物具有以下几个特点:(1)纳米金属有机骨架表面有可供共价反应的活性位点,如氨基、醛基、叠氮官能团等;(2)药物通过共价修饰之后构建的纳米药物体系必须具有前药的性质;(3)活性药物能够在特定的生理环境中从纳米金属有机骨架上被释放出来. Wei等人通过形成席夫碱的方式将具有氨基官能团的DOX药物分子与金属有机骨架上的醛基官能团共价交联,从而实现药物分子在金属有机骨架上的高效负载(图1b),并在酸性pH条件下释放药物[18].
图1 构建基于金属有机骨架的小分子药物运载系统
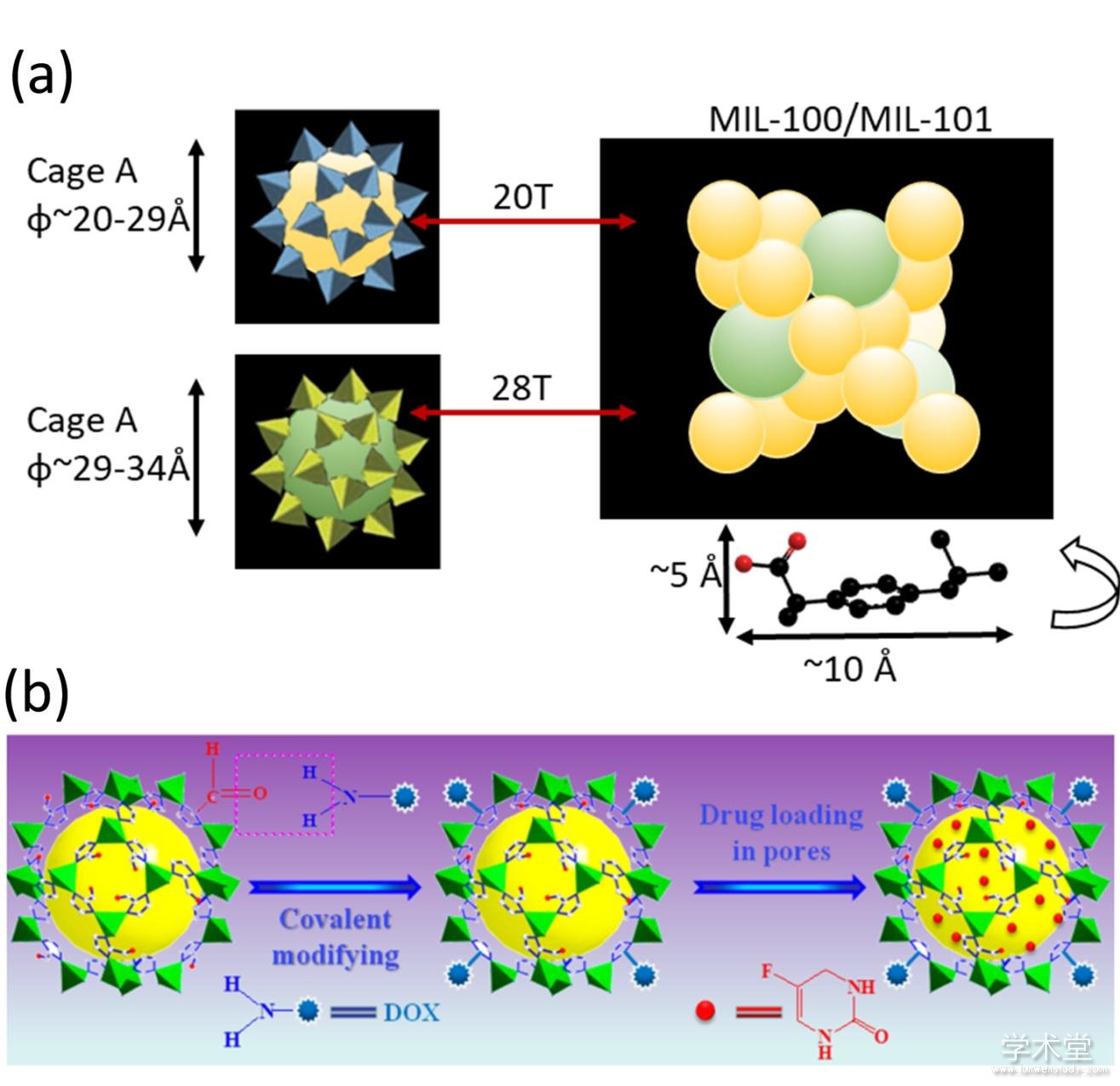
Fig.1 Illustration for construction of MOF based small drug molecular delivery system
(a) MIL-100和MIL-101的结构示意图[16]和(b)药物与ZIF-90共价交联策略[18]
1.2、 生物大分子药物
生物大分子药物主要包括多肽、蛋白质、抗体、聚糖与核酸等. 这些生物大分子本身很难进入细胞,因此需要特定的载体将其运输进入细胞发挥功能[19]. 金属有机骨架具有良好的框架结构设计可变性和无可比拟的表面可调性,是一种非常有潜力的生物大分子药物递送平台(尤其是蛋白类药物[20,21]). 目前,关于MOF-生物大分子药物已经有许多报道[22,23],其中MOF-蛋白质复合物的研究最为广泛.
MOF-蛋白质复合物主要通过蛋白质与金属有机骨架之间形成键或非键形式的相互作用. MOF-蛋白质复合物的形成方式可以分为:表面固定、共价交联、孔渗透、原位生长法等方式.在共价交联法中,利用蛋白质的氨基等基团与金属有机骨架上的相应官能团(如羧基)共价交联,能够确保较高的蛋白质负载效率,并且避免蛋白的泄露[22]. 除了共价交联以外,其他方式主要依靠金属有机骨架和蛋白分子之间的范德华力、氢键等相互作用力. 其中,表面固定法的实验条件非常温和,有利于保持蛋白质的结构与活性[24,25,26]. 近年来,孔渗透和原位生长法的方式非常受欢迎,详细介绍如下:
1.2.1、 孔渗透
MOF-蛋白质复合物最初多采用孔渗透的方法合成[27,28,29,30,31,32,33,34]. 生物大分子的孔渗透方法将蛋白分子与合适孔径的金属有机骨架混合孵育,使得蛋白分子进入金属有机骨架的孔隙中. 2011年,Ma等人首次将尺寸为3.3 nm× 1.7 nm× 1.1 nm的微过氧化物酶MP-11通过孔渗透法包裹到介孔金属有机骨架Tb-mesoMOF中(图2a). MP-11分子主要在纳米级的孔中,而0.9 nm的孔正好可以为MP-11的底物分子提供通道,方便底物分子与酶结合. 实验结果表明包裹MP-11可以防止MP-11聚集失活[35]. 体积稍大于金属有机骨架孔体积的分子,例如:细胞色素C(Cyt c)(?2.6 nm × 3.2 nm × 3.3 nm),也可以进入到金属有机骨架中. 机理研究揭示细胞色素C要经过一个大的构型变换才可以进入到相对较小的金属有机骨架孔隙中(图2b)[36].
随后,基于金属有机骨架的孔径可调性以及一系列合理的设计,Zhou等人开发出具有三种不同尺寸孔隙的介孔MOF(PCN-333)[37],实现单分子包裹三种不同尺寸的蛋白酶. 蛋白酶的使用环境通常是多变的,因此,研究者考察了PCN-333酶复合物在不同环境中的催化活性,结果发现PCN-333酶复合物在各种介质中的活性均比裸露酶要高. 并且在PCN-333的孔中不会出现自聚集、低温或低pH失活的情况. PCN-333包裹酶不仅能够保对酶起到保护作用,还可以实现酶的可循环使用,这是一般介孔硅等材料达不到的效果.类似的,Zhou等人将具有三种孔隙的金属有机骨架PCN-888用来装载两种不同尺寸的酶[38]. PCN-888最大的孔可以装载一个辣根过氧化物酶(GOx)分子,中等大小的孔可以装载一个葡萄糖氧化酶(HRP)分子,而小孔是空的,可作为底物或产物的通道(图2c). 两种酶只能按照顺序进入到PCN-888的孔隙中,先包裹GOx,后包裹HRP分子,构建一个酶的串联纳米反应器. 该体系不仅具有很高的酶催化活性,还可以保护酶不被胰酶降解.
除了将酶包裹在金属有机骨架的孔里外,微乳液包裹[39]等其它方法还将酶包裹在金属有机骨架的孔外. 微乳液包裹法是将合成好的金属有机骨架通过一步乳液法使MOF在酶的表面生成一个三维的胶体层. 该方法成功实现了带正电荷酶的包裹,并以过氧化物酶为模型构建的过氧化物酶-MOF复合物具有高的酶催化活性、稳定性和可循环利用.
图2 孔渗透法包裹蛋白质分子
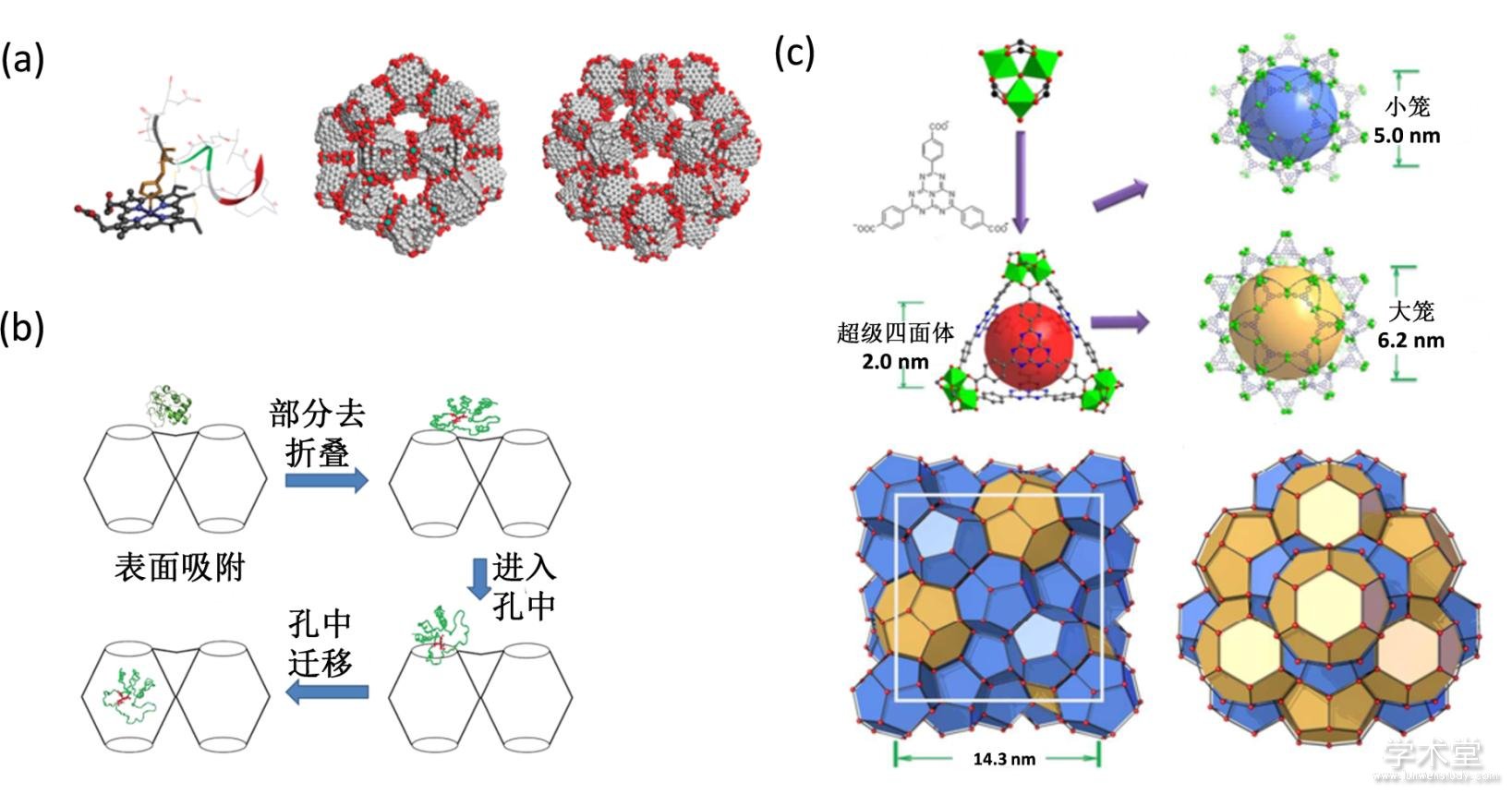
Fig. 2 Proteins penetration into MOF
(a) MP-11的分子结构和Tb-mesoMOF的孔结构[35],(b) Cyt c进入Tb-mesoMOF空穴的机理[36],(c) PCN-888的结构示意图[38]
1.2.2、 原位生长法
金属有机骨架的原位生长法,又称共沉淀法,是一种直接在蛋白质等生物分子表面生长金属有机骨架的包裹方法. 上述的孔渗透方法要求金属有机骨架的孔尺寸与蛋白质的尺寸相互匹配. 相比之下,原位生长的方法的最大优势则是不限制蛋白质分子的尺寸[40,41,42].
蛋白酶通常与有机配体之间存在着相互作用,这种相互作用使得两者的结合成为可能. 将金属有机骨架ZIF-8的原料与蛋白酶分子在溶液中混合,一段时间后即可获得ZIF-8酶复合物,简单而有效的实现蛋白酶的原位包裹(图3a)[43]. 通过这种方法得到的ZIF-8酶复合物同样可以维持酶在特殊环境下(蛋白水解剂、沸水、有机溶剂等)的活性. 同时,由于ZIF-8在偏酸性环境中会被降解,因此ZIF-8酶复合物可以实现低pH下蛋白酶的可控释放,从而与底物相互接触并发挥催化作用. 其他MOF(如ZIF-90)也可以通过这种原位生长的方法包裹蛋白酶分子[44].
在酶表面原位生长MOF的方法虽然不受尺寸的限制,但会受蛋白酶的表面电荷以及表面化学性质的影响. 对蛋白表面的氨基酸进行化学修饰可以有效的控制ZIF-8在蛋白表面的生长[45]. 蛋白表面的赖氨酸残基与琥珀酸酐反应会增加表面负电荷,促进ZIF-8的生长;而蛋白表面羧基基团与乙二胺反应会增加表面正电荷,阻碍ZIF-8生长(图3b). 计算模拟的结果表明蛋白的表面电荷大大影响它引起表面生物矿化的能力. 可见蛋白的表面物化性质对其实现原位包裹非常重要. 基于类似的原理,在蛋白质表面修饰氨基酸链使其表面带有很多的半胱氨酸残基将大大促进ZIF-8在其表面生长(图3c),并且有利于其他种类的金属有机骨架(如HKUST-1)在蛋白质表面的生长[46].
除了蛋白的性质对原位包裹效果有影响之外,金属有机骨架孔的性质对包裹在其中的蛋白酶的功能也会有影响. 研究表明,将酶包裹到亲水性的金属有机骨架MAF-7或者ZIF-90中可以在高温、失活剂、有机溶剂等环境中保持活性,但是包裹到疏水性金属有机骨架中的过氧化氢酶和脲酶则会失活(图3d)[47].
图3 MOF原位生长法包裹蛋白质分子
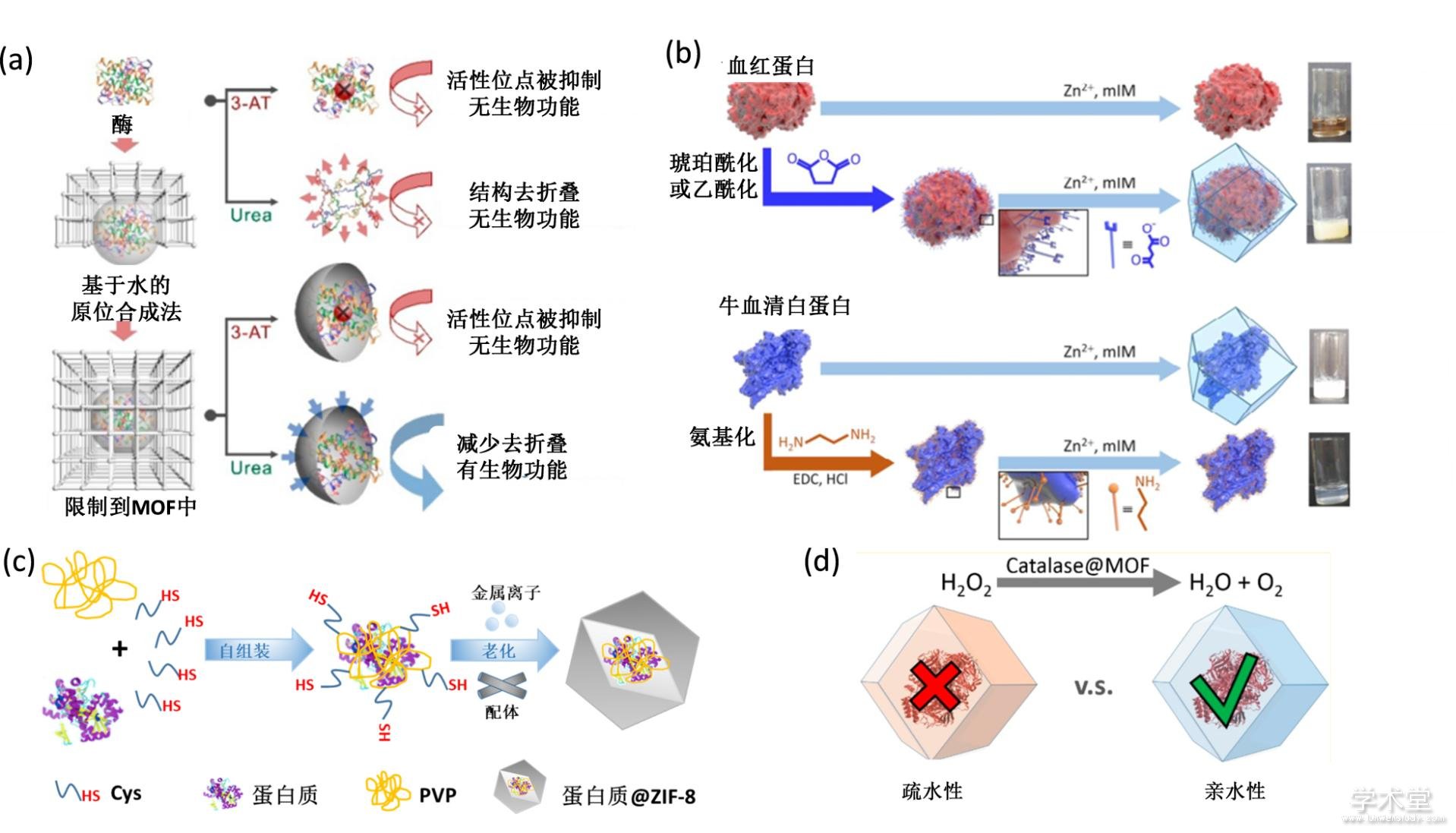
Fig. 3 De novo approach for construction of MOF-protein complex
(a) 共沉淀合成法包裹蛋白酶示意图[43],(b) 蛋白表面修饰对共沉淀包裹的影响示意图[45],(c) 氨基酸促进共沉淀法示意图[46],(d) 亲水性或者疏水性金属有机骨架包裹酶示意图[47]
1.3、 金属有机骨架自身作为药物
以上体系都是将小分子药物或生物大分子药物结合在金属有机骨架里,除此之外,有些金属有机骨架自身也可以作为药物. 这种方法直接选用具有药物活性的物质作为配体或金属离子,直接组装成金属有机骨架材料实现治疗功能. 该法不仅可以提高药物分子的水溶性,而且可以一定程度上降低药物的生物毒性[48].将具有药物功能的分子作为配体形成可金属有机框架药物体系.例如,Rosi等人将内源性的腺嘌呤作为配体,与金属离子组装成金属有机骨架,发现该方法能够维持配体原有的生物活性(图4a)[49,50,51]. 此外,Wu等人利用具有光敏性的分子作为配体合成金属有机骨架(图4b). 在该体系中,光敏剂在结构阵列中被规则排列开来,避免了光敏剂分子聚集猝灭的问题,并极大提高了疏水性光敏剂分子在水溶液中的溶解性[52]. 基于光敏性配体的金属有机骨架同样具有光敏性,在光照条件下可以催化氧气产生活性氧. 同时,利用金属有机骨架的尺寸可调性质,通过控制合成条件可以获得理想尺寸的金属有机骨架,可以进一步提高活体治疗效果[53]. 对于无法直接作为配体构建金属有机骨架的光敏剂,Xie等人发展了一种新的方法,通过合成后配体交换的方式合成光敏性金属有机骨架[54](图4c).
选用具有生物活性的金属是构建金属有机框架药物体系的另一种途径. 金属锌、银等被广泛用于抗菌,以它们作为金属结点组装成的金属有机骨架在可控的条件下分解释放出金属离子可以实现抗菌效果[55,56,57,58]. 一些能够提高细胞对放射线敏感度的金属离子(如金属铪、钨等)与合适的配体组装成金属有机骨架可以用于放射线治疗增敏,提高放射线治疗效果[59]. 此外,金属钆、锰等作为金属结点组装成的金属有机骨架也被用于生物医学领域[60,61,62,63].
图4 合成MOF纳米药物
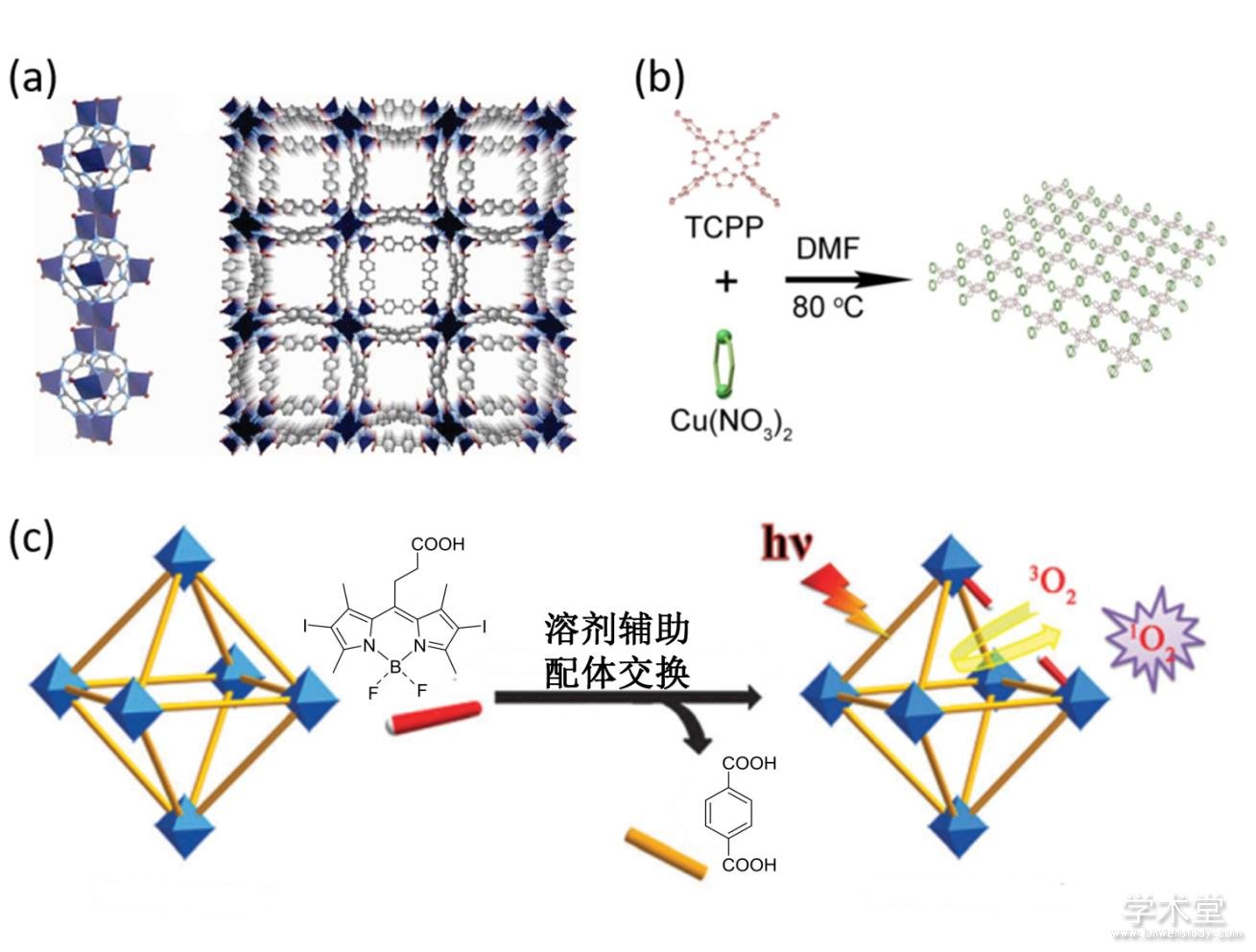
Fig. 4 Construction of MOF-based nanodrugs
(a) 锌-腺嘌呤金属有机骨架示意图[50],(b) 铜-TCPP金属有机骨架示意图[52],(c) UiO-PDT 纳米颗粒的合成和应用示意图[54]
1.4、 金属有机骨架的表面修饰
纳米颗粒的一些特性(如尺寸、电荷、表面亲水性以及表面配体的性质和密度等)会影响纳米颗粒的血液循环半衰期、生物分布和靶向能力. 其中,纳米颗粒的长血液循环能力通常是成功实现靶向药物递送的一个重要前提.
为了实现金属有机骨架材料的长血液循环,Forgan等人将亲水性的聚合物[64,65,66](如聚乙二醇)用来作为纳米颗粒的表面包裹材料,从而提高纳米颗粒的亲水性并降低血液中蛋白的调理素作用,避免纳米颗粒被巨噬细胞吞噬(图5a). 除此之外,在表面包裹PVP材料是纳米材料修饰常用手段,同样适用于金属有机骨架与酶复合物体系[67]. 此外,在MOF-蛋白复合物表面包裹细胞膜不仅可以保护蛋白不被降解,还可以避免系统性免疫清除(图5b). 由于细胞膜的特殊表面性质,该体系还可以实现肿瘤部位的同源靶向,并在肿瘤细胞中释放蛋白药物,从而抑制肿瘤生长,大大提高肿瘤治疗效果[68,69]. 此外,在MOF表面包裹无机材料(如CaCO3),也可以提高材料的稳定性并实现药物的可控释放[70].
图5 MOF的表面修饰
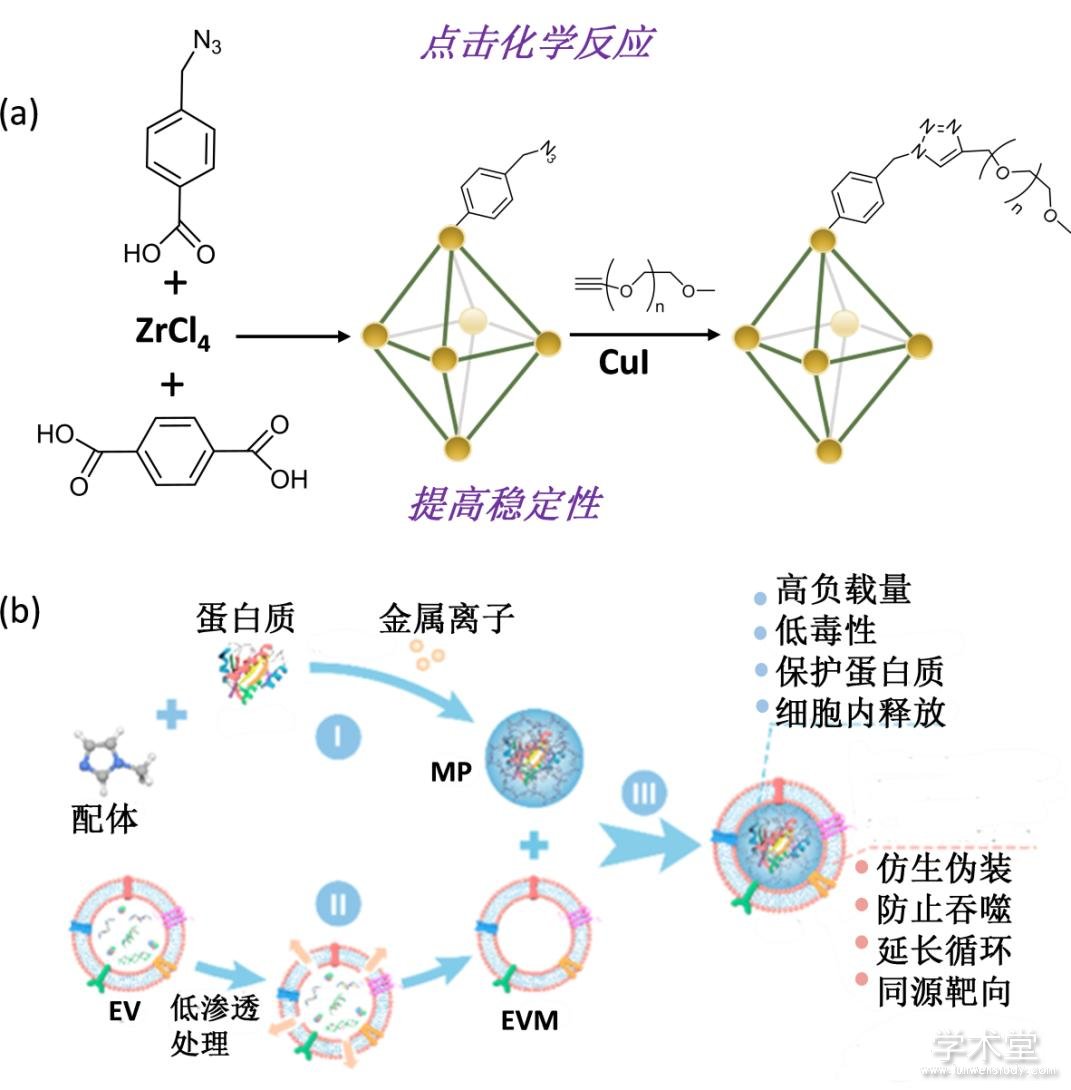
Fig. 5 Surface modification of MOFs
(a) 金属有机骨架表面修饰PEG示意图和pH激活药物释放[66],(b) 金属有机骨架表面包裹细胞膜示意图[68]
2、 基于MOF的药物递送体系的应用
金属有机骨架在肿瘤治疗领域具有巨大的潜力,并已取得一系列进展. 根据治疗方式的区别,该部分进展主要可分为以下四个方面:
2.1、 化学治疗
金属有机骨架作为有潜力的化学治疗药物递送载体,具有几下几个特征:(1)孔大小可调性和化学性质可调性;(2)配体组分的种类繁多,易于实现表面多功能修饰;(3)大的BET比表面积,利于大量负载生物分子;(4)一种金属有机骨架可有几种不同尺寸的孔,可实现同时负载几种不同功能的生物分子. 医学领域的应用对金属有机骨架载药系统往往有更高的要求. 为了确保有效的药物递送,还需要纳米金属有机骨架具有一下几个特性:(1)高效的负载药物或其他生物活性分子;(2)易于表面修饰或调控,从而实现靶向性地递送药物;(3)可控的药物释放;(4)材料本身可被机体代谢,避免毒副作用.
2006年,Serre等人首次将金属有机骨架MIL用作化疗药物载体[16]. 该体系使用的MIL-100和MIL-101是由金属铬(Cr)八面体三聚体和二羧酸或三羧酸组装而成,具有较大的孔径(25—34 ?)、比表面积(3100--5900 m2g-1)和孔体积(2 cm3g-1). 得益于高比表面积以及与药物分子之间的特异性相互作用,MIL-101的药物装载量远高于一般的沸石类多孔材料. 据报道,每克MIL-101可以装载药物高达1.376 g,而每克MIL-100可以装载0.35克布洛芬药物. 此外,由于MIL-100和MIL-101的化学稳定性非常高,两种材料均具有较长的可控的给药时间,为金属有机骨架在载药系统中的应用提供了极大的优势.
另外一类金属有机骨架ZIF也被证明具有很强的小分子药物递送能力. 其中,ZIF-8是一种有金属锌和2-甲基咪唑组装而成的金属有机骨架,有着足够大的孔隙和可控的形貌. 2016年,Liu组报道了第一个集高药物负载量和靶向运输能力于一身的基于ZIF-8的抗肿瘤药物五氟尿嘧啶的运载体系,并成功实现抑制肿瘤生长[17].
利用肿瘤微环境(如低pH)来刺激药物释放对于实现药物的可控释放具有重要意义. Panahi等人利用ZIF-8包裹二甲双胍药物分子,使其在肿瘤细胞内低pH刺激下释放药物分子[71](图6a),实现了细胞内源性因子激活的药物释放. 除了ZIF-8之外,Yu等人还开发了其他金属有机骨架用于运载五氟尿嘧啶药物分子,并实现了pH可控药物释放[72,73]. 例如:由4,4'-磺酰基二苯甲酸(H2SDBA)、N,N-二甲基乙酰胺(DMA)与金属镝组装而成的金属有机骨架可以通过简单的浸润法包裹五氟尿嘧啶分子[74],在低pH环境中释放药物分子,能够明显抑制人骨肉瘤细胞系的生长. 在这个体系中,pH依赖的药物最终完全释放的时间大约为20小时. 结果显示五氟尿嘧啶分子位于金属有机骨架的通道中间,通过短氢键(2.991 ?)和镝-氧键(2.915 ?)之间的相互作用结合. 除了这种作用力之外,五氟尿嘧啶与配体的苯环之间有π-π相互作用,距离为3.370 ?. 这几种相互作用力使得五氟尿嘧啶和金属有机骨架之间强有力的结合起来,从而实现药物的缓释.
还有其他一些基于金属有机骨架的可控释放的载药体系被开发用于抑制肿瘤细胞的生长.例如:Wang等人发展了一种基于锌离子的pH可控释放的金属有机骨架[Zn3(BTC)2(Me)(H2O)2](MeOH)13 (H3BTC = 1,3,5-benzenetricarboxylic acid, Me = melamine)[75]. 这些金属有机骨架包裹药物的方式都是通过简单的浸润法实现,使得药物分子通过与孔隙的相互作用而被限制在孔道中. 纳米级的沸石类金属有机骨架ZIF-90是由锌离子和配体2-醛基咪唑组装而成,具有大量的醛基,可以通过席夫碱反应与带氨基的DOX药物分子共价交联. 同时,ZIF-90还能够包裹药物分子五氟尿嘧啶,从而实现两种抗肿瘤药物的共同递送. 在pH 5. 5的环境中,药物在16小时之后释放量达到95%,而在中性环境中药物释放量显着降低[18].
金属有机骨架药物递送体系除了对pH刺激响应之外,还对其他因素(如锌离子)响应释放药物. Yang等人将五氟尿嘧啶装载到金属有机骨架MOF-In1中(图6b). 由于MOF-In1的孔隙是负电荷的,当细胞内的锌离子浓度较高时,锌离子会进入到孔隙中. 在静电作用下,五氟尿嘧啶药物被释放出来[76].
金属有机骨架还能够用于递送其他药物,如DOX[77,78,79]、喜树碱[80]、缬沙坦(valsartan)[81]、姜黄素[82]等,并达到了比小分子药物更好的治疗效果.
图6 金属有机骨架的刺激响应药物释放示意图
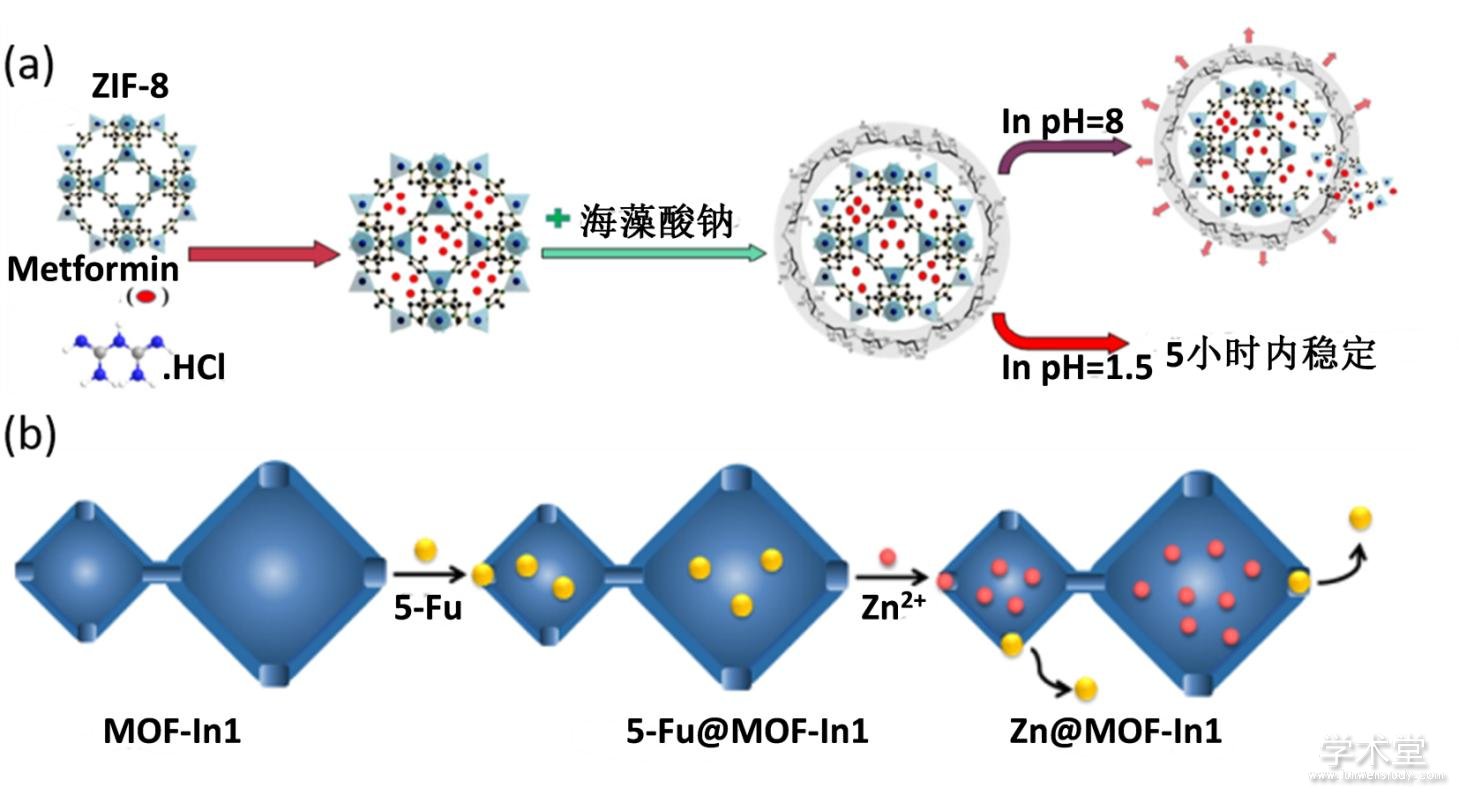
Fig. 6 Stimulus triggered drug release of MOF
(a) 金属有机骨架pH响应的药物释放示意图[71],(b) 金属有机骨架的锌离子响应药物释放示意图[76]
2.2、 光动力学治疗
光动力学治疗(photodynamic therapy, PDT)是近几年发展起来的一种新型肿瘤治疗手段[83,84,85,86],主要依赖低毒性的光敏剂在光照条件下催化氧气产生活性氧杀死肿瘤细胞[87,88]. 传统的小分子光敏剂存在水溶性差、光穿透深度低等缺点,导致其临床应用受限. 光敏性纳米材料由于其优良的水溶性、生物富集功能等优点,可以弥补传统小分子光敏剂的不足,因而在肿瘤光动力学治疗方面具有巨大的潜力[89,90]. 其中,光敏性金属有机框架,无论是作为小分子光敏剂的载体还是本身具有光敏性,由于其框架结构本身可调控而被广泛用于肿瘤的光动力学治疗研究[91,92,93,94]. 金属有机骨架应用于PDT的主要优点在于:(1)规则而可控的晶体结构使得被包裹在其孔中的光敏剂分子彼此分开,避免了光敏剂聚集猝灭,很大程度上有利于活性氧的产生;(2)孔结构有利于单线态氧的扩散;(3)纳米尺寸效应极大提高了光敏剂的水溶性,增强了被细胞摄取的量;(4)金属有机骨架可生物降解,具有良好的生物相容性.
卟啉类光敏剂由于其独特的分子结构,可被用来作为配体与金属离子组装成金属有机骨架. 利用这一特点,Lin等人2014年报道了第一个被用于PDT的纳米级卟啉金属有机骨架[95],并成功将其应用于肿瘤的活体治疗(图7a). 在该体系中,卟啉衍生物5,15-di(p-benzoato)porphyrin (H2DBP)与金属铪配位组装成金属有机骨架DBP-UiO,且光敏剂的含量高达77 wt%,产生单线态氧的量是H2DBP的两倍以上,可以用于比较难以治疗的癌症. 肿瘤模型治疗结果说明DBP?UiO在光辐射下产生毒性,达到抑制肿瘤生长甚至是清除肿瘤的效果. 值得一提的是,在光动力学治疗之后,没有出现小鼠皮肤和组织损伤. 进一步的组织病理学表明注射DBP?UiO的实验组肿瘤部位有巨噬细胞渗入,说明大量的肿瘤细胞凋亡或坏死. 在DBP?UiO之后,该研究小组报道了基于卟吩的金属有机骨架DBC-UiO,实现了比DBP?UiO更高的单线态氧产生效率,并被成功应用于结肠癌的活体治疗[96].
除了金属有机骨架的成份之外,金属有机骨架的尺寸也是影响其光动力学治疗效果的一个重要因素. 通过筛选理想尺寸的光敏性金属有机骨架纳米颗粒可以提高纳米颗粒的靶向能力,从而提高其PDT效果. Zhou等人利用锆与卟啉组装的金属有机骨架验证了这一猜想(图7b). 他们合成了几种不同尺寸(分别为30、60、90、140、190 nm)的光敏性金属有机骨架,并系统考察尺寸对PDT治疗效果的影响. 根据细胞毒性研究结果,90 nm的金属有机骨架的治疗效果最佳,说明90 nm的颗粒是最理想的尺寸[53].
除了PDT治疗效果,通过外部刺激和环境实现PDT药物的控制也具有非常重要的意义.单线态氧的产生离不开光辐射,因此通过金属有机骨架的配体可控性实现光控有可能实现PDT治疗的调控. Zhou等人将光转换开关分子1,2-bis(5-(4-carbonxyphenyl)-2-methylthien-3-yl)cyclopent-1-ene (BCDTE)与金属锌组装成双色光敏性金属有机骨架[97]. 在紫外光照下,光转换分子BCDTE关环,光敏剂TCPP发射的光被BCDTE吸收,导致无单线态氧产生;在可见光照下,光转换开关分子BCDTE开环,光敏剂发挥作用,产生单线态氧. 该体系实现了在细胞内可逆控制单线态氧产生,从而实现了PDT治疗效果的可逆调控.
利用肿瘤标志物(如硫化氢)激活光敏性金属有机骨架的PDT治疗效果是另一种非常有效的策略. 例如,Tang等人将铜离子与锌卟啉衍生物组装成金属有机骨架NP-1(图7c),铜离子能够完全猝灭锌卟啉配体的荧光,从而大大地降低配体的单线态氧产率[98]. 当金属有机骨架与硫化氢混合,铜离子金属节点会与硫化氢反应生成硫化铜,使得金属有机骨架分解,配体的荧光随之恢复,单线态氧的产量大大提升,从而实现硫化氢激活的光动力学治疗. 该体系被用于结直肠癌的活体光动力学治疗,治疗后肿瘤接近完全消除.
提高光动力学治疗还可以通过消耗细胞内的还原性物质来实现. 例如,还原性谷胱甘肽(GSH)会消耗光敏剂在光照下催化产生的单线态氧,一些研究表明,消耗这些谷胱甘肽分子可以确保产生的单线态氧不被其消耗,从而大大提高光动力学治疗的效果. 纳米级金属有机骨架 {CuL-[AlOH]2}n (MOF-2, H6L=mesotetrakis(4-carboxylphenyl)porphyrin))能够催化产生单线态氧和吸附谷胱甘肽分子[99]. 该金属有机骨架被内吞进入细胞,在光照条件下产生单线态氧,单线态氧会通过孔隙扩散到细胞中. 细胞中大量的GSH会被金属有机骨架吸附,无法猝灭扩散到细胞中的大量的单线态氧,确保了单线态氧的活性,从而提高光动力学治疗效果. 该体系的疗效可以与商业化抗乳腺癌药物喜树碱媲美.
图7 MOF用于光动力学治疗
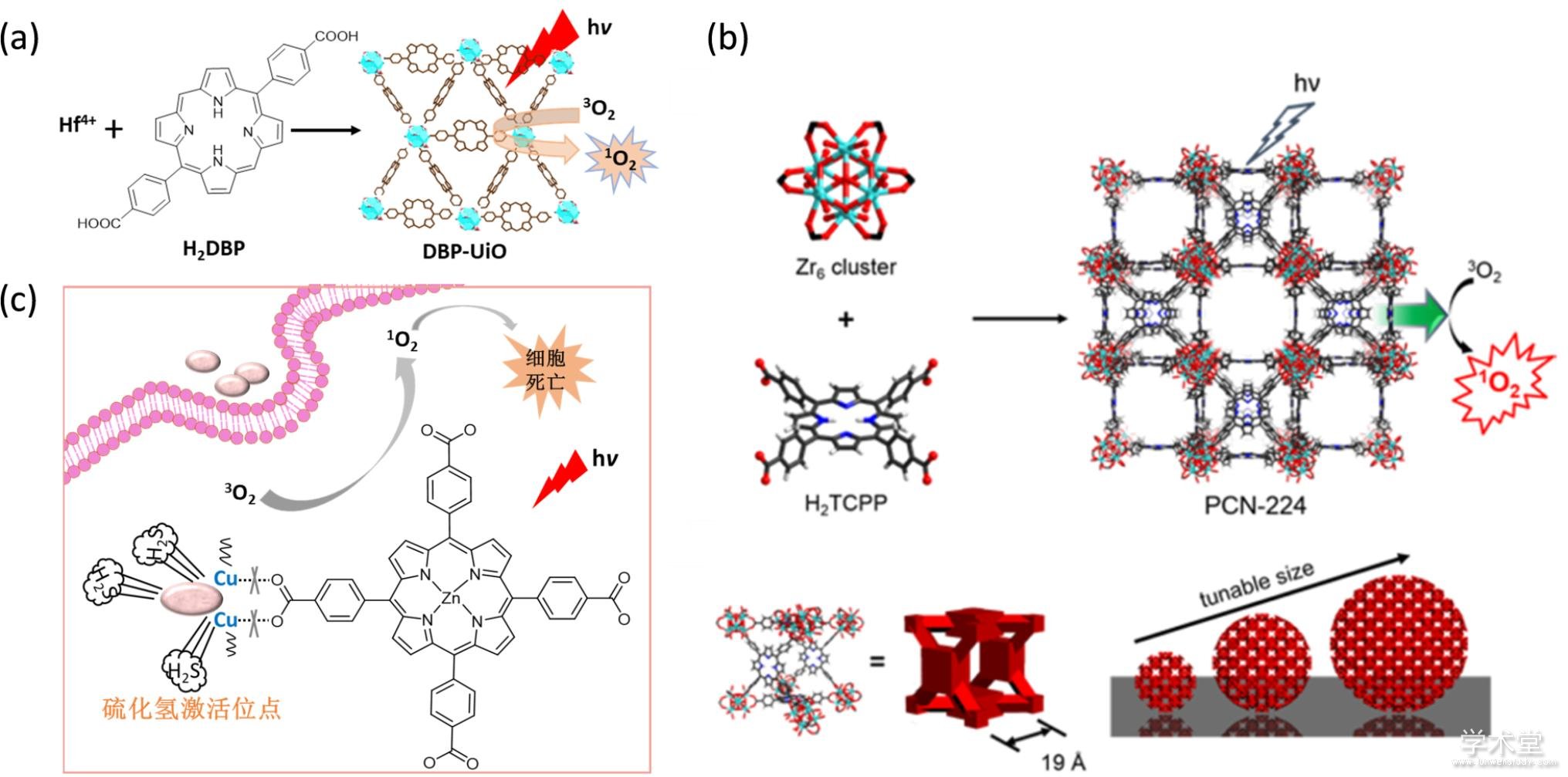
Fig. 7 MOF-based photodynamic therapy
(a) Hf-DBP合成示意图和单线态氧产生机制[95],(b) PCN-224的结构和单线态氧产生机制以及尺寸可调示意图[53],(c) MOF NP-1和单线态氧产生示意图[98]
2.3、 基于MOF-生物大分子体系的治疗方式
MOF-蛋白质复合物在生物医学领域和蛋白质工程领域有着非常广泛的应用价值. 现今,越来越多的酶或者抗体类药物被开发和应用[100,101,102,103,104]. 然而,目前蛋白类药物的活体应用仍然存在着诸多阻碍. 其中,如何将蛋白类药物递送到病灶部位后释放并保持其活性就是一个非常重要的研究方向[105,106,107,108]. 从上述MOF蛋白质复合物的一些优势来看,金属有机骨架是一个理想的蛋白类药物载体.
将金属有机骨架包裹过氧化物酶可以实现细胞内催化双氧水,为光动力学治疗提供氧气,改善肿瘤乏氧状态[109,110] MOF结合葡萄糖氧化酶可以消耗肿瘤细胞生存所需的葡萄糖,阻断营养来源,实现饥饿治疗[111](图8a). 用金属有机骨架PCN-333包裹酪氨酸酶构建纳米反应器在肿瘤部位激活扑热息痛前药,生成毒性药物,引起GSH减少和ROS的产生(图8b),从而有效的杀死肿瘤细胞,抑制肿瘤生长[112]. 金属有机骨架包裹神经药物清除酶(organophosphorus acid anhydrolase(OPAA),可以提高酶的热稳定性以及长时间稳定性,实现高效水解神经毒性分子[113,114].
一些口服蛋白质药物(如胰岛素)由于在胃部不稳定,因此其临床应用疗效仍然有待提高. 为了解决这个问题,Farha等人利用金属有机骨架NU-1000包裹胰岛素(胰岛素@NU-1000),从而保护胰岛素在胃中不被降解[115](图8c). 他们发现,胰岛素的负载量在30分钟即可达到40wt%. NU-1000在酸性环境中,甚至是pH为1的环境中仍然非常稳定,因此能够保护胰岛素在胃酸环境中的稳定性,并保持胰岛素的构型和活性. NU-1000在磷酸缓冲液(PBS)环境中降解,释放出包裹的胰岛素,使其发挥降血糖的功能. 这个体系尽管对磷酸盐不稳定,可能会导致部分胰岛素泄露从而失活,但是可以经过一定的修饰提高运载胰岛素的能力,在制备口服胰岛素制剂方面有着很大的潜力.
Cas9是一种基于CRISPR(Clustered Regularly Interspersed Short Palindromic Repeats,成簇的规律间隔的短回文重复序列)的基因编辑剪刀蛋白,可以用于编辑哺乳动物细胞的基因组,从而实现疾病的基因治疗[116]. Khashab等人用ZIF-8包裹Cas9,发现该方法可以有效的将其带入细胞. 在溶酶体的酸性环境中,ZIF-8因为配体被质子化而降解,实现溶酶体逃逸和释放Cas9,并保持Cas9剪切基因的功能[117](图8d). 另外一种金属有机骨架ZIF-90也可以包裹cas9蛋白,将其带到肿瘤细胞质基质中. 细胞质中的ATP分子与ZIF-90的金属元件Zn2+有强配位作用,使得ZIF-90降解,从而释放Cas9蛋白[118]. Cas9将肿瘤细胞中的基因剪切,达到基因沉默的效果. 利用这种体系,设计合适的剪切位点,可以干扰肿瘤细胞的基因表达、蛋白质合成,从而引起肿瘤细胞功能紊乱而死,达到抑制肿瘤生长的目的.
另一类生物大分子药物——核酸也被广泛用于肿瘤治疗,尤其是小干扰RNA(siRNA),通过特异性地与目标mRNA结合来干扰蛋白质的表达[119]. 同样地,siRNA需要载体才能进入到细胞中发挥功能. 金属有机骨架具有特殊的表面性质,能够与核酸类药物通过静电作用、π-π相互作用等方式结合[120]. 金属有机骨架吸附siRNA之后可以将siRNA运输到细胞质中,提高细胞摄取siRNA的量,防止siRNA被水解,促进siRNA逃逸溶酶体,从而达到更好的基因治疗效果[10]. DNAzyme是具有催化活性的DNA序列,可以特异性催化核糖核酸或者脱氧核糖核酸的裂解,因此常被用于基因治疗[121]. 同样的,DNAzyme需要载体运输才能进入到细胞中. Wang等人用ZIF-8包裹DNAzyme将其达到细胞中[88],并能溶酶体逃逸释放出DNAzyme和辅酶因子Zn2+,实现基因治疗.
图8 MOF蛋白质复合物用于疾病治疗
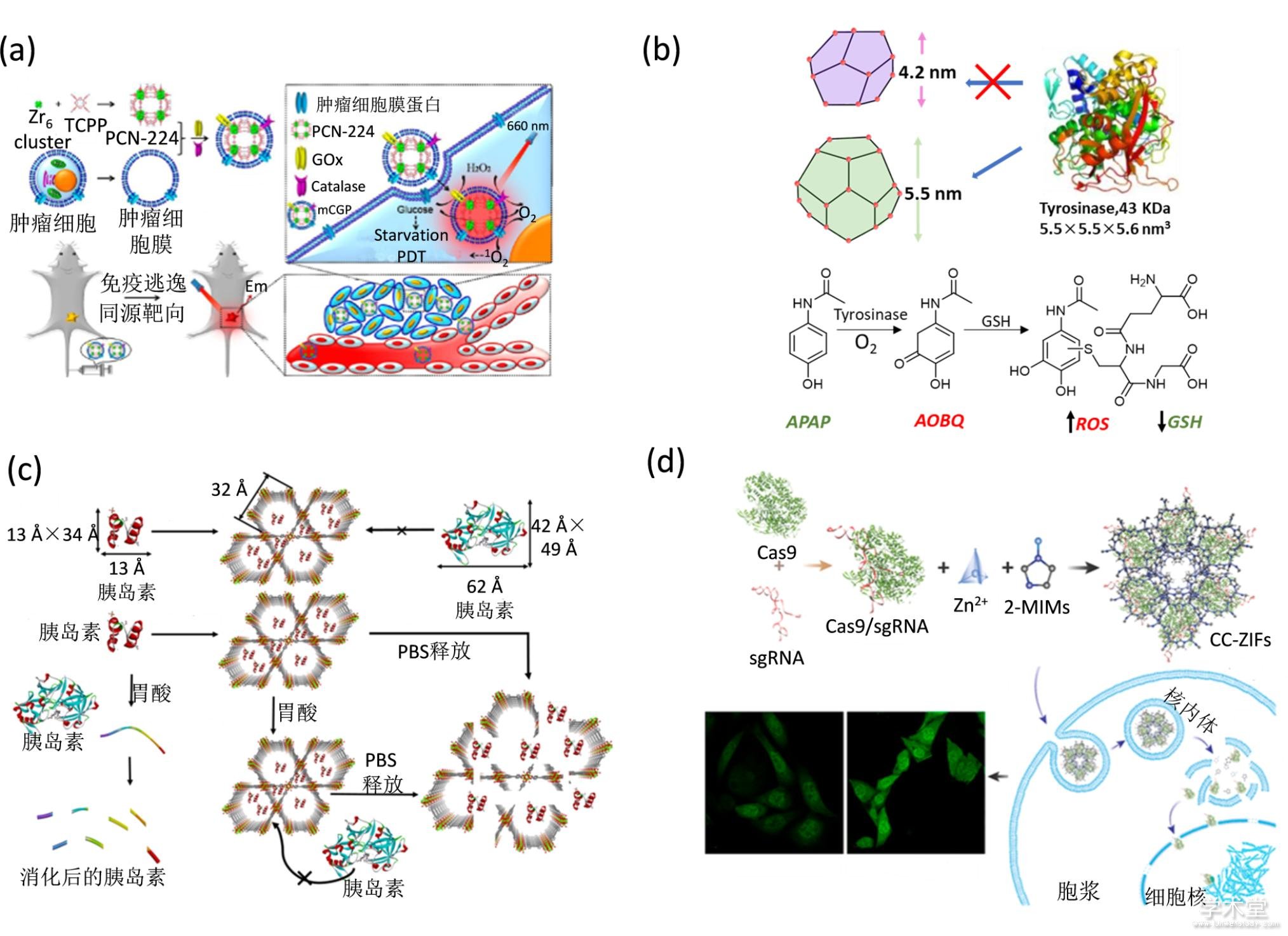
Fig. 8 MOF-protein complex based therapy
(a) 金属有机骨架用于饥饿治疗[111],(b) PCN-333的结构示意图和潜药激活示意图[112],(c) 金属有机骨架包裹胰岛素示意图和胰岛素释放示意图[115],(d) Cas9@ZIF的制备示意图,细胞递送示意图和基因编辑效果[117]
2.4、 联合治疗
以上基于金属有机骨架的纳米药物递送体系尽管取得了一定进展[122],但是在治疗的过程中仍然面临单一治疗效果不够高等问题. 因此,开发高效的联合治疗体系具有非常重要的意义.金属有机骨架具有大的比表面积、可调的尺寸、可控的晶体结构和具有生物活性的配体和金属结点,因此非常适合用于联合治疗平台的构建. 联合治疗体系的构建相比于单一治疗体系需要更加细致的设计,需要考虑到金属有机骨架的靶向运输和降解,以及不同治疗手段的实施.
含有high-Z元素,如Au[4]、Hf[5]、Bi[6] 和稀土元素等[123,124],常用来构建金属有机骨架材料. Liu等人将构建了PDT与放疗联合的金属有机骨架治疗体系. 他们将对放射线敏感的金属离子Hf与光敏剂卟啉类衍生物TCPP组装成纳米级金属有机骨架,并通过表面修饰聚乙二醇得到具有良好生物稳定性的NMOF-PEG[64](图9a). NMOF-PEG具有非常高光敏剂负载量,在光照下,能够高效的产生单线态氧. High-Z元素Hf作为放射线敏感剂,通过吸收离子化辐射来提高放疗效果. 因此,这个金属有机骨架集合光动力学治疗和放疗功能于一身. 通过尾静脉注射,NMOF-PEG可以通过EPR效应高效的富集到肿瘤部位. NMOF-PEG的设计充分利用了金属有机骨架的配体和金属结点的可变性以及表面可修饰性. 通过合理的实施治疗手段,将光动力学治疗和放疗有机结合,达到高效抑制肿瘤生长的效果.
除了放疗,免疫治疗也可与PDT联用提高肿瘤治疗效果. 免疫治疗是近年来发展起来的一种高效的肿瘤治疗手段,其中对于检查点截流免疫治疗的研究最为广泛. 但是由于无效的抗原呈递和不足的抗肿瘤免疫等原因,免疫治疗的单独治疗效果不佳. Lin等人将光敏性金属有机骨架包裹检查点抑制剂(IDOi),构建了IDOi@TBC-Hf[5,10,15,20-tetra(pbenzoato)chlorin (H4TBC)]系统,将检查点截流免疫治疗与光动力学治疗结合了起来[125],充分利用了光敏性金属有机骨架的药物递送功能(图9b). 将IDOi包裹到金属有机骨架的孔道中,IDOi@TBC-Hf可以将IDOi释放到肿瘤环境,IDOi进入血液循环引起系统性IDO抑制. 协同PDT和检查点截流免疫治疗可以促进远位效应,抑制远位肿瘤的生长.
除了光动力治疗,常用的光治疗方法还有光热治疗,也能够进一步提高PDT的治疗效果. 例如,Zhang等人将铁卟啉衍生物作为配体与金属锆配位组装得到Zr-FeP MOF. 在近红外光照下,Zr-FeP MOF同时产生氧基自由基和单线态氧,实现光动力治疗. Zr-FeP MOF还可以负载siRNA用于沉默热休克蛋白,有效的增强光动力学治疗的效果. 此外,在同一个光照条件下,Zr-FeP MOF的光热转换效率为33.7%,实行低温光热治疗. 通过这个金属有机骨架体系,实现了光动力学治疗、光热治疗和基因治疗三种治疗方法协同作用[126].
Lee等人通过原位生长法用金属有机骨架包裹光敏剂graphitic carbon nitride (g-C3N4) nanosheets和孔包裹法装载化疗药物Doxorubicin hydrochloride (DOX),得到光动力学治疗和化疗联合治疗体系[127](图9c). 该体系的构架主要得益于金属有机骨架共沉淀法对被包裹材料的包容性、可控性和金属有机骨架壳层的大孔隙度. 通过类似的构建方法,Yang等人用金属有机骨架包裹光热转换材料聚吡咯纳米颗粒(PPy NPs)和化疗药物五氟尿嘧啶, 实现化疗和光热联合治疗[128](图9d).此外,利用金属卟啉衍生物作为配体组装的金属有机骨架可以负载前药分子(如亚硝基硫醇[129]等). 在近红外光照下,金属有机骨架实现光热治疗的同时,其负载的亚硝基硫醇受热产生一氧化氮气体用于抗肿瘤治疗.
总而言之,联合治疗效果比单一的治疗效果要好很多. 利用金属有机骨架构建联合治疗体系可以大大提高肿瘤治疗效果,有望用于解决转移性肿瘤和其他难以治疗的癌症.
图9金属有机骨架用于联合治疗
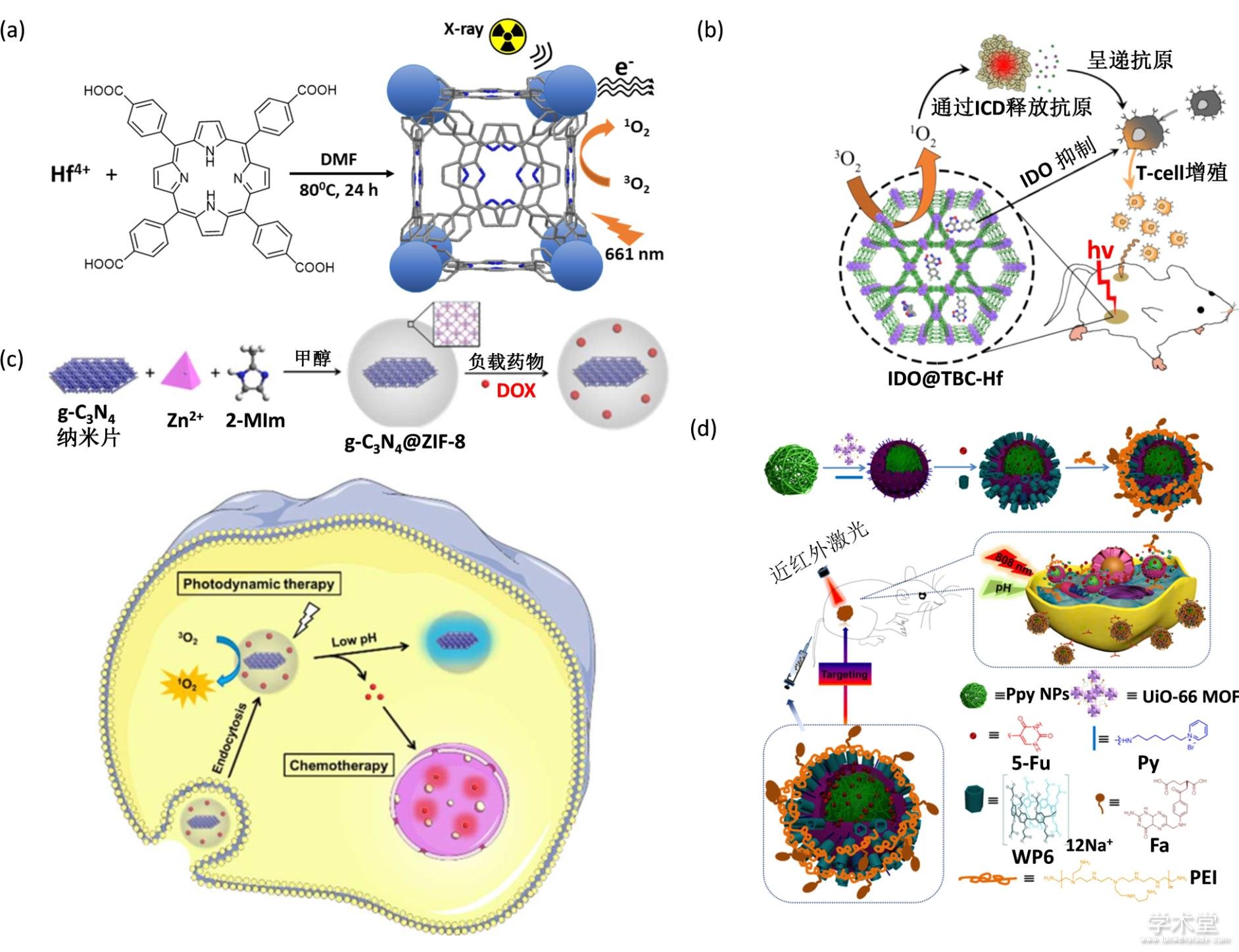
Fig. 9 MOF for combined therapy
(a) PDT和放疗联合治疗[64],(b) PDT和免疫联合治疗[125],(c)化疗和PDT联合治疗[127],(d)化疗和光热联合治疗[128]
3 、总结与展望
综上所述,基于NMOF的肿瘤治疗研究在近十几年来取得了阶段性的成果. 通过非共价浸润法、共价交联等方法能够高效地将小分子药物负载在金属有机骨架上,同时利用孔渗透、原位生长等方法也能够实现MOF-生物大分子药物的高效构建. 值得一提的是,选用具有药物活性的金属中心或有机配体,金属有机骨架本身也能够设计成高效安全的药物. 基于NMOF的药物递送系统在化学治疗、光动力学治疗、放射性治疗和免疫治疗等几种治疗方式上均有涉猎. 通过包裹药物小分子用于化疗或免疫治疗、组装具有光敏性的NMOF用于光动力学治疗、组装具有放射性性质的NMOF用于增强放疗、包裹蛋白用于生物催化等方法构建具有不同功能的NMOF治疗体系,都展现了良好的治疗效果,对金属有机骨架治疗体系的进一步开发和应用有着非常重大的指导意义. 此外,从上述基于金属有机骨架的联合治疗体系,我们不难发现,它非常适用于联合治疗体系的构建,从而避免单一治疗效果不佳和具有毒副作用的缺点.
综合以上研究,我们不难看出,相比于脂质体(liposome)[130,131]、聚合物纳米颗粒(polymer)[132]、介孔硅(MSN)[133]、氧化石墨烯(GO)[134]等药物递送体系,NMOF作为药物递送体系具有一定的特点. 首先,NMOF具有较高的药物运载效率,且适用于包裹蛋白等容易失活的生物大分子. 其次,相比于MSN和GO等无机材料,NMOF具有更好的生物相容性和生物可降解性,能够降低体积代谢负担,避免长期累积带来的毒副作用. 再者,NMOF成分可调,易于构建可控药物释放载体,可以在不进行修饰的情况下实现机体内源性物质(ATP等)激活的药物释放. 然而,NMOF也同时存在一些缺点. 首先,NMOF主要是通过配位作用组装而成,导致其生物环境中的稳定性较差. 例如:ZIF-8或者以Fe、Zr等作为金属结点的金属有机骨架通常在PBS环境中不稳定. 因此,通常需要进行表面修饰或者引入多种其他相互作用力来提高稳定性. 此外,NMOF药物递送体系会将金属离子引入到机体内,可能会带来一定程度的肝脏或者肾损伤. 因此,NMOF在实际应用仍然存在许多需要解决的问题,该领域将来的研究挑战包括:(1)实现药物的靶向递送与可控释放. 目前大多数体系在药物递送过程中会有一定程度的药物泄露,可能会一定程度上导致毒副作用的出现. 通过合理的表面修饰(如核酸适配体、叶酸、透明质酸等主动靶向识别分子),有望降低药物泄露,同时还能赋予纳米粒子主动靶向的能力,是一种潜在的解决方法. (2)开发长波长激活的NMOF光敏剂. 目前绝大部分的光敏性金属有机骨架是基于卟啉类衍生物,其最佳PDT激发波长在630 nm左右,组织穿透深度有限(一般小于0.5 cm),这在很大程度上限制了光敏性金属有机骨架对于深层组织肿瘤的治疗应用. 因此,需要开发波长更长的光敏剂配体来合成新型长波长光敏性金属有机骨架,进一步提高和深化金属有机骨架的肿瘤治疗效果.(3)按需调控金属有机骨架在生物体内的稳定性. 配体与金属之间形成稳定的配位键是MOF结构形成的一个关键作用力,而且配体与配体之间也可以有分子间相互作用力(如氢键). 金属有机骨架在活体的复杂环境中容易分解,这既是其缺点,也是其优点,视具体应用而定,因此根据应用需要调控金属有机骨架在生物体内的稳定性非常重要. (4)提高NMOF-蛋白复合物的稳定性与治疗效率. 虽然可以通过表面修饰来提高稳定性和水溶性,但是可能会影响蛋白与底物的接触或者蛋白的释放. 此外,蛋白酶扩散进入到NMOF孔中的机制仍不明确,了解机制有助于优化酶的载量,并提高其治疗效率.
NMOF具有许多其他多孔纳米材料不具备的优良性质,在肿瘤治疗领域具有重要的应用潜力. 尽管目前还存在许多困难,但是随着对NMOF越来越深入的研究,这些困难会被攻克,从而实现肿瘤的高效、安全、经济的治疗效果.
参考文献
[1] Idikio H A. Human cancer classification: a systems biology- based model integrating morphology, cancer stem cells, proteomics, and genomics. Journal of Cancer, 2011, 2: 107-115.
[2] Heng H H, Stevens J B, Bremer S W, et al. Evolutionary mechanisms and diversity in cancer. Advances in Cancer Research, 2011, 112: 217-253.
[3] Heng H H, Stevens J B, Bremer S W, et al. The evolutionary mechanism of cancer. Journal of Cellular Biochemistry, 2010, 109(6): 1072-1084.
[4] Ulbrich K, Holá K, ?ubr V, et al. Targeted drug delivery with polymers and magnetic nanoparticles: covalent and noncovalent approaches, release control, and clinical studies. Chemical Reviews, 2016, 116(9): 5338-5431.
[5] Kamaly N, Yameen B, Wu J, et al. Degradable controlled-release polymers and polymeric nanoparticles: mechanisms of controlling drug release. Chemical Reviews, 2016, 116(4): 2602-2663.
[6] Zhou L, Qiu T, Lv F, et al. Self-assembled nanomedicines for anticancer and antibacterial applications. Advanced Healthcare Materials, 2018, 7(20): 1800670-1800698.
[7] Giménez-Marqués M, Hidalgo T, Serre C, et al. Nanostructured metal–organic frameworks and their bio-related applications. Coordination Chemistry Reviews, 2016, 307: 342-360.
[8] Horcajada P, Gref R, Baati T, et al. Metal-organic frameworks in biomedicine. Chemical Reviews, 2012, 112(2): 1232-1268.
[9] Chowdhury M A. Metal-organic-frameworks for biomedical applications in drug delivery, and as MRI contrast agents. Journal of Biomedical Materials Research Part A, 2017, 105(4): 1184-1194.
[10] He C, Lu K, Liu D, et al. Nanoscale metal-organic frameworks for the co-delivery of cisplatin and pooled siRNAs to enhance therapeutic efficacy in drug-resistant ovarian cancer cells. Journal of the American Chemical Society, 2014, 136(14): 5181-5184.
[11] Guan Q, Li Y A, Li W Y, et al. Photodynamic therapy based on nanoscale metal-organic frameworks: from material design to cancer nanotherapeutics. Chemistry, an Asian Journal, 2018, 13(21): 3122-3149.
[12] Ma T, Liu Y, Wu Q, et al. Quercetin-modified metal-organic frameworks for dual sensitization of radiotherapy in tumor tissues by inhibiting the carbonic anhydrase IX. ACS nano, 2019, 13(4): 4209-4219.
[13] Lian X, Fang Y, Joseph E, et al. Enzyme-MOF (metal-organic framework) composites. Chemical Society Review, 2017, 46(11): 3386-3401.
[14] Datt A, Ndiege N, Larsen S C. Development of porous nanomaterials for applications in drug delivery and imaging [M]. Nanomaterials for Biomedicine. American Chemical Society. 2012, 1119: 239-258.
[15] Wu M-X, Yang Y-W. Metal–Organic Framework (MOF)-based drug/cargo delivery and cancer therapy. Advanced Materials, 2017, 29(23): 1606134-1606153.
[16] Horcajada P, Serre C, Vallet-Regi M, et al. Metal-organic frameworks as efficient materials for drug delivery. Angewandte Chemie, 2006, 45(36): 5974-5978.
[17] Gao X, Hai X, Baigude H, et al. Fabrication of functional hollow microspheres constructed from MOF shells: Promising drug delivery systems with high loading capacity and targeted transport. Scientific Reports, 2016, 6(1): 37705-37714.
[18] Zhang F M, Dong H, Zhang X, et al. Postsynthetic modification of ZIF-90 for potential targeted codelivery of two anticancer drugs. ACS Applied Materials & Interfaces, 2017, 9(32): 27332-27337.
[19] Fu J, Yu C, Li L, et al. Intracellular delivery of functional proteins and native drugs by cell-penetrating poly(disulfide)s. Journal of the American Chemical Society, 2015, 137(37): 12153-12160.
[20] Bailey J B, Zhang L, Chiong J A, et al. Synthetic modularity of Protein-Metal-Organic Frameworks. Journal of the American Chemical Society, 2017, 139(24): 8160-8166.
[21] Lian X, Erazo-Oliveras A, Pellois J P, et al. High efficiency and long-term intracellular activity of an enzymatic nanofactory based on metal-organic frameworks. Nature Communications, 2017, 8(1): 2075-2084.
[22] Jung S, Kim Y, Kim S J, et al. Bio-functionalization of metal-organic frameworks by covalent protein conjugation. Chemical Communication (Camb), 2011, 47(10): 2904-2906.
[23] Lian X, Chen Y P, Liu T F, et al. Coupling two enzymes into a tandem nanoreactor utilizing a hierarchically structured MOF. Chemical Science, 2016, 7(12): 6969-6973.
[24] Cao Y, Wu Z, Wang T, et al. Immobilization of bacillus subtilis lipase on a Cu-BTC based hierarchically porous metal-organic framework material: a biocatalyst for esterification. Dalton transactions, 2016, 45(16): 6998-7003.
[25] Liu W L, Yang N S, Chen Y T, et al. Lipase-supported metal-organic framework bioreactor catalyzes warfarin synthesis. Chemistry, 2015, 21(1): 115-119.
[26] Patra S, Hidalgo Crespo T, Permyakova A, et al. Design of metal organic framework–enzyme based bioelectrodes as a novel and highly sensitive biosensing platform. Journal of Materials Chemistry B, 2015, 3(46): 8983-8992.
[27] Fracaroli A M, Siman P, Nagib D A, et al. Seven Post-synthetic covalent reactions in tandem leading to enzyme-like complexity within Metal-Organic Framework crystals. Journal of the American Chemical Society, 2016, 138(27): 8352-8355.
[28] Liang W, Ricco R, Maddigan N K, et al. Control of structure topology and spatial distribution of biomacromolecules in protein@ZIF-8 biocomposites. Chemistry of Materials, 2018, 30(3): 1069-1077.
[29] Sontz P A, Bailey J B, Ahn S, et al. A Metal Organic Framework with spherical protein nodes: rational chemical design of 3D protein crystals. Journal of the American Chemical Society, 2015, 137(36): 11598-11601.
[30] Wang Z, Hu S, Yang J, et al. Nanoscale Zr-based MOFs with tailorable size and introduced mesopore for protein delivery. Advanced Functional Materials, 2018, 28(16): 1707356-1707364.
[31] Zhang H, Lv Y, Tan T, et al. Atomistic simulation of protein encapsulation in metal-organic frameworks. The Journal of Physical Chemistry B, 2016, 120(3): 477-484.
[32] Larsen R W, Wojtas L, Perman J, et al. Mimicking heme enzymes in the solid state: metal-organic materials with selectively encapsulated heme. Journal of the American Chemical Society, 2011, 133(27): 10356-10359.
[33] Liu X, Qi W, Wang Y, et al. A facile strategy for enzyme immobilization with highly stable hierarchically porous metal–organic frameworks. Nanoscale, 2017, 9(44): 17561-17570.
[34] Wang S, Chen Y, Wang S, et al. DNA-functionalized metal-organic framework nanoparticles for intracellular delivery of proteins. Journal of the American Chemical Society, 2019, 141(6): 2215-2219.
[35] Lykourinou V, Chen Y, Wang X S, et al. Immobilization of MP-11 into a mesoporous metal-organic framework, MP-11@mesoMOF: a new platform for enzymatic catalysis. Journal of the American Chemical Society, 2011, 133(27): 10382-10385.
[36] Chen Y, Lykourinou V, Vetromile C, et al. How can proteins enter the interior of a MOF? Investigation of cytochrome c translocation into a MOF consisting of mesoporous cages with microporous windows. Journal of the American Chemical Society, 2012, 134(32): 13188-13191.
[37] Feng D, Liu T F, Su J, et al. Stable metal-organic frameworks containing single-molecule traps for enzyme encapsulation. Nature Communications, 2015, 6: 5979-5986.
[38] Lian X, Chen Y-P, Liu T-F, et al. Coupling two enzymes into a tandem nanoreactor utilizing a hierarchically structured MOF. Chemical Science, 2016, 7(12): 6969-6973.
[39] Zhu G, Zhang M, Bu Y, et al. Enzyme-embedded metal-organic framework colloidosomes via an emulsion-based approach. Chemistry, an Asian journal, 2018, 13(19): 2891-2896.
[40] Nadar S S, Rathod V K. Facile synthesis of glucoamylase embedded metal-organic frameworks (glucoamylase-MOF) with enhanced stability. International Journal of Biological Macromolecules, 2017, 95: 511-519.
[41] Salgaonkar M, Nadar S S, Rathod V K. Combi-metal organic framework (Combi-MOF) of alpha-amylase and glucoamylase for one pot starch hydrolysis. International Journal of Biological Macromolecules, 2018, 113: 464-475.
[42] Lyu F, Zhang Y, Zare R N, et al. One-pot synthesis of protein-embedded metal-organic frameworks with enhanced biological activities. Nano Letters, 2014, 14(10): 5761-5765.
[43] Liao F S, Lo W S, Hsu Y S, et al. Shielding against unfolding by embedding enzymes in metal-organic frameworks via a de novo approach. Journal of the American Chemical Society, 2017, 139(19): 6530-6533.
[44] Liang K, Ricco R, Doherty C M, et al. Biomimetic mineralization of metal-organic frameworks as protective coatings for biomacromolecules. Nature Communications, 2015, 6: 7240-7247.
[45] Maddigan N K, Tarzia A, Huang D M, et al. Protein surface functionalisation as a general strategy for facilitating biomimetic mineralisation of ZIF-8. Chemical Science, 2018, 9(18): 4217-4223.
[46] Chen G, Huang S, Kou X, et al. A convenient and versatile amino-acid-boosted biomimetic strategy for the nondestructive encapsulation of biomacromolecules within metal-organic frameworks. Angewandte Chemie, 2019, 58(5): 1463-1467.
[47] Liang W, Xu H, Carraro F, et al. Enhanced activity of enzymes encapsulated in hydrophilic metal-organic frameworks. Journal of the American Chemical Society, 2019, 141(6): 2348-2355.
[48] Imaz I, Rubio-Martinez M, An J, et al. Metal-biomolecule frameworks (MBioFs). Chem Commun (Camb), 2011, 47(26): 7287-7302.
[49] An J, Farha O K, Hupp J T, et al. Metal-adeninate vertices for the construction of an exceptionally porous metal-organic framework. Nature Communications, 2012, 3: 604-609.
[50] An J, Geib S J, Rosi N L. Cation-triggered drug release from a porous zinc?adeninate metal?organic framework. Journal of the American Chemical Society, 2009, 131(24): 8376-8377.
[51] An J, Shade C M, Chengelis-Czegan D A, et al. Zinc-adeninate metal-organic framework for aqueous encapsulation and sensitization of near-infrared and visible emitting lanthanide cations. Journal of the American Chemical Society, 2011, 133(5): 1220-1223.
[52] Zhang L, Lei J, Ma F, et al. A porphyrin photosensitized metal–organic framework for cancer cell apoptosis and caspase responsive theranostics. Chemical Communications, 2015, 51(54): 10831-10834.
[53] Park J, Jiang Q, Feng D, et al. Size-controlled synthesis of porphyrinic metal-organic framework and functionalization for targeted photodynamic therapy. Journal of the American Chemical Society, 2016, 138(10): 3518-3525.
[54] Wang W, Wang L, Li Z, et al. BODIPY-containing nanoscale metal-organic frameworks for photodynamic therapy. Chem Commun (Camb), 2016, 52(31): 5402-5405.
[55] Chen J, Zhang X, Huang C, et al. Osteogenic activity and antibacterial effect of porous titanium modified with metal-organic framework films. Journal of Biomedical Materials Research Part A, 2017, 105(3): 834-846.
[56] Seyedpour S F, Rahimpour A, Najafpour G. Facile in-situ assembly of silver-based MOFs to surface functionalization of TFC membrane: A novel approach toward long-lasting biofouling mitigation. Journal of Membrane Science, 2019, 573: 257-269.
[57] Wu Y, Luo Y, Zhou B, et al. Porous metal-organic framework (MOF) Carrier for incorporation of volatile antimicrobial essential oil. Food Control, 2019, 98: 174-178.
[58] Guo X, Guo B, Wang Y, et al. Preparation of spherical metal-organic frameworks encapsulating ag nanoparticles and study on its antibacterial activity. Materials Science & Engineering C, Materials for Biological Applications, 2017, 80: 698-707.
[59] Lan G, Ni K, Veroneau S S, et al. Nanoscale metal-organic framework hierarchically combines high-Z components for multifarious radio-enhancement. Journal of the American Chemical Society, 2019, 141(17): 6859-6863.
[60] Chen Z -F, Xue H-B, Wu L-R, et al. Bifunctional (3,6)-connected Gd(III) metal–organic framework material with catalytic properties for the cyanosilylation reaction and anti-gastric cancer activity. Journal of Cluster Science, 2018, 29(6): 1269-1274.
[61] Qi X, Tian H, Dang X, et al. A bimetallic Co/Mn metal–organic-framework with a synergistic catalytic effect as peroxidase for the colorimetric detection of H2O2. Analytical Methods, 2019, 11(8): 1111-1124.
[62] Sun L-L, Li Y-H, Shi H. A Ketone Functionalized Gd(III)-MOF with Low Cytotoxicity for Anti-Cancer Drug Delivery and Inhibiting Human Liver Cancer Cells. Journal of Cluster Science, 2018, 30(1): 251-258.
[63] Wan S S, Cheng Q, Zeng X, et al. A Mn(III)-Sealed Metal-Organic Framework Nanosystem for Redox-Unlocked Tumor Theranostics. ACS nano, 2019, 13(6): 6561-6571.
[64] Prencipe G, Tabakman S M, Welsher K, et al. PEG Branched Polymer for Functionalization of Nanomaterials with Ultralong Blood Circulation. Journal of the American Chemical Society, 2009, 131(13): 4783-4787.
[65] Liu J, Yang Y, Zhu W, et al. Nanoscale metal-organic frameworks for combined photodynamic & radiation therapy in cancer treatment. Biomaterials, 2016, 97: 1-9.
[66] Abanades Lazaro I, Haddad S, Sacca S, et al. Selective Surface PEGylation of UiO-66 Nanoparticles for Enhanced Stability, Cell Uptake, and pH-Responsive Drug Delivery. Chem, 2017, 2(4): 561-578.
[67] Chen T T, Yi J T, Zhao Y Y, et al. Biomineralized Metal-Organic Framework Nanoparticles Enable Intracellular Delivery and Endo-Lysosomal Release of Native Active Proteins. Journal of the American Chemical Society. 2018, 140(31): 9912-9920.
[68] Cheng G, Li W, Ha L, et al. Self-Assembly of Extracellular Vesicle-like Metal-Organic Framework Nanoparticles for Protection and Intracellular Delivery of Biofunctional Proteins. Journal of the American Chemical Society, 2018, 140(23): 7282-7291.
[69] Zhang L, Wang Z, Zhang Y, et al. Erythrocyte Membrane Cloaked Metal-Organic Framework Nanoparticle as Biomimetic Nanoreactor for Starvation-Activated Colon Cancer Therapy. ACS nano, 2018, 12(10): 10201-10211.
[70] Wan X, Zhong H, Pan W, et al. Programmed Release of Dihydroartemisinin for Synergistic Cancer Therapy Using a CaCO3 Mineralized Metal-Organic Framework. Angewandte Chemie, 2019, 58(40): 14134-14139.
[71] Azizi Vahed T, Naimi-Jamal M R, Panahi L. Alginate-coated ZIF-8 metal-organic framework as a green and bioactive platform for controlled drug release. Journal of Drug Delivery Science and Technology, 2019, 49: 570-576.
[72] Ren M, Li H, Liu H, et al. A Biocompatible GdIII–Organic Framework Incorporating Polar Pores for pH-Sensitive Anti-Cancer Drug Delivery and Inhibiting Human Bone Tumour Cells. Australian Journal of Chemistry, 2019, 72(3): 233.
[73] Gupta V, Tyagi S, Paul A K. Development of Biocompatible Iron-Carboxylate Metal Organic Frameworks for pH-Responsive Drug Delivery Application. Journal of Nanoscience and Nanotechnology, 2019, 19(2): 646-654.
[74] Zhao L-C, Tang M, Zhang Q-H, et al. Fabrication of a Porous Metal-Organic Framework with Polar Channels for 5-Fu Delivery and Inhibiting Human Osteosarcoma Cells. Journal of Chemistry, 2018, 2018: 1-7.
[75] Cai Y, Sheng Z, Wang J. A Biocompatible Zinc(II)-based Metal-organic Framework for pH Responsive Drug Delivery and Anti-Lung Cancer Activity. Zeitschrift Für Anorganische und Allgemeine Chemie, 2018, 644(16): 877-882.
[76] Du X, Fan R, Qiang L, et al. Controlled Zn2+-Triggered Drug Release by Preferred Coordination of Open Active Sites within Functionalization Indium Metal Organic Frameworks. ACS Applied Materials & Interfaces, 2017, 9(34): 28939-28948.
[77] Luo Z, Jiang L, Yang S, et al. Light-Induced Redox-Responsive Smart Drug Delivery System by Using Selenium-Containing Polymer@MOF Shell/Core Nanocomposite. Advanced Healthcare Materials, 2019, e1900406.
[78] Javanbakht S, Pooresmaeil M, Namazi H. Green one-pot synthesis of carboxymethylcellulose/Zn-based metal-organic framework/graphene oxide bio-nanocomposite as a nanocarrier for drug delivery system. Carbohydrate Polymers, 2019, 208: 294-301.
[79] Xue Z, Zhu M, Dong Y, et al. An integrated targeting drug delivery system based on the hybridization of graphdiyne and MOFs for visualized cancer therapy. Nanoscale, 2019, 11, 11709.
[80] Dong K, Zhang Y, Zhang L, et al. Facile preparation of metal-organic frameworks-based hydrophobic anticancer drug delivery nanoplatform for targeted and enhanced cancer treatment. Talanta, 2019, 194: 703-708.
[81] Zhang W, Guo T, Wang C, et al. MOF Capacitates Cyclodextrin to Mega-Load Mode for High-Efficient Delivery of Valsartan. Pharmaceutical research, 2019, 36(8): 117-129.
[82] Nasihat Sheno N, Farhadi S, Maleki A, et al. A novel approach for the synthesis of phospholipid bilayer-coated zeolitic imidazolate frameworks: preparation and characterization as a pH-responsive drug delivery system. New Journal of Chemistry, 2019, 43(4): 1956-1963.
[83] Chen Z-X, Liu M-D, Zhang M-K, et al. Interfering with Lactate-Fueled Respiration for Enhanced Photodynamic Tumor Therapy by a Porphyrinic MOF Nanoplatform. Advanced Functional Materials, 2018, 28(36): 1803498-1803509.
[84] Gao S, Zheng P, Li Z, et al. Biomimetic O2-Evolving metal-organic framework nanoplatform for highly efficient photodynamic therapy against hypoxic tumor. Biomaterials, 2018, 178: 83-94.
[85] He L, Brasino M, Mao C, et al. DNA-assembled core-satellite upconverting-metal-organic framework nanoparticle superstructures for efficient photodynamic therapy. Small, 2017, 13(24): 1700504-1700510.
[86] Kan J L, Jiang Y, Xue A, et al. Surface Decorated Porphyrinic Nanoscale Metal-Organic Framework for Photodynamic Therapy. Inorganic Chemistry, 2018, 57(9): 5420-5428.
[87] Fan W, Huang P, Chen X. Overcoming the Achilles' heel of photodynamic therapy. Chemical Society Reviews, 2016, 45(23): 6488-6519.
[88] Shen Y, Shuhendler A J, Ye D, et al. Two-photon excitation nanoparticles for photodynamic therapy. Chemical Society Reviews, 2016, 45(24): 6725-6741.
[89] Li Y-A, Zhao X-D, Yin H-P, et al. A drug-loaded nanoscale metal–organic framework with a tumor targeting agent for highly effective hepatoma therapy. Chemical Communications, 2016, 52(98): 14113-14116.
[90] Lismont M, Dreesen L, Wuttke S. Metal-Organic Framework nanoparticles in photodynamic therapy: current Status and perspectives. Advanced Functional Materials, 2017, 27(14): 1606314-1606329.
[91] Min H, Wang J, Qi Y, et al. Biomimetic metal-organic framework nanoparticles for cooperative combination of antiangiogenesis and photodynamic therapy for enhanced efficacy. Advanced Materials, 2019, 31(15): 1808200-1808210.
[92] Park J, Feng D, Yuan S, et al. Photochromic metal-organic frameworks: reversible control of singlet oxygen generation. Angewandte Chemie, 2015, 54(2): 430-435.
[93] Wang D, Wu H, Lim W Q, et al. A mesoporous nanoenzyme derived from metal-organic frameworks with endogenous oxygen generation to alleviate tumor hypoxia for significantly enhanced photodynamic therapy. Advanced Materials, 2019, 1901893-1901901.
[94] Wang H, Chen Y, Wang H, et al. DNAzyme-loaded metal–organic frameworks (MOFs) for self-sufficient gene therapy. Angewandte Chemie International Edition, 2019, 58(22): 7380-7384.
[95] Lu K, He C, Lin W. Nanoscale metal-organic framework for highly effective photodynamic therapy of resistant head and neck cancer. Journal of the American Chemical Society, 2014, 136(48): 16712-16715.
[96] Lu K, He C, Lin W. A chlorin-based nanoscale metal-organic framework for photodynamic therapy of colon cancers. Journal of the American Chemical Society, 2015, 137(24): 7600-7603.
[97] Park J, Jiang Q, Feng D, et al. Controlled generation of singlet oxygen in living cells with tunable ratios of the photochromic switch in metal–organic frameworks. Angewandte Chemie International Edition, 2016, 55(25): 7188-7193.
[98] Ma Y, Li X, Li A, et al. H2S-Activable MOF nanoparticle photosensitizer for effective photodynamic therapy against cancer with controllable singlet-oxygen release. Angewandte Chemie International Edition, 2017, 56(44): 13752-13756.
[99] Zhang W, Lu J, Gao X, et al. Enhanced photodynamic therapy by reduced levels of intracellular glutathione obtained by employing a nano-MOF with CuII as the active center. Angewandte Chemie International Edition, 2018, 57(18): 4891-4896.
[100] Bim Júnior O, Bedran-Russo A, Flor J B S, et al. Encapsulation of collagenase within biomimetically mineralized metal–organic frameworks: designing biocomposites to prevent collagen degradation. New Journal of Chemistry, 2019, 43(2): 1017-1024.
[101] Gkaniatsou E, Sicard C, Ricoux R, et al. Enzyme encapsulation in mesoporous metal-organic frameworks for selective biodegradation of harmful dye molecules. Angewandte Chemie, 2018, 57(49): 16141-16146.
[102] Kato S, Otake K I, Chen H, et al. Zirconium-based metal-organic frameworks for the removal of protein-bound uremic toxin from human serum albumin. Journal of the American Chemical Society, 2019, 141(6): 2568-2576.
[103] Liang Z, Yang Z, Yuan H, et al. A protein@metal-organic framework nanocomposite for pH-triggered anticancer drug delivery. Dalton transactions, 2018, 47(30): 10223-10228.
[104] Luzuriaga M A, Welch R P, Dharmarwardana M, et al. Enhanced stability and controlled delivery of MOF-encapsulated vaccines and their immunogenic response in vivo. ACS Applied Materials & Interfaces, 2019, 11(10): 9740-9746.
[105] Nath I, Chakraborty J, Verpoort F. Metal organic frameworks mimicking natural enzymes: a structural and functional analogy. Chemical Society Reviews, 2016, 45(15): 4127-4170.
[106] Shieh F K, Wang S C, Yen C I, et al. Imparting functionality to biocatalysts via embedding enzymes into nanoporous materials by a de novo approach: size-selective sheltering of catalase in metal-organic framework microcrystals. Journal of the American Chemical Society, 2015, 137(13): 4276-4279.
[107] Xu M, Yuan S, Chen X Y, et al. Two-dimensional metal-organic framework nanosheets as an enzyme inhibitor: modulation of the alpha-chymotrypsin activity. Journal of the American Chemical Society, 2017, 139(24): 8312-8319.
[108] Yu M, You D, Zhuang J, et al. Controlled release of naringin in metal-organic framework-loaded mineralized collagen coating to simultaneously enhance osseointegration and antibacterial activity. ACS Applied Materials & Interfaces, 2017, 9(23): 19698-19705.
[109] Cheng H, Zhu J-Y, Li S-Y, et al. An O2 self-sufficient biomimetic nanoplatform for highly specific and efficient photodynamic therapy. Advanced Functional Materials, 2016, 26(43): 7847-7860.
[110] Liu J, Liu T, Du P, et al. Metal-Organic Framework (MOF) hybrid as a tandem catalyst for enhanced therapy against hypoxic tumor cells. Angewandte Chemie, 2019, 58(23): 7808-7812.
[111] Li S Y, Cheng H, Xie B R, et al. Cancer cell membrane camouflaged cascade bioreactor for cancer targeted starvation and photodynamic therapy. ACS nano, 2017, 11(7): 7006-7018.
[112] Lian X, Huang Y, Zhu Y, et al. Enzyme-MOF nanoreactor activates nontoxic paracetamol for cancer therapy. Angewandte Chemie International Edition, 2018, 57(20): 5725-5730.
[113] Li P, Moon S Y, Guelta M A, et al. Encapsulation of a nerve agent detoxifying enzyme by a mesoporous zirconium metal-organic framework engenders thermal and long-term stability. Journal of the American Chemical Society, 2016, 138(26): 8052-8055.
[114] Li P, Moon S Y, Guelta M A, et al. Nanosizing a metal-organic framework enzyme carrier for accelerating nerve agent hydrolysis. ACS nano, 2016, 10(10): 9174-9182.
[115] Chen Y, Li P, Modica J A, et al. Acid-resistant mesoporous metal-organic framework toward oral insulin delivery: protein encapsulation, protection, and release. Journal of the American Chemical Society, 2018, 140(17): 5678-5681.
[116] Siu K H, Chen W. Riboregulated toehold-gated gRNA for programmable CRISPR-Cas9 function. Nature Chemical Biology, 2019, 15(3): 217-220.
[117] Alsaiari S K, Patil S, Alyami M, et al. Endosomal escape and delivery of CRISPR/Cas9 genome editing machinery enabled by nanoscale zeolitic imidazolate framework. Journal of the American Chemical Society, 2018, 140(1): 143-146.
[118] Yang X, Tang Q, Jiang Y, et al. Nanoscale ATP-responsive zeolitic imidazole framework-90 as a general platform for cytosolic protein delivery and genome editing. Journal of the American Chemical Society, 2019, 141(9): 3782-3786.
[119] Ngamcherdtrakul W, Yantasee W. siRNA therapeutics for breast cancer: recent efforts in targeting metastasis, drug resistance, and immune evasion. Translational Research : the Journal of Laboratory and Clinical Medicine, 2019, 214: 105-120.
[120] Zhu W, Guo J, Agola J O, et al. Metal-organic framework nanoparticle-assisted cryopreservation of red blood cells. Journal of the American Chemical Society, 2019, 141(19): 7789-7796.
[121] Yin C, Ye B, Tan W, Wang H, et al. An allosteric dual-DNAzyme unimolecular probe for colorimetric detection of copper(II). Journal of the American Chemical Society, 2009, 131:14624–14625.
[122] Rojas S, Arenas-Vivo A, Horcajada P. Metal-organic frameworks: A novel platform for combined advanced therapies. Coordination Chemistry Reviews, 2019, 388: 202-226.
[123] Ni K, Lan G, Veroneau S S, et al. Nanoscale metal-organic frameworks for mitochondria-targeted radiotherapy-radiodynamic therapy. Nature Communications, 2018, 9(1): 4321-4333.
[124] Chao Y, Liang C, Yang Y, et al. Highly effective radioisotope cancer therapy with a non-therapeutic isotope delivered and sensitized by nanoscale coordination polymers. ACS nano, 2018, 12(8): 7519-7528.
[125] Lu K, He C, Guo N, et al. Chlorin-based nanoscale metal-organic framework systemically rejects colorectal cancers via synergistic photodynamic therapy and checkpoint blockade immunotherapy. Journal of the American Chemical Society, 2016, 138(38): 12502-12510.
[126] Zhang K, Meng X, Cao Y, et al. Metal-organic framework nanoshuttle for synergistic photodynamic and low-temperature photothermal therapy. Advanced Functional Materials, 2018, 28(42): 1804634-1804643.
[127] Chen R, Zhang J, Wang Y, et al. Graphitic carbon nitride nanosheet@metal–organic framework core–shell nanoparticles for photo-chemo combination therapy. Nanoscale, 2015, 7(41): 17299-17305.
[128] Wu M X, Yan H J, Gao J, et al. Multifunctional supramolecular materials constructed from polypyrrole@UiO-66 nanohybrids and pillararene nanovalves for targeted chemophotothermal therapy. ACS Applied Materials & Interfaces, 2018, 10(40): 34655-34663.
[129] Zhang H, Tian X T, Shang Y, et al. Theranostic Mn-porphyrin metal-organic frameworks for magnetic resonance imaging-guided nitric oxide and photothermal synergistic therapy. ACS Applied Materials & Interfaces, 2018, 10(34): 28390-28398.
[130] Liu X, Situ A, Kang Y, et al. Irinotecan delivery by lipid-coated mesoporous silica nanoparticles shows improved efficacy and safety over liposomes for pancreatic cancer. ACS nano, 2016, 10(2): 2702-2715.
[131] Zhang Y, Chan H F, Leong K W. Advanced materials and processing for drug delivery: the past and the future. Advanced Drug Delivery Reviews, 2013, 65(1): 104-120.
[132] Li F, Zhao X, Wang H, et al. Multiple layer-by-layer lipid-polymer hybrid nanoparticles for improved FOLFIRINOX chemotherapy in pancreatic tumor models. Advanced Functional Materials, 2015, 25(5): 788-798.
[133] Lijue Chen X S, Taowang, Li He, Sarah Shigdar, Wei Duanb and Lingxue Kong. Overcoming acquired drug resistance in colorectal cancer cells by targeted delivery of 5-FU with EGF grafted hollow mesoporous silica nanoparticles. Nanoscale, 2015, 7:14080-14092.
[134] Fan X, Jiao G, Zhao W, et al. Magnetic Fe3O4-graphene composites as targeted drug nanocarriers for pH-activated release. Nanoscale, 2013, 5(3): 1143-1152.