摘 要: 目的 分析测定大鼠脊髓突触体中生理活性物质氨基酸神经递质、ATP、Ca2+等。方法 不连续性Percoll密度梯度离心法从Sprague-Dawley雌性大鼠中提取脊髓突触体。采用高效液相色谱仪检测其中氨基酸神经递质, 紫外分光光度计检测ATP含量、Na+-K+-ATP酶活性、Ca2+-Mg2+-ATP酶活性、总ATP酶活性, 荧光分光光度计检测Ca2+浓度。结果 氨基酸神经递质主要为天冬氨酸、甘氨酸、谷氨酸、γ-氨基丁酸;ATP浓度约414.7461μmol/mg, 总ATP酶活性> Na+-K+-ATP酶活性> Ca2+-Mg2+-ATP酶活性;Ca2+浓度可用吸光度值直接换算。结论 大鼠脊髓突触体中含有多种生理活性物质, 以上方法能准确地进行检测分析, 了解其生理活性。
关键词: 脊髓; 突触体; 氨基酸神经递质; 三磷酸腺苷; 钙离子; 大鼠;
Abstract: Objective To analyze the physiologically active substances, named amino acid neurotransmitters, ATP and Ca2+ in rat spinal synaptosomes.Methods The spinal synaptosome was extracted by discontinuous Percoll density gradient centrifugation from a female Sprague-Dawley rat. The amino acid neurotransmitters were determined with high performance liquid chromatography, ATP content, Na+-K+-ATPase activity, Ca2+-Mg2+-ATPase activity and total ATPase activity with ultraviolet spectrophotometer, and Ca2+ concentration with fluorescence spectrophotometer.Results The amino acid neurotransmitters contained mainly aspartic acid, glycine, glutamic acid and r-aminobutyric acid. The concentration of ATP was about 414.7461 μmol/mg, total ATPase activity > Na+-K+-ATPase activity >Ca2+-Mg2+-ATPasese activity. The concentration of Ca2+ could be calculated from absorbancy directly.Conclusion The rat spinal synaptosome contains a variety of physiologically active substances, which can be accurately analyzed to explore their activities.
Keyword: spinal cord; synaptosomes; amino acid neurotransmitters; adenosine triphosphate; calcium ion; rats;
突触是神经元相互接触的部位, 是神经元之间在功能上发生联系的部位, 也是信息传递的关键部位。突触体最早由Whittaker等命名[1], 是指具有突触区完整形态结构的封闭颗粒[2], 某种意义上可被认为是具有功能完整的活细胞[3], 但与细胞又有很大区别。
中枢神经系统典型突触前神经末梢具有100~200个神经递质填充的突触小泡, 在动作电位刺激下以Ca2+依赖性方式将其内容物释放到突触间隙中[4]。本研究对大鼠脊髓突触体中生理活性物质进行分析测定, 为探究相关疾病的机制提供方法学基础。
1 材料和方法
1.1 实验动物
雌性Sprague-Dawley大鼠, 标准体质量, 由兰州大学医学院实验动物中心提供。实验动物生产许可证号SCXY (甘) 2009-0004, 使用许可证号SYXK (甘) 2009-0005。
1.2 主要仪器与设备
1260高效液相色谱仪、ZORBAX Eclipse-AAA色谱柱 (4.6×150 mm, 5μm) :美国AGILENT TECHNOL-OGIES公司。BP1215分析天平:德国SARTORIUS公司。Heal Force NW超纯水机系统:上海力新仪器有限公司。3K15、3-30k离心机:北京五洲东方科技发展有限公司。U-3900H紫外分光光度计、U-3900H荧光分光光度计:日本日立公司。
1.3 主要试剂及其配制
Percoll分层液:美国GE HEALTHCARE公司。γ-氨基丁酸 (γ-aminobutyric acid, GABA) 、天冬酰胺、谷氨酸、天冬氨酸、甘氨酸、10×PBS (NaCl 40.0 g、KCl 1.0 g、KH2PO41.0 g、Na2HPO4?12H2O 10.4 g) 、TritonX-100、乙二醇-双- (2-氨基乙基) 四乙酸EGTA:北京索莱宝科技有限公司, 纯度≥99%。OPA衍生剂、硼酸盐缓冲液:美国AGILENT TECHNOLOGIES公司。甲醇、乙腈 (色谱纯) :天津市光复科技发展有限公司。Na2HPO4?10H2O (优级纯) 、蔗糖缓冲液 (0.32mol/L蔗糖、1 mmol/L EDTA、5 mmol/L Tris, pH=7.4) 、人工脑脊液:上海源叶生物科技有限公司。戊二醛:上海生工生物有限公司。超微量ATP酶测试盒 (Na+-K+、Ca2+-Mg2+、总ATP酶) 、ATP测试盒:南京建成生物工程研究所。Ca2+荧光探针Fluo-3AM (5mM) :上海碧云天生物技术有限公司。
流动相A:Na2HPO4?10H2O 14.32 g加水1 L, 盐酸调p H=7.8。流动相B:乙腈∶甲醇∶水=45∶45∶10 (体积比) 。
氨基酸标准品配制:分析天平准确量取一定质量氨基酸标准品, 溶于超纯水中配制1 nmol/L氨基酸标准品溶液, 4℃保存, 使用时稀释至不同浓度。
1.4 样品提取
雌性Sprague-Dawley大鼠断头处死, 冰袋上迅速取出颈髓至腰髓全部脊髓组织, 4℃蔗糖缓冲液中洗涤2~3次, 尽可能剥除脊髓膜;用预冷的滤纸吸干表面水分, 称重后放入预冷的玻璃匀浆管中, 按质量体积比1∶10加入蔗糖缓冲液, 匀浆6~10次。匀浆液3600 r/min 4℃离心10 min, 取上清液;上清液2 ml平铺于3%Percoll蔗糖梯度层, 20, 000 r/min 4℃离心5 min, 取第三、四层分界处悬液。悬液1∶5 (体积比) 加入蔗糖缓冲液稀释, 置10 ml离心管中, 15, 000r/min离心20 min, 沉淀即为脊髓突触体。置预先持续通以O2、CO2 (体积比95∶5) 30 min, 并在5%CO2细胞培养箱37℃预培养30 min的适量人工脑脊液中, 混匀。
1.5 氨基酸神经递质测定
人工脑脊液中脊髓突触体分成3份, 置24孔板的3个孔中, 5%CO2细胞培养箱中37℃培养15 min。
第1份加适量人工脑脊液后, 超声细胞破碎仪破碎 (超声破碎组) , 工作参数:50 W, 工作5 s, 暂停10 s, 共15次。破碎时试管应完全浸入冰水浴, 防止高温造成突触体碳化。破碎后, 12, 000 r/min 4℃离心20 min, 取上清液-70℃保存。
第2份加等体积终浓度50 mmol/ml KCl溶液 (KCl刺激组) , 继续反应30 min, 迅速置于冰水浴中, 12, 000 r/min 4℃离心20 min, 取上清液于-70℃保存。
第3份加入等体积人工脑脊液, 其余处理同第2份 (正常温育组) 。
高效液相色谱仪测定3份上清液中谷氨酸、甘氨酸、天冬氨酸、GABA的含量。上样前平衡色谱柱, 待柱温箱温度适宜, 色谱波稳定后上样。
1.6 ATP和ATP酶测定
脊髓突触体混悬液15, 000 r/min离心10 min, 取下层沉淀, 加入热双蒸水500μl, 100℃热水浴破碎;悬液于沸水浴中加热10 min, 混匀抽提1 min。所得样本用于ATP含量测定。
取适量脊髓突触体混悬液离心后取下层沉淀, 加生理盐水500μl混匀, 超声细胞破碎仪破碎。所得样本用于ATP酶活性测定。
紫外分光光度计, 测定波长636 nm, 光径1 cm, 双蒸水调零。

1.7 Ca2+测定
用人工脑脊液 (纯氧负载1 h) 将混匀的脊髓突触体平均分成2份, 置24孔板2个孔中, 5%CO2细胞培养箱37℃培养15 min。一份加终浓度50 mmol/L KCl (KCl处理组) , 另一份加等量生理盐水 (生理盐水组) , 然后两份各加入等量0.25 mmol/L Fluo-3AM, 使终浓度为0.5μmol/L, 继续于细胞培养箱中避光温育30min。荧光探针装载, 15, 000 r/min离心10 min, 共2次。去上清液, 加等量人工脑脊液重悬。荧光分光光度计检测, 激发波长506 nm, 发射波长525 nm, 测定吸光度值F;加入4%TritonX-100, 使终浓度为0.1%, 避光混匀10 min, 测定最大吸光度值Fmax;加入EGTA使终浓度为5 mmol/L, 避光混匀10 min, 测定最小吸光度值Fmin。计算细胞内Ca2+浓度 ([Ca2+]i) [5]:
图1 混合氨基酸标准品的色谱图
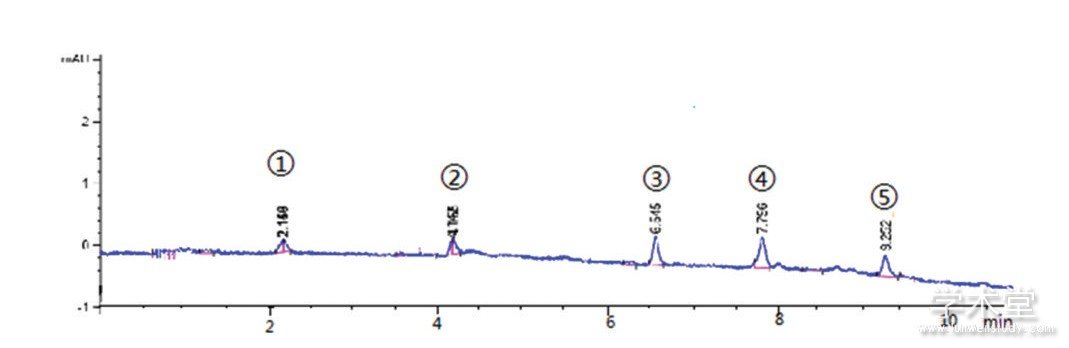
注: (1) 天冬氨酸; (2) 谷氨酸; (3) 天冬酰胺; (4) 甘氨酸; (5) GABA。
1.8 统计学分析
采用SPSS 23.0软件进行数据分析。数据以表示, 多组间比较采用方差分析。标准品浓度梯度采用线性回归分析, 建立标准曲线。
2 结果
2.1 氨基酸神经递质
各氨基酸标准品溶液稀释至10 pmol/ml, 高效液相色谱仪色谱图见图1。
大鼠脊髓突触体悬液用高效液相色谱仪检测, 结果见图2。在8.7 min左右分离出一个色谱峰 (5) , 排除相近氨基酸后, 无对应标准品对照, 无法进行检测。
根据样本所得峰面积计算样本氨基酸浓度, 再根据样本的蛋白浓度 (1.873 g/ml) 转化为pmol/mg蛋白质。与正常温育组相比, KCl刺激组天冬氨酸、谷氨酸、天冬酰胺、甘氨酸、GABA增加 (P<0.05) 。超声破碎组由于含量低于氨基酸标样范围 (4.5~450 pmol/ml) , 数据未参与统计学分析。见表1。
样本试样后, 估计氨基酸递质浓度, 配制10pmol/ml、15 pmol/ml、20 pmol/ml、25 pmol/ml、50pmol/ml氨基酸标准品, 得到不同浓度氨基酸标准品对应峰面积, 建立线性公式。见表2。
图2 样品的色谱图
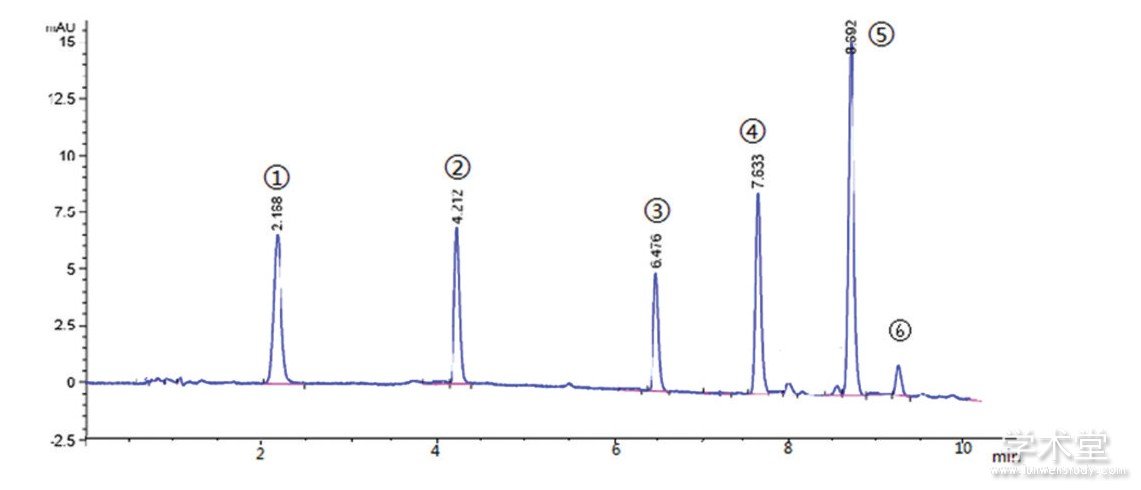
注: (1) 天冬氨酸; (2) 谷氨酸; (3) 天冬酰胺; (4) 甘氨酸; (5) 未知物质; (6) GABA
表1 各组氨基酸含量 (pmol/mg)
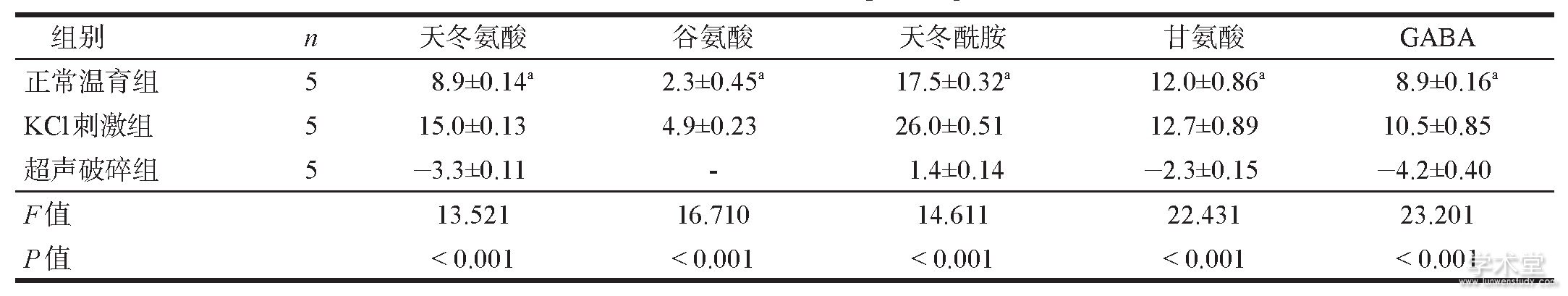
注:与KCl刺激组比较, P<0.05
表2 各氨基酸浓度线性公式及检验

2.2 ATP酶活性和ATP含量
ATP酶活性测定样本蛋白浓度为1.099 g/L, ATP含量测定样本蛋白浓度为1.648 g/L, 标准品线性公式为Y=0.9407x+0.0938 (R2=0.99) 。ATP酶活性测定和结果见表3。Na+-K+-ATP酶活性高于Ca2+-Mg2+-ATP酶活性。
ATP含量 (414.7461±3.8562) μmol/mg (n=3) 。
表3 ATP酶活性结果
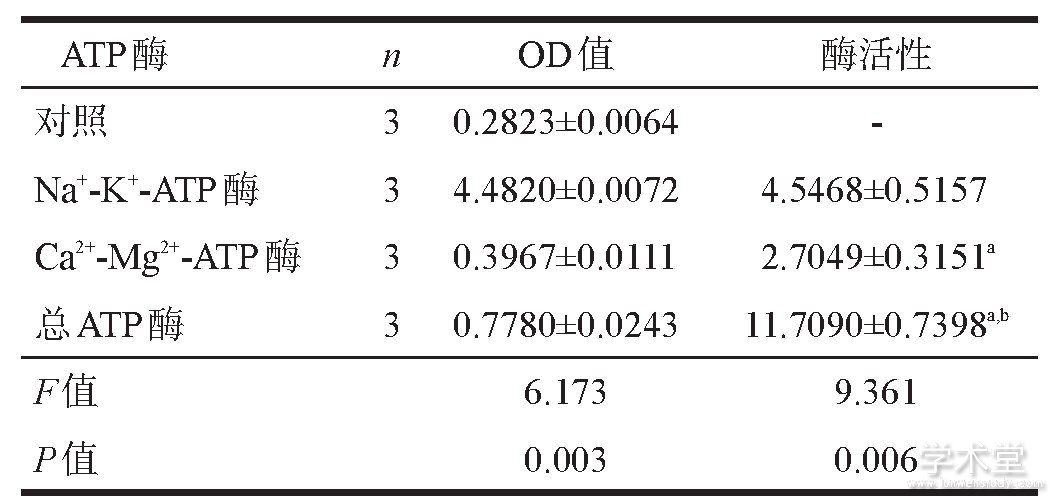
注:a.与Na+-K+-ATP酶活性比较, P<0.01;b.与Ca2+-Mg2+-ATP酶活性比较, P<0.01
2.3[Ca2+]i测定
荧光分光光度计检测荧光光谱见图3。样本蛋白浓度为1.20 g/ml。各组Ca2+浓度见表4。
图3 样品荧光光谱
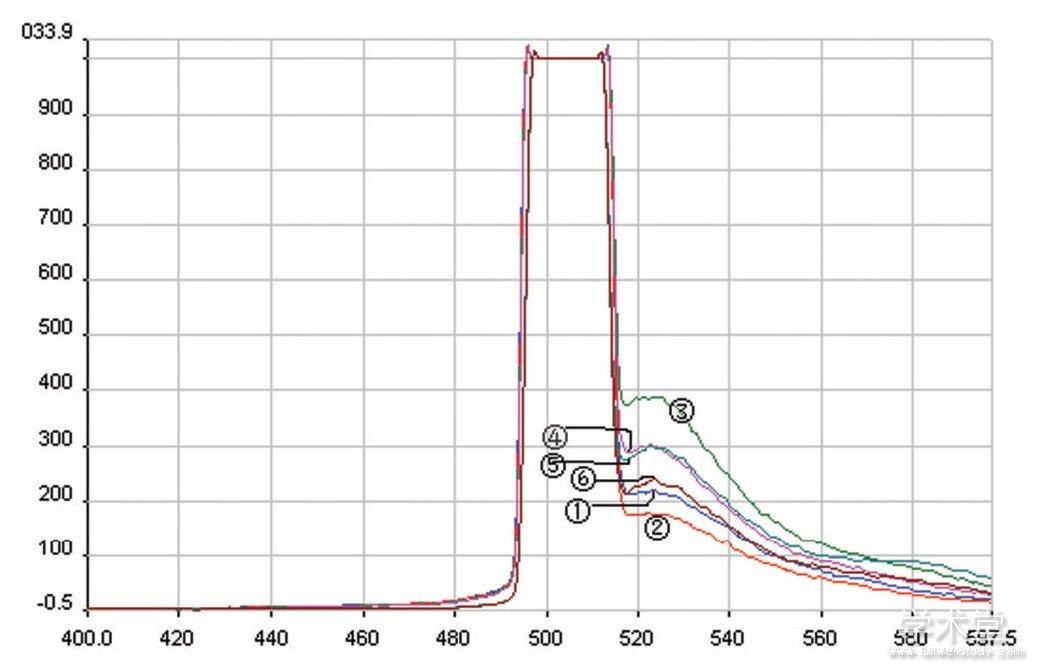
注: (1) 生理盐水组Fmin; (2) KCl处理组Fmin; (3) 生理盐水组Fmax; (4) KCl处理组Fmax; (5) 生理盐水组F; (6) KCl处理组F
表4 各组[Ca2+]i测量结果
![表4 各组[Ca2+]i测量结果](http://www.xueshut.com/uploads/allimg/190202/36-1Z202161S44T.jpg)
3 讨论
本研究在大鼠脊髓突触体中氨基酸神经递质测定中, 发现在8.7 min左右分离出一个色谱峰, 该峰较高, 峰面积大, 但由于没有标准品对照 (已排除相近氨基酸) , 未进行检测。根据OPA衍生试剂衍生氨基酸的原理, 推测这是一种含有氨基端的物质。
ATP作为生命活动能量的直接来源, 可以为突触体释放或传递氨基酸递质等短暂生理活动, 以及维持完整的膜结构提供能量。组织有炎症、损伤时, 损伤周围会释放大量ATP[6,7], 脊髓组织同样存在这一现象[8,9]。刘磊等[10]证实, 脊髓缺血再灌注损伤时, ATP酶活性下降;陆新颖等[11]发现, 脊髓运动神经元Na+-K+-ATP酶活性会在骨骼肌损伤后现迅速下降, 后逐渐恢复。Na+-K+-ATP酶主要负责神经系统Na+和K+的主动转运, 以及神经元兴奋性所需电化学梯度的维持和重建[12]。此外, Na+-K+-ATP酶还可能在神经元和突触可塑性中起重要作用, 酶活性降低与许多行为异常有关, 包括运动改变[13]。
突触前膜对神经递质的释放有Ca2+依赖性量子式囊泡释放和Ca2+非依赖非囊泡释放[14]。生理条件下, 哺乳动物中枢神经系统重要氨基酸递质谷氨酸和GA-BA主要依靠Ca2+依赖性释放[15];神经系统受损时, 神经元缺血缺氧, ATP缺乏, 细胞外K+浓度升高, 兴奋性氨基酸递质释放增加, 引起相应受体门控离子通道开放, Ca2+内流入细胞, 细胞内Ca2+大量增加, 造成迟发性神经元损害[16]。Ca2+超载是神经系统缺血时神经元死亡的主要原因[17]。
突触体相关实验有助于鉴定神经递质, 典型的方法包括检测放射性标记的神经递质诱发释放, 包括GABA、谷氨酸、乙酰胆碱等;或通过高效液相色谱检测内源性释放。后来通过荧光酶联免疫法实时检测内源性胞吐作用, 并通过荧光苯乙烯基染料的摄取实时检测突触囊泡内吞作用[18]。随着用于操纵离子通道和受体的药理学工具出现, 关于突触体的大量实验有助于确定调节神经传递的主要调节信号传导途径。
突触在许多神经障碍的发病机制和病理学中起着重要作用。近年来, 敲除或敲入基因小鼠制备的突触体已被用于支持突触蛋白作用的研究[19,20]。突触体和突触小泡制剂也经过蛋白质组学和磷酸化蛋白质组学分析[21]。蛋白质组学研究编制了神经元特异性蛋白质在突触中的运作, 强调这些蛋白质经历大量翻译后修饰, 以响应突触活动而发生变化[22]。
本研究建立了脊髓突触体内物质的检测方法, 可用来研究相关致病因素与脊髓疾病的关系。脊髓突触体模型可以研究脊髓神经元变性的机制, 从而找到临床干预点, 探讨更加合理的治疗方式。利用药物作用于脊髓突触体, 可探讨药物对脊髓突触体的作用, 对于验证临床用药的合理性以及开发新药都有重大意义。
参考文献:
[1] Whittaker VP, Michaelson IA, Kirkl RJ.The separation of synaptic vesicles from nerve-ending particles ("synaptosomes") [J].Biochem J, 1964, 90 (2) :293-303.
[2]周荣易, 王娇娇, 韩新民.突触体制备方法研究[J].中风与神经疾病杂志, 2016, 33 (3) :280-282.
[3] Whittaker VP.Structure and Function of Synapses[M].New York:Publishers New York, 1972:87-88.
[4]Sudhof TC.Neurotransmitter release:the last millisecond in the life of a synaptic vesicle[J].Neuron, 2013, 80 (3) :675-690.
[5]张四洋, 周末, 高建, 等.Ca~ (2+) 荧光蛋白探针Cameleon和荧光染料探针fluo-3测定H_2O_2刺激的A549细胞中Ca~ (2+) 浓度变化[J].现代肿瘤医学, 2014, 22 (7) :1497-1501.
[6]Nieber K, Eschke D, Brand A.Brain hypoxia:effects of ATPand adenosine[J].Prog Brain Res, 1999, 120:287-297.
[7] Lazarowski ER, Boucher RC, Harden TK.Constitutive release of ATP and evidence for major contribution of ecto-nucleotide pyrophosphatase and nucleoside diphosphokinase to extracellular nucleotide concentrations[J].J Biol Chem, 2000, 275 (40) :31061-31068.
[8] Keane RW, Davis AR, Dietrich WD.Inflammatory and apoptotic signaling after spinal cord injury[J].J Neurotrauma, 2006, 23 (3-4) :335-344.
[9]Danton GH, Dietrich WD.Inflammatory mechanisms after ischemia and stroke[J].J Neuropathol Exp Neurol, 2003, 62 (2) :127-136.
[10]刘磊, 孟春阳, 李鹏, 等.锌对脊髓缺血再灌注损伤大鼠ATP酶、MAO活性和T-AOC含量影响的研究[J].中国实验诊断学, 2015, 19 (1) :10-13.
[11]陆新颖, 王全震, 王发斌, 等.细胞外ATP对失神经支配后骨骼肌和脊髓前角运动神经元ATPase活性的影响[J].中华手外科杂志, 2006, 22 (2) :120-123.
[12]Souza LC, Wilhelm EA, Bortolatto CF, et al.The protective role of melatonin against brain in oxidative stress and hyperlocomotion in a rat model of mania induced by ouabain[J].Behav Brain Res, 2014, 271:316-324.
[13] Baldissera MD, Souza CF, Santos RCV, et al.Pseudomonas aeruginosa strain PAO1 infection impairs locomotor activity in experimentally infected Rhamdia quelen:interplay between a stress response and brain neurotransmitters[J].Aquaculture, 2017, 473:74-79.
[14]Marchi M, Zappettini S, Olivero G, et al.Chronic nicotine exposure selectively activates a carrier-mediated release of endogenousglutamate and aspartate from rat hippocampal synaptosomes[J].Neurochem Int, 2012, 60 (6) :622-630.
[15]王璨, 宋奇繁, 于海洋, 等.锰对小鼠脑基底核突触体谷氨酸和γ-氨基丁酸释放的影响[J].环境与健康杂志, 2015, 32 (6) :513-516.
[16]徐蜀远, 蒋青松, 周岐新, 等.Nifedipine对缺血突触体游离钙和氨基酸释放的影响[J].重庆医科大学学报, 2002, 27 (4) :427-429.
[17]Li H, Xie Y, Zhang N, et al.Disruption of IP3R2-mediated Ca~ (2+) signaling pathway in astrocytes ameliorates neuronal death and brain damage while reducing behavioral deficits after focal ischemic stroke[J].Cell Calcium, 2015, 58 (6) :565-576.
[18]Marks B, McMahon HT.Calcium triggers calcineurin-dependent synaptic vesicle recycling in mammalian nerve terminals[J].Curr Biol, 1998, 8 (13) :740-749.
[19] Sumioka A, Brown TE, Kato AS, et al.PDZ binding of TARPγ-8 controls synaptic transmission but not synaptic plasticity[J].Nat Neurosci, 2011, 14 (11) :1410-1412.
[20]Lonart G, Simsek-Duran F.Deletion of synapsins I and IIgenes alters the size of vesicular pools and rabphilin phosphorylation[J].Brain Res, 2006, 1107 (1) :42-51.
[21] Collins MO, Yu L, Coba MP, et al.Proteomic analysis of in vivo phosphorylated synaptic proteins[J].J Biol Chem, 2005, 280 (7) :5972-5982.
[22] Evans GJ.The synaptosome as a model system for studying synaptic physiology[J].Cold Spring Harb Protoc, 2015, 2015 (5) :421-424.