摘 要: 背景:生长激素释放肽具有促进生长激素分泌、调节机体能量代谢平衡及一些尚在探索的药理学特性,这些都与机体代谢状态密切相关。目的:就生长激素释放肽对于骨骼细胞功能的调节及其在骨代谢和能量代谢中的整合作用做一综述,以期阐明生长激素释放肽在骨骼发育过程中发挥的重要作用。方法:检索Pub Med数据库1993年1月至2017年1月相关文献,检索词为“ghrelin,Bone metabolism,leptin,osteoblast,osteoclast,castric resection,cartilage cells”。排除重复研究及与综述内容关系不密切的文献,对最终纳入的74篇文献进行分析。结果与结论:机体骨骼系统的重塑是一个高度耗能的过程,与之相应的是,骨骼的生长发育涉及到外周和中枢的能量代谢,包括交感神经系统和瘦素等激素的作用。国外研究表明,生长激素释放肽能够调节成骨细胞的分化和功能,诱导骨髓干细胞的增殖及分化,通过不同的方式调节生长激素-胰岛素轴的状态,并能够通过与瘦素相作用来调配骨骼代谢与机体能量代谢从而影响骨骼的生长状态。
关键词: 生长激素释放肽; 骨代谢; 生长激素; 瘦素; 成骨细胞; 破骨细胞; 软骨细胞;
Abstract: BACKGROUND: Growth hormone-releasing peptide(Ghrelin) can promote the secretion of growth hormones, regulate the balance of energy metabolism and have some unknown pharmacological properties, which are closely related to the body's metabolic state. OBJECTIVE: To review the regulatory effect of Ghrelin on skeletal cell function and its integration in bone metabolism and energy metabolism, in order to clarify the important role of Ghrelin in skeletal development. METHODS: PubMed database was searched for relevant literature published from January 1993 to January 2017. Search words were “ghrelin, bone metabolism, leptin, osteoblast, osteoclast, castric resection, cartilage cells.” After removal of repetitive studies and inconsistent literature, 74 eligible articles were included in final analysis. RESULTS AND CONCLUSION: The remodeling of the body's skeletal system is a highly energy-consuming process. Correspondingly, the growth and development of the skeleton involves the energy metabolism of peripheral and central nervous systems, including the sympathetic nervous system and hormones such as leptin. Recent studies abroad have shown that Ghrelin can regulate the differentiation and function of osteoblasts, induce the proliferation and differentiation of bone marrow stem cells, and regulate the state of Ghrelin-insulin axis in different ways. Ghrelin can also regulate bone metabolism and energy metabolism through interaction with leptin, thus affecting the skeletal growth.
Keyword: growth hormone-releasing peptide; bone metabolism; growth hormone; leptin; osteoblasts; osteoclasts; chondrocytes;

文章快速阅读:
文章描述—
(1)在骨骼发育过程中生长激素释放肽具有重要作用;
(2)生长激素释放肽可能也会与其他的神经肽类,如PYY,NPY等物质来调节和调控骨骼代谢。

文题释义:
生长激素释放肽(Ghrelin):也被称为饥饿素及内源性脑肠肽,20世纪80年代人们通过从大鼠胃组织中分离提取出一种多肽类激素,发现其具有促进生长激素分泌而被命名为生长激素释放肽。
骨代谢:骨的功能是为肌肉收缩提供附着处及保护内脏等重要的生命器官。一般认为骨在细胞水平上是不活跃的,事实上骨的细胞在不停地进行着细胞代谢,不仅骨的细胞之间会相互作用,还存在骨髓中的红细胞生成细胞、基质细胞相互作用,以进行骨的改建和重建。
0、引言Introduction
生长激素释放肽(Ghrelin),也被称为饥饿素及内源性脑肠肽,20世纪80年代人们通过从大鼠胃组织中分离提取出一种多肽类激素,发现其具有促进生长激素分泌而被命名为生长激素释放肽[1]。此外,生长激素释放肽还有调节机体能量代谢平衡及一些尚在探索的药理学特性,这些都与机体代谢状态密切相关。骨是体内的多功能器官,贮存机体大量的钙盐和磷酸盐。骨通过对肌肉的驱使而使机体产生运动行为,同时还起到保护大脑和内脏器官的屏障作用,又是造血干细胞和间叶组织干细胞贮存的场所。骨还是一个代谢很活跃的组织。其能够根据周围环境变化来不断调节重塑来适应环境的需要[2,3]。比如,在一个完整的骨骼重塑周期中,包括骨的去除和重吸收、重塑,这就要涉及到两个密切相关的过程:破骨细胞破坏骨质和成骨细胞重塑骨质。文章就生长激素释放肽对于骨骼细胞功能的调节及其在骨代谢和能量代谢中的整合作用做一综述,以期阐明生长激素释放肽在骨骼发育过程中发挥的重要作用。
1 、资料和方法Data and methods
1.1 、资料来源
检索PubMed数据库1993年1月至2017年1月相关文献,检索词为“ghrelin,Bone metabolism,leptin,osteoblast,osteoclast,castric resection,cartilage cells”。
1.2 、入选标准
1.2.1、 纳入标准
(1)与骨的代谢平衡相关的文献;(2)骨代谢与肠道的相互作用有关的文献;(3)促生长激素分泌素与骨代谢关系的相关文献;(4)生长激素释放肽与骨密度相关性分析的文献;(5)生长激素释放肽与瘦素相互作用的有关文献;(6)生长激素释放肽对骨细胞影响的相关文献。
1.2.2 、排除标准
重复研究及与此次综述内容关系不密切的文献。
将检索词组合后检索得到306篇相关文献,通过阅读文题及摘要筛选后,最终入选文献74篇。文献检索流程图见图1。
2 、结果Results
2.1 、骨的代谢平衡
在机体的生命周期中,骨的状态会随着年龄呈现出一种动态的变化。在青壮年时期成骨过程占优势,而在中年以后破骨过程即骨的吸收占优势。人们所熟悉的骨质疏松症,就是因为骨质被大量破坏吸收所致。研究证实,雌激素水平对于骨质的保持相当重要,而骨质疏松症尤其高发于绝经后的女性,究其原因主要是因为女性在绝经后期体内雌激素水平骤降,导致骨的微构架结构的破坏,使骨变脆增加骨折的风险[4]。国外文献报道称,对于白种人而言,50岁以后是骨折的高发期。而目前对于骨折的预防主要是双膦酸盐和雌激素的替代治疗,以及近期兴起的甲状旁腺激素替代治疗,这是一种新型的代谢治疗方法[5]。
图1 文献检索流程图
2.2、骨代谢与肠道的相互作用及对胃切除术后肠道的影响
机体骨骼系统的完整性依赖于多种器官的相互协调。由于胃肠消化道中存在多种对机体健康所必须的矿物质,如维生素D、K等营养物质,所以胃肠道对于骨代谢及维持骨骼系统的完整性发挥重要作用。研究表明,骨代谢的物质都源于胃肠道的代谢吸收。毫无疑问,胃肠道功能的紊乱或者恶性疾病的进程会导致机体的骨密度降低;肠道及腹部的疾病会引起机体的炎症,引起细胞激酶分泌增多,从而对骨密度产生重大影响,并且这种影响会对胃肠道激素的再利用产生影响[6]。此外,肥胖患者实施腹部肠切除手术,以及胃部疾病患者接受胃大部切除术后都对于骨代谢有着很大的影响,而这种影响与胃酸分泌减少或者进食量减低关系不大[7]。
肠道是内分泌激素和神经源性内分泌激素的主要作用场所。肠道与很多效应器官都有着密切的关系,例如下丘脑就与生长代谢调节有关[8]。因此,人们很容易认为胃大部切除术所导致的骨质减低的主要原因,是通过减少了胃内激素的分泌导致的,而这些激素对于骨代谢来说是十分重要的。在这些发挥重要作用的激素中,胃泌素能够直接从胃底的肠嗜铬细胞分泌肠钙素来增强肠道对于钙类物质的吸收。LARSSON等[9]研究认为,胃底提取物包括肠嗜铬细胞,能够激发包括人、鼠、鼠破骨细胞在内的细胞内钙分泌,使其含量增加。而上述的这种效应会被预孵外肽的提取物所破坏。这也说明胃钙素就其本质而言是类肽类激素。早期的研究认为,胃肠道的肽类激素——生长激素释放肽是一类能够偶联与钙相关的G蛋白耦联受体,并且应该能够激发成骨细胞内钙含量的这样一种激素[10]。然而,当时人们发现生长激素释放肽并不会促进成骨细胞内钙的流动,它的作用发挥并不依赖于胃泌素[11]。当前,更进一步的研究认为:生长激素释放肽能够刺激成骨细胞外信号调节通路,而这条通路是由钙释放磷酸酶C驱动通路所激活,这样就表明了生长激素释放肽的确能够增加细胞内的钙含量[12]。一项给予大鼠长期应用奥美拉唑的研究发现,在灌胃给予大鼠1个月奥美拉唑后,大鼠的骨密度显着下降,同时伴有胃出血。但过程中,研究人员发现,在这过程中合成了一种趋钙因子,当时人们假定为生长激素释放肽,理由是在应用奥美拉唑后,A样细胞的数量并不会减少,且生长激素释放肽的水平也不会发生明显改变[13]。PERSSON等[14]认为这种前后相矛盾的现象说明,大鼠在短时间的服用奥美拉唑后,并不会引起骨密度减低。而对于奥美拉唑会使骨密度减低的具体机制仍然不是很清楚。在人类质子泵抑制剂的使用与骨质疏松之间的关系有待进一步探索[15]。
LEHTO-AXTELIUS等[16]的研究认为,实施胃底切除术的大鼠不仅肠嗜铬细胞数量减低且血清生长激素释放肽水平伴随着胃底的切除而降低,但并不会明显影响骨的长度和骨密度。DORNONVILLE DE LA COUR等[17]的研究表明,实施胃大部切除的大鼠经给予生长激素释放肽治疗一段时间后,部分大鼠会出现体质量减轻及体内脂肪含量增加,但这并不会改变骨的含量。研究表明,生长激素释放肽在体内循环存在两种形式:一种是乙酰化形式;另一种是非乙酰化形式。生长激素释放肽的乙酰化主要是由O-酰基转移酶在胃或其他部位催化发生的。一系列的研究表明,乙酰化的生长激素释放肽并不会对骨密度产生影响[18]。在人体进行的相关研究表明,生长激素释放肽对于骨贮存量标志物——β-CTX来说是一个十分重要的预测因子。然而,在DORNONVILLE等[11]的研究中,短期的注入生长激素释放肽并不会对大鼠骨的生物标记物β-CTX产生明显的影响[19,20]。
综上所述,胃大部切除术后出现的骨密度减低与乙酰化的生长激素释放肽的水平减低以及其他因素诸如体质量减低、热量摄入减少、胰岛素、瘦素作用有关。尽管上述的这些因素并没有被明确的确认,但是会认为,生长激素释放肽可以通过直接或者间接的途径等中枢代谢机制来影响骨的代谢。
2.3 、促生长激素分泌素与骨代谢的关系
人在出生前,骨的生长的调节主要是通过胰岛素样生长因子1、胰岛素样生长因子2的旁分泌或自分泌来调节,在很大程度上并不依赖于生长激素[21]。而人在出生后,骨骼的生长则主要依赖于生长激素(growth hormone,GH)和胰岛素样生长因子1的调节。在出生后,垂体腺瘤会刺激儿童或成人释放过多的生长激素会分别导致垂体的巨人症和肢端肥大症;相反,如果生长激素分泌不足则会导致矮小症(侏儒症),导致这样的结果是由于激素分泌不足或者受体不足等[22,23]。1957年Salmon和Daughaday提出假说认为,生长激素的效果主要是受肝脏分泌的胰岛素样生长因子1的调控,即所谓的“激素调节假说”。随后的研究反对这样的假说,即生长激素和胰岛素样生长因子1都是独立发挥其生长调节作用,可能会有交叉叠加的效果,也就是“双重效果假说”,这可能适用于长骨的生长解释[24]。生长激素的生长调节效果会被肝源性或局部产生的胰岛素样生长因子1所调控。后续的一系列研究也证实机体局部和系统性的胰岛素样生长因子1都对骨的生长起着重要的作用。除了调节生长,这两个激素对于人体一生的骨的重塑都起着非常重要的作用[25]。
当前,有人认为生长激素/胰岛素样生长因子1轴的改变可能是骨质疏松的发病机制,发病人群的老年化与体内生长激素/胰岛素样生长因子1的低水平有关。儿童或成人生长激素分泌不足都会影响到骨骼的钙化,而对于治疗都与改善骨的重塑空间有关。最终对于生长激素分泌不足的儿童或成人经过长期的生长激素治疗后,骨的生长会提高骨的密度[26]。当前替代治疗已经成功运用于生长激素分泌不足的患者。一些数据可为生长激素治疗骨质疏松提供依据。然而这些数据却存在一些矛盾,一方面说对绝经后妇女和男性自发性骨质疏松有效,另一方面对其他方面有不良反应[27,28]。生长激素的替代治疗得益于持久的治疗,因为促生长激素分泌治疗会激发放大激素的脉冲式分泌效应,并模仿其生理功能,这样的治疗方法将会取得成功[29]。
生长激素分泌素是一类能够在体内或体外刺激生长激素分泌的人工合成化合物[30]。肽类的和非肽类的都已被测试过。这两项研究认为,非肽类的生长激素分泌素MK-0677会对人体骨的形成和贮存有益,这与先前的生长激素的双向性作用相吻合。研究发现,长期口服MK-0677能够加速髋骨骨折老年人的恢复以及增加停经后妇女的骨密度[31,32]。然而,最近的一次多地联合的随机对照临床研究认为,得到的结果与上述结果并不一致,但是长期口服MK-0677却显着提高了胰岛素样生长因子1的水平[33]。此外,研究认为MK-0677在临床用药安全方面存在一些问题,但与骨质方面无关。
在动物研究中,肽类生长激素释放素—海沙瑞林,能够增加成骨标志物的表达,但是与生长激素或非肽类生长激素释放激素不同。在对狗及大鼠的用药研究中表明,肽类生长激素减少能够降低贮骨标记物的表达。在一项关于大鼠的研究中表明,海瑞沙林和伊帕瑞林能够引起与生长激素相似的皮质及总骨量的增加。就肽类与非肽类生长激素释放激素的作用机制而言,肽类激素也许有生长激素依赖的效果,能够显着刺激骨的形成,并可能对骨质疏松有着直接的疗效[34]。
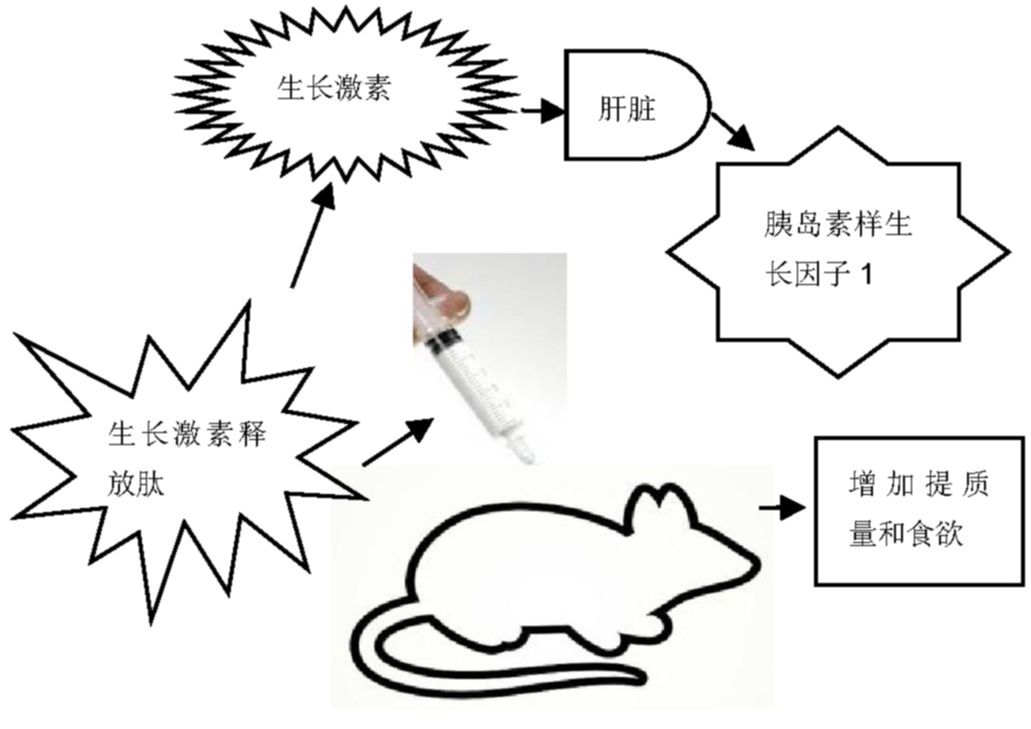
生长激素释放肽能够在体内或体外刺激生长激素的释放主要是依赖于生长激素促分泌受体发挥作用。生长激素反过来会刺激肝脏释放胰岛素样生长因子1。然而,生长激素释放肽对于骨的代谢作用并不完全依赖于生长激素释放活性。因为在缺乏生长激素的矮小鼠内注入生长激素释放肽,会加强骨代谢但不会增加体质量和食欲(示意图见图2),这表明生长激素释放肽可以通过非依赖生长激素直接发挥作用[35,36]。尽管生长激素释放肽作用于缺乏生长激素促分泌受体的大鼠并不会改变其骨密度,但是最近的研究表明,生长激素释放肽作用于缺乏生长激素促分泌受体的大鼠会使其骨的微结构发生改变[37,38,39]。
图2 生长激素释放肽刺激生长激素释放示意图
2.4、临床研究中的生长激素释放肽和骨相关参数的相关性分析
一项协同研究表明,在韩国中年男子人群中,血清生长激素释放肽的水平与骨密度并无明显相关性[39]。同样的研究在年龄大于50岁的男子和非服用雌激素绝经后女性中也得到了和上面一样的结果。有趣的是,在骨的重吸收标记物NTX展现出性别的特异性分布,总的血浆生长激素释放肽水平与男性的NTX呈负相关,而与女性呈正相关,并且这种相关性不随年龄和骨密度发生改变[40]。GONNELLI等[41]在对意大利的137名大于55岁的男性人群研究中发现,骨密度和BCTX与股骨颈、髋骨及体格的大小呈正相关,而与腰椎脊柱无相关性。在经过调整一系列的相关指数如年龄、钙摄入量后发现,只有股骨颈的骨密度会发生显着变化。在另一项健康的306名男性和401名女性平均年龄为75岁的意大利人群的研究中发现,生长激素释放肽水平与骨密度无明显相关性。在众多的研究中,骨小梁非皮质区的骨小梁在多种变异分析中与生长激素释放肽的水平有着显着的正相关性[42]。另一项基于青少年男孩的研究表明生长激素释放肽水平与骨密度无明显关系[43]。
文献报道称,神经性厌食症患者会伴随有骨密度的降低,这是由多因素共同导致的,包括有:性腺功能减低、营养不良、过度活动、营养依赖性低水平胰岛素样生长因子1,获得性生长激素抵抗以及高皮质激素血症等。但是厌食症患者还有一个显着特征就是高生长激素释放肽水平[44,45,46]。除了刺激生长激素分泌,生长激素释放肽也会刺激促肾上腺皮质素释放,同时抑制黄体生成素的脉冲释放,这些都会导致骨密度增加[47]。在综合上述因素的研究中发现,这些因素会导致骨量下降。而与之相反的是,肥胖患者则是体内低水平的生长激素释放肽和高水平的骨密度。唯一例外的是普瑞德威利综合征,该类患者有高水平的生长激素释放肽和低水平的骨密度,这可能是由于生长激素/胰岛素样生长因子1轴的功能不良导致的[48]。在一项关于炎症性肠病患者的研究中,患者体内生长激素释放肽水平与腰椎脊柱呈现显着地负相关,而与股骨颈骨密度无关系[49]。雷特综合征的患者的体内生长激素释放肽的水平显着高于正常人群水平,并与多种原因有关。均一性的分析结果表明:生长激素释放肽与整个机体的骨密度及定量超声参数呈负相关性。然而这样的结果并不是独立存在的,它与年龄,身高及其他身体参数有关[50]。
显而易见的是,上述的诸多研究并没有关于体内生长激素释放肽水平与机体骨代谢的直接的因果联系。更为重要的是,总体上激素水平和营养状态以及食欲情况等,在它们调节生长激素释放肽水平及测量时这些因素相互混杂。并且许多研究都有其局限之处,总体来说这些研究都是小规模并且缺乏很好的同质性。今后,需要的是大样本的具有特点的人群来进研究探讨生长激素释放肽与骨密度以及骨折之间的关系。
2.5 、生长激素释放肽与瘦素之间的相互作用
越来越多的证据表明,骨骼的逆转与能量代谢有关。来源于脂肪组织的调节因子——瘦素就与上述两个过程密切相关[51]。瘦素作为一种脂肪来源的调节因子,它能够通过代谢脂肪来改变体重和代谢状态,从而影响到骨骼的代谢。瘦素可以通过直接或者间接的方式来影响成骨细胞和破骨细胞的比例或者是通过间接影响生长激素-IGF轴来调节皮质骨的含量[52,53]。此外,KARSENTY和他的研究团队已经证明,瘦素能够通过神经性内分泌环路来刺激下丘脑-可卡因和苯丙胺调节的转录表达来抑制骨的吸收。然而骨的吸收和抑制骨的形成均是通过中枢神经及刺激交感神经来调节的[54]。最近的研究表明,尽管瘦素能够通过中枢机制来影响骨代谢,但是瘦素的外周代谢途径可能对骨的代谢平衡有着更大的影响[55]。
有趣的是,最近的研究表明,成骨细胞来源的骨钙素能够提高胰腺胰岛素的分泌,并能调节胰岛素在外周部位的敏感性,同时增加能量消耗。这样的研究结果说明,在骨和控制能量代谢的中枢存在着双向调节机制。这些因素表明它们在骨骼的调节和能量代谢及体质量方面都存在着相互作用[56]。
而瘦素调节受体的拮抗剂是生长激素释放肽。它能够与同时表达生长激素释放肽的瘦素受体的下丘脑Ag RP/NPY神经元的弓形神经核发生显着地相互作用[57]。尽管当前已经明确在调控机体能量代谢方面瘦素与生长激素释放肽能够发生拮抗作用,但是对于二者对于骨代谢的影响还不得而知。通过研究生长激素促分泌受体和瘦素受体单打击或双打击老鼠来了解生长激素促分泌受体缺失或瘦素受体缺失对于机体代谢的影响。结果表明,生长激素释放肽和瘦素共同控制着破骨细胞的生成和骨的代谢,更重要的是年龄对于二者骨代谢的调节十分重要[58,59]。当前的研究已经表明,瘦素和生长激素释放肽共同调解骨骼的代谢。
2.6、生长激素释放肽对于骨细胞体内与体外的影响
2.6.1、 成骨细胞
过去的10多年里,大量的研究业已证明,生长激素释放肽对于成骨细胞功能的影响巨大。体外实验证实,生长激素释放肽能够刺激成骨细胞增殖变异。此外,也会抑制凋亡的发生。几乎在所有的研究中,生长激素释放肽的有效浓度就保持在毫微摩尔级别[60]。KIM等[61]的研究表明,生长激素促激素分泌拮抗剂GHRP-6,能够阻止生长激素释放肽对于老鼠成骨细胞的增殖作用。
上述的研究还表明,生长激素释放肽能够诱导丝裂原激活的蛋白酶激酶(MAPK)的磷酸化,而这一过程能够被MAPK抑制剂PD98059所抑制,这表明生长激素释放肽的调节处于下游路径。同样的研究表明:PD98059和Wortmannin对于生长激素释放肽的扩增效应十分敏感,这表明不仅MAPK而且PI3K都参与到生长激素释放肽对于成骨细胞的增殖作用中。其他的研究也都证实,生长激素释放肽能够通过MAPK和PI3K路径来调节不同类型细胞的增殖[62,63,64]。
先前的COCCHI等[29]提供的数据表明,颅骨的成骨细胞对于生长激素释放肽并不敏感,因此他得出的结论是:在体内是通过循环来产生对某些细胞的磷酸化影响而不是通过局部产生生长激素释放肽。这与FUKUSHIMA等[35]得出的结论正好相反,他通过对幼鼠颅骨成骨细胞的RT-PCR和免疫组织化学研究发现,幼鼠颅骨成骨细胞原始表达生长激素释放肽,并且在人的成骨细胞及骨组织活检中都发现生长激素释放肽的mRNA,这表明生长激素释放肽具有自分泌或旁分泌的能力。总而言之,通过生长激素释放肽对成骨细胞的作用以及生长激素释放肽受体表达的研究均表明,生理状态浓度下的生长激素释放肽可能扮演的就是成骨细胞分裂素的角色。此外,生长激素释放肽对于成骨细胞的作用除了系统性的作用外,还能够通过自分泌或者旁分泌来传递信号。
除了体内实验,还有一些报道关于体外生长激素释放肽对于骨骼代谢的影响。FUKUSHIMA等[35]的实验表明,用生长激素释放肽处理正常和侏儒的小鼠,它们的股骨骨密度都会增加。这样的结果除了表明了生长激素释放肽对于体外的成骨细胞的钙化,说明生长激素释放肽能够对侏儒的小鼠起作用;其作用途径不单单是依赖于生长激素轴来发挥作用。DENG等[65]的研究表明,用生长激素释放肽处理的有缺陷的颅骨细胞模型与盐水处理组相比,能够显着地提高新骨的形成,并且会伴随有成骨细胞生物标记基因的表达,例如,碱性磷酸盐、骨钙素、胶原1等因子。这些研究都证实生长激素释放肽对于诱导成骨细胞因子有着很大的潜能。
在基因表达调控方面,ABDANIPOUR等[66]研究表明生长激素释放肽可以上调Hoxb4在小鼠骨髓干细胞中的表达,影响小鼠的形态及生理构造,继而影响小鼠消化、骨骼、神经内分泌系统的发育及构造[67]。
生长激素释放肽信号通路会通过生长激素促分泌受体来进行传导。研究证明,生长激素促分泌受体会在几种鼠科动物和人类破骨细胞及几种不同类型的骨细胞瘤中表达,但在人的破骨细胞或骨性关节炎骨活检上并没有发现[66]。这与先前的研究认为,生长激素促分泌受体广泛表达,但并不会在骨重表达相一致[68]。然而,生长激素促分泌受体的m RNA的表达却发生了明显的变异,GHSR1b在人类的成骨细胞及骨性关节炎活检中都已发现。
生长激素释放肽的主要体内循环形式是处于非酰化状态的,并且很早的研究报道称,这种没有活性的生长激素释放肽不会通过生长激素促分泌受体来传导信号,但是当前越来越多的研究表明,这种非酰化的生长激素释放肽也就有功能。有报道称,非酰化的生长激素释放肽作用于成骨细胞系大都没有效果。但是在一项高分化的人类成骨细胞系SV-HFO中却发挥了作用。研究结果显示,生长激素释放肽和非酰化的生长激素释放肽都可以使SV-HFO细胞系扩增,但是对于这两种肽来说,在其作用于细胞过程中,它们的作用效果会随时间推移而下降,最有效的时间段在第1周,而在第3周就完全没有了效果。而在小鼠的成骨细胞的作用研究认为,这两种肽都表现出作用,并且在特异的ELISA实验中这两种肽都会增加MAPK的磷酸化。这些数据都表明,酰化和非酰化的生长激素释放肽都能够刺激人类破骨细胞的增殖,且其具体的信号通路机制将很快被阐明。
研究已表明,生长激素释放肽刺激人成骨细胞增生貌似是通过自分泌或旁分泌来实现的,而不是通过生长激素促分泌受体来实现的。实验研究证明,生长激素促分泌受体途径也是可以发挥促增生效应的[69]。但是一个有趣的现象就是:在培养过程中,随着生长激素释放肽和非酰化的生长激素释放肽的作用效果的下降,GHSR1b的基因表达量却在上升。也许正是因为GHSR1b作为拮抗剂才能够阻止上述的两种肽发挥作用[70]。然而,SMITH等[71]的研究发现,GHSR1b并不会表达在细胞表面,这就使人想到它也许会影响到细胞内信号转导。有趣的是,上述两种肽都会表现出钙化的生物标记物,这与以往的研究不同。也许这是因为在发挥作用的过程中会发生变异。然而,在人类的成骨细胞系SaOS-2和MG63都发现了GHSR的表达,这表明关于GHSR的表达变异的说法是行不通的。再者,考虑到人SV-HFO成骨细胞系缺乏GHSR的表达,试图推测成骨细胞在扩增过程中的变异可能与GHSR和其他受体有关。但是令人疑惑的是,生长激素释放肽对于成骨细胞的扩增效应会被GHSR的拮抗剂GHRP-6所阻断。理论上讲,生长激素释放肽对于成骨细胞的增生作用可被与GHSR相似受体进行调节,也许这个受体对GHRP-6很敏感,或者也有可能是在受体的调节过程中存在着变异。
2.6.2 、破骨细胞
与前面大量的关于生长激素释放肽对成骨细胞的研究不同,到目前为止,只有少量的关于生长激素释放肽对于破骨细胞的影响。COSTA等[72]的研究认为,乙酰化的生长激素释放肽对于大鼠和小鼠的效果有差异影响,结果发现生长激素释放肽能够增强大鼠破骨细胞的骨吸收量,但对于其骨髓来源的破骨细胞机制却没有影响。相反,生长激素释放肽会对骨髓来源的破骨细胞有一定的抑制作用。3个月的小鼠缺乏GHSR与野生型相比,其破骨细胞的数量会更多。然而降低骨量并不会很快表现出来,直到再过3个月才会表现出来。这表明在幼年时期,会有系统性或中枢性的机制来调控局部的破骨细胞的活性。相对于体外实验的数据,几个临床研究的数据表明,在生长激素释放肽与骨的贮存量上无显着相关性。
2.6.3、 软骨细胞
长骨的生长主要是依赖于软骨骨面的生长。而软骨的生长主要是依靠于GH-I/GF-I轴的调控。但是现在也有证据表明,软骨的生长也是需要局部有生长因子调控,这其中就包括生长激素释放肽[73]。人们在鼠及人的软骨生长面上以及软骨细胞系上都发现了生长激素释放肽的m RNA,并且在鼠及人的永久软骨细胞系中发现mRNA酰化转移酶。生长激素释放肽被认为能够调节软骨的代谢活性。这些研究结果表明,在软骨的生长方面,生长激素释放肽具有自分泌或这旁分泌的功能。然而,这些效应可能被受体GHSR所调节[74]。
3 、小结Conclusions
尽管研究生长激素释放肽的发现相当复杂,但是大量的动物实验及体外实验研究都已经证明,生长激素释放肽在骨代谢方面在小鼠、大鼠、人类有着积极的促进增殖的效果。在人类成骨细胞的研究表明,生长激素释放肽不仅在骨代谢方面发挥作用,同时也能够调节骨细胞的增殖。此外,多方面的研究也证实生长激素释放肽对骨骼发挥作用可能通过旁分泌或者自分泌途径实现。通过体内对于缺乏GHSR和瘦素受体的小鼠实验研究发现,年龄对于生长激素释放肽作用的发挥有着很大的影响。这对于生长激素释放肽对于骨代谢影响的研究有增加了难度。
综上所述,生长激素释放肽在骨骼发育过程中发挥重要作用。通过对于瘦素与生长激素释放肽的相互作用研究,可以认为:生长激素释放肽可能也会与其他的神经肽类如:PYY,NPY等物质来调节和调控骨骼代谢并且会与饮食摄入,骨代谢平衡及骨骼健康有着紧密的关系。但文章中还缺乏更多的关于酰化和非酰化的生长激素释放肽的提取物对于骨代谢作用机制的描述,后续作者将查阅更多的文献资料进行深入研究。
作者贡献:研究设计、评估为第一作者,资料收集为全体作者,第一作者成文,通讯作者审校。
经费支持:该文章接受了“内蒙古自然科学基金(2017BS0813)”的资助。所有作者声明,经费支持没有影响文章观点和对研究数据客观结果的统计分析及其报道。
利益冲突:文章的全部作者声明,在课题研究和文章撰写过程不存在利益冲突。
写作指南:该研究遵守《系统综述和荟萃分析报告规范》(PRISMA指南)。
文章查重:文章出版前已经过专业反剽窃文献检测系统进行3次查重。
文章外审:文章经小同行外审专家双盲外审,同行评议认为文章符合期刊发稿宗旨。
文章版权:文章出版前杂志已与全体作者授权人签署了版权相关协议。
开放获取声明:这是一篇开放获取文章,根据《知识共享许可协议》“署名-非商业性使用-相同方式共享4.0”条款,在合理引用的情况下,允许他人以非商业性目的基于原文内容编辑、调整和扩展,同时允许任何用户阅读、下载、拷贝、传递、打印、检索、超级链接该文献,并为之建立索引,用作软件的输入数据或其它任何合法用途。
参考文献
[1]YIN YANDZHANG W.The Role of Ghrelin in Senescence:AMini-Review.Gerontology.2016;62(2):155-162.
[2]HAKIM DN,PELLY T,KULENDRAN M,et al.Benign tumours of the bone:A review.J Bone Oncol.2015;4(2):37-41.
[3]ZERNOTTI ME,SARASTY AB.Active Bone Conduction Prosthesis:Bonebridge(TM).Int Arch Otorhinolaryngol.2016;19(4):343-348.
[4]LUPSA BC,INSOGNA K.Bone Health and Osteoporosis.Endocrinol Metab Clin North Am.2015;44(3):517-530.
[5]VAN DER VELDE M,DELHANTY P,VAN DER EERDEN B,et al.Ghrelin and bone.Vitam.Horm.2008;77:239-258.
[6]LIMA CA,LYRA AC,ROCHA R,et al.Risk factors for osteoporosis in inflammatory bowel disease patients.World JGastrointest Pathophysiol.2015;6(4):210-218.
[7]WANG A,POWELL A.The effects of obesity surgery on bone metabolism:what orthopedic surgeons need to know.Am JOrthop.2009;38:77-79.
[8]SAM AH,TROKE RC,TAN TM,et al.The role of the gut/brain axis in modulating food intake.Neuropharmacology 2012;63:46-56.
[9]LARSSON B,NORLEN P,LINDSTROM E,et al.Effects of ECL cell extracts and granule/vesicle-enriched fractions from rat oxyntic mucosa on c AMP and IP(3)in rat osteoblast-like cells.Regul.Pept.2017;106:13-18.
[10]KOJIMA M,HOSODA H,DATE Y,et al.Ghrelin is a growth-hormone-releasing acylated peptide from stomach.Nature.1999;402:656-660.
[11]DORNONVILLE DE LA COUR C,BJORKQVIST M,SANDVIK AK,et al.A-like cells in the rat stomach contain ghrelin and do not operate under gastrin control.Regul Pept.2016;99:141-150.
[12]DELHANTY PJ,VAN DER EERDEN BC,VAN DER VELDE M,et al.Ghrelin and unacylated ghrelin stimulate human osteoblast growth via mitogen-activated protein kinase(MAPK)/phosphoinositide 3-kinase(PI3K)pathways in the absence of GHS-R1a.J Endocrinol.2014;188:37-47.
[13]CUI GL,SYVERSEN U,ZHAO CM,et al.Long-term omeprazole treatment suppresses body weight gain and bone mineralization in young male rats.Scand J Gastroenterol.2001;36;1011-1015.
[14]PERSSON P,GAGNEMO-PERSSON R,CHEN D,et al.Gastrectomy causes bone loss in the rat:is lack of gastric acid responsible?Scand J Gastroenterol.1993;28:301-306.
[15]ABRAHAM NS.Proton pump inhibitors:potential adverse effects.Curr.Opin.Gastroenterol.2014;28:615-620.
[16]LEHTO-AXTELIUS D,CHEN D,SURVE W,et al.Post-gastrectomy osteopenia in the rat:bone structure is preserved by retaining 10%-30%of the oxyntic gland area.Scand J Gastroenterol.2002;37:437-443.
[17]DORNONVILLE DE LA COUR C,LINDQVIST A,EGECIOGLU E,et al.Ghrelin treatment reverses the reduction in weight gain and body fat in gastrectomised mice.Gut.2015;54:907-913.
[18]DELHANTY PJ,NEGGERS SJ,VAN DER LELY AJ.Mechanisms in endocrinology:ghrelin:the differences between acyl-and des-acyl ghrelin.Eur J Endocrinol.2012;167:601-608.
[19]DE VRIESE C,GREGOIRE F,LEMA-KISOKA R,et al.Ghrelin degradation by serum and tissue homogenates:identification of the cleavage sites.Endocrinology.2004;145:4997-5005.
[20]HUDA MS,DURHAM BH,WONG SP,et al.Lack of an acute effect of ghrelin on markers of bone turnover in healthy controls and post-gastrectomy subjects.Bone.2015;(41):406-413.
[21]MOHAN S,KESAVAN C.Role of insulin-like growth factor-1 in the regulation of skeletal growth.Curr Osteoporos Rep.2012;10:178-186.
[22]VAN DER EERDEN BC,KARPERIEN M,WIT JM.Systemic and local regulation of the growth plate.Endocr Rev.2013;24:782-801.
[23]OHLSSON C,VANDENPUT L.The role of estrogens for male bone health.Eur J Endocrinol.2012;160:883-889.
[24]OHLSSON C,BENGTSSON BA,ISAKSSON OG,et al.Growth hormone and bone.Endocr Rev.1998;19:55-79.
[25]YAKAR S,BOUXSEIN ML,CANALIS E,et al.The ternary IGFcomplex influences postnatal bone acquisition and the skeletal response to intermittent parathyroid hormone.JEndocrinol.2006;189:289-299.
[26]DRAKE WM,HOWELL SJ,MONSON JP,et al.Optimizing gh therapy in adults and children.Endocr Rev.2001;22:425-450.
[27]LANDIN-WILHELMSEN K,NILSSON A,BOSAEUS I,et al.Growth hormone increases bone mineral content in postmenopausal osteoporosis:a randomized placebo-controlled trial.J Bone Miner Res.2003;18:393-405.
[28]GILLBERG P,MALLMIN H,PETREN-MALLMIN M,et al.Two years of treatment with recombinant human growth hormone increases bone mineral density in men with idiopathic osteoporosis.J Clin.Endocrinol Metab.2002;87:4900-4906
[29]COCCHI D,MACCARINELLI G,SIBILIA V,et al.GH-releasing peptides and bone.J Endocrinol Invest.2015;28:11-14.
[30]SMITH RG,SUN Y,JIANG H,et al.Ghrelin receptor(GHS-R1A)agonists show potential as interventive agents during aging.Ann N Y Acad Sci.2007;1119:147-164.
[31]MURPHY MG,WEISS S,MCCLUNG M,et al.Effect of alendronate and MK-677(a growth hormone secretagogue),individually and in combination,on markers of bone turnover and bone mineral density in postmenopausal osteoporotic women.J Clin Endocrinol Metab.2001;86:1116-1125
[32]BACH MA,ROCKWOOD K,ZETTERBERG C,et al.The effects of MK-0677,an oral growth hormone secretagogue,in patients with hip fracture.J Am Geriatr Soc.2014;52:516-523.
[33]ADUNSKY A,CHANDLER J,HEYDEN N,et al.MK-0677(ibutamoren mesylate)for the treatment of patients recovering from hip fracture:a multicenter,randomized,placebo-controlled phase IIb study.Arch Gerontol Geriatr.2015;53:183-189.
[34]EUGSTER EA,CLARKE W,KLETTER GB,et al.Efficacy and safety of histrelin subdermal implant in children with central precocious puberty:a multicenter trial.J Clin Endocrinol Metab.2007;92(5):1697-704.
[35]FUKUSHIMA N,HANADA R,TERANISHI H,et al.Ghrelin directly regulates bone formation.J.Bone Miner.Res.2015;20:790-798.
[36]SUN YX,AHMED S,SMITH RG.Deletion of ghrelin impairs neither growth nor appetite.Mol Cell Biol.2003;23:7973-7981.
[37]SUN Y,WANG P,ZHENG H,et al.Ghrelin stimulation of growth hormone release and appetite is mediated through the growth hormone secretagogue receptor.Proc Natl Acad Sci USA.2014;101:4679-4684.
[38]VAN DER VELDE M,VAN DER EERDEN BC,SUN Y,et al.An age-dependent interaction with leptin unmasks ghrelin’s bone-protective effects.Endocrinology.2012;153,3593-3602.
[39]OH KW,LEE WY,RHEE EJ,et al.The relationship between serum resistin,leptin,adiponectin,ghrelin levels and bone mineral density in middle-aged men.Clin Endocrinol.2015;63:131-138.
[40]WEISS LA,BARRETT-CONNOR E,VON MUHLEN D,et al.Leptin predicts BMD and bone resorption in older women but not older men:the Rancho Bernardo study.J Bone Miner Res.2006;21:758-764.
[41]GONNELLI S,CAFFARELLI C,DEL SANTO K,et al.The relationship of ghrelin and adiponectin with bone mineral density and bone turnover markers in elderly men.Calcif Tissue Int.2015;83:55-60.
[42]NAPOLI N,PEDONE C,POZZILLI P,et al.Effect of ghrelin on bone mass density:the In Chianti study.Bone.2013;49:257-263.
[43]POMERANTS T,TILLMANN V,JURIMAE J,et al.The influence of serum ghrelin,IGF axis and testosterone on bone mineral density in boys at different stages of sexual maturity.JBone Miner Metab.2007;25:193-197.
[44]TOLLE V,KADEM M,BLUET-PAJOT MT,et al.Balance in ghrelin and leptin plasma levels in anorexia nervosa patients and constitutionally thin women.J Clin Endocrinol Metab.2003;88:109-116.
[45]HOTTA M,OHWADA R,KATAKAMI H,et al.Plasma levels of intact and degraded ghrelin and their responses to glucose infusion in anorexia nervosa.J Clin Endocrinol Metab.2015;89:5707-5712.
[46]MISRA M,KLIBANSKI A.Anorexia nervosa and osteoporosis.Rev Endocr Metab Disord.2006;7:91-99.
[47]VULLIEMOZ NR,XIAO E,XIA-ZHANG L,et al.Decrease in luteinizing hormone pulse frequency during a five-hour peripheral ghrelin infusion in the ovariectomized rhesus monkey.J Clin Endocrinol Metab.2011;89:5718-5723.
[48]HOYBYE C.Endocrine and metabolic aspects of adult Prader-Willi syndrome with special emphasis on the effect of growth hormone treatment.Growth Horm IGF Res.2004;14:1-15.
[49]KOUTROUBAKIS IE,ZAVOS C,DAMILAKIS J,et al.Role of ghrelin and insulin-like growth factor binding protein-3 in the development of osteoporosis in inflammatory bowel disease.J Clin Gastroenterol.2011;45:e60-e65.
[50]CAFFARELLI C,GONNELLI S,TANZILLI L,et al.The relationship between serum ghrelin and body composition with bone mineral density and QUS parameters in subjects with Rett syndrome.Bone.2012;50:830-835.
[51]ROSEN CJ.Bone:serotonin,leptin and the central control of bone remodeling.Nat Rev Rheumatol.2009;5:657-658.
[52]HAMRICK MW,FERRARI SL.Leptin and the sympathetic connection of fat to bone.Osteoporos Int.2008;19:905-912
[53]WELT CK,CHAN JL,BULLEN J,et al.Recombinant human leptin in women with hypothalamic amenorrhea.N Engl J Med.2004;351:987-997.
[54]ELEFTERIOU F,AHN JD,TAKEDA S,et al.Leptin regulation of bone resorption by the sympathetic nervous system and CART.Nature.2005;434:514-520.
[55]IDELEVICH A,SATO K,BARON R.What are the effects of leptin on bone and where are they exerted?J.Bone Miner.Res.2013;28:18-21.
[56]CLEMENS TL,KARSENTY G.The osteoblast:an insulin target cell controlling glucose homeostasis.J Bone Miner Res.2016;26:677-680.
[57]NOGUEIRAS R,TSCHOP MH,ZIGMAN JM.Central nervous system regulation of energy metabolism:ghrelin versus leptin.Ann N Y Acad Sci.2008;126:14-19.
[58]DUCY P,SCHINKE T,KARSENTY G.The osteoblast:a sophisticated fibroblast under central surveillance.Science.2000;289:1501-1504.
[59]KOMORI T,DOI A,FURUTA H,et al.Regulation of ghrelin signaling by a leptin-induced gene,negative regulatory elementbinding protein,in the hypothalamic neurons.J Biol Chem.2013;85:37884-37894.
[60]NIKOLOPOULOS D,THEOCHARIS S,KOURAKLIS G.Ghrelin,another factor affecting bone metabolism.Med Sci Monit.2010;16:RA147-RA162.
[61]KIM SW,HER SJ,PARK SJ,et al.Ghrelin stimulates proliferation and differentiation and inhibits apoptosis in osteoblastic MC3T3-E1 cells.Bone.2011;37:359-369.
[62]BALDANZI G,FILIGHEDDU N,CUTRUPI S,et al.Ghrelin and des-acyl ghrelin inhibit cell death in cardiomyocytes and endothelial cells through ERK1/2 and PI 3-kinase/AKT.J Cell Biol.2002;159:1029-1037.
[63]KIM MS,YOON CY,JANG PG,et al.The mitogenic and antiapoptotic actions of ghrelin in 3T3-L1 adipocytes.Mol Endocrinol.2009;18:2291-2301.
[64]NANZER AM,KHALAF S,MOZID AM,et al.Ghrelin exerts a proliferative effect on a rat pituitary somatotroph cell line via the mitogen-activated protein kinase pathway.Eur JEndocrinol.2004;151:233-240.
[65]DENG F,LING J,MA J,et al.Stimulation of intramembranous bone repair in rats by ghrelin.Exp Physiol.2008;93:872-879.
[66]ABDANIPOUR A,SHAHSAVANDI B,ALIPOUR M,et al.Ghrelin Upregulates Hoxb4 Gene Expression in Rat Bone Marrow Stromal Cells.Cell J.2018;20(2):183-187.
[67]PACHECO-PANTOJA EL,RANGANATH LR,GALLAGHERJA,et al.Receptors and effects of gut hormones in three osteoblastic cell lines.BMC Physiol.2011;11:12
[68]GNANAPAVAN S,KOLA B,BUSTIN SA.et al.The tissue distribution of the m RNA of ghrelin and subtypes of its receptor,GHS-R,in humans.J Clin Endocrnol Metab.2002;87:2988.
[69]GAUNA C,VAN DE ZANDE B,VAN KERKWIJK A,et al.Unacylated ghrelin is not a functional antagonist but a full agonist of the type 1a growth hormone secretagogue receptor(GHS-R).Mol Cell Endocrinol.2015;274:30-34.
[70]CHAN CB,LEUNG PK,WISE H,et al.Signal transduction mechanism of the seabream growth hormone secretagogue receptor.FEBS Lett.2014;577:147-153.
[71]SMITH RG,JIANG H,SUN Y.Developments in ghrelin biology and potential clinical relevance.Trends Endocrinol.Metab.2012;16:436-442.
[72]COSTA JL,NAOT D,LIN JM,et al.Ghrelin is an osteoblast mitogen and increases osteoclastic bone resorption in vitro.Int J Pept.2011;2011:605193..
[73]CAMINOS JE,GUALILLO O,LAGO F,et al.The endogenous growth hormone secretagogue(ghrelin)is synthesized and secreted by chondrocytes.Endocrinology.2005;146:1285-1292.
[74]GOMEZ R,LAGO F,GOMEZ-REINO JJ,et al.Expression and modulation of ghrelin O-acyltransferase in cultured chondrocytes.Arthritis Rheum.2009;60:1704-1709.
骨骼是一个动态器官,机体通过对骨形成与骨吸收的精密调控,重塑骨骼。成骨细胞和破骨细胞是参与骨重建的主要细胞,分别介导骨形成与骨吸收过程,维持骨代谢动态平衡,使骨骼保持完整的结构和一定的强度。...
斯钙素-1(stanniocalcin-1,STC-1)是首先在鱼类中被发现的重要的参与钙调节的激素,血清钙升高可以引起斯坦尼小体释放STC-1,调节钙离子流通过鳃和肠来保持血液中钙浓度稳定[1].直到由两个实验室分别成功克隆老鼠和人类斯钙素(stannio-calcin,STC)cDNA才证...
本文综述了降钙素的化学结构、降钙素的合成与分泌、降钙素对破骨细胞、成骨细胞、血钙的调节等生理作用、降钙素实验研究的临床意义以及降钙素的实验研究进展、降钙素的临床应用和研究成果分享。降钙素在临床骨质疏松治疗、骨质疏松性骨折的治疗及变形性骨炎的...