摘 要: 目的 探讨急性高原低氧对脑电(Electroencephalogram, EEG)功率的影响。方法 采用低压低氧舱模拟海拔4300 m低氧环境,采集并分析EEG信号。结果 (1)各频段功率受氧气环境影响显着,低氧环境下功率增强,尤其是alpha、delta、theta频段功率显着增强。(2)急性低氧后,常氧下额区活动呈左偏侧化的个体,偏侧化指标有所降低;常氧下额区活动呈右侧化的个体,偏侧化指标则略为上升。结论 模拟低氧环境影响了个体的额区偏侧化指标,导致个体情绪调节灵活性变差。
关键词: 职业健康; 生物心理; 情绪调节; 脑电图; 低氧; 脑电功率; 偏侧化;
1、 引言
高原地区自然环境相对恶劣,这种恶劣环境会影响急进高原人群的生理、心理功能。以往研究显示,高原环境中的低压低氧、干燥低温等因素都会影响人包括感知觉、注意、记忆和情绪等在内的认知功能,还会影响机体的健康与作业能力[1]。康琳等[2]研究表明,缺氧对高原边防军人的心理功能影响最为明显,随着海拔的增加心理功能受影响的程度也会增大。杨国愉等[3]研究表明,高原环境对军人认知功能产生明显影响,这种影响与海拔高度、进入高原时间和军事作业状态均有明显关系。
情绪调节能有效改善个体的情绪状态维护其身心健康。研究表明,积极的情绪调节策略有助于高原官兵心理健康的维护与促进[4],良好的情绪调节方式有助于降低个体的不良情绪体验,显着促进个体的心理健康。在常氧环境中常以额区偏侧化程度作为情绪调节能力的指标,额区偏侧化程度是根据额区alpha波(8-13Hz)的活动强度进行测量和计算得到的指标,alpha波的活动越强说明脑区的活动越弱[5],实验室中的测量方法是提取被试静息状态下左侧与右侧额区的alpha波,计算右侧额区alpha波自然对数值与左侧额区alpha波自然对数值的差值(ln[右侧alpha]-ln[左侧alpha]),以此作为额区活动偏侧化程度的指标。差值为正,说明左侧额区的活动较于右侧额区活动更强烈,额区左侧化活动优势;反之,额区右侧化活动优势[6,7]。研究表明,具有良好的情绪调节能力的个体,脑电信号往往伴随着左额叶更大的活动[6]。额区活动具有左侧化优势的个体情绪调节的灵活性更高[6,8],在负性刺激情况下相对于右侧化优势的个体情绪状态更容易恢复[9,10]。Dennis和Solomon认为[11],额区EEG偏侧化除了能够反映情绪调节的变化以外,还可以反映情绪调节过程中情绪性内容的资源需求,也就是说,个体调节情绪付出的努力程度越大,偏侧化指标也就会越大。虽然静息态的EEG偏侧化指标反映了个体在特质或情绪调节能力上的差异已经得到了绝大部分研究的证实[12,13],但是在特殊环境下测量的EEG偏侧化指标的含义则有着许多争论[14]。从以往研究可知,低氧能够影响人的生理心理功能,但未有研究比较过常氧和低氧环境下影响情绪调节能力的脑指标变化的区别,因此急性高原低氧环境对大脑不同波段偏侧化的影响亟待探讨。

本研究采用低压低氧舱模拟海拔4300m的高原低氧环境,被试分别在舱内常氧、低氧环境10 h过夜之后进行脑电信号测量。本研究期望通过对急性高原低氧环境中静息脑电信号的分析,观察氧气环境(常氧/低氧)对脑电各频段功率的影响。
2、 对象与方法
2.1、 对象
实验对象为12名健康男性,从北京各高校招募,本科以上文化程度,年龄在20岁到25岁之间(22.42±1.62)。所有被试无色盲色弱,视力或矫正视力正常,右利手,无特殊病史,无心理疾病和精神障碍史,近期无服用对神经系统有影响或损害作用的药物。实验开始前,被试均被告知实验目的及实验流程并填写了知情同意书。
2.2 、实验设计与流程
本研究为单因素被试内设计,自变量是氧气环境(常氧/低氧),其中低氧氧分压为12.3kPa, 因变量是额区偏侧化指标(alpha、beta、delta、gamma、theta )。实验在航空医学研究所低压低氧舱内进行。12名被试被随机分成3组,轮流进行实验,每组实验周期是4天。第一、二天22:00开始,安排4名被试进入低压氧舱内在常氧环境下进行整晚适应性睡眠;第三天8:00开始,轮流进行情绪诱发并采集脑电信号;第三天22:00开始,进入海拔4300米低压低氧舱进行睡眠过夜实验,同时应用睡眠床垫进行睡眠监测;第四天8:00开始,在舱内轮流进行情绪诱发并采集脑电信号。
2.3、 脑电数据采集与分析
本研究使用BP(BrainProducts, BP)-32导设备采集脑电信号,电极分布为国际通用的10-20系统。采集数据时,参考电极位于Fz和Cz电极之间,离线分析时转换为TP9、TP10的平均作为参考,接地电极Ground位于Fp1和Fp2电极之间,眼电(Electrooculogram, EOG)电极置于右眼下方约1.5cm处,采样率为250Hz, 记录带宽为0Hz-100Hz, 采集过程中所有电极的电阻保持在5kΩ以下。
静息态额区偏侧化指标分析:使用Matlab R2013b软件对实验起始部分的60s静息脑电信号进行数据预处理及频谱分析。(1)预处理:剔除眼电电极,使用TP9、TP10电极的平均对数据进行重参考,0.05Hz-40Hz的带通滤波以及50Hz陷波,筛选出实验起始部分60s的静息电信号,每2秒(500 point)分为一段(epoch),使用独立主成分分析(Independent principal component analysis, ICA)并剔除眼动伪迹。(2)通过快速傅里叶变换(Fast Fourier Transform, FFT)提取前额叶alpha(8-13Hz)频率波段的功率谱,计算F3、F4电极自然对数转换后的差值作为偏侧化指标(Ln(F4)-Ln(F3))。正值表示前额左侧比右侧有更高的alpha激活,即前额右侧皮层相对左侧有更大的激活。
2.4、 统计分析
我们通过采集实验起始部分时60s的静息脑电信号,对静息状态下额区EEG偏侧化指标的变化进行分析,使用FFT提取前额叶alpha(8-13Hz)频率波段的功率谱,计算F3、F4电极自然对数转换后的差值作为偏侧化指标(Ln(F4)-Ln(F3)),并根据常氧下静息态偏侧化指标的情况进行偏侧化分组,使用SPSS 21.0分别对两组被试低氧前后的偏侧化数据进行配对样本T检验。
3、 结果
3.1 、急性低氧环境下各频段功率的变化
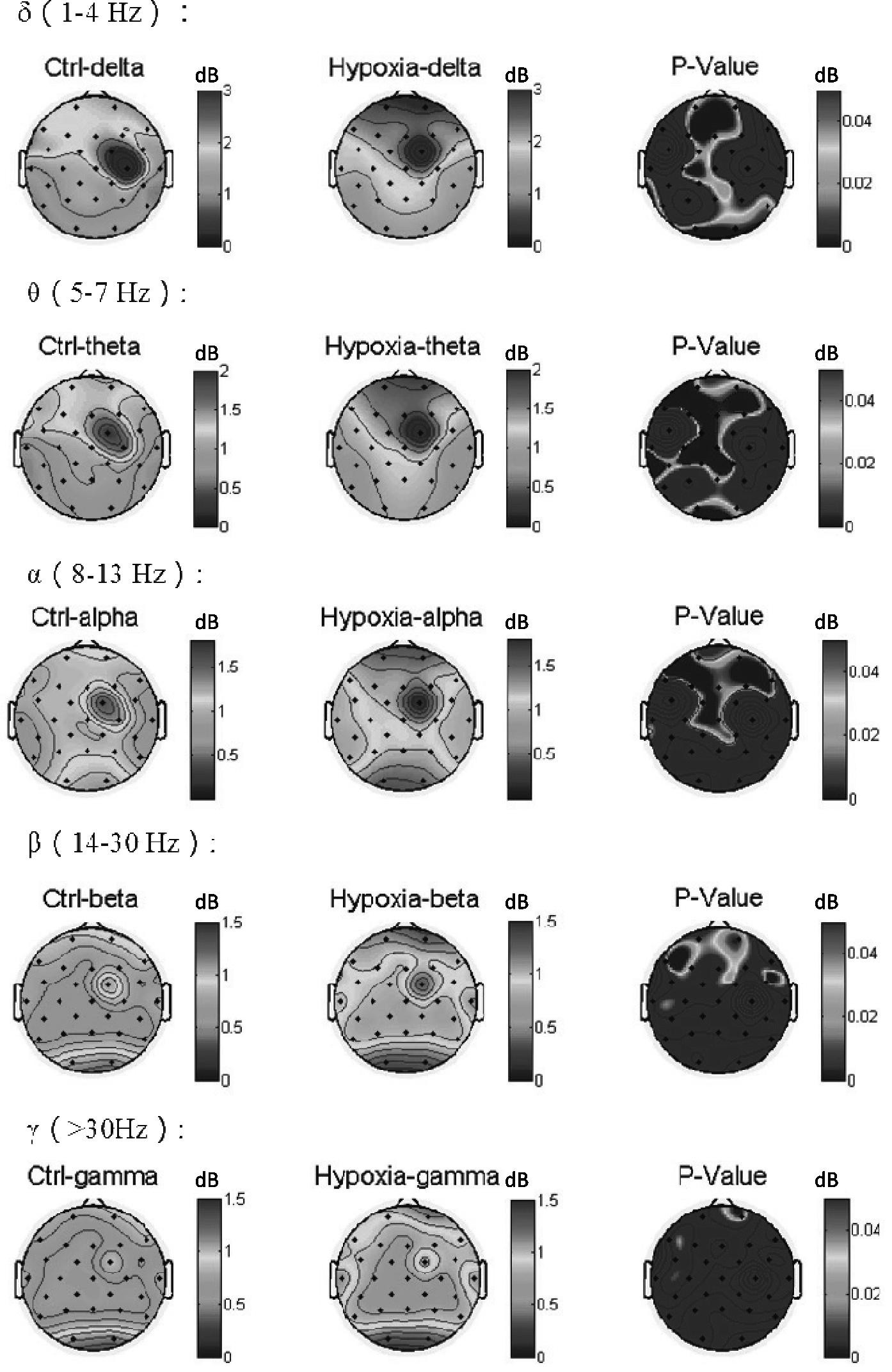
使用Matlab R2013b软件对实验起始部分的60s静息脑电信号进行频谱分析:将脑电按照频率从低到高划分为δ(1-4 Hz)、θ(5-7 Hz)、α(8-13 Hz)、β(14-30 Hz)、γ(>30Hz)五个频段,并通过FFT提取脑电各频段功率(幅值)的全脑地形分布,如图1所示。
图1 脑电各频段功率(幅值)的全脑地形分布
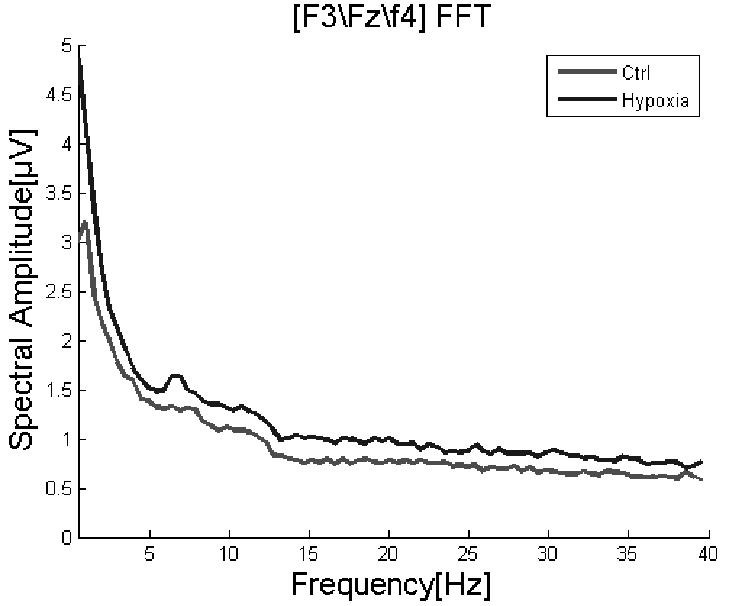
额区频谱分析通过FFT将随时间变化的波幅转换为随频率变化的脑电功率谱图,额区(F3fzF4均值)频谱图如图2所示。
图2 额区频谱分析图
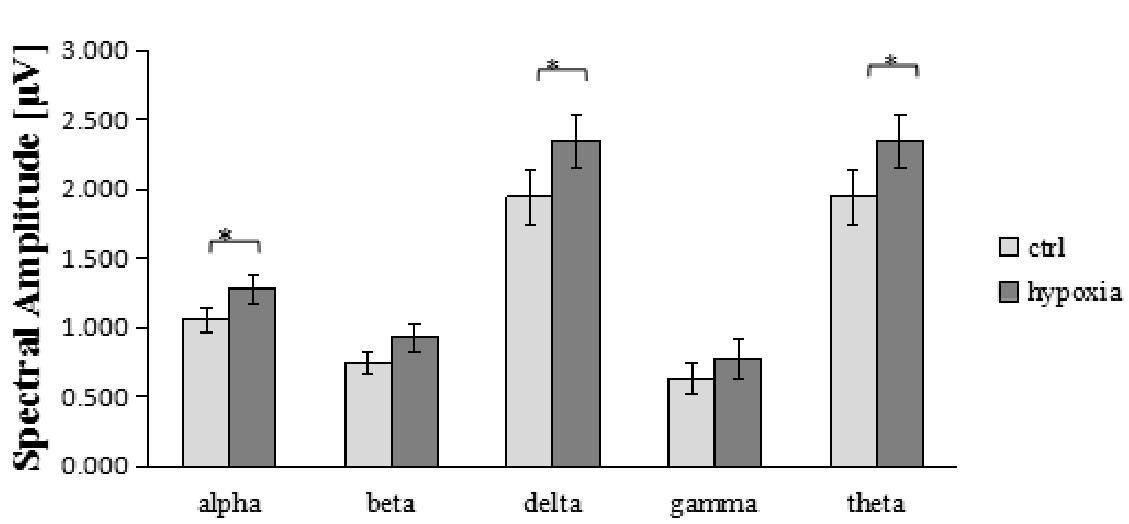
采用SPSS 21.0对额区(F3/Fz/f4)各频段数据进行统计分析。经Shapiro-Wilk检验,低氧前后各频段数据的差值皆服从正态分布(P>0.05),因此对低氧前、后的各频段数据进行配对样本T检验,检验结果如表1所示。额区alpha、delta、theta频段在低氧前后差异显着,如图3所示。
表1 额区各频段低氧前、后比较(mean±SD,n=12)
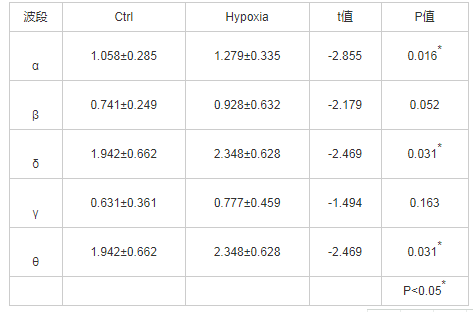
图3 额区各频段低氧前、后比较
3.2、 额区偏侧化指标分析结果
额区各频段偏侧化总体情况:FFT后提取各频段绝对功率,偏侧化=ln(F4)-ln(F3)没有进行正负值分组。研究采用SPSS 21.0对各频段偏侧化指标数据进行统计分析,经Shapiro-Wilk检验,低氧前后各频段数据的差值皆服从正态分布(P>0.05),因此对低氧前、后的各频段数据进行配对样本T检验,如表2所示。
表2 低氧前、后额区偏侧化比较(mean ±SD,n=12)
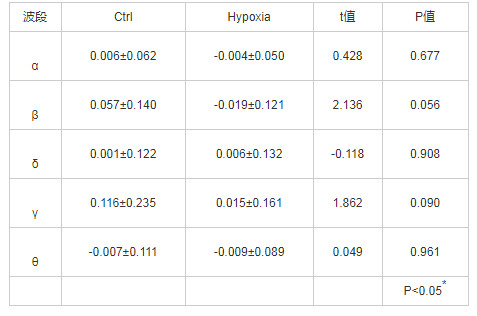
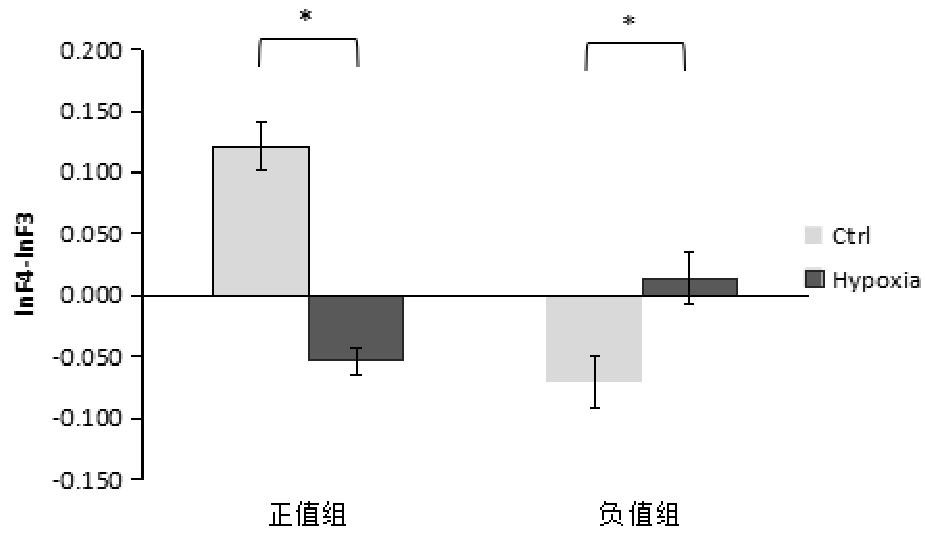
本研究根据常氧下静息态偏侧化指标的情况,将被试分为左偏侧化组(5人)和右偏侧化组(7人),经Shapiro-Wilk检验,左、右偏侧化组低氧前后数据的差值皆服从正态分布(P>0.05),分别对两组低氧前后的数据进行配对样本T检验。在静息状态下,alpha频段左\右偏侧化组低氧前后比较发现,左偏侧化组低氧前后差异显着,t(4)=7.116,P=0.002;右偏侧化组低氧前后差异也显着,t(6)=-2.804,P=0.031。左、右偏侧化组低氧前后额区偏侧化指标的差异结果如图4所示。左侧组偏侧化指标为正值,说明左侧alpha低,左边脑区活动强,称为左偏侧化。
图4 左、右偏侧化组低氧前后额的差异比较
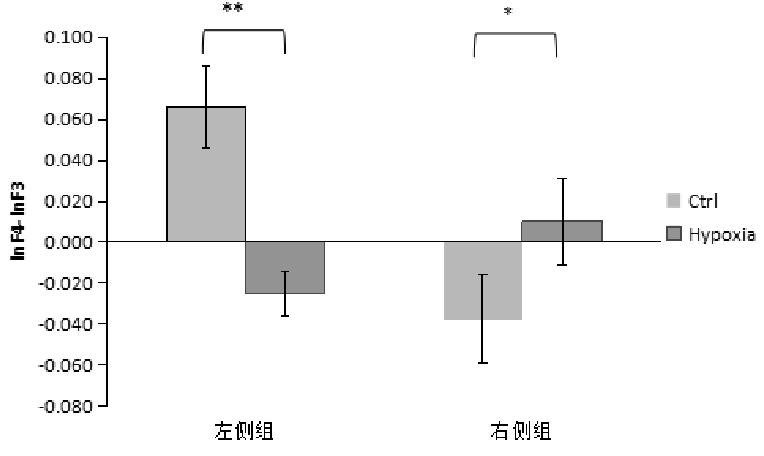
然后利用相同的方法,又分别对beta、delta、theta、gamma频段左、右偏侧化低氧前后的变化差异进行了比较。
对于左\右偏侧化组,正值组即:偏侧化指标为正值,左侧组,说明F4_beta>F3_ beta。在静息状态下,beta频段左\右偏侧化组低氧前后比较发现,左偏侧化组低氧前后差异显着,t(6)=4.842,P=0.003;右偏侧化组低氧前后差异不显着,t(4)=-0.311,P=0.771。其变化如图5所示。
图5 beta频段低氧前后差异比较
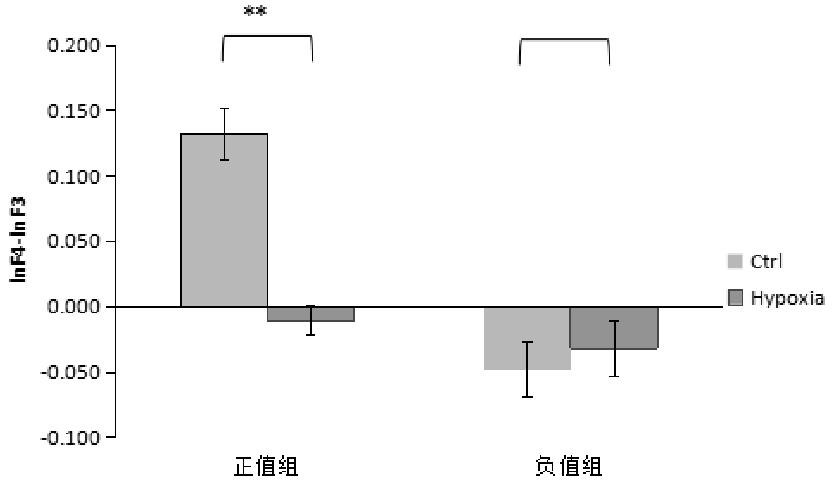
在静息状态下,delta频段左\右偏侧化组,低氧前后比较发现,左偏侧化组低氧前后差异不显着,t(5)=1.915,P=0.114;右偏侧化组低氧前后差异也不显着,t(5)=-1.378,P=0.227。如图6所示。
图6 delta频段低氧前后差异
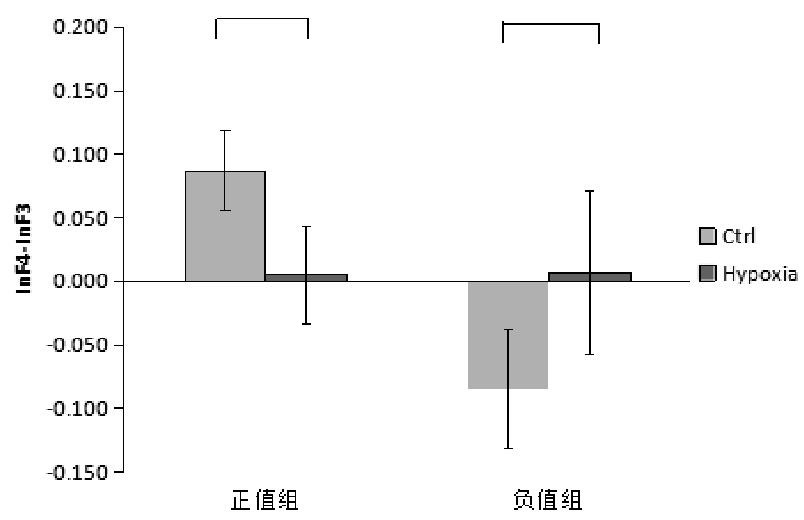
在静息状态下gamma频段左\右偏侧化组,低氧前后比较发现,左偏侧化组低氧前后差异不显着t(8)=1.976,P=0.084;右偏侧化组低氧前后差异也不显着,t(2)=-0.243,P=0.830。如图7所示。
图7 gamma频段低氧前后差异
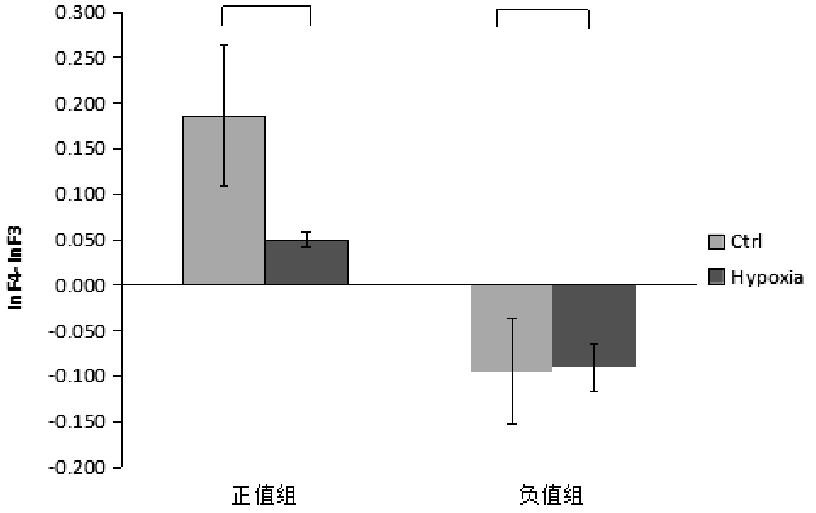
对于静息状态下,theta频段左\右偏侧化组低氧前后比较,经Shapiro-Wilk检验,左偏侧化数据低氧前、后的差值服从正态分布(P>0.05),进行配对样本T检验;右偏侧化数据低氧前、后的差值不服从正态分布(P=0.003),进行Wilcoxon 符号秩检验。theta频段左\右偏侧化组低氧前后比较发现,左偏侧化组低氧前后差异显着,P=0.035;右偏侧化组中,低氧前后差异也显着,P=0.017,如图8所示。
图8 theta频段低氧前后差异
4、 讨论
本研究探讨了急性低氧环境对额区偏侧化指标的影响,在低压氧仓中模拟急进高原人群低氧10h 以上,对个体额区偏侧化指标的改变情况进行探究,期待能够描述和探究在经历低氧环境前后额区不同波段偏侧化的变化。研究结果显示,个体在低氧前后,额区各频段频谱振幅有一定的变化,其中在delta、theta、alpha、beta、gamma频段中,常氧下额区活动呈左偏侧化的个体在经历急性低氧环境后偏侧化指标均有所降低,常氧下额区活动呈右偏侧化的个体在急性低氧环境后偏侧化指标均有所增加。其中对于alpha、beta和theta频段,偏侧化指标从正值下降到了负值,差异达到了显着性水平,额区活动性从左侧活动较强变成右侧活动较强,说明模拟的急性低氧环境影响了被试的额区偏侧化指标;但是对于delta、gamma频段,差异并没有达到显着性水平,可能的原因主要考虑是急性高原低氧环境暴露时间太短,或者与模拟环境密闭性可能没有达到最佳状态影响了个体状态及测试效果等有关。另外,常氧时额叶活动左侧化优势的个体在低氧之后呈右侧化优势,说明情绪调节能力在很大程度上受到急性低氧环境的影响,导致个体情绪调节能力出现了明显的下降。虽然大量的研究显示,静息额叶EEG偏侧化具有相对稳定性,可以作为一个稳定的神经指标[15,16,17,18,19],但本研究发现突然的环境变化除了会让人的生理和心理功能产生不适之外,还在很大程度上影响了个体长期稳定的生理指标和情绪状态。
此外,值得注意的是,本研究发现常氧下额区活动呈右侧化的个体在经历急性高原低氧环境之后,偏侧化指标略为上升,其中alpha和theta频段的上升指标均达到了显着性水平。根据相关的研究结果表明,静息状态下,额叶EEG偏侧化与情绪调节有关,良好的情绪调节能力往往伴随着左额叶更大的活动[20,21,22]。那么,右偏侧化指标的上升,是否说明了本身情绪调节能力不太灵活或者自身具有焦虑和抑郁特质的个体,在经历急性高原低氧环境后,情绪调节能力能有所改善?焦虑、抑郁特质的个体如果长期处于高原低氧环境下是否个人特质会改变,以至于负性情绪更少?这一问题还值得我们进一步深入探究。
但就目前的研究结果而言,不同波段大脑功率的变化以及低氧前后大脑偏侧化程度的变化,均表明急性高原低氧环境前后对个体脑电功率变化的影响比较明显,对探究个体额区偏侧化指标的变化规律具有深刻意义。
5 、结论
常氧下额区活动呈左侧化的被试在急性低氧之后,偏侧化指标从正值下降到了负值,额区活动性从左侧活动较强变成右侧活动较强,说明模拟低氧环境影响了个体的额区偏侧化指标,导致个体情绪调节灵活性变差。
参考文献
[1] 朱玲玲,范明.高原缺氧对人认知功能的影响及干预措施[J].中国药理学与毒理学志,2017,31(11):1114-1119.
[2] 康琳,李小明,肖伟宏,等.新疆不同海拔高原边防军人心理健康状况调查分析[J].中国健康教育,2013,29(7):634-635,653.
[3] 杨国愉,冯正直,秦爱粉,等.高原训练期间军人认知功能的追踪研究[J].第四军医大学学报,2005,26(3):272-275.
[4] 徐媛媛,谢守蓉,李丽,等.情绪调节方式在军人幸福感促进心理健康中的作用[J].第三军医大学学报,2017,39(15):1520-1524.
[5] Allen JJB,Coan JA,Nazarian M.Issues and Assumptions on the Road from Raw Signals to Metrics of Frontal EEG Asymmetry in Emotion[J].Biological Psychology,2004,67(1-2):0-218.
[6] Reznik Samantha J,Allen John JB.Frontal Asymmetry as A Mediator and Moderator of Emotion:An Updated Review[J].Psychophysiology,2018,55(1):10-44
[7] 张晶,周仁来.额叶EEG偏侧化:情绪调节能力的指标[J].心理科学进展,2010,18(11):1679-1683.
[8] 刘雷,杨萌,韩卓,等.额叶EEG偏侧化预测情绪灵活性[J].中国科学:生命科学,2014,44(6):614-622.
[9] Harmonjones,E.The Role of Asymmetric Frontal Cortical Activity in Emotion-related Phenomena:A Review and Update[J].Biological Psychology,2010,84(3):451-462.
[10] Kline JP,Blackhart GC,Williams WC.Anterior EEG Asymmetries and Opponent Process Theory[J].International Journal of Psychophysiology,2007,63(3):302-307.
[11] Solomon B,Dennis TA.Frontal EEG and Emotion Regulation:Electrocortical Activity in Response to Emotional Film Clips is Associated with Reduced Mood Induction and Attention Interference Effects[J].Biological Psychology,2010,85(3):456-464.
[12] Allen JJB,Urry HL,Hitt SK,et al.The Stability of Resting Frontal Electroencephalographic Asymmetry in Depression[J].Psychophysiology,2004,41(2):269-280.
[13] Tomarken AJ,Davidson RJ,Wheeler RE,et al.Psychometric Properties of Resting Anterior EEG Asymmetry:Temporal Stability and Internal Consistency[J].Psychophysiology,1992,29(5):576.
[14] James A,Coan.A Capability Model of Inpidual Differences in Frontal EEG Asymmetry[J].Biological Psychology,2006,72(2):198-207.
[15] Henriques JB,Davidson RJ.Left Frontal Hypoactivation in Depression[J].Journal of Abnormal Psychology,1991,100(4):535-545.
[16] Sabrina K Hitt,John JB Allen,James A Coan,et al.The Stability of Resting Frontal Electroencephalographic Asymmetry in Depression[J].Psychophysiology,2004,41(2):269-280.
[17] Vuga M,Fox NA,Cohn JF,et al.Long-term Stability of Frontal Electroencephalographic Asymmetry in Adults with A History of Depression and Controls[J].International Journal of Psychophysiology,2006,59(2):0-115.
[18] Fox NA,Kovacs M,George CJ,et al.Long-term Stability of Electroencephalographic Asymmetry and Power in 3 to 9 Year-old Children[J].International Journal of Psychophysiology,2008,67(1):70-77.
[19] Schmidt LA.Patterns of Second-by-second Resting Frontal Brain (EEG) Asymmetry and Their Relation to Heart Rate and Temperament in 9-month-old Human Infants[J].Personality & Inpidual Differences,2008,44(1):216-225.
[20] Jetha MK,Schmidt LA,Goldberg JO.Long-term Stability of Resting Frontal EEG Alpha Asymmetry and Power in A Sample of Stable Community Outpatients with Schizophrenia[J].International Journal of Psychophysiology,2009,72(2):0-233.
[21] Dagmar Kr Hannesdóttir,Doxie J,Bell MA,et al.A Longitudinal Study of Emotion Regulation and Anxiety in Middle Childhood:Associations with Frontal EEG Asymmetry in Early Childhood[J].Developmental Psychobiology,2010,52(2):197-204.
[22] Mikolajczak M,Bodarwe K,Laloyaux O,et al.Association between Frontal EEG Asymmetries and Emotional Intelligence among Adults[J].Personality and Inpidual Differences,2010,48(2):177-181