摘 要: 心脏因子是指由心脏所分泌的细胞因子,可抑制心脏的病理性重塑,改善心脏的功能,在冠心病、高血压以及心肌梗死等心血管疾病的代谢过程中发挥重要作用。适宜的运动可影响心脏因子的产生和分泌,进而对心血管疾病的防治产生影响。梳理心脏因子对心血管的保护作用及运动干预的研究进展,可为心血管疾病的预防和治疗提供新的作用靶点和思路。
关键词 : 心脏因子,心血管疾病:运动干预:
Abstract: Cardiokines refers to the cytokine secreted by the heart, which can inhibit the pathological remolding of heart, improve heart function, and play an important role in the metabolic process of cardiovascular diseases such as coronary heart disease, hypertension and myocardial infarction. Appropriate exercise can have an impact on cardiokines, thereby effectively preventing cardiovascular diseases. This paper reviews the cardiokines on cardiovascular protection and exercise intervention, and provides new targets and ideas for the prevention and treatment of cardiovascular diseases.
Keyword: cardiokines; cardiovascular diseases; exercise intervention;
《中国心血管病报告2018》结果显示,我国心血管疾病的患病率呈现持续增长趋势,心血管疾病患者人数约为2.9亿,死亡率居于疾病死亡的首位,占40%以上。[1]心血管疾病已经成为我国重大公共卫生问题,其预防和治疗刻不容缓。研究表明,适宜的运动可以改善心功能,最终发挥心血管保护作用,但其具体机制仍在不断探索中。
心脏作为分泌器官,在正常或应激的状态下可分泌某些细胞因子,这些因子对于保护心脏功能具有重要作用,也可以通过内分泌途径参与远隔器官及全身的代谢功能,被称为“心脏因子”(cardiokines)。研究表明,心脏因子如卵泡抑素样蛋白1(follistatin-like protein 1,FSTL1)、神经调节蛋白1(neuregulin-1,NRG1)、白血病抑制因子(leukemia inhibitory factor, LIF)、酸性成纤维细胞生长因子(acidic fibroblast growth factor, FGF1或aFGF)等,可抑制心肌细胞凋亡,促进心肌细胞增殖和心肌血管新生,降低心肌纤维化,最终改善心功能,发挥心血管保护作用。适宜运动可刺激心脏因子的产生和分泌,预防和治疗心血管疾病,但其具体机制仍需进一步研究。本文梳理了部分心脏因子对心血管的保护作用及运动干预研究进展,以期为心血管疾病的临床和基础研究提供理论依据。
一、卵泡抑素样蛋白1(FSTL1)
FSTL1又称TSC-36 (TGF-β-stimulated clone 36) 或FRP(follistatin-related protein),是一种分泌型细胞外基质糖蛋白,其结构不仅包含细胞外钙结合域(extracellular calcium-binding ,EC),还包含卵泡抑素样结构域(follistatin, FS),可认为其归属于两个家族。FSTL1最早发现是在小鼠的成骨细胞系MC3T3-E1中,后来研究发现,心脏、骨骼肌、肾脏和肺等均有FSTL1表达,并发挥重要作用。
相关研究表明,心衰病人心肌FSTL1基因和蛋白表达升高,同时,血清中FSTL1升高且与左心室肥厚有关[2,3],此外,冠状动脉综合征病人循环FSTL1水平升高[4,5]。据此推测,FSTL1也许可作为心脏疾病的生物标志物之一。另外,小鼠经主动脉狭窄(Transverse aortic constriction, TAC)、缺血/再灌注(Ischemia Reperfusion, I/R)和心肌梗死(Myocardial Infarction, MI)等手术造成病理性心脏损伤后,心脏FSTL1表达上调。I/R小鼠静脉注射FSTL1腺病毒载体后,心肌细胞凋亡和心肌梗死面积均显着减少。[6]MI大鼠腹腔注射重组FSTL1蛋白,可激活心肌TGF-β/Smad2/3 信号通路,促进心肌血管新生,改善心功能。[7]此外,FSTL1可通过Erk1/2信号通路促进MI早期小鼠心肌成纤维细胞的激活进而抑制心脏破裂[8],可通过AMPK信号通路抑制TAC小鼠病理性心肌肥大[9],可通过AMPK和BMP4信号通路抑制I/R小鼠心肌细胞凋亡,减少心肌的炎症反应和梗死的面积,改善心功能[10],可刺激MI小鼠心肌细胞增殖[11]。以上结果均表明,FSTL1可作用于其下游不同信号通路,发挥对病理性心脏的保护作用,并有可能成为治疗心血管疾病的新靶点之一。
关于运动对机体FSTL1表达的影响,国内外研究表明,抗阻运动可上调MI大鼠心肌FSTL1蛋白表达,进而激活心肌PI3K/Akt信号通路,促进心肌细胞增殖,抑制心肌细胞凋亡和心肌纤维化扩大,改善心功能。[12,13]间歇有氧运动、机械振动训练和抗阻训练三种训练方式均可刺激MI大鼠心肌FSTL1蛋白表达,促进心肌血管新生,减少心肌纤维化,改善心功能,但对心肌fstl1 mRNA表达无显着影响[14],因此推测,运动促进心肌FSTL1蛋白表达的增加,一部分来自心脏,另一部分来自其他组织或器官。运动作用的直接器官是骨骼肌,骨骼肌被认为是分泌样器官,可以分泌多种细胞因子。文献表明,力量训练后骨骼肌fstl1 mRNA表达增加[15],自行车运动1 h后人类循环FSTL1水平上升[16],间歇有氧运动和机械振动训练两种训练方式均可提高MI大鼠骨骼肌和血清中FSTL1蛋白水平[7]。小鼠左股动脉损伤后,骨骼肌特异性敲除fstl1后血清中FSTL1水平下降50%,骨骼肌特异性fstl1过表达后血清中FSTL1水平升高6.9倍。[17]表明,运动上调心脏FSTL1蛋白表达,其中部分来源于骨骼肌。综上,运动可直接刺激心脏FSTL1产生,或通过促进骨骼肌FSTL1表达,分泌入血进而到达心脏,发挥心血管保护作用。
二、神经调节蛋白1(NRG1)
NRG1是表皮生长因子(epidermal growth factor, EGF)家族成员之一,其基因位于小鼠和人的8号染色体上,基因产物被加工成含有EGF样结构域的跨膜蛋白,分为三个亚群(I-III)。I型NRG1主要表达在心内膜、神经组织和呼吸道以及卵黄囊等胚胎组织中;II型NRG1主要表达在骨骼肌、神经组织、脑垂体以及视网膜神经节细胞层中;III型NRG1主要分布在神经组织,视网膜神经节细胞层,心内膜中也有微量表达。此外,心脏中的NRG1由心内膜及微血管内皮细胞释放表达,且一般需要通过与其受体ErbBs结合,激活NRG1/ErbBs信号通路,发挥生物学作用。
研究表明,NRG1可改善心功能,在心脏损伤后的修复过程中发挥重要作用。动物实验结果显示,NRG1可减少MI、扩张性和病毒性心肌病大鼠的心脏病理性变化,改善左心室的功能,提高存活率[18],可促进MI小鼠心肌细胞增殖,降低心肌纤维化[19],可上调心肌肌球蛋白轻链激酶和心室肌球蛋白轻链2的磷酸化水平,进而促进肌节重组,改善心室收缩功能[20],可抑制糖尿病心肌病大鼠心肌细胞凋亡,减少心肌纤维化[21],可激活MI大鼠PI3K/Akt信号通路,促进心肌血管新生,抑制心肌细胞凋亡[22],可减弱MI大鼠线粒体功能障碍,恢复呼吸功能,抑制心肌细胞凋亡,减少心肌氧化应激[23],可调节MI大鼠交感神经和迷走神经的重构,从而使自主神经系统达到新的平衡,减少心脏损伤[24],最终改善心功能。临床实验结果显示,慢性心衰患者连续注射10天重组人NRG1蛋白,第30天检测结果显示:左心室功能有所改善,第90天检测时发现左心室功能进一步改善[25],实验表明,NRG1注射可使左心室重构发生逆转。因此推测,NRG1有可能成为治疗心脏疾病的广谱药物之一。以上动物实验和临床实验结果均表明,NRG1可作为心血管保护的重要靶点之一。
文献表明,运动可刺激心脏NRG1的表达,且对正常和病理性心脏均可产生影响。适宜强度的运动可上调正常大鼠心脏NRG1表达,促进心肌细胞增殖和血管新生[26],可上调MI大鼠心脏NRG1表达,激活 PI3K/Akt 信号通路,促进心肌细胞增殖和心肌血管新生,抑制心肌细胞凋亡,降低心肌纤维化[27,28],可上调MI大鼠心肌NRG1蛋白表达,激活PI3K/Akt-eNOS-PKG-PLN-SERCA2a信号通路,强化心肌细胞钙瞬变和收缩力[29],改善心功能。以上结果表明,运动改善心功能与心脏因子NRG1有关。
三、白血病抑制因子(LIF)
LIF是由Tomida等于1984年发现的一种具有多种生物学效应的细胞因子,因其可诱导小鼠骨髓样白血病细胞分化并抑制增殖,故而得名。人的LIF基因位于第22号染色体上,而小鼠的LIF基因位于第11号染色体上。LIF是一种单分子糖蛋白,且为一种多功能蛋白,属于IL-6家族,在心肌、骨骼肌、平滑肌、神经胶质细胞、肝成纤维细胞、胚胎干细胞以及骨髓基质细胞等均有分布。
LIF在病理性心脏的治疗和康复过程中发挥重要作用。相关文献表明,MI小鼠肌肉注射LIF cDNA质粒后,可抑制缺血区心肌细胞凋亡,可诱导心肌新生血管形成,同时增加细胞周期中的心肌细胞数量,增强骨髓细胞向心脏的动员和向心肌细胞的分化,抑制左心室病理性重构和纤维化面积进一步扩大,改善心功能。[30]LIF通过Ca(2+)的增加激活钙调蛋白激酶II和IV及钙调神经磷酸酶,进而调控心肌肥厚。[31]MI大鼠梗死边缘区注射LIF腺病毒载体6周后,可抑制心肌细胞凋亡,改善心功能。[32]以上结果表明,心脏因子LIF在心血管疾病保护中具有较强的应用潜力。
目前,关于运动对机体LIF表达影响的相关研究较少,主要集中在运动对骨骼肌和心脏LIF表达的作用。研究表明,运动可上调正常大鼠骨骼肌LIF蛋白表达,促进骨骼肌细胞增殖和肥大[33],可上调MI大鼠骨骼肌LIF蛋白表达,促进骨骼肌的细胞增殖,减少骨骼肌的细胞凋亡,抑制骨骼肌萎缩[34]。以上文献表明,LIF对正常和病理性骨骼肌均发挥积极作用。文献表明,间歇运动可上调MI大鼠心肌LIF蛋白表达,进而激活STAT3信号通路,促进MI大鼠心肌血管新生,抑制心肌细胞凋亡,降低心肌纤维化,改善心肌细胞的代谢功能,最终改善心功能[35,36]。文献提示,LIF对病理性心脏发挥积极作用。而运动对骨骼肌和心脏LIF蛋白表达之间是否具有相关性,运动是否通过刺激心脏LIF蛋白表达发挥其他心血管保护作用,均有待进一步研究。综上,心脏因子LIF可为心血管疾病患者的运动康复筛选提供新的靶点和新的思路。
四、酸性成纤维细胞生长因子(FGF1)
FGF1是成纤维细胞生长因子家族典型成员之一,最早是在脑垂体和脑中发现的。[37]文献表明, FGF家族成员有广泛的促有丝分裂和细胞存活的能力,往往涉及许多生物学过程,诸如胚胎发育、细胞生长、形态建成、组织修复等。近年来的研究发现,心脏因子FGF1在心血管的保护中发挥重要作用。
国内外关于心脏因子FGF1对病理性心脏保护作用的研究越来越多。FGF1具有多种生物学特征,包括促有丝分裂活性[38]、刺激DNA合成以及组织器官发育和血管发生等[39]。研究表明,MI和I/R心肌损伤模型中FGF1和FGF2可通过FGFR1发挥心肌保护作用[40]。FGF1可通过蛋白激酶C信号来调节心脏发育[41],可诱导MI大鼠心肌细胞有丝分裂,促进心肌血管新生,降低纤维化水平,减少心肌瘢痕的形成[42,43],可抑制糖尿病心肌病大鼠心肌细胞凋亡,促进心肌血管新生,降低心肌纤维化[44],改善心功能。另有研究表明,FGF1可通过内分泌作用途径,进入到细胞核内与p53蛋白相结合,进而抑制p53依赖性的细胞凋亡以及细胞周期的阻滞。[45]FGF1可促进I/R猪的心肌血管重建[46],可激活蛋白激酶C和酪氨酸激酶,抑制I/R小鼠心肌细胞死亡[47],改善心功能。因此认为,FGF1可通过促进心肌细胞有丝分裂和心肌血管新生,抑制心肌细胞凋亡,降低心肌纤维化,最终发挥心血管保护作用。
目前,国内外关于运动通过影响心脏FGF1表达,发挥心血管保护作用的文献少之又少。有研究表明,间歇运动可激活FGF1-PI3K-Akt信号通路,促进MI大鼠心肌细胞增殖,改善心功能。[48]因此,未来对FGF1在运动发挥心血管保护过程中的作用研究不可忽视。
五、结语与展望
众所周知,心血管疾病具有较高的死亡率,并呈现出年轻化趋势,必然是研究的热点问题之一。研究表明,心脏因子在心血管疾病保护中发挥着重要作用(见表1),可促进心肌细胞增殖,抑制心肌细胞凋亡,促进心肌血管新生,抑制心脏病理性重塑,改善心功能。且运动可刺激心脏因子的表达,最终发挥心血管保护作用(见图1)。因此,心脏因子可作为运动发挥预防和治疗作用的调节靶点。但心脏因子较多,且在心血管疾病中的具体作用机制以及运动干预作用仍有待进一步研究。
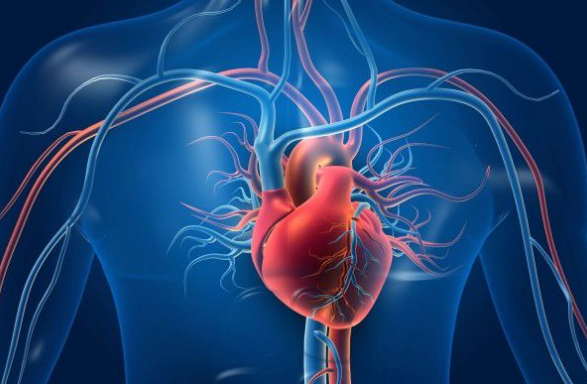
表1 心脏因子在心血管中的生物学功能
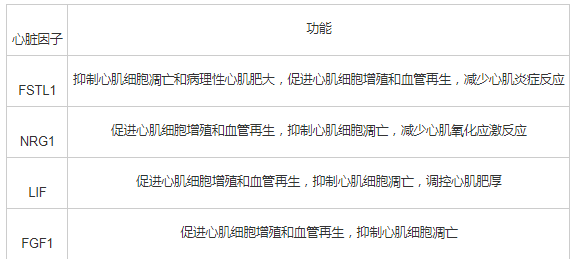
图1 运动刺激心脏因子产生发挥心血管保护作用
参考文献
[1]胡盛寿,高润霖,刘力生,等.《中国心血管病报告2018》概要[J]中国循环杂志, 2019(3):209-220.
[2] LARA-PEZZI E,FELKIN L E,BIRKS E J,et al.Expression of ollistatin-related genes is altered in heart failure[J] Endocrinology ,2008, 149(11):5822-5827.
[3] EL-ARMOUCHE A,OUCHI N,TANAKA K,et aliatin-like 1 in chronic systolic heart failure:a marker of left ventricular remodeling[J] .Circ Heart Fail,2011,4(5):621-627.
[4] WIDERA C,HORN-WICHMANN R,KEMPF T,et alCirculating concentrations of flistatin-like 1 in healthy individuals and patients with acute coronary syndrome as assessed by an immunoluminometric sandwich assay[J] Clin Chem,2009.55(10):1794-1800.
[5] WIDERA C,GIANNITSIS E,KEMPF T,et al.ldentification of llistatin-like 1 by expression cloning as an activator of the growth diferentiation factor 15 gene and a prognostic biomarker in acute coronary syndrome[J] Clin Chem,2012,58(8):1233-1241.
[6] OSHIMA Y,OUCHI N,SATO K,et alollistin-like 1 Is an Akt- Regulated Cardioprotective Factor That Is Secreted by the Heart[J] Circulation,2008, 117(24):3099-3108.
[7] XI Y,GONG D W,TIAN Z.FSTL1 as a Potential Mediator of Exercise-Induced Cardioprotection in Post-Myocardial Infarction Rats[J] Scientific Reports ,2016,6:32424.
[8] MARUYAMA S,NAKAMURA K PAPANICOLAOU K N,et alollitatin-lie 1 promotes cardiac fibroblast activation and protects the heart from rupture[J] EMBO Mol Med,2016,8(8):949-966.
[9] SHIMANO M,OUCHI N.NAKAMURA K,et al.Cardiac myocyte flistatin-like 1 functions to attenuate hypertrophy following pressure overload[J] Proc Natl Acad Sci USA,2011,108(43)-:17581-17582.
[10] OGURA Y,OUCHI N,OHASHI K,et al.Therapeutic impact of flistatin-like 1 on myocardial ischemic injury in preclinical models[J]. Circulation,2012,126(14):1728-1738.
[11] MAGADUM A,SINGH N,KURIAN AA.et al.Ablation of a Single N-Glycosylation Site in Human FSTL 1 Induces Cardiomyocyte Proliferation and Cardiac Regeneration[J].Mol Ther Nucleic Acids,2018,13:133-143.
[12]田振军,郝美丽,席悦抗阻运动激活FSTL1-Akt-mTOR信号通路促进心梗大鼠心肌细胞增殖[J].体育科学, 2018(3):40-47.
[13]郝美丽,席悦,田振军抗阻运动通过刺激骨骼肌FSTL1分泌抑制心梗大鼠心肌细胞凋亡及其机制探讨[J].体育科学, 2020(1):67-78.
[14]席悦,蔡梦昕,田振军.不同运动方式上调FSTL1蛋白表达诱导心梗心脏血管新生[J]体育科学, 2016(10):32-39.
[15] NORHEIM F,RAASTAD T,THIEDE B,et al.Proteomic identification of secreted proteins from human skeletal muscle cells and expression in response to strength training[J].American Journal of Physiology Endocrinology & Metabolism,2011,301(5):E1013-E1021.
[16] RGENS S W,RASCHKE S,HOLVEN K B R,et al.Regulation of flistatinilike protein 1 expression and secretion in primary human skeletal muscle cells[J] Archives of Physiology & Biochemistry,2013, 119(2):75-80.
[17] MIYABE M,OHASHI K SHIBATA R,et al.Muscle-derived flsiatin-like 1 functions to reduce neointimal formation after vascular injury[J]. Cardiovascular Research,2014,103(1)111-120.
[18] LIU X,GU X,LI Z,et al.Neuregulin-1/erbB-activation improves cardiac function and survival in models of ischemic, dilated, and viral cardiomyopathy[J]J Am Coll Cardiol,2006,48(7):1438-1447.
[19] BERSELL K,ARAB S,HARING B,et al.Neuregulin1/ErbB4 signaling induces cardiomyocyte proliferation and repair of heart injury[J]. Cell,2009,138(2):257-270.
[20] GU X,LIU X,XU D,et al. Cardiac functional improvement in rats with myocardial infarction by up-regulating cardiac myosin light chain kinase with neuregulin[J]. Cardiovasc Res,2010,88(2).334-343.
[21] LI B,ZHENG Z,WEI Y,et al.Therapeutic effects of neuregulin-1 in diabetic cardiomyopathy rats[J].Cardiovasc Diabetol,2011,10(1):1-8.
[22] XIAO J,LI B,ZHENG Z,et al.Therapeutic effects of neuregulin-1 gene transduction in rats with myocardial infarction[J]. Coron Artery Dis ,2012,23(7):460-468.
[23] GUO Y F,ZHANG X X,LIU Y,et al.Neuregulin-1 attenuates mitochondrial dysfunction in a rat model of heart failure[J]. Chin Med J (Engl),2012,125(5):807-814.
[24] LAI X,ZHONG L.FU H X,et al. Efects of neuregulin-1 on autonomic nervous system remodeling post-myocardial infarction in a rat model[J].Neural Regen Res 2017,12(11):1905-1910.
[25] GAO R,ZHANG J,CHENG L,et al.A Phase ,randomized,double-blind,multicenter,based on standard therapy,placebocontrolled study of the efficacy and safety of recombinanthuman neuregulin-1 in patients with chronic heart failure[J]J Am Coll Cardiol,2010,55(18): 1907-1914.
[26] WARING C D,VICINANZA C,PAPAL AMPROU A.et al.The adult heart responds to increased workload with physiologic hypertrophy, cardiac stem cell activation,and new myocyte formation[J] Eur Heart J,2014,35(39):2722-2731.
[27] CAI M X,SHI X C,CHEN T,et al. Exercise training activates neuregulin 1/ErbB signaling and promotes cardiac repair in a rat myocardial infarction mode[J]Life Sci,2016,149:1
[28]蔡梦昕,王庆安,田振军抗阻训练对心梗大鼠心肌Neuregulin-1的表征和心脏结构与功能的影响[J].体育科学, 2014(9):23-30.
[29]田振军,薄文艳,李达刚早期间歇运动干预激活心肌NRG1-SERCA2a通路改善心梗大鼠心功能[J.北京体育大学学报, 2019(9):137-147.
[30] ZOU Y,TAKANO H,MIZUKAMI M.et alLeukemia inhibitory factor enhances survival of cardiomyocytes and induces regeneration of myocardium after myocardial infarction[J].Circulation,2003, 108(6):748-753.
[31] KATO, SANO,MIYOSHI,et al.Calmodulin kinases II and IV and calcineurin are involved in leukemia inhibitory factorinduced cardiac hypertrophy in rats[J.Circulation Research,2000,87(10):937-945.
[32] BERRY M F,PIROLLI T J,JAYASANKAR V,et al. Targeted overexpression of leukemia inhibitory factor to preserve myocardium in a rat model of postinfarction heart failure[J].The Journal of Thoracic and Cardiovascular Surgery,2004, 128(6):866-875.
[33]贾单单,田振军, SHAO J.8周间歇运动激活LIF-LIFR-STAT3信号和诱导骨骼肌细胞增殖[J].北京体育大学学报, 2017(10)-44-49.
[34] JIA D,CAI M,XI Y,et al.Interval exercise training increases LIF expression and prevents myocardial infarction-induced skeletal muscle atrophy in rats[J].Life Sci,2017,193:77-86.
[35]贾单单,田振军间歇运动激活LIF/LIFR/STAT3信号促进心梗大鼠心脏血管新生([J].北京体育大学学报, 2018(7):56-63.
[36]田振军,贾单单,蔡梦昕,等歇运动对心梗大鼠心肌LIF及其受体表征和细胞凋亡的影响[J].体育科学, 2015(12):34-40.
[37] GOSPODAROWICZ D,BIALECKI H,GREENBURG G. Purifiation of the fibroblast growth factor activity from bovine brain[J].J Biol Chem, 1978,253(10):3736-3743.
[38] HIDAI C,MASAKO O,IKEDA H,et al.FGF-1 enhanced cardiogenesis in diferentiating embryonal carcinoma cell cultures,which was opposite to the effect of FGF-2[J].Journal of Molecular & Cellular Cardiology,2003,35(4):421-425.
[39] FOROUGH R,WANG X,MARTINEZ-LEMUS L A.et alCll-based and direct gene transfer-induced angiogenesis via a secreted chimeric fibroblast growth factor-1 (sp-FGF-1)in the chick choriallantoic membrane (CAM)[J] Angiogenesis,2003,6(1):47-54.
[40] ENGEL F B p38 MAP kinase inhibition enables proliferation of adult mammalian cardiomyocytes[J] Genes Dev,2005, 19(10)-1175-1187.
[41] LIN HY,LEE D C,WANG H D,et al.Activation of FGF1B Promoter and FGF1 Are Involved in Cardiogenesis Through the Signaling of PKC. but Not MAPK[J] Stem Cells & Development,2015,24(24):2853-2863.
[42] ENGEL F B,HSIEH P C,LEE R T,et al.FGF 1/p38 MAP kinase inhibitor therapy induces cardiomyocyte mitosis,reduces scarring,and rescues function after myocardial infarction[J]Proc Natl Acad Sci USA,2006, 103(42): 15546-15551.
[43] FORMIGA F R,PELACHO B,GARBAYO E,et al.Controlled delivery of fibroblast growth factor-1 and neuregulin-1 from biodegradable micropaticles promotes cardiac repair ina rat myocardial infarction model through activation of endogenous regeneration[J]. Journal of Controlled Release,2014, 173:132-139.
[44]张明,赵应征,马卫成,等FGF1纳米脂质体结合超声靶向微泡爆破技术治疗糖尿病心肌病的实验研究[J].中华心血管病杂志, 2017(5):427-433.
[45] BOULEAU S,GRIMAL H,RINCHEVAL V,et al.FGF1 inhibits p53-dependent apoptosis and cell cycle arrest via an intracrine pathway[J].Oncogene,2006 24(53):7839-7849.
[46] GARBAYO E GAVIRAJ J,DE YEBENES M G,et al.Catheter-based Intramyocardial Injection of FGF1 or NRG 1-loaded MPs Improves Cardiac Function in a Preclinical Model of lschemia-Reperfusion[J] Scientific Reports ,2016,6(1):25932.
[47] PALMEN M,DAEMEN M J A P,DE WINDT L J,et al.Fibroblast growth factor-1 improves cardiac functional recovery and enhances cell survival after ischemia and reperfusion[J].Journal of the American College of Cardiology 2004445)1113-1123.
[48]史秀超间歇运动和rhG- CSF激活FGF 1-PI3K-AKT通路促进心肌细胞增殖改善心梗大鼠心功能[D].西安:陕西师范大学, 2017.
运动中心血管风险属于运动风险中运动条件的风险,目前还未有统一的定义。运动中心血管风险主要包括心血管意外和脑血管意外。遗传或先天性心血管系统异常是年轻人心血管意外的主要原因,而动脉硬化性疾病则是中老年人发生心血管事件的主要原因。运动干预是降...
本研究收集近年来运动干预促进儿童粗大动作发展的随机对照试验(Randomized Controlled Trial,RCT)研究进行Meta分析,旨在把多项结果进行量化分析,为促进3~6岁学龄前儿童的粗大技能发展提出最佳运动干预方案。...
肌间脂肪不仅与代谢性疾病和炎症过程相关,也可能通过影响代谢过程造成骨骼肌细胞的损害,甚至影响肌纤维类型转化,并与骨骼肌的活化动员能力减弱有关,从而与肌力下降和运动功能减退建立确切的联系....