摘要:以荧光碳点为载体, 3-氨丙基三乙氧基硅烷为功能单体, 正硅酸乙酯为交联剂, 牛血红蛋白为模板分子, 采用溶胶-凝胶法制备出对牛血红蛋白具有高选择性识别性能的新型荧光印迹聚合复合材料 .采用红外光谱 (IR) 和扫描电子显微镜 (SEM) 对聚合物进行表征, 结果表明, 分子印迹聚合物包覆在荧光碳点表面, 印迹因子为4.60.此对牛血红蛋白具有高选择性, 相对于卵清蛋白、牛血清蛋白、人血清蛋白的选择因子分别为4.38、4.73和3.66.在最佳条件下, 此对牛血红蛋白的响应线性范围为0.1~10.0μmol/L, 检出限为23.0 nmol/L.将此用于牛血液样品中牛血红蛋白的测定, 回收率为99.0%~102.5%.
关键词:分子印迹; 牛血红蛋白; 荧光碳点;
Fluorescence Carbon Dot-based Imprinted Polymer for Highly Selective Detection of Bovine Hemoglobin
Abstract:A novel fluorescent imprinted polymer with selective recognition of hemoglobin was prepared by the sol-gel method using fluorescent carbon dots as the carrier material, 3-aminopropyltriethoxysilane as the functional monomer, tetraethoxysilane as the crosslinking agent and bovine hemoglobin as template molecule. The results of IR and scanning electron microscopy showed that the molecularly imprinted polymer was coated on the surface of fluorescent carbon dots. The CDs@ MIP showed selective recognition properties for bovine hemoglobin with an imprinting factor of 4. 60. Also the adsorption ability and specific recognition performance of were investigated, and it was found that the CDs@ MIP had high selectivity toward bovine hemoglobin, and the selection factors for ovalbumin, bovine serum albumin and human serum albumin were 4.38, 4.73 and 3.66, respectively. Under the optimal conditions, the linear range of for bovine hemoglobin was 0. 1-10. 0 μmol/L and the detection limit was 23. 0 nmol/L. The CDs@ MIP was successfully used for the determination of bovine hemoglobin in bovine blood samples with recoveries of 99.0%-102.5%.
Keyword:Molecular imprinting; Bovine hemoglobin; Fluorescent carbon dots;
1、引言
分子印迹技术是在交联剂作用下使模板分子与功能单体通过共价或非共价等作用形成聚合物, 脱除模板分子后在聚合物材料上留下与模板分子大小、形状和官能团都互补的三维空穴结构的新技术[1].印迹聚合物具有稳定性高和选择识别性能高等优点[2].荧光型分子印迹聚合物结合了荧光检测技术的高灵敏度和分子印迹聚合物的高选择性, 在复杂基质中检测痕量物质展现出明显优势[3].目前, 制备荧光分子印迹聚合物主要有两种:一种是采用荧光型功能单体[4], 但这类功能单体的制备过程通常比较复杂;另一种方法是将荧光纳米粒子, 如半导体量子点[5]和上转换纳米粒子[6]等包裹在分子印迹聚合物中, 其制备过程相对简便。目前, 荧光印迹聚合物已经成功用于检测溶菌酶[7]、四环素[8]、色氨酸[9]等, 但是绝大部分研究都是采用半导体量子点为荧光源, 这些基于重金属合成的半导体量子点对人和环境的毒害较大[10].因此, 探索简便、绿色的新型荧光印迹聚合物制备方法非常重要。
荧光碳点 (CDs) 是一种新型碳材料量子点[11~13].相较于传统的半导体量子点和有机染料, 碳点具有低毒性、生物相容性、抗光漂白性、易于合成和功能化等优点, 但未经修饰的碳点通常量子产率低[14].研究者开发了化学还原法[15]、光化学还原[16]、碳点表面钝化[17]和碳点表面修饰[18]等技术提高碳点量子点产率;而基于荧光碳点的分子印迹聚合物也已成功制备, 并应用于环境污染物[19,20]、金属离子[21]、生物分子[22~25]等的检测, 而关于碳点的蛋白印迹聚合物的研究还比较少。
本研究首先通过水热法合成裸CDs, 然后用聚乙烯亚胺修饰CDs, 通过溶胶-凝胶反应固定CDs于BHb印迹层中。制备得到的荧光印迹聚合物 结合了碳点优良的荧光性能和分子印迹技术的高选择性, 为蛋白检测提供了高选择性和高灵敏度的快速检测方法。
2、实验部分
2.1 仪器与试剂
SIGMA HD场发射扫描电子显微镜 (德国蔡司公司) ;Nicolet i S10型傅里叶变换红外光谱仪 (美国尼高力公司) ;F-7000荧光光谱仪 (日本日立公司) ;UV-2550紫外-可见分光光谱仪、LC2010AHT高效液相色谱 (日本岛津公司) .
牛血红蛋白 (BHb) 、牛血清白蛋白 (BSA) 、卵清蛋白 (OVA) 和人血清蛋白 (HSA) 购自Sigma公司;抗坏血酸 (Ascorbic acid) 、聚乙烯亚胺 (PEI) 、3-氨丙基三乙氧基硅烷 (APTES) 、四乙氧基硅烷 (TEOS) 、Triton X-100 (Tri, 纯度>99%) 、氨水溶液 (NH3·H2O, 25%~28%, w/V) 购自北京梦怡美生物科技有限公司。肝素钠抗凝牛血液购自鸿泉生物科技有限公司。其它试剂均为分析纯;实验用水为二次蒸馏水。
2.2 荧光印迹材料制备
2.2.1 荧光碳点制备
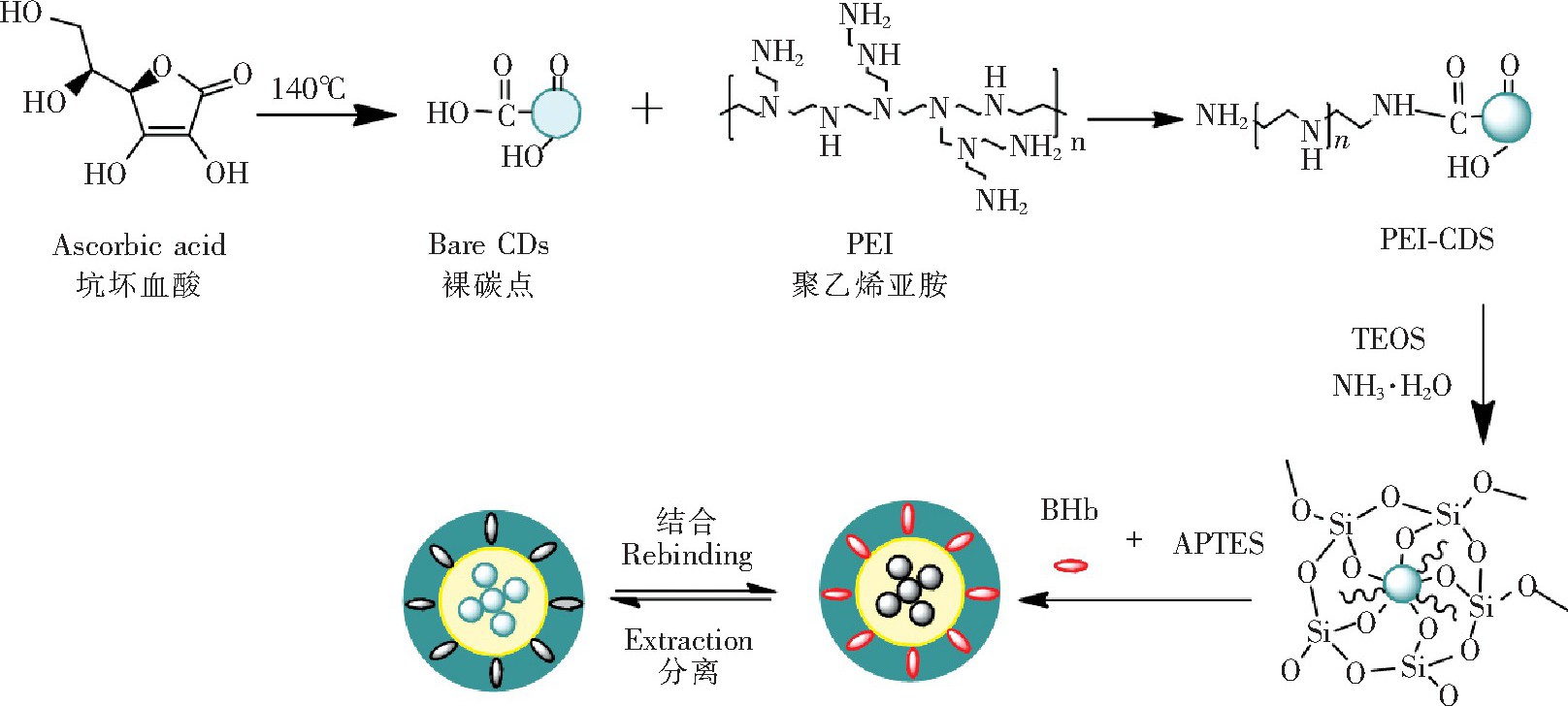
荧光碳点的制备参考文献[24]的方法并稍做修改。称取0.40 g抗坏血酸分散于14.0 m L蒸馏水和6.0 m L无水乙醇的混合液中, 将混合物转移到高压反应釜中, 140℃反应1.0 h.取出反应液, 待冷却至室温后加入1.0 m L PEI, 70℃下搅拌3.0 h.将得到的混合溶液用蒸馏水透析出多余的前体。最终所得产物在60℃下真空干燥2.0 h, 得到荧光CDs, 以水配制成1.2 g/L CDs溶液, 备用。
2.2.2制备
向20.0 m L 1.2 g/L CDs溶液中加入0.12 m L TEOS和0.20 m L NH3·H2O (25%, w/V) , 在室温下搅拌1.0 h得混合溶液1.取20.0 mg BHb溶于5.0 m L蒸馏水中, 加入0.08 m L APTES, 在室温下搅拌30.0 min得混合溶液2.将混合液2加入到混合液1中, 在室温下继续搅拌反应6.0 h.离心, 用蒸馏水洗去未反应的单体和产生的低聚物, 再用0.5%Tri洗脱印迹聚合物中的牛血红蛋白, 重复多次, 直到采用紫外-可见分光光度计在406 nm处检测不到模板蛋白为止。在50℃下真空干燥3 h, 得到荧光印迹聚合物。
荧光非印迹聚合物 制备与上述过程相同, 只是不加入模板分子。
2.3 性能表征
分别采用扫描电子显微镜表征印迹材料的形貌, 傅里叶变换红外光谱仪测定材料的红外光谱图, 荧光光谱仪测定荧光材料的荧光光谱图。荧光测试时激发波长为375 nm, 激发和发射的狭缝宽均为10 nm, 光电倍增压为500 V.使用高效液相色谱验证实际样品中的BHb浓度。色谱柱为Spherigel C18柱 (250 mm×4.6mm, 5μm) .流动相为p H 7.0的50 mmol/L磷酸盐缓冲液, 流速为0.5 m L/min.注射样品体积为10.0μL, UV检测器的波长为406 nm.所有检测的溶液用0.45μm聚四氟乙烯膜过滤。
2.4 牛血红蛋白荧光检测原理
当未结合BHb时, 印迹层包裹的碳点被光激发时, 会产生明显的绿色荧光;当和BHb溶液混合时, 由于印迹层中存在与模板蛋白大小、形状和官能团互补的结合位点, 模板蛋白可与印迹位点结合, 这时印迹层内的碳点上的电子转移到BHb, 导致碳点的荧光发射减弱, 发生的荧光猝灭现象[27], 且BHb对的荧光猝灭遵循Stern-Volmer方程[8]:
其中, F0是不存在BHb时或的初始荧光强度, F是BHb存在下的荧光强度, KSV是BHb的猝灭常数, C是BHb的浓度。
CDs@MIP和
CDs@NIP的猝灭常数KSV之间的比值定义为印记因子 (IF) , 用于评估该材料的选择性;F0/F-1为猝灭效应[28], 用于评估分析物对该材料的荧光影响强度。
2.5 荧光印迹聚合物识别性能
2.5.1 响应时间的影响
通过动态吸附实验测定荧光印迹材料对BHb的吸附速率。分别称取
CDs@MIP和
CDs@NIP 7.0 mg, 加入到5.0 m L 10.0μmol/L BHb溶液中, 室温下振荡吸附, 每隔4 min测定印迹聚合物和非印迹聚合物的荧光强度变化。
2.5.2 吸附容量
通过等温吸附实验测定荧光印迹材料对BHb的吸附性能。分别称取20.0 mg
CDs@MIP和
CDs@NIP加入到10.0 m L 20.0μmol/L BHb溶液中, 在室温下振荡吸附20 min.离心分离, 采用紫外-可见分光光度计分别测定上清液中BHb浓度。
2.5.3 荧光响应性能
称取
CDs@MIP和
CDs@NIP 7.0 mg加入到5.0 m L系列浓度 (0.1~10.0μmol/L) 的BHb溶液中孵育20 min后, 分别检测印迹聚合物和非印迹聚合物的荧光强度。
2.5.4 选择性识别
分别称取多份
CDs@MIP和
CDs@NIP 7.0 mg加入到5.0 m L 5.0μmol/L的OVA、BSA、HSA和BHb溶液中孵育20 min, 测定溶液中印迹聚合物和非印迹聚合物的荧光强度。考察不同蛋白质存在下印迹聚合物和非印迹聚合物荧光强度变化情况 (ΔF=F0-F, 其中F0为不加蛋白质时聚合物溶液的荧光强度, F为蛋白质存在下混合溶液的荧光强度) .
2.5.5 实际样品分析
用0.2 mol/L磷酸盐缓冲溶液 (PBS, p H=7.0) 将牛血液稀释1000倍。
CDs@MIP的浓度为1.4 g/L, 在样品中添加不同质量的BHb, 测定溶液的荧光强度, 并计算加标回收率。
3、结果与讨论
3.1 聚合物制备及表征
CDs@MIP的制备过程如图1所示。通过水热法制备具有强荧光的荧光碳点, 然后采用PEI对荧光碳点表面进行改性, 以进一步提高碳点的荧光性能。在氨水存在下, 采用溶胶-凝胶技术在荧光碳点表面修饰硅层, 然后以APTES为功能单体, 牛血红蛋白模板分子通过非共价键结合, 得到的复合产物再与硅修饰碳点表面的交联剂TEOS反应, 生成印迹聚合层。最后用0.5%Tri溶液洗脱聚合层中的模板蛋白, 制得荧光印迹聚合物。
3.1.1 制备条件优化
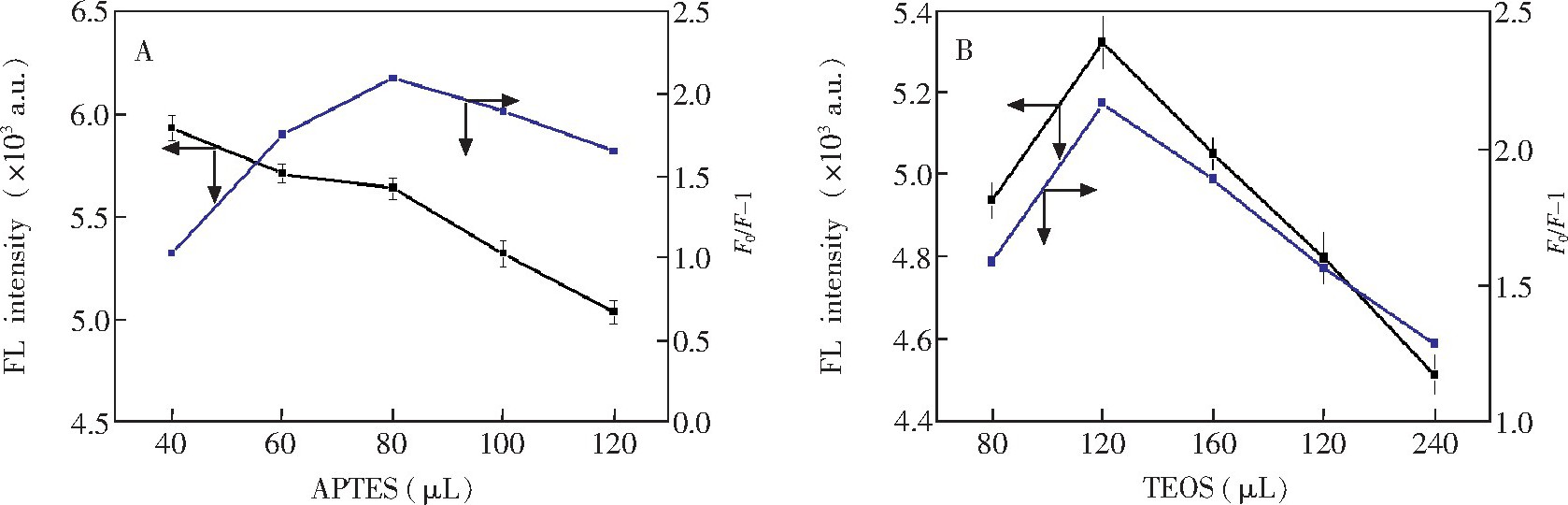
通过改变APTES和TEOS的用量考察功能单体和交联剂对荧光印迹聚合物性能的影响。如图2A所示, 随着APTES量增加,
CDs@MIP的荧光强度逐渐降低, 而
CDs@MIP的荧光猝灭效应先升高, 然后降低。综合考虑到APTES对
CDs@MIP的猝灭效应和
CDs@MIP荧光强度的影响, APTES最佳用量为0.08 m L.基于相同的考虑, 如图2B所示, 合成分子印迹聚合物时, 选择TEOS最佳用量为0.12 m L.
3.1.2 聚合物表征
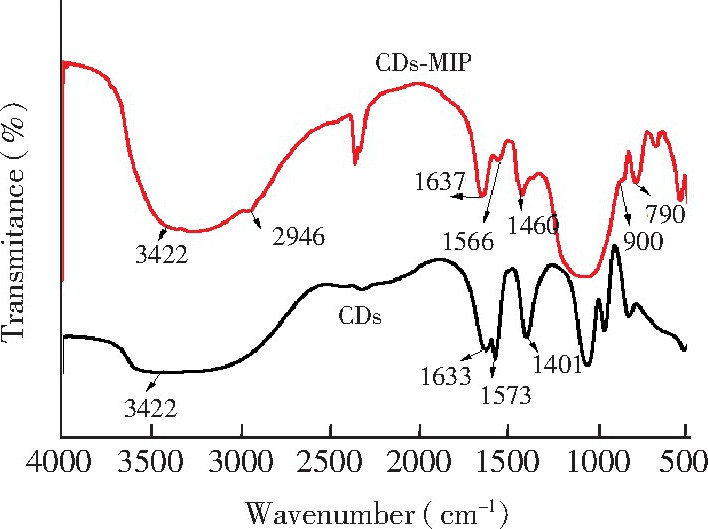
图3是CDs和
CDs@MIP的红外光谱图。在CDs的红外光谱图中, 3422 cm-1处为O-H/N-H的振动峰, 1633 cm-1处为 C-O的振动峰, 1573和1401 cm-1处为-NH2的振动峰。与CDs的红外光谱图相比,
CDs@MIP的红外光谱图中出现了新的吸收峰, 其中900 cm-1处为Si-O-Si不对称拉伸峰, 790 cm-1处为Si-O振动峰, 2946 cm-1处是C -H拉伸带峰, 这表明碳点已被印迹材料包裹。
扫描电子显微镜图 (图4) 中, 非印迹材料和印迹材料都可以观察到发生联结的球状颗粒, 表明聚合物成功包裹在碳点表面, 且
CDs@NIP的表面更致密 (图4A,
CDs@MIP (图4B) 的表面更粗糙和疏松, 这有利于提高印迹材料的吸附能力。
3.2 荧光印迹聚合物性能
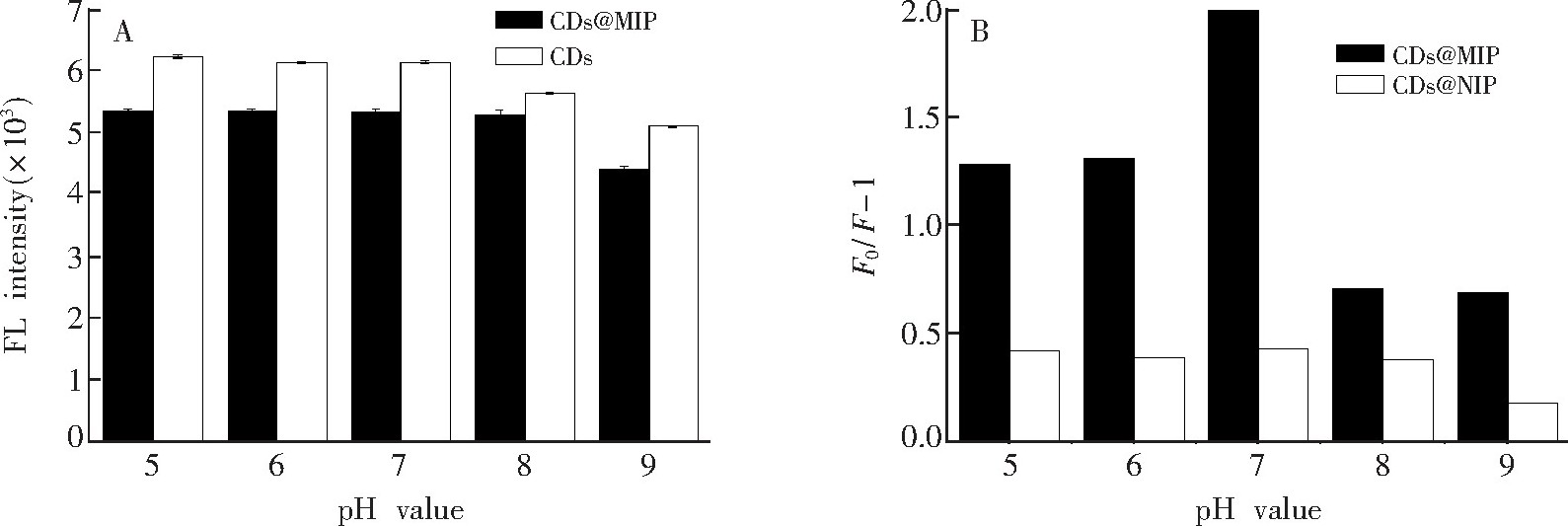
3.2.1 溶液p H值影响
溶液的p H值可能会影响印迹聚合物的荧光性质和BHb的三维结构以及电荷分布, 因此测定在不同p H值下CDs和
CDs@MIP的荧光强度以及牛血红蛋白对
CDs@MIP和
CDs@NIP的猝灭效应。如图5A所示, p H值在5.0~8.0的范围内,
CDs@MIP的荧光强度几乎不变;当p H=9.0时,
CDs@MIP的荧光强度明显降低。这是由于
CDs@MIP的荧光都源于荧光碳点, 而碳点的荧光在较强碱性条件下减弱[26].如图5B所示,
CDs@MIP和
CDs@NIP的最大猝灭效应都发生在溶液p H=7.0时。当p H>7.5时, 印迹的硅层会电离, 模板蛋白和印迹位点作用力会减弱[27].选择0.2 mol/L PBS (p H 7.0) 作为最佳荧光检测条件。
3.2.2 响应时间
实验结果表明, 随着孵化时间的增加,
CDs@NIP和
CDs@MIP的荧光强度均快速下降并逐渐达到稳定值。
CDs@MIP对BHb达到吸附平衡时间约为20.0 min, 而
CDs@NIP的吸附平衡的时间为12.0 min, 这是因为
CDs@NIP对模板蛋白的吸附主要依靠其表面的非特异性吸附, 因而达到吸附平衡时间短。因此, 后续实验响应时间为20.0 min.
3.2.3 吸附容量
CDs@MIP和
CDs@NIP对BHb的吸附容量按下式计算[29]:
其中, Q为聚合物的吸附容量 (μmol/g) ;C0和C分别为溶液吸附前BHb的浓度和吸附饱和后BHb的浓度 (μmol/L) ;V是溶液体积 (L) ;m表示聚合物的质量 (g) .经计算得出
CDs@MIP对BHb的吸附容量为1.75μmol/g,
CDs@NIP对BHb的吸附容量为0.37μmol/g.相对于
CDs@NIP,
CDs@MIP具有较大的吸附容量, 这是由于印迹聚合物壳层内含有对模板分子特异吸附的结合位点。
3.2.4 重现性和稳定性
对以相同方法制备的5批
CDs@MIP的荧光强度分别进行3次平行测定, 结果显示,
CDs@MIP的荧光强度的相对标准偏差RSD<4.7%.在最大发射峰375 nm处每隔10 min检测
CDs@MIP荧光强度, 结果表明, 在60 min内
CDs@MIP的荧光强度几乎维持不变;放置5天后检测其荧光强度,
CDs@MIP仍然保留其初始荧光强度的93.8%, 表明荧光印迹聚合物具有良好的荧光稳定性。
3.2.5 BHb对荧光印迹聚合物的荧光猝灭效应
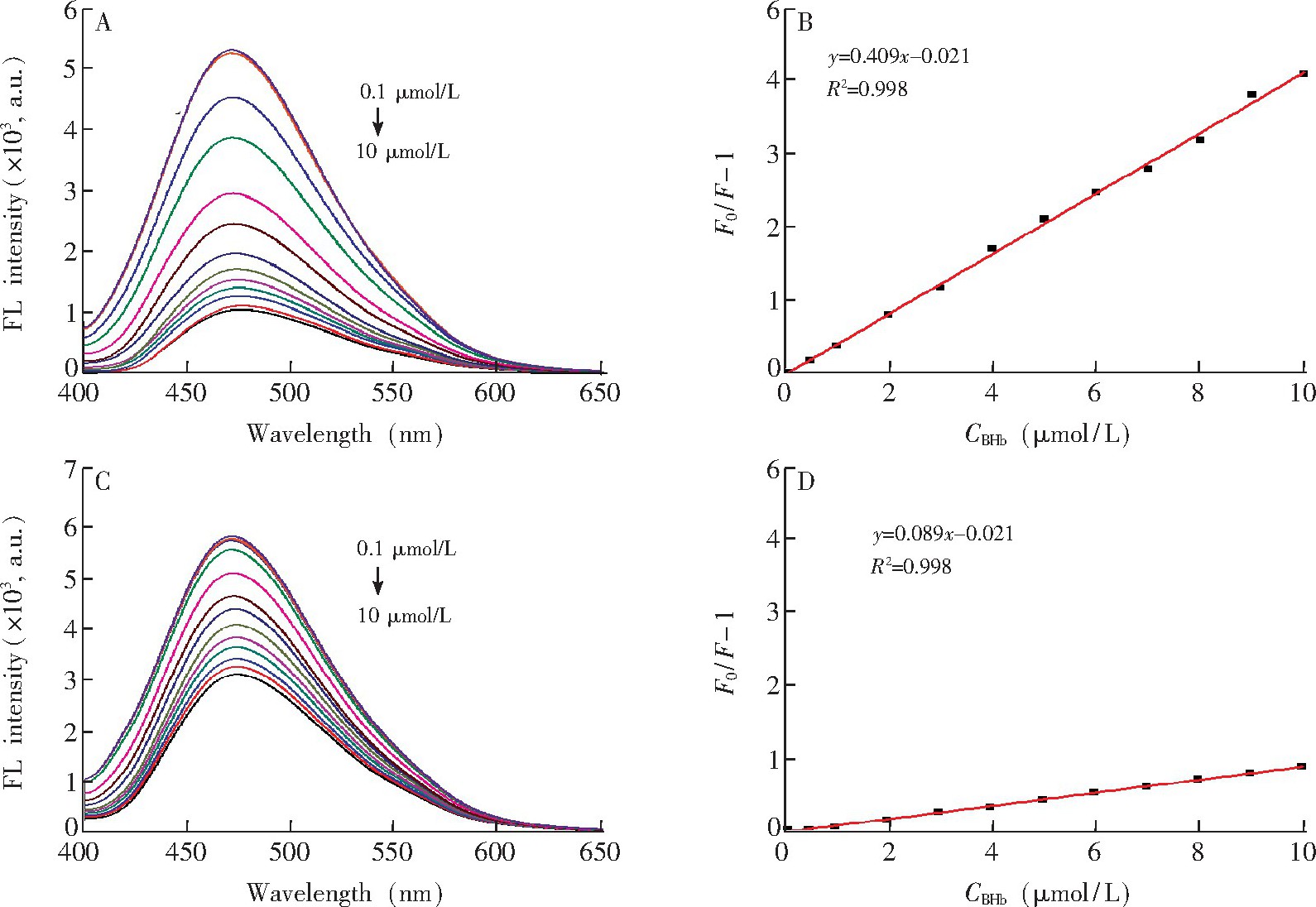
如图6所示, 随着BHb浓度的增加,
CDs@MIP和
CDs@NIP的荧光强度逐渐降低。在相同BHb浓度下,
CDs@MIP荧光强度的降幅远大于
CDs@NIP.这是由于在
CDs@MIP中存在对BHb的特异吸附的印迹位点, 而
CDs@NIP中不存在印迹位点, 只存在非特异性吸附。体系的荧光猝灭遵循Stern-Volmer方程。如图6B所示, 在BHb浓度为0.1~10.0μmol/L的范围内,
CDs@MIP的荧光猝灭效应 (F0/F-1) 对BHb浓度 (C) 的线性关系良好, 相关系数为0.998.使用KsvMIP和KsvNIP的比值即印迹因子 (IF) 评估印迹材料的选择性, 经计算得IF为4.60, 表明
CDs@MIP具有对BHb高选择性识别的能力。
CDs@MIP对BHb的检出限为23.0 nmol/L (3σ/S) .
3.2.6 荧光印迹聚合物的特异选择性
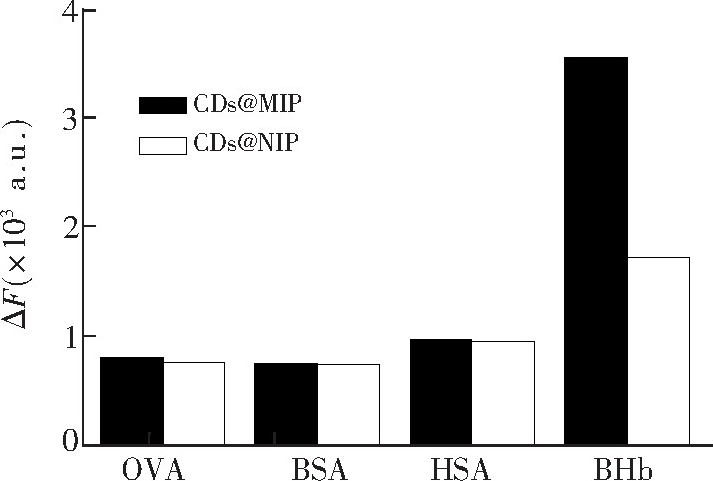
荧光印迹聚合物的选择吸附实验结果见图7, OVA、BSA、HSA对
CDs@MIP和
CDs@NIP荧光强度影响差别很小;而BHb对于
CDs@MIP的荧光猝灭效应明显大于
CDs@NIP, 表明
CDs@MIP对模板分子BHb具有较高的选择性识别特性。这是由于合成的荧光印迹聚合物中具有对模板分子BHb特定识别的印迹位点, 而其它的类似物与模板分子的形状和大小、表面的官能团等存在差异, 因此不被特异性吸附而对其荧光强度影响小。
采用选择因子 (α) 进一步表征
CDs@MIP特异识别能力。选择因子 (α) 定义如下[30]:
式中, △F (A) 和△F (B) 分别为
CDs@MIP对模板蛋白BHb和其它蛋白的荧光强度响应值。经计算得
CDs@MIP对OVA、BSA、HSA的选择因子分别为4.38、4.73和3.66, 表明
CDs@MIP对BHb具有良好的选择性。
3.3 荧光印迹聚合物的应用
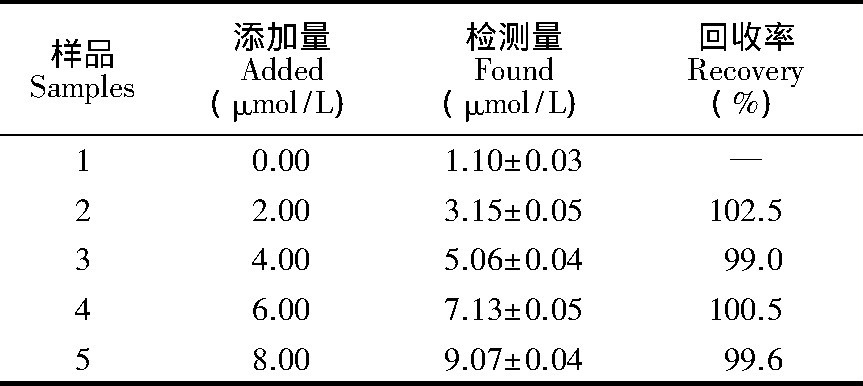
用高效液相色谱检测1000倍稀释的牛血液中BHb浓度为 (1.12±0.04) μmol/L, 结果与
CDs@MIP的检测结果一致, 如表1所示, 牛血液中BHb的回收率为99.0%~102.5%, 表明
CDs@MIP可用于实际生物样品中BHb的检测。不同荧光方法检测BHb的性能比较见表2.
4、结论
以聚乙烯亚胺修饰后的荧光碳点为荧光源和载体, 采用溶胶-凝胶法制备了高灵敏度和高选择性的荧光牛血红蛋白印迹聚合物。在优化的检测条件下, 此荧光印迹聚合物成功应用于实际样品中牛血红蛋白的选择性识别和检测。本方法具有制备条件温和、过程简便、检测速度快、灵敏度高等优点, 为复杂环境中蛋白快速灵敏检测提供了新方法。
参考文献
[1] Mosbach K, Ramstr9m O.Bio/technol., 1996, 14 (2) :163-170
[2] MA Xiong-Hui, LI Jian-Ping, WANG Chao, XU Guo-Bao.Chinese J.Anal.Chem., 2016, 44 (1) :152-159马雄辉, 李建平, 王超, 徐国宝。分析化学, 2016, 44 (1) :152-159
[3] Liu Y B, Huang S, Li Z, Zhao M P.Adv.Biochem.Engineer.Biotechnol., 2015, 150:1-20
[4] Cheng Y, Jiang P, Lin S, Li Y N, Dong X C.Sens.Actuators B, 2014, 193 (Suppl 1) :838-843
[5] XU Wan-Zhen, QIU Chun-Xiao, HUANG Wei-Hong, LIU Hong, YANG Wen-Ming.Chem.J.Chinese Universities, 2017, 38 (7) :1155-1162徐婉珍, 邱春孝, 黄卫红, 刘鸿, 杨文明。高等学校化学学报, 2017, 38 (7) :1155-1162
[6] Ma Y X, Wang L Y.Talanta, 2014, 120 (1) :100-105
[7] ZHANG Xin, JIANG Rui, YANG Shu, SUN Li-Quan, PANG Si-Ping, LUO Ai-QinChinese Journal of Chromatography, 2017, 35 (3) :252-254张鑫, 姜锐, 杨戍, 孙立权, 庞思平, 罗爱芹。色谱, 2017, 35 (3) :252-254
[8] Zhang L, Chen L G.ACS Appl.Mater.Interfaces, 2016, 8 (25) :16248-16256
[9] Tiradoguizar A, Paraguaydelgado F, Pinaluis G E.Methods Appl.Fluores., 2016, 4 (4) :045003
[10] Reschgenger U, Grabolle M, Cavalierejaricot S, Nitschke R, Nann T.Nat.Methods, 2008, 5 (9) :763-775
[11] TANG Zhi-Jiao, LI Gong-Ke, HU Yu-Ling.Journal of Instumental Analsis, 2015, 34 (8) :970-978唐志姣, 李攻科, 胡玉玲。分析测试学报, 2015, 34 (8) :970-978
[12] FU Peng, ZHOU Li-Hua, TANG Lian-Feng, CAI Qian-Qian, YUAN Yong.Chinese J.Appl.Chem., 2016, 33 (7) :742-755傅鹏, 周丽华, 唐连凤, 蔡茜茜, 袁勇。应用化学, 2016, 33 (7) :742-755
[13] LIU Xue-Ping, YANG Juan, BAI Yan.Chinese J.Anal.Chem., 2016, 44 (5) :804-808刘雪萍, 杨娟, 白燕。分析化学, 2016, 44 (5) :804-808
[14] Peng H, Li Y, Jiang C L, Luo C H, Qi R J, Huang R, Duan C G, Jadranka T S.Carbon, 2016, 100:386-394
[15] Sadhanala H K, Khatei J, Nanda K K.RSC Adv., 2014, 4 (22) :11481-11485
[16] Sun H J, Li W, Nan G, Ren J S, Qu X G.ACS Appl.Mater.Interfaces., 2013, 5 (3) :1174-1179
[17] Liu J, Liu X L, Luo H J, Gao Y F.RSC Adv., 2014, 4 (15) :7648-7654
[18] Zhang Y Q, Liu X Y, Fan Y, Guo X Y, Zhou L, Lv Y, Lin J.Nanoscale, 2016, 8 (33) :15281-15288
[19] Liu G L, Chen Z, Jiang X Y, Feng D Q, Zhao J Y, Fan D H, Wang W.Sens.Actuators B, 2016, 228:302-307
[20] Hao T F, Wei X, Nie Y J, Xu Y Q, Yan Y S, Zhou Z P.Microchim.Acta, 2016, 183 (7) :2197-2203
[21] Jiang Y L, Wang Z Y, Dai Z H.ACS Appl.Mater.Interfaces, 2016, 8 (6) :3644-3650
[22] Zuo P L, Gao J F, Peng J, Liu J H, Zhao M M, Zhao J H, Zuo P J, He H.Microchim.Acta, 2016, 183 (1) :329-336
[23] Wang H, Yi J H, Velado D, Yu Y Y, Zhou S Q.ACS Appl.Mater.Interfaces, 2015, 7 (29) :15735-15745
[24] Li D Y, Zhang X M, Yan Y J, He X W, Li W Y, Zhang Y K.Biosens.Bioelectron., 2016, 79:187-192
[25] Paramita K, Ekta R, Santanu P, Deepak K, Rashmi M, Prashant K.S.Biosens.Bioelectron., 2016, 78:454-463
[26] Han B F, Wang W X, Wu H Y, Fang F, Wang N Z, Zhang X J, Xu S K.Colloid.Surface.B, 2012, 100 (12) :209-214
[27] Wang X, Cao L, Lu F S, Mezaani M J, Li H T, Qi G, Zhou B, Harruff B A, Kermarrec F, Sun Y P.Chem.Commum., 2009, 46 (25) :3774-3776
[28] Zhang Z, Li J H, Wang X Y, Shen D Z, Chen L X.ACS Appl.Mater.Interfaces, 2015, 7 (17) :9118-9127
[29] Yin Y L, Yan L, Zhang Z H, Wang J.Talanta, 2015, 144:671-679
[30] Feng L M, Tan L, Li H, Xu Z G, Shen G X, Tang Y W.Biosens.Bioelectron., 2015, 69:265-271
[31] Tan L, Huang C, Peng R F, Tang Y W, Li W M.Biosens.Bioelectron., 2014, 61:506-511
[32] Li D Y, He X W, Chen Y, Li W Y, Zhang Y K.ACS Appl.Mater.Interfaces, 2013, 5:12609-12616
[33] Guo T, Deng Q L, Fang G Z, Gu D H, Yang Y K, Wang S, Biosens.Bioelectron., 2016, 79:341-346
[34] Mei F, He X W, Li W Y, Zhang Y K.J.Fluoresc., 2008, 18:883-890