摘 要: PPM1A, 又称PP2Cα, 即镁离子依赖的蛋白磷酸酶1A, 是丝氨酸/苏氨酸蛋白磷酸酶家族一员, 该家族被认为是真核细胞压力应答通路中必需的负向调控因子。近年来的研究结果表明, PPM1A可与多种蛋白结合使其去磷酸化, 广泛调控如细胞生长、细胞应激、免疫反应和肿瘤形成等众多生命活动。本文对PPM1A的结构、活性调控和作用底物做一个简要的综述, 以期对PPM1A有一个全面的了解进而有助于后期的进一步研究。
关键词: PPM1A; 蛋白磷酸酶; 信号通路;

可逆的蛋白质磷酸化修饰在蛋白质活性调控方面起着非常重要的作用, 参与到几乎每一个主要的生理过程中。蛋白磷酸酶是一类具有催化已经磷酸化的蛋白质分子发生去磷酸化反应的酶分子, 与蛋白激酶相对应存在, 共同构成了磷酸化和去磷酸化这一重要的蛋白质活性的开关系统。蛋白激酶通过对底物的磷酸化起到调控的作用, 而蛋白磷酸酶可以通过将磷酸基团脱去的方式发挥反向作用, 这种可逆的磷酸化作用保证了信号分子功能的平衡稳定[1]。以前, 大部分的注意力都集中在蛋白激酶及其调控作用上, 而磷酸酶仅被看做是简单持家基因编码的酶。但是随着对于蛋白磷酸酶了解的深入, 发现这类酶在涉及到磷酸化作用的细胞通路精确调控方面起的作用丝毫不亚于蛋白激酶[2]。
通过序列分析发现, 人体中大约存在150种蛋白磷酸酶, 按照作用底物可以分为以下三类:酪氨酸蛋白磷酸酶 (protein tyrosine phosphatases, PTP, 38种) 家族;丝氨酸/苏氨酸蛋白磷酸酶 (protein serine/threonine phosphatases, PS/TP, 40种) 家族;双特异性丝氨酸/苏氨酸/酪氨酸磷酸酶 (Dual-specificity phosphatases, DUSP, 68种) 。PS/TP通过使蛋白质上丝氨酸和苏氨酸脱去磷酸基而控制细胞的功能, 根据其结构的不同分为依赖金属离子的蛋白磷酸酶 (metal-dependent protein phophatase, PPM) ;磷蛋白磷酸酶 (phosphoprotein phosphatases, PPP) 和FCP/SCP (TFIIF-associating component of RNA polymerase II/small CTD phosphatase) 家族[3]。
PPM家族, 也称为PP2C家族, 具有Mg2+或Mn2+依赖性, 为单体磷酸酶, 由一个催化亚基构成, 没有调节亚基, 但包含额外的结构域和具有保守性的序列来决定底物特异性。截止到目前为止, 至少有16种不同的PP2C的基因, 通过选择性剪切的方式, 可编码至少22种的不同的PP2C同工酶。PP2C家族蛋白定位于细胞浆和细胞核, 可以特异性的结合多种底物进行去磷酸化修饰作用。该家族被认为是真核细胞压力应答通路中必需的负向调控因子[4,5]。
PPM1A (protein phosphatase magnesium-dependent 1A) , 又称PP2Cα, 是一种常见的蛋白磷酸酶, 是PP2C家族最具特征性的成员。它是1992年在大鼠肝组织和人类畸胎瘤组织文库中被首次鉴定, 1996年晶体结构被解析出来, 之后其发生反应时的化学机制也被分析出来。人的PPM1A基因位于14号染色体上, 位置是14q23.1, 小鼠中的基因位于12号染色体上, 位置是12C3。下面, 我们对PPM1A的结构、活性调控和作用底物做一个简要的综述。
一、PPM1A结构
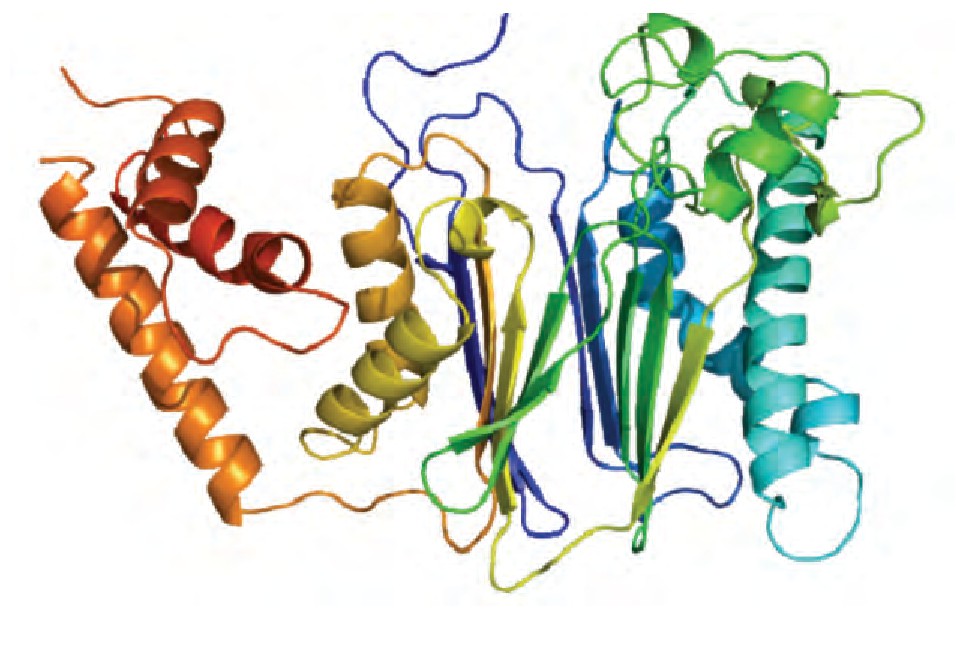
PPM1A由两个结构域构成, 位于N端的催化结构域和C端的蛋白结合结构域。晶体结构显示了PPM1A新型的蛋白折叠方式:催化结构域的中心为结合两个锰离子的β夹层 (β-sandwich) , 周围围绕α螺旋 (α-helices) 结构。结合锰离子的水分子在金属离子双核中心与底物的磷酸基团协作, 在去磷酸反应中提供亲核酸基团。Jackson等[6]报导PPM1A的Asp239和Arg 174对其磷酸酶活性至关重要, 并且单位点突变的PPM1A D239N和PPM1A R174G的磷酸酶活性将会持续丧失。其C端是保守结构域, 在PPM1A与底物的结合中发挥重要作用。另外, 人类PPM1A的C端结构域有约90个氨基酸残基, 由α螺旋组成, 距离催化中心的位置较远, 推测可能与特异性结合底物有关 (PPM1A的一级和二级结构分别见图1和图2) 。
图1 PPM1A的一级结构图

图2 PPM1A的二级结构 (图片来源wikimedia)
二、PPM1A的活性调控
不同于PPP蛋白磷酸酶家族, 一般以形成同源或者异源多聚体的形式来发挥功能, 其活性调节主要依赖于抑制性蛋白和调节亚基的功能。PPM家族以单体形式存在, 虽然其活性依赖于的金属离子如Mg2+或Mn2+, 但是由于正常生理状况下, 细胞内的这些金属离子的的浓度不会有较大幅度的波动, 所以在正常生理情况下, 这些二价阳离子不大会影响到PPM的活性。故其活性的调节可能有以下几种形式:组织或者细胞的特异性表达水平、翻译后修饰、亚细胞定位和降解[5]。
三、PPM1A的功能
在体内, PPM1A底物非常广泛, 可与多种蛋白结合使其去磷酸化, 并广泛调控如细胞生长、细胞应激、免疫反应、肿瘤形成等众多生命活动。已有研究表明, PPM1A对以下信号通路和分子有调节作用:
(一) AMPK
PPM1A调节细胞应激通路的第一手资料来自于Davies和同事, 他报道了PPM1A能够去磷酸化并失活腺苷一磷酸活化的蛋白激酶 (AMP activated protein kinase, AMPK) 信号通路[7]。AMPK能够通过感受细胞能量状态来维持真核细胞的ATP生成和消耗的平衡, 即能量稳态, 是蛋白激酶级联反应中的核心组成成分。多种应激反应, 尤其是与ATP耗竭有关的, 如缺氧、热休克和代谢性中毒等均可激活AMPK。
(二) MAPK (JNK/p38)
已有研究表明, PPM1A可抑制由紫外线辐射、热休克、渗透压休克和创伤等环境压力引起的p38和JNK/MAPK激酶级联通路的激活。进一步的研究表明, JNK的上游激酶MKK4和MKK7, 以及p38的上游激酶MKK3b和MKK6b, 均可成为PPM1A的底物, 并被去磷酸化[8]。此外, Takekawa等[9]发现, PPM1A也能够与p38相互作用。有趣的是, 他们之间的结合只有在细胞应激状态下才能够检测到, 这表明PPM1A只能与细胞应激状况下, 磷酸化形式存在的p38相互作用。
与JNK和p38通路不同的是, 并没有发现PPM1A影响ERK通路的激活。因为不同MAPK家族有不同的分工, ERK主要参与细胞的增殖分化的调控。多种生长因子受体、营养相关因子受体等都需要ERK的活化来完成信号转导过程;JNK家族是细胞对各种应激原诱导的信号转导的关键分子, 参与细胞对辐射、渗透压、温度变化等应激反应;p38主要介导炎症、凋亡等。这些结果表明PPM1A可以选择性地抑制不同的细胞应激信号通路[10]。
(三) CDK
PPM1A可以通过和细胞周期蛋白依赖的激酶 (cyclin-dependent protein kinase, CDK) 结合, 并通过去磷酸化作用参与细胞周期调控。Cheng等 (2000) 最初报道, 酵母中PP2Cs家族的Ptc2和Ptc3能够在体内和体外去磷酸化并失活负责酵母出芽生殖的激酶Cdc28p。随后该团队又在人类的Hela细胞中发现, PPM1A和PP2C家族的其他酶, 负责了超过99%的CDK2的去磷酸化[11,12]。此外, 有研究人员发现PPM1A能对CDK9 T-loop上的Thr186位去磷酸化, 使得CDK9不能行使正性转录延伸因子b (positive transcription elongation factor b, P-TEFb) 的功能[12]。
(四) p53/MDM2
Ofek等[13]发现在293T细胞里面过表达PPM1A可导致细胞不能够增殖和形成克隆, 同时他们还发现, 过表达PPM1A能够使细胞周期停滞于G2/M期并引起细胞凋亡。进一步研究表明, PPM1A能够同时上调p53的蛋白表达量和转录活性, 以及下游基因p21的表达, 导致细胞周期停滞于G2/M期并引起细胞凋亡[14]。
(五) TGF-β/Smad
TGF-β是一种多功能的细胞因子, 它以细胞或背景依赖的方式发挥着肿瘤抑制或肿瘤促进的作用[15]。通常认为, 在肿瘤发生的早期阶段, 它可直接作用于癌细胞来抑制肿瘤生长。当癌症发展过程中引入突变或表观遗传修饰时, TGF-β信号通路的肿瘤抑制臂丧失, 转而促进那些支持肿瘤发展的过程, 包括细胞增殖、免疫抑制、血管生成、癌症干细胞自我更新、上皮间质转化等[16]。事实上人类的大多数肿瘤中TGF-β信号通路依然有功能, 所以通常认为, TGF-β在促进肿瘤侵袭和转移中的作用要超过它的抑制肿瘤的作用。
冯新华教授的团队发现PPM1A可以特异性对活化的p-smad2/smad3蛋白去磷酸化, 并促smad2/3蛋白的出核, 进而终止TGF-β信号通路, 并且在哺乳动物细胞中敲除PPM1A能够增强TGF-β信号, 在斑马鱼中敲除PPM1A影响其生长发育, 该项发现扩充了PPM1A的底物类型和其作用的信号通路[17]。随后该团队还发现, PPM1A能够对smad1去磷酸化, 从而调节TGF-β超家族中的骨形态蛋白信号通路[18]。此外, 该团队还发现, PPM1A能够与smad2/3的出核转运子 (nuclear exporter) RanBP3结合, 并对其Ser 58进行去磷酸化, 进而增强其转运smad2/3出核, 进而终止TGF-β信号通路的能力[19]。之后另有研究人员发现TGF-β通路上二氢神经鞘氨醇-1-磷酸 (dihydrosphingosine 1-phosphate, dhS1P) 和鞘氨醇-1-磷酸 (sphingosine 1-phosphate, S 1 P) 的去磷酸化修饰也是依赖PTEN/PPM 1 A途径[20]。
(六) Wnt/Axin
PPM1A可以去磷酸化Axin, 缩短其半衰期, 解除Axin介导的对LEF-1依赖的转录的抑制, 进而活化Wnt通路。Wnt信号通路和LEF-1依赖的转录可以促进肿瘤的增殖和恶性转化[21]。这些结果表明, 除了抑制细胞生长, 在某些特定条件下, PPM1A也能够促进细胞生长。
(七) NF-κB
NF-κB信号通路在细胞因子诱导的基因表达中起关键性的调控作用, 它通过调控多种基因的表达, 参与免疫反应、炎症反应、细胞凋亡、肿瘤发生等多种生物进程。NF-κB信号在人类疾病, 尤其是炎症性疾病和癌症中起重要的促进作用。PPM1A可以对NF-κB通路的RelA (p65) 的Ser 536和Ser 276去磷酸化, 进而选择性的抑制NF-κB的转录活性, 导致单核细胞趋化蛋白-1 (monocyte chemotactic protein-1, MCP-1) 和白介素-6 (interleukin-6, IL-6) 的低表达, 而IL-6 and MCP-1在癌症尤其是前列腺癌和乳腺癌中的转移中起重要作用[22]。另有研究表明, PPM1A协同PPM1B对TNF-α激活下的NF-κB通路的另一个重要分子, IKKβ的Ser1 7 7和Ser 1 8 1去磷酸化, 进而终止NF-κB信号通路[23]。
(八) IFN信号通路
干扰素基因刺激蛋白 (stimulator of interferon genes, STING, 又称为MITA和ERIS) , 一种内质网相关蛋白, 在DNA病毒激活干扰素通路中起非常关键的作用。然而, 病毒感染后持续活化的STING可能会导致致命的炎症性疾病, 因此必须精确的调控STING的活性, 以确保适当的抗病毒信号持续时间和强度。然而, 活化后的STING在病毒感染后期是如何减弱并终止的, 还尚未清楚。Li等[24]发现PPM1A可靶向并去磷酸化STING和TBK1, 关闭信号复合体的形成, 在DNA病毒感染的后期减弱并终止干扰素信号通路方面起重要作用。此外, 冯新华工作团队也发现, PPM1A能够与RNA病毒激活的IFN信号通路中的TBKl/IKKε形成内源复合物, 并将处于激活状态的MAVS和TBKl/IKKε去磷酸化。相反, 活化的MAVS能干扰PPM1A与TBKl/IKKε复合物的形成, 抵消PPM1A对抗病毒信号的抑制作用[25]。
四、结语与展望
蛋白激酶通过对底物的磷酸化起到调控的作用, 而蛋白磷酸酶通过将磷酸基团脱去的方式发挥反向作用, 这种可逆的磷酸化作用保证了信号分子功能的平衡稳定。PPM1A是依赖金属离子的蛋白磷酸酶PPM家族最重要的成员, 一直被认为是细胞压力应答通路中的负调节因子。随着对PPM1A的研究不断深入, 发现PPM1A在调节致癌信号通路和干扰素通路方面同样发挥重要作用。但一直以来, PPM1A的表达调控、细胞定位和磷酸酶活性的调控都不清楚。因此, 对于PPM1A生理功能尤其是抗肿瘤方面和自身调控的研究将是未来研究的方向。
参考文献:
[1] Kostich M, English J, Madison V, et al.Human members of the eukaryotic protein kinase family.Genome Biol, 2002, 3:Research0043.
[2] Schmid AC, Woscholski R.Phosphatases as small-molecule targets:inhibiting the endogenous inhibitors of kinases.Biochem Soc Trans, 2004, 32:348~349.
[3] Van Hoof C, Goris J.Phosphatases in apoptosis:to be or not to be, PP2A is in the heart of the question.Biochim Biophys Acta, 2003, 1640:97~104.
[4] Singh A, Pandey A, Srivastava AK, et al.Plant protein phosphatases 2C:from genomic diversity to functional multiplicity and importance in stress management.Crit Rev Biotechnol, 2016, 36:1023~1035.
[5] Lammers T, Lavi S.Role of type 2C protein phosphatases in growth regulation and in cellular stress signaling.Crit Rev Biochem Mol Biol, 2007, 42:437~461.
[6] Jackson MD, Fjeld CC, Denu JM.Probing the function of conserved residues in the serine/threonine phosphatase PP2Calpha.Biochemistry, 2003, 42:8513~8521.
[7] Davies SP, Helps NR, Cohen PT, et al.5'-AMP inhibits dephosphorylation, as well as promoting phosphorylation, of the AMP-activated protein kinase.Studies using bacterially expressed human protein phosphatase-2C alpha and native bovine protein phosphatase-2AC.FEBS Lett, 1995, 377:421~425.
[8] Hanada M, Kobayashi T, Ohnishi M, et al.Selective suppression of stress-activated protein kinase pathway by protein phosphatase 2C in mammalian cells.FEBS Lett, 1998, 437:172~176.
[9] Takekawa M, Maeda T, Saito H.Protein phosphatase2Calpha inhibits the human stress-responsive p38 and JNKMAPK pathways.Embo j, 1998, 17:4744~4752.
[10] Zhou B, Wang ZX, Zhao Y, et al.The specificity of extracellular signal-regulated kinase 2 dephosphorylation by protein phosphatases.J Biol Chem, 2002, 277:31818~31825.
[11] Cheng A, Kaldis P, Solomon MJ.Dephosphorylation of human cyclin-dependent kinases by protein phosphatase type2C alpha and beta 2 isoforms.J Biol Chem, 2000, 275:34744~34749.
[12] Wang Y, Dow EC, Liang YY, et al.Phosphatase PPM1Aregulates phosphorylation of Thr-186 in the Cdk9 T-loop.JBiol Chem, 2008, 283:33578~33584.
[13] Ofek P, Ben-Meir D, Kariv-Inbal Z, et al.Cell cycle regulation and p53 activation by protein phosphatase 2C alpha.JBiol Chem, 2003, 278:14299~14305.
[14] Kwun HJ, Jung EY, Ahn JY, et al.p53-dependent transcriptional repression of p21 (waf1) by hepatitis C virus NS3.J Gen Virol, 2001, 82:2235~2241.
[15] Akhurst RJ, Derynck R.TGF-beta signaling in cancer--a double-edged sword.Trends Cell Biol, 2001, 11:S44~S51.
[16] Bierie B, Moses HL.Tumour microenvironment:TGFbeta:the molecular Jekyll and Hyde of cancer.Nat Rev Cancer, 2006, 6:506~520.
[17] Lin X, Duan X, Liang YY, et al.PPM1A functions as a Smad phosphatase to terminate TGFbeta signaling.Cell, 2006, 125:915~928.
[18] Duan X, Liang YY, Feng XH, et al.Protein serine/threonine phosphatase PPM1A dephosphorylates Smad1 in the bone morphogenetic protein signaling pathway.J Biol Chem, 2006, 281:36526~36532.
[19] Dai F, Shen T, Li L, et al.PPM1A dephosphorylates RanBP3 to enable efficient nuclear export of Smad2 and Smad3.EMBO Rep, 2011, 12:1175~1181.
[20] Bu S, Kapanadze B, Hsu T, et al.Opposite effects of dihydrosphingosine 1-phosphate and sphingosine 1-phosphate on transforming growth factor-beta/Smad signaling are mediated through the PTEN/PPM1A-dependent pathway.JBiol Chem, 2008, 283:19593~195602.
[21] Strovel ET, Wu D, Sussman DJ.Protein phosphatase2Calpha dephosphorylates axin and activates LEF-1-dependent transcription.J Biol Chem, 2000, 275:2399~2403.
[22] Lu X, An H, Jin R, et al.PPM1A is a Rel A phosphatase with tumor suppressor-like activity.Oncogene, 2014, 33:2918~2927.
[23] Sun W, Yu Y, Dotti G, et al.PPM1A and PPM1B act as IKKbeta phosphatases to terminate TNFalpha-induced IKK-beta-NF-kappaB activation.Cell Signal, 2009, 21:95~102.
[24] Li Z, Liu G, Sun L, et al.PPM1A regulates antiviral signaling by antagonizing TBK1-mediated STING phosphorylation and aggregation.PLo S Pathog, 2015, 11:e1004783.
[25] Xiang W, Zhang Q, Lin X, et al.PPM1A silences cytosolic RNA sensing and antiviral defense through direct dephosphorylation of MAVS and TBK1.Sci Adv, 2016, 2:e1501889.