摘 要: 纤溶活性蛋白研究是当前研究之一, 该蛋白具有良好的溶栓效果。中华圆田螺富含活性蛋白。本实验以中华圆田螺为研究对象, 采用硫酸铵分段盐析分离和提取得到了活性粗蛋白。纤溶平板法证明其具有纤溶活性, 并研究了温度、pH值、金属离子对其纤溶活性的影响。实验结果表明中华圆田螺活性蛋白最适作用温度为58℃;pH值为7~10范围内影响较小, 活性较强;Na+、K+对其纤溶活性无影响, Ca2+、Fe3+对其有抑制作用。
关键词: 中华圆田螺; 纤溶活性; 蛋白提取;
0 、引言
由于蛋白质控制体内重要的生理活动, 人们一直在研究蛋白质的生物作用机理。随着科学技术的发展, 蛋白质的研究越来越深入, 一些特殊蛋白质的生物学有了新的发展。而且一些动植物蛋白开始应用到人类的生产、医疗等方面。
中华圆田螺是属于软体动物门、腹足纲、田螺科、圆田螺属。国内主要分布于南方各省区, 国外分主要布在北美等地。它的繁殖能力强, 生长速度快, 食性范围广, 肉质鲜美。螺肉营养价值很高, 主要是蛋白质很丰富, 另外还有磷、钙、铁、维生素B, 以及丰富的维生素A等, 属于高蛋白低脂肪的一类食品。中华圆田螺常以水生植物和低等藻类为食, 体内可能富含纤溶酶等酶。同时中华圆田螺的个头较大, 生长迅速, 而它体内富含的纤溶活性蛋白极具医药价值, 具有较大的经济意义。目前有一些研究发现, 某些纤溶活性蛋白具有较好的溶栓效果, 与此同时还具有对许多肿瘤细胞的抑瘤作用[1,2]。当前的药物已经无法满足人类的需求, 人类社会急需开发新的具有高效、无毒的药物, 而纤溶活性蛋白[4,5]、多肽等物质将会是未来研究的重要方向。
1、 材料及方法
1.1、 试验材料
1.1.1 、原料与试剂
中华圆田螺:南昌水产品综合市场购买;磷酸二氢钠:天津市大茂化学试剂厂;磷酸氢二钠:天津市大茂化学试剂厂;硫酸铵:天津市福晨化学试剂厂;三 (羟甲基) 氨基甲烷试剂:天津市大茂化学试剂厂。
盐酸:西陇化工股份有限公司;氢氧化钠:西陇化工股份有限公司;甘氨酸:天津市大茂化学试剂厂;乙二胺四乙酸二钠 (EDTA) :天津市大茂化学试剂厂;氯化钡:上海山浦化工有限公司;聚乙二醇8000:实验试剂;氯化钠:天津市大茂化学试剂厂;D34mm透析袋:进口;氯化钾:天津市大茂化学试剂厂;无水氯化钙:天津市大茂化学试剂厂;BME (巯基乙醇) :西陇化工股份有限公司;三氯化铁:西陇化工股份有限公司;琼脂糖:GENE COMPANGY;尿激酶:生化试剂;考马斯亮蓝G-250:上海蓝季科技发展有限公司;牛血清蛋白:冻干粉, 北京索莱宝科技有限公司以上试剂均为分析纯。

1.1.2、 仪器与设备
组织捣碎机:上海精科仪器有限公司;JB-2型恒温磁力搅拌器:上海雷磁新泾仪器有限公司;AUY220电子分析天平:梅特勒-上海;高速冷冻离心机:热电 (上海) 科技仪器有限公司;DHG-9076A型电热型恒温鼓风干燥箱:上海精宏实验设备有限公司;WFZ—UV-2000型紫外可见分光光度计:尤尼柯 (上海) 仪器有限公司;微量移液器:德国Eppendorf公司;生化培养箱:上海博迅实业有限公司。
1.2、 实验方法
1.2.1 、总蛋白的提取
将中华圆田螺洗净, 破壳取螺肉组织, 高速组织捣碎机进行捣碎。加入5倍中华圆田螺重量体积 (V/W) 的磷酸盐缓冲液, 预冷后, 磁力振荡搅拌器搅拌20min, 4℃浸提过夜。先用纱布过滤浸提液除去大块的螺肉, 滤液在4℃下5000r/min离心20min, 取上清液, 即中华圆田螺粗提液, 并测量液体体积[3]。
采用硫酸铵溶液饱和的方法, 分段盐析分别以30%、65%、90%的盐饱和度进行盐析。在25℃下, 30%硫酸铵饱和度需要加入176g/L的硫酸铵质量, 加入到中华圆田螺粗提液中, 4℃预冷, 通过磁力振荡搅拌器搅拌20min后使硫酸铵完全溶解, 4℃下静置1h后, 再在4℃条件下10000r/min离心20min, 沉淀可以用3倍体积的磷酸盐缓冲液溶解, 收集上清液用量筒测量体积。采用同样的方法进行盐析, 65%硫酸铵饱和度需要加入235g/L的硫酸铵质量, 而90%硫酸铵饱和度需要加入190g/L的硫酸铵质量。各盐析段的沉淀的溶解溶液4℃保存, 备用。各盐析段的沉淀的溶解溶液分别装入到事先处理过的透析袋中, 用蒸馏水透析5h后, 再用Tris-HCl缓冲液透析, 定时换缓冲液透析, 直到用氯化钡溶液检测不出白色的硫酸钡沉淀为止[6]。透析结束后的透析袋放到固体聚乙二醇8000中进行浓缩, 浓缩完后将透析袋中待测液4℃保存, 备用。用过的透析袋先用蒸馏水洗干净, 然后用沸水煮沸8min, 最后放入蒸馏水中, 冰箱中保存可以供再次使用。聚乙二醇在烘干箱中干燥可以再次利用。
1.2.2 、纤维蛋白活性测定
首先将0.3g琼脂糖先溶于36mL磷酸盐缓冲液 (PBS, pH=7.6) 中, 煮沸后琼脂溶解, 45℃左右, 加入1.5mL纤维蛋白原溶液 (10mg/mL) 和60uL凝血酶 (100u/mL) 溶液, 混匀后迅速倒入45℃预热培养皿, 在室温下静置30min, 等到平板完全凝固后, 置4℃冰箱备用。
1.2.3 、纤维活性蛋白含量测定
用8根10mL比较干净的试管, 按下表2-1取样, 溶液混匀后, 放置2min后用比色杯在280nm波长下, 用分光光度度计测量, 记录各管测定的光密度A280nm, 分别以吸光度为纵坐标, 蛋白质浓度为横坐标作图。
取未知浓度的样品蛋白液40μL, 加蒸馏水3.96mL, 测A280nm条件下的吸收系数, 对照标准曲线求得蛋白质溶度。
表1 紫外吸收法测定蛋白质浓度——标准曲线制作
1.2.4、 物化因子对中华圆田螺活性蛋白的影响
1.2.4. 1、 金属离子、变性剂和抑制剂对田螺活性蛋白的影响
按表4配制出1mol/L的NaCl、KCl、MgCl2、CaCl2、FeCl3、巯基乙醇 (BME) 试剂分别与等量的样品溶液混合均匀后, 通过纤维蛋白平板法测定其酶活力。
1.2.4. 2 、温度和pH对田螺活性蛋白的影响
把样品溶液分别置于8组 (20~70℃) 温度下处理30min后, 用纤维蛋白平板法测定其酶活力。
把样品溶液和6组不同的pH值缓冲液 (p H6~8的磷酸盐缓冲液, pH8.5~10的甘氨酸-NaOH缓冲液, 用NaOH调节pH10.5~11.5的生理盐水) 等量混匀, 用纤维蛋白平板法测定其酶活力。
图1 中华圆田螺活性蛋白纤溶平板

1:PBS;2:BSA (10mg/mL) ;3:UK (160U/mL) ;4:30%MFP;5:65%MFP;6:90%MFP
2、 结果及讨论
2.1 、纤溶活性的鉴定
由图1看出, 3号尿激酶 (160U/mL) 的纤溶活性最强, 4号、5号和6号样品都有纤溶活性, 其中5号65%的样品活性最强, 含量最高。
2.2 、纤溶活性的测定
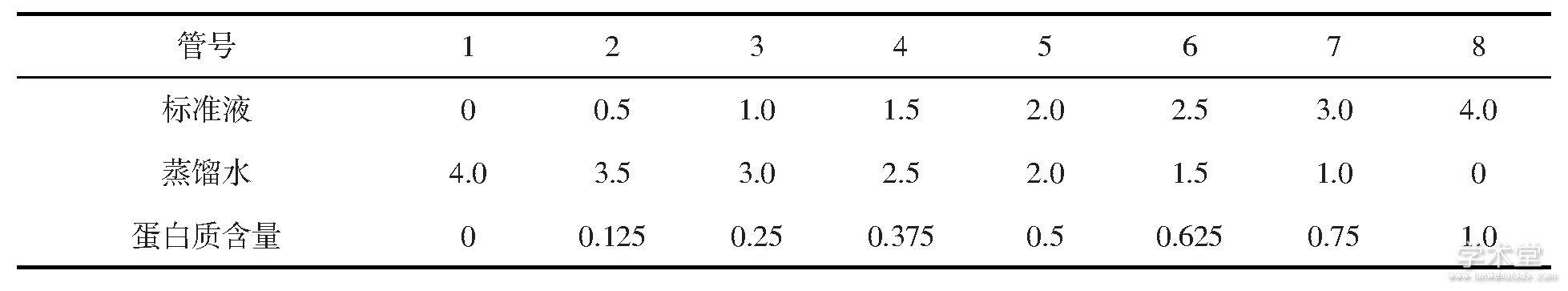
通过测量溶圈的直径, 然后算出溶圈的面积。分别以溶圈面积为横坐标, 尿激酶浓度为纵坐标得到纤维蛋白酶活力曲线。图2方程式为y=0.4865x+0.3113, y-为尿激酶标准溶液浓度 (U/mL) , x-为溶圈面积, R2-线性回归系数 (R2=0.9718说明尿激酶标准溶液浓度与溶圈面积成良好的线性关系) 。计算65%的样品的纤溶活性, 把样品的纤溶圈面积大小对照标准曲线换算成尿激酶单位。测得中华圆田螺浓缩液纤溶酶相当于尿激酶标准活力138U/mL。
2.3 、提取蛋白含量的测定
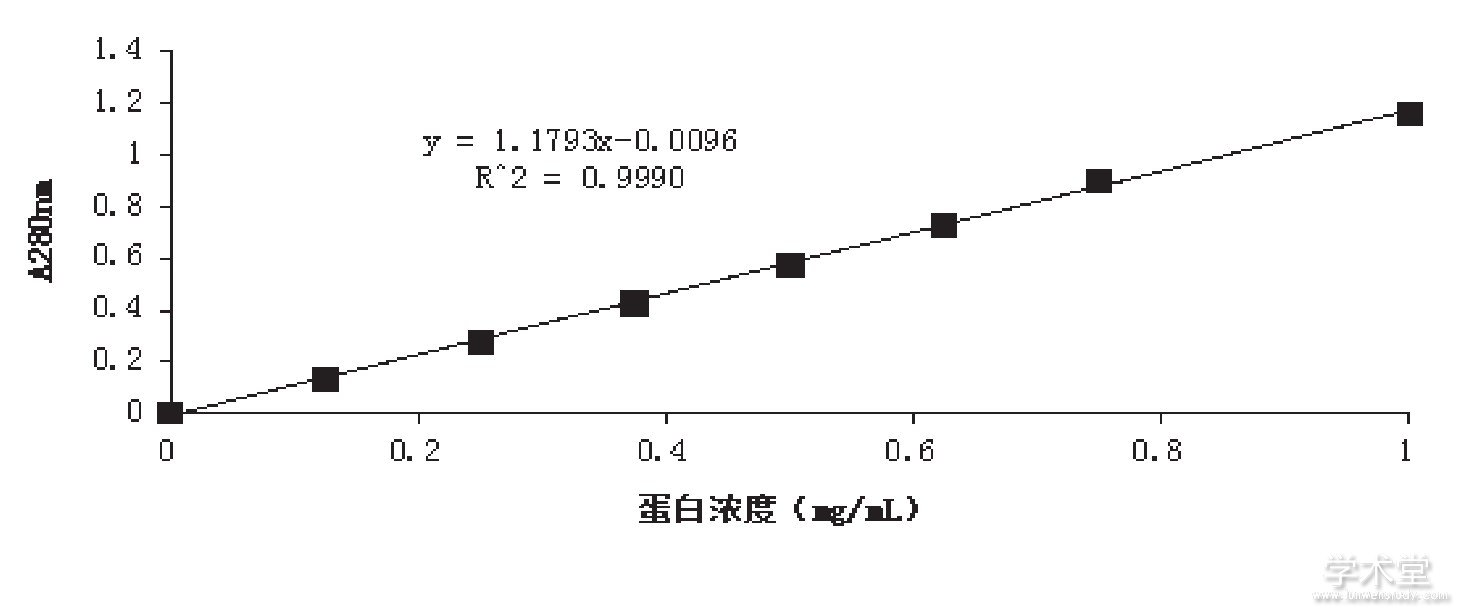
用紫外吸收法分光光度计检测中华圆田螺蛋白浓度, 以卵清蛋白为标准, 用卵清蛋白为标准液的标准工作曲线进行线性回归, 如图3所示, 得到y=1.793x-0.0096, R2=0.9990。式中:y-卵清蛋白为标准液在280nm波长处吸光度, x-为-卵清蛋白为标准液的浓度 (mg/mL) , R2-线性回归系数 (R2=0.9990) 说明卵清蛋白标准液的浓度与吸光度保持良好的线性关系。计算出样品蛋白浓度为65mg/mL。
表2 尿激酶活力曲线的制作

图2 尿激酶活力标准曲线
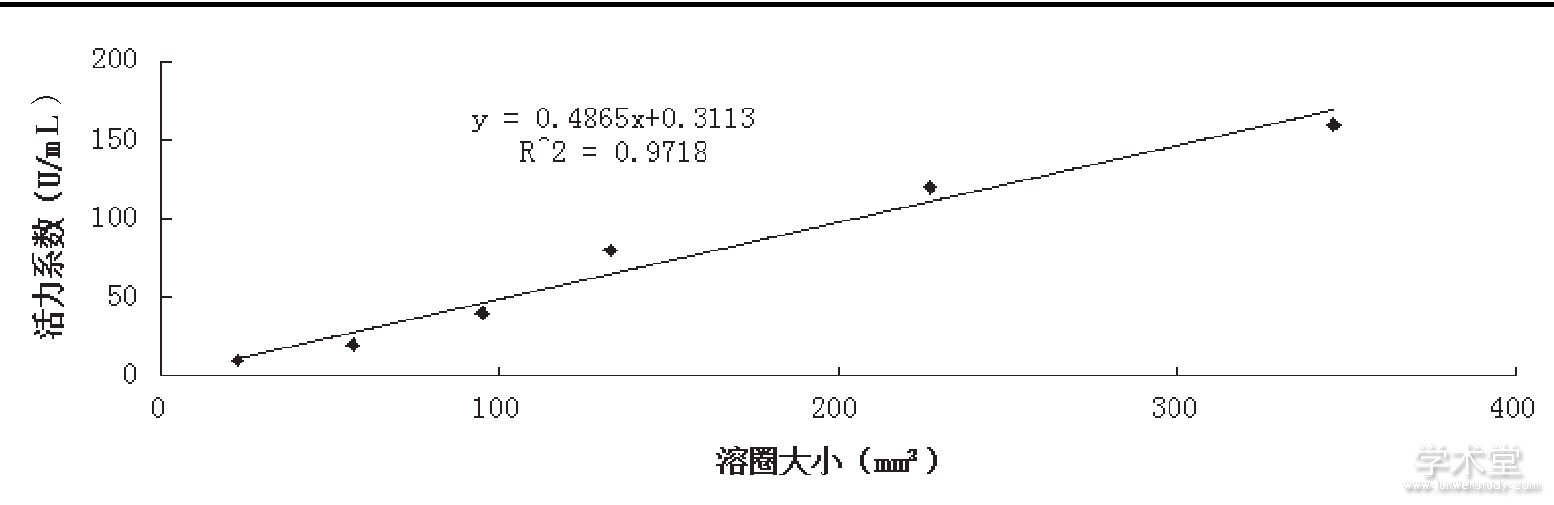
表3 紫外吸收法测定蛋白质浓度—标准曲线的制作
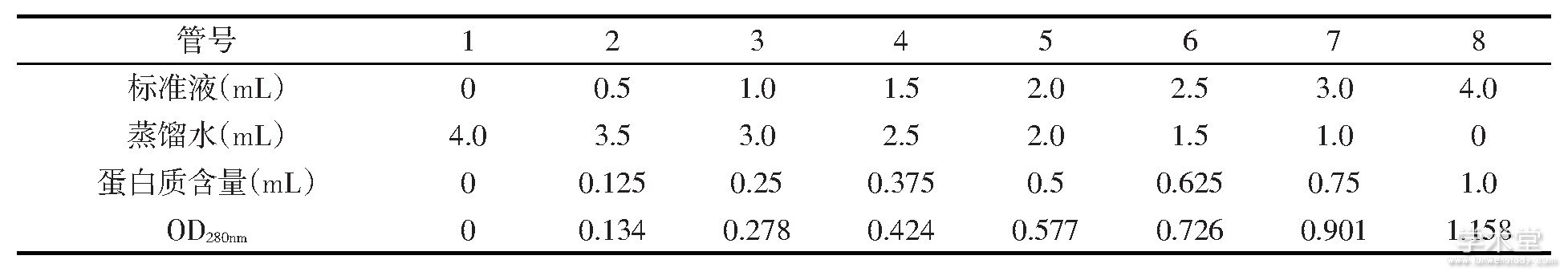
图3 紫外吸收法测定蛋白质浓度—标准曲线
2.4、 不同物化因子对中华圆田螺活性蛋白的影响
2.4.1、 金属离子、变性剂和抑制剂对中华圆田螺提取物的影响
用纤维蛋白平板法进行金属离子和变性剂对中华圆田螺活性蛋白纤溶活力影响的实验 (见表4) 。
表4 金属离子和变性剂对中华圆田螺活性蛋白纤溶活力的影响
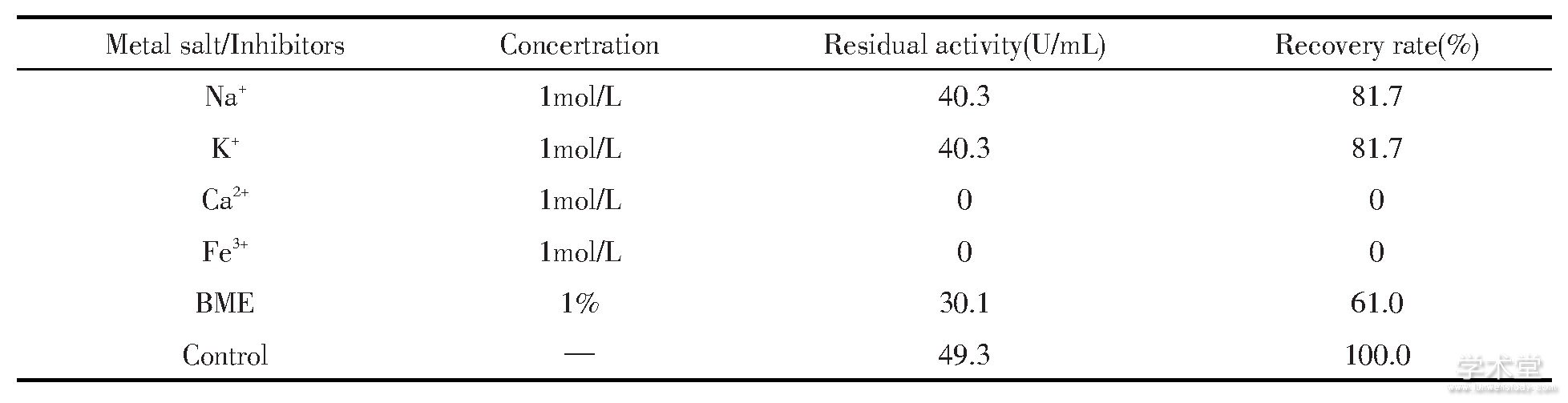
由表4可以看出, Na+和K+对其纤溶活性影响较小, 变性剂BME (巯基乙醇) 不是完全抑制, 可能是因为浓度过低。而Ca2+和Fe3+完全抑制了中华圆田螺的活性。
2.4.2、 温度和pH对中华圆田螺活性蛋白的影响
温度对中华圆田螺活性蛋白纤溶活性的影响见图4。从图4中可以看出, 50~60℃, 中华圆田螺活性蛋白纤溶活性能保持较高活性, 最适温度为58℃左右。随着温度的升高, 中华圆田螺活性蛋白纤溶活性迅速下降。
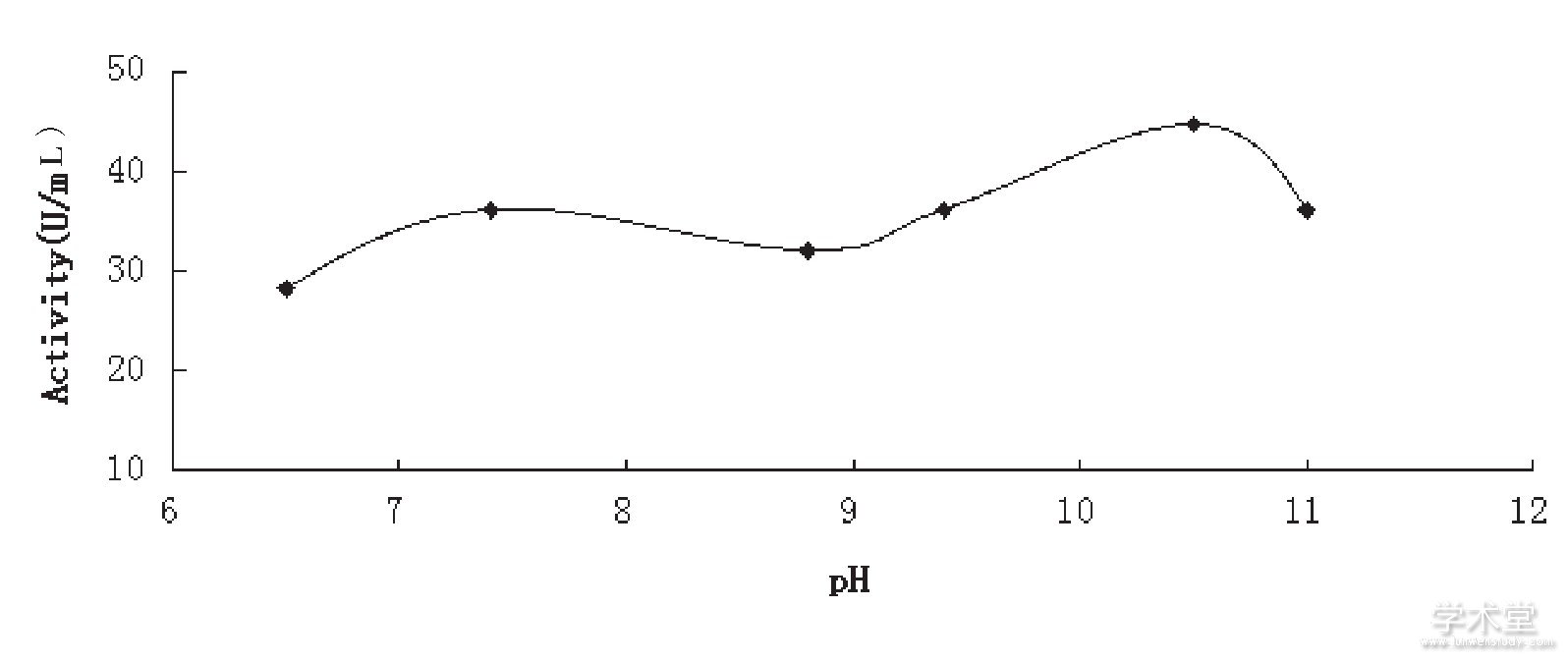
pH对中华圆田螺活性蛋白纤溶活性的影响见图5。从图5中可以看出, pH对中华圆田螺活性蛋白纤溶活性的影响不大。当pH在6.5~11.0时, 其纤溶活性变化不是很明显。
图4 温度对中华圆田螺纤溶活性蛋白的影响
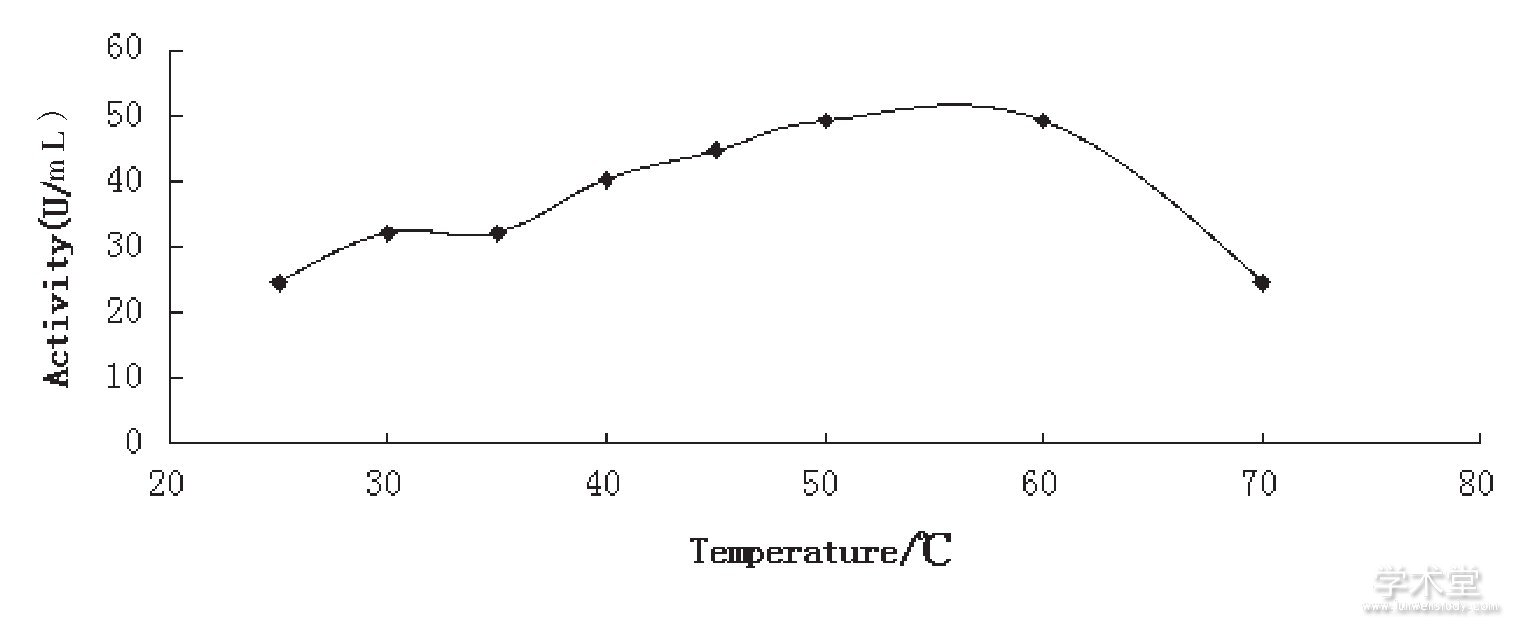
图5 p H对中华圆田螺纤溶活性蛋白活性的影响
3、 结论与讨论
本实验从中华圆田螺体内提取出的活性蛋白具有纤溶活性, 而且粗提物的活性就已经表现表现出较强的纤溶活性。如果可以进一步的纯化, 分离出单蛋白, 那纤溶活性就会很强, 是一种目前看来有研究价值的纤溶活性蛋白。目前的研究已经发现有一些具备大量降解肿瘤细胞外基质特性的纤溶活性蛋白酶和活性产物。它们通过使肿瘤细胞失去生存的环境, 导致肿瘤组织降解, 肿瘤也不会很容易地发生侵袭和转移[7,8,9]。由于纤溶活性成分还具有抑制内皮细胞增生的作用, 肿瘤血管的形成同样会受到强烈抑制[10,11]。因此, 中华圆田螺纤溶活性蛋白的研究具备一定的研究价值, 深入研究下去, 有可能可以开发出一种新型的溶栓药物。
参考文献
[1] Mi Young Ahn, Bum-Soo Hahn, Kang Sun Ryu, Jin Won Kim, et a1.Purification and characterization of a serine protease with fibfinolytic activity from the dung beetles, Catharsius molossus[J].Thromb Res.2003 (12) 339-347.
[2] Wang Ying, Yan Hongyi, Wang Yipeng, Yang Hallong, et a1.Proteomics and transcriptome analysis coupled with pharmacological test reveals the diversity of anti-thrombosis proteins from the medicinal insect, Eupolyphaga sinesis[J].Insect Biochem Mol Bi01.2012 (4) :537-544.
[3] 陈雅雄.黄粉虫活性蛋白的提取纯化及其作用性质研究[D].广东工业大学硕士研究生论文, 2012.
[4] Milstone JH, Thrombokinase as prime activator of prothrombin:Historical perspectives and present status[J].Federation proceedings, 1964, 23:742-748.
[5] Papahadjopoulos D, Hanahan DJ, Observations on the interaction of phospholipids and certain clotting factors in prothrombin activator formation[J].Biochimica Et Biophysica Acta, 1964, 90:436-439.
[6]黄明星.地鳖虫和黄粉虫纤溶活性蛋白的分离纯化, 性质研究及其基因克隆[D]广东工业大学博士论文, 2012.
[7] Karen, BG, Roy KS.Hypercoagulability in cancerl[J].Hematoln Oncol Clin North Am, 1996, 10 (2) :499-509.
[8]Michelson AD, Bamaard M R.Evaluation of platelet functionby flow cytometry[J].Methods, 2000, 21 (3) :259-270.
[9]沈珊珊, 陈洪, 张治国等.蚯蚓纤溶酶对肝癌细胞黏附性影响的研究[J].江苏中医药, 2008, 40 (3) :81-83.
[10]李穗晶, 韩雅莉, 张冬梅等.地鳖纤溶活性蛋I刍 (EFP) 分离纯化, 红外光谱分析及抑制鸡胚尿囊 (CAM) 血管生成研究[J].高等学校化学学报, 2009, 30 (11) :1998.2002.
[11]刘浩, 韩雅莉, 丁鸿等.地鳖纤溶蛋白对荷S180和H22小鼠的抑瘤作用研究[J].时珍国医国药, 2010, 21 (9) :2140.2142.