摘 要: 木糖(xylose)是自然界中仅次于葡萄糖的第二大糖类物质,作为五碳醛糖,木糖多以缩聚化合物形式组成半纤维素等。尽管针对植物和微生物中木糖的代谢与结构的相关研究众多,但是在动物尤其哺乳动物中的研究较少。本综述总结了哺乳动物体内木糖的吸收、来源与利用,参与的糖链结构,及木糖相关结合蛋白的相关研究,为阐明木糖在哺乳动物体内的重要作用及其潜在的功能研究提供参考。
关键词: 木糖; 哺乳动物; 糖基化修饰; 糖结合蛋白;
Abstract: Xylose is the second largest carbohydrate in nature after glucose. As a pentaaldehyde, xylose exists mostly as hemicellulose in the form of polycondensation compounds. Although there are many studies related to the metabolism and structure of xylose in plants and microorganisms, there are fewer studies in animals, especially mammals. This review summarized the absorption, source and utilization of xylose in mammals, participates in sugar chain structure, and related research on xylose-related binding proteins, provided a theoretical summary for elucidating the important role of xylose in mammals, and provided potential references for its functional studies.
Keyword: xylose; mammal; glycosylation modification; glycoprotein;
木糖(D-xylose,Xyl)是一种五碳糖,其分子式为C5H10O5,常呈粉末或晶体状,易溶于水[1]。在木质纤维素中,木糖含量可高达30%,是自然界中除葡萄糖外最丰富的单糖,多以缩聚状态存在[2]。在植物中,木聚糖的单体为木糖,也是细胞壁半纤维素的重要成分,例如双子叶植物细胞壁的半纤维素是由β-D-(1→4)-葡聚糖主链组成,其主链上含有木糖基(xylosyl)、半乳糖基-木糖基(galactosyl-xylosyl)或岩藻糖基-半乳糖基-木糖基(fucosyl-galactosylxylosyl)的侧链[3]。木糖还存在于植物的果胶聚糖和其他植物糖蛋白中,果胶聚糖中的同型半乳糖醛酸聚糖(homogalacturonan,HG)是由α-1,4糖苷键连接而成的半乳糖醛酸聚合体,HG的半乳糖醛酸残基的O-3或O-4可以被木糖残基取代以形成木糖半乳糖醛酸聚糖(xylogalacturonan,XG)[4,5]。
木糖同样存在于某些细菌和真菌中,Barpeled等[6]在新生隐球菌(Cryptococcus neoformans)中发现了木糖参与荚膜多糖的合成。葡萄糖醛酸木糖基甘露聚糖(glucuronoxylomannan,GXM)是荚膜多糖中最重要的毒力因子,这种聚糖主要由甘露糖、葡萄糖醛酸、木糖构成;Karr等[7]在日本野生型大豆根瘤菌(Bradyrhizobium japonrcum)中发现含有木糖的胞外多糖和脂多糖;Fletcher等[8]通过分析狄氏副拟杆菌(Parabacteroides distasonis)S层糖蛋白中的某种聚糖发现,这种聚糖几乎完全由木糖组成,每个聚糖分子由大约16个木糖与数个葡萄糖组成。
在动物尤其是哺乳动物中,木糖广泛地存在于糖胺聚糖和部分糖蛋白中[9]。含有木糖的聚糖类物质参与了体内细胞的增殖、迁移、通讯等,并影响到生物体的生长发育。多项研究表明,木糖相关酶表达异常与肝病、系统性硬化病、糖尿病并发症等有着密切联系[10],这些都反映了木糖的重要作用。
研究表明,自然界中可以直接代谢木糖的物种较少,主要包括细菌、酵母菌和丝状真菌等[11]。由于生存环境、生长方式等的不同,为了满足生长需求,经过长期的进化,这些微生物产生了不同的木糖利用途径。如在大肠杆菌中,木糖经过木糖异构酶(xyloseisomerase,XI)作用形成木酮糖(D-xylulose),随后木酮糖激酶催化其形成木酮糖-5-磷酸(D-xylulose-5-p),最后进入磷酸戊糖途径(pentose phosphate pathway,PPP);而在酵母菌或者某些真菌中,木糖首先在依赖NADPH的木糖还原酶(xylose reductase,XR)的作用下形成木糖醇,再由依赖NAD+的木糖醇脱氢酶(xylitol dehydrogenase,XDH)催化形成木酮糖,最后在木酮糖激酶(xylulokinase)的催化下形成木酮糖-5-磷酸,由此进入PPP[12,13]。除此之外,Liu等[14]通过13C同位素示踪实验,发现丙酮丁醇梭菌(Clostridium acetobutylicum)通过磷酸转酮酶途径(phosphoketolase pathway,PK)分解代谢木糖,在该代谢途径中,木酮糖-5-磷酸被磷酸转酮酶(phosphoketolase)催化裂解形成乙酰磷酸(acetylphosphate)和甘油醛-3-磷酸(glyceraldehyde-3-p),最后进入糖酵解途径(embden-meyerhof-parnas pathway,EMP),该途径分解代谢了大约40%的木糖。Tanaka等[15]发现乳酸乳球菌(Lactococcus lactis)也通过磷酸转酮酶途径(phosphoketolase pathway,PK)分解代谢木糖。Stephens等[16]在新月柄杆菌(Caulobacter crescentus)中发现木糖进入细胞后经木糖脱氢酶(xylose dehydrogenase)、木糖酸脱水酶(xylonate dehydratase)、木糖酸内酯酶(xylonolactonase)催化生成2-酮-3-脱氧-木糖酸(2-keto-3-deoxy-xylonate),然后经过脱水反应及脱氢反应生成α-酮戊二酸,最后进入三羧酸循环(tricarboxylic acid cycle,TCA)。刘维喜[17]对微生物中已知的木糖的代谢途径进行了全面总结。

本综述总结了木糖相关物质在哺乳动物体内的来源与涉及功能,针对木糖参与结构、涉及疾病和分子功能进行系统分类,为哺乳动物中的木糖相关功能研究提供参考借鉴。
1 、哺乳动物体内木糖物质的来源及利用
木糖在生物体内广泛分布,哺乳动物自身无法合成代谢木糖单体。在猪饲料中添加纯化的D-木糖后发现,木糖的影响通常是负面的,以含有37.4%木糖的猪粮喂养两周大的猪,与含37.4%葡萄糖猪粮喂养的猪相比,木糖组出现了呕吐、腹泻等症状[18];但Longstaff等[19]在两组猪的基础日粮中分别添加5%的葡萄糖和10%的D-木糖,两组猪体重增加的速率相似,10%D-木糖的代谢能大约等于5%葡萄糖,且木糖组并未出现不良反应。Diebold等[20]的实验解释了这一现象,只有在体外补充纯化的D-木糖而不是木聚糖酶的情况下,才能观察到木糖对动物性能的明显影响,外源木聚糖酶在体内仅释放少量单体木糖,并在大肠中被微生物发酵利用。
木糖耐热耐酸且甜度相对较低,因此常作为无热量的甜味剂、风味改良剂等添加到食物中[21],因其较好的理化性质,各界学者致力于研究其对人体的作用。已有较多实验证明木糖可用来调节血糖浓度,但也有一些学者认为木糖的摄入在高血糖人群和健康人群之间会产生不同的影响[22]。Sheu等[23]发现,2型糖尿病患者连续8周摄入木糖,血糖水平明显降低;但Chung等[24]发现,健康老年人连续8周摄入木糖,空腹血糖水平基本不变。Wang等[25]在小鼠体内也发现了类似现象,肥胖小鼠摄入5%木糖后,血糖水平显着降低,但健康小鼠的血糖水平并无明显变化。根据以上的研究情况来看,木糖确实对高血糖人群、糖尿病患者的血糖水平调节有一定的作用,但对健康人群血糖水平的影响并不显着。木糖还能降低血脂及胆固醇水平,2型糖尿病患者在连续摄入木糖8周后,脂肪水平明显下降[23];Sarma等[26]以阿拉伯木聚糖喂养高脂膳食的肥胖小鼠,10周后,发现小鼠的胆固醇水平有所下降;但Cloetens等[22]发现健康人群在摄入阿拉伯木聚糖3周后,脂肪水平没有显着变化。由此可以看出,对于不同的实验对象,低聚木糖对脂质代谢起到的调控作用也不同。另外,木糖在肠道中发酵产生的短链脂肪酸能增加小鼠体内的T细胞和B细胞的激活潜力并促进免疫应答反应,进而起到抗肿瘤的作用[25,27]。Cao等[28]发现小鼠摄入小麦木聚糖后,表现出良好的抗炎症效果。从以上研究结果来看,木糖在调节血糖、降低血脂以及改善肠道菌群等方面具有重要意义,但具体的影响机制还未有准确报导,而对于木糖在病理病害方面的有效利用还有待进一步研究。
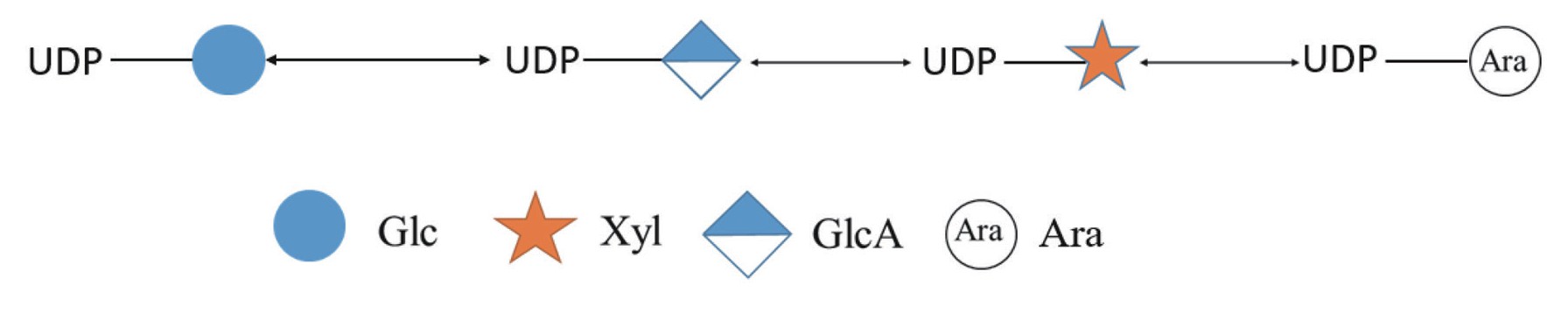
UDP-木糖是木糖在哺乳动物体内的活化形式,也是形成参与糖链结构的木糖唯一来源。UDP-木糖是由UDP-葡萄糖(UDP-Glc)经UDP-葡萄糖脱氢酶(UDP-glucose 6-dehydrogenase,UDP-G l c D H)催化脱氢生成U D P-葡萄糖醛酸(U D P-GlcA),而后通过UDP-木糖合成酶(UDP-xylose synthase,UXS)生成UDP-木糖[29]。此外,UDP-木糖还可以被UDP-4-异构酶(UDP-4-epimerase)催化形成UDP-阿拉伯糖(UDP-Ara),UDP-Ara是阿拉伯糖的活化形式,也是细菌的胞外多糖及植物细胞壁果胶等多糖中一种重要的单糖[30](图1)。Ginsburg等[31]发现,UDP-木糖还可以通过单糖回收补体途径合成,即被降解后的游离木糖先被磷酸化为木糖-1-磷酸(xylose-1-phosphate),之后被焦磷酸化酶(pyrophosphorylase)催化生成UDP-木糖。
在哺乳动物体内,木糖在小肠被吸收。除了之前提到过的Wise等[18]使用木糖代替了猪粮中的葡萄糖,木糖吸收的相关研究较少。最初有报道指出木糖代谢是被动扩散[32],但后来发现,部分高等动物体内存在一种钠依赖的主动转运系统,例如大鼠饮食中的D-木糖可以诱导钠-葡萄糖协同转运蛋白mRNA的表达,推测这种转运蛋白携带的部分木糖可与葡萄糖竞争性地结合Na+[33],Freeman[34]将马和兔子的空肠组织在1 mol/L的木糖溶液中孵育,并检测到木糖产生了积累,但当组织在5 mol/L的木糖溶液中孵育时,木糖并未产生任何积累,此研究进一步证实了哺乳动物体内可能存在木糖主动转运系统,但是它的亲和力很低且很容易饱和。Nichole等[35]研究了猪对木糖的吸收和代谢,发现随着猪日粮中木糖浓度的增加,尿液中木糖排泄量也呈线性增加,表明猪对木糖的吸收利用率同样也很低;Christiansen等[36]推测,木糖可能是从肠道细胞的浆膜面通过静脉进入全身循环;同时还有研究指出,木糖在大鼠的十二指肠和近端空肠被吸收[37];而在人体内,Maki等[38]进行的木糖实验表明,木糖进入人体后,在肠部被双歧杆菌利用并产生短链脂肪酸等有机酸,且木糖的摄入显着增加了人肠道中双歧杆菌的数量,双歧杆菌作为一种有益菌,可以选择性地利用木糖。Anderson等[39]认为短链脂肪酸可以通过抑制丙酮酸羧化酶降低糖异生的方式来间接调节哺乳动物体内的血糖水平;Rolston等[40]采用肠道灌流技术研究了木糖在人空肠中的转运,进一步证明了木糖在人体内被不依赖钠的被动扩散吸收,因此,动物体内的木糖转运方式并不适用于人。目前关于木糖在哺乳动物体内的代谢研究指出绝大多数木糖最终都出现在了尿液中,并显着降低了可从饮食中获得的代谢能[41]。Verstegen等[42]比较了以10%木糖和5%葡萄糖饲料喂养的猪的代谢能,发现木糖饮食的代谢能明显低于葡萄糖。Wyngaarden等[43]向人体内注射了14C标记的木糖,45 min后,在呼出的CO2中检测到14C,因此作者依据木糖在植物及微生物体内的代谢途径推测:木糖在人体内可通过TCA循环被氧化为CO2。Weser等[44]在豚鼠腹腔内注射了14C标记的木糖,4 h后,在呼出的CO2中检测到了放射性14C,同时木糖在多个组织中被氧化为CO2,其中在肾脏中氧化最多,但缺乏具体木糖涉及代谢途径的报道,推测木糖最初被氧化为木糖酸,后脱羧形成CO2。综合来看,木糖在哺乳动物体内的吸收方式存在种间差异,大部分木糖会随着尿液排出,少部分会被氧化为CO2。
2 、木糖参与哺乳动物糖链结构
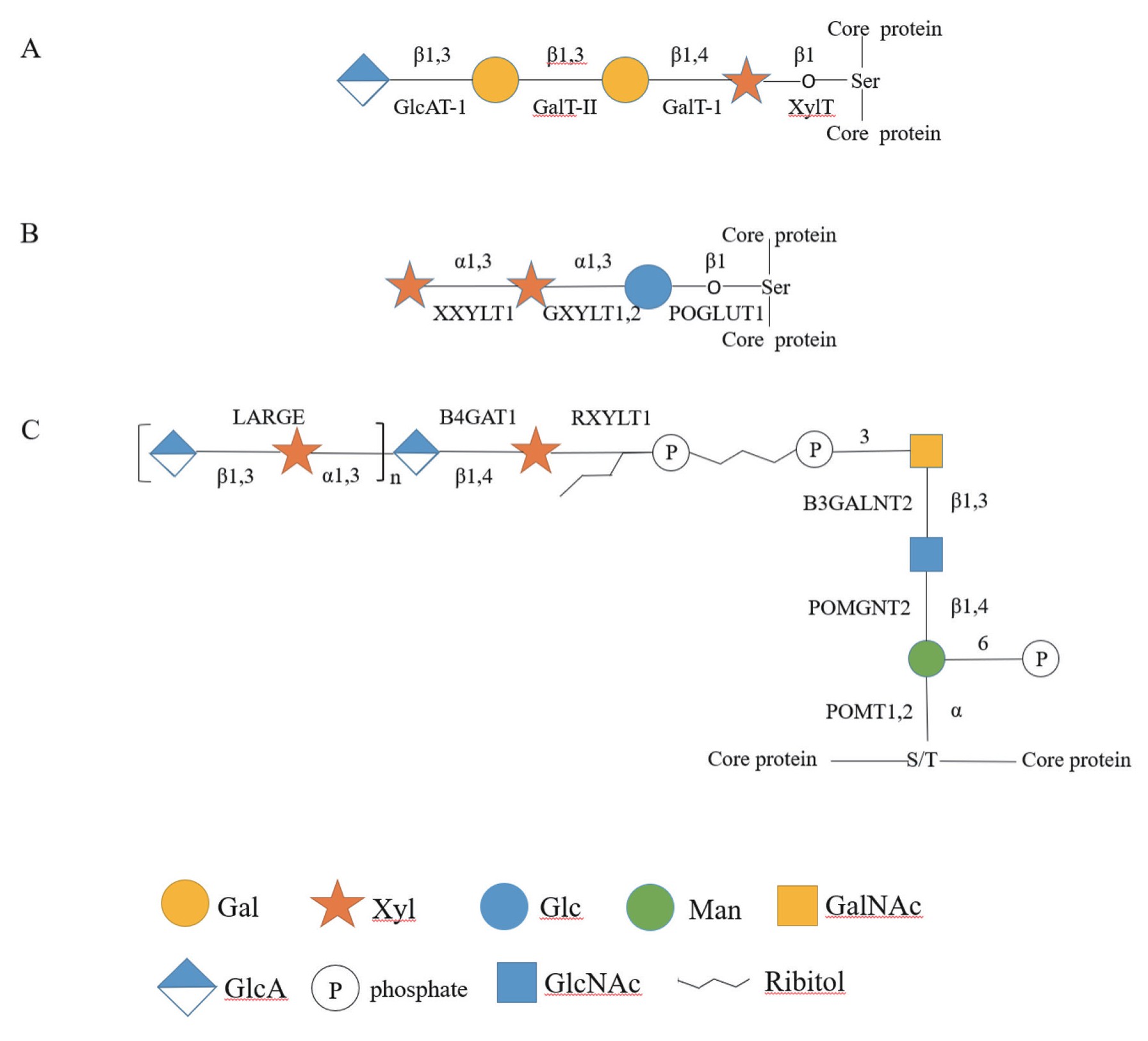
蛋白聚糖由核心蛋白和糖胺聚糖组成,蛋白聚糖的生物学功能依赖核心蛋白上附着的糖胺聚糖链。糖胺聚糖在细胞中参与了增殖、隔离和释放细胞生长因子,甚至维持软骨水合作用的功能[45]。除透明质酸(hyaluronic acid)和硫酸角质素(keratan sulfate)以外,其余糖胺聚糖均由含木糖的四糖核心结构(GlcA-β1,3-Gal-β1,3-Gal-β1,4-Xyl)(图2A)将糖胺聚糖连接至蛋白质的丝氨酸残基上[46]。Castellani等[47]首次发现木糖存在于蛋白聚糖中,木糖基转移酶(xylosyltransferases,XTs)催化木糖与丝氨酸间β糖苷键的形成,此过程为此类蛋白多糖合成的限速步骤。有关木糖基转移酶,讨论最多的是XT-I和XT-II,高等生物都有两种木糖基转移酶编码基因[48,49]。人的XT-I的编码基因是xylt-1,位于染色体16p13.1上,XT-II的编码基因是xylt-2,位于染色体17q21.3-22上[50],对应基因在鼠中分别位于7号和11号染色体,但在果蝇和线虫中只发现了一个相关基因[49,51]。上述木糖基转移酶都在高尔基体驻留,将UDP-木糖转移到相似的核心蛋白受体。由于木糖基转移酶具有的糖胺聚糖糖基转移酶活性是最早被发现的,因而木糖基转移酶曾被认为是糖胺聚糖糖基转移酶。Grebner等[52]在哺乳动物体内对木糖进行了放射性标记,检测到UDP-木糖向糖蛋白转移的活动踪迹,并确认了木糖基转移酶的活性。
图1 UDP-木糖的合成途径
XT-II和XT-I在功能上有许多相似之处,但在不同物种中存在组织特异性表达。XT-I相关研究众多,其催化UDP-木糖转移到核心蛋白的特定丝氨酸残基上,此过程为催化蛋白聚糖糖基化的限速步骤,随后GalT-I、GalT-II和GlcAT-1相关酶催化其它活性单糖连接到木糖上,最终形成完整的糖胺聚糖[53]。David等[54]确定了XT-I及其与UDP-木糖供体复合物的晶体结构,XT-I是II型膜蛋白,这是高尔基驻留的糖基转移酶的典型特征,其含胞质尾、单次跨膜域和一个由内腔组成的茎区域和催化结构域等。Bui等[55]研究XT-I在2型Desbuquois发育不良中的突变,证实XT-I的突变在严重软骨发育不良中有关键作用;Schreml等[56]的数据表明,XT-I的功能改变会导致与智力障碍相关的常染色体隐性矮身材综合征;Lee等[57]利用全外显子组测序证明,XT-I的突变可能导致儿童早发性近视。Munns等[58]的研究表明XT-II移码突变可导致脊柱炎综合征骨脆、白内障和听力缺陷;人血清中XT活性的改变与多种疾病直接相关,Kuhn等[59]的实验证明在以细胞外基质重塑为特征的系统性疾病中,人血清中的XT活性增加,且XT-II是使XT活性改变的主要同工酶;Gotting等[10]综述了哺乳动物木糖基转移酶及相关疾病,阐明了XT-I和XT-II的序列或表达修饰的改变影响了骨关节炎和糖尿病并发症,这为预防治疗相关疾病提供了新的诊断思路和方法。
除糖胺聚糖外,木糖也存在于其它少见的糖链中。在Notch信号通路中,Xyl-α1,3-Xyl-α1,3-Glc-β1-O-Ser糖链结构(图2B)被发现广泛存在于Notch通路的凝血因子VII、Notch配体Delta和Serrate/Jagged等各种蛋白EGF重复序列的O-葡萄糖基化(O-glucosylation)中[60]。具体来说,葡萄糖被两个连续的α-1,3糖苷键连接的木糖残基进一步延伸,其中葡萄糖苷木糖基转移酶1(glucoside xylosyltransferase 1,Gxylt1)和Gxylt2共同作用将第一个木糖添加至Xyl-α1,3-Xyl-α1,3-Glc-β1-O-Ser糖链结构中,木糖苷木糖基转移酶1(xyloside xylosyltransferase 1,Xxylt1)负责添加第二个木糖[61],该糖链是动物中唯一末端木糖基化的聚糖。但同时,异常的木糖基化修饰对Notch信号通路具有负调控,木糖残基在Notch通路的特定区域可以减少信号转导,Lee等[62]在果蝇Notch通路的EGF16-20重复序列上添加木糖残基,导致了果蝇Shams基因的功能缺失,Shams基因是果蝇体内的木糖基转移酶编码基因,因此可以通过改变木糖的延伸形式来改变Notch信号通路。Shi等[63]通过二代测序发现,在全肺静脉回流异常患者中存在GXYLT1突变,作者据此推测,GXYLT1的突变与全肺静脉回流异常有关。
木糖也存在于O-甘露糖糖基化的核心结构“Core3”单元中,如图2所示,蛋白O-甘露糖基转移酶1(protein O-mannosyltransferases 1,POMT1)和POMT2将甘露糖转移到丝氨酸或苏氨酸残基上,从而形成Core M0结构[64],紧接着N-乙酰氨基葡糖基转移酶II(N-acetylglucosaminyltransferase II,POMGNTII)催化GlcNAc以β-1,4糖苷键的方式连接到甘露糖的4位上形成GlcNAcβ1,4Man结构;随后,β-1,3-N-乙酰氨基半乳糖转移酶(β-1,3-N-acetylgalactosaminyltransferase,β3GALNT2)催化GalNAc以β-1,3糖苷键的方式连接到GlcNAc残基上,最后在POMK表达的一种特异性O-甘露糖激酶催化修饰下生成磷酸化Core M3[65]。在FKTN基因表达的fukutin蛋白和FKPP基因表达的FKPP蛋白以及ISPD基因表达的具有胞苷二磷酸核糖醇合酶的催化作用下,5-磷酸核糖醇(ribitol 5-phosphate,Rbo5P)被添加至GalNAc上[66],木糖可以通过核糖醇木糖基转移酶1(ribitol xylosyltransferase 1,Rxylt1)以β-1,4糖苷键的形式连接到Rbo5P上,随后β-1,4-葡萄糖醛酸转移酶1(beta-1,4-glucuronyltransferase 1,B4GAT1)催化GlcA连接到木糖上形成GlcA-β1,4-Xyl-β1,4-Rbo5P糖链结构(图2C)。而GlcA-β1,4-Xyl可以作为二糖单元受体并由类乙酰葡糖胺转移酶(like-acetylglucosaminyltransferase,LARGE)催化形成重复单元(-3GlcAβ1,3Xylα1-)[67]。Praissman等[68]利用斑马鱼模型以及人类患者证明,Rxylt1的缺陷会导致肌肉营养不良及大脑异常发育。Inamori等[69]指出如果LARGE相关酶活性下降,也会导致肌肉营养不良综合征。
尽管木糖广泛存在于植物的N-五糖核心中,但在哺乳动物内目前尚未发现相关酶作用于N-糖链,因此含木糖的N-糖链在哺乳动物体中鲜有报道,带有木糖的N-糖链有可能还会引起人体免疫反应[70]。但Yang等[71]通过将凝集素偶联磁性复合材料,随后利用基质辅助激光解析电离飞行时间质谱(MALDI-TOF-MS)鉴定发现肝癌患者血清蛋白中含有木糖残基的N-糖链结构,推测人体在病理状态的情况下可能存在木糖的异常修饰。
图2 哺乳动物体内三种含木糖的糖链结构
3、 木糖结合蛋白研究
糖结合蛋白是指与某些单糖或者寡糖特异性结合的蛋白质,这些糖结合蛋白基于糖基识别域以及氨基酸的相似性可以分为S型、C型、P型等十个大家族[72],纵观已报道的糖结合蛋白种类,与木糖相关的糖结合蛋白却仅限数种,其中报道最多的木糖结合蛋白(xylose binding protein,XBP)为xylF基因编码的膜外侧底物结合蛋白。
XylF蛋白来源于大肠杆菌和沙门氏菌,此蛋白对木糖具有高亲和力,它与xylH基因编码的通道蛋白以及xylG基因编码的ATP结合蛋白组成木糖ABC转运蛋白。ABC转运蛋白通过水解ATP提供能量将木糖转运至细胞,这种木糖转运目前只在大肠杆菌和伤寒沙门氏菌等菌体中有报道[73]。相对于这种高亲和力的依赖结合蛋白的转运系统,木糖还可以依赖木糖-H+质子同向转运系统进入细胞[74],xyl E基因编码与木糖具有低亲和力的木糖-H+质子同向转运蛋白[75],木糖进入细胞后在木糖异构酶(XylA)和木酮糖激酶(XylB)的作用下生成核糖-5-磷酸,随后进入PPP参与代谢。Wisedchaisri等[76]通过分子动力学模拟方法研究了木糖分子在XylE蛋白模型中的跨膜过程,并观察了吉布斯自由能以及结合能等参数,证明XylE蛋白也对木糖具有亲和力。Li等[77]证明蛋白O-葡萄糖基转移酶1(protein O-glucosyltransferase 1,POGLUT1)介导的表皮生长因子样重复序列糖基化在Notch信号通路中起重要作用,POGLUT1具有对UDP-葡萄糖和U D P-木糖的双亲和力,且P O G L U T 1只能使C1XSXPC2基序中的丝氨酸残基糖基化。尽管目前缺少有关木糖结合蛋白的相关报道和总结,但Zhong等[78]在人肝纤维化过程中发现众多与木糖结合蛋白相关的改变。在LX-2细胞系中,通过荧光标记木糖进行染色发现XBP在细胞膜表面呈较弱的散点式分布,但在细胞质中和核质周围展现出较强的分布。通过将木糖偶联至磁性复合物微粒,分离来源于LX-2细胞系、在TGF-β1激活前后具有木糖结合力的蛋白,发现XBP的表达水平在激活后显着升高。
相对于糖结合蛋白,糖结合基序(carbohydratebinding module,CBM)指在蛋白质中存在可以特异性识别和结合某类糖链结构的一段氨基酸序列。参与糖分子结构转移或水解等酶活性的蛋白质均有糖结合域,类似的众多糖结合基序家族被收录在碳水化合物活性酶数据库中,该数据库根据糖结合蛋白对糖底物结合区域的序列相似性,总结出数十个CBM家族,其中已知的木糖结合基序有GH5、GH8、GH10、GH11和GH43等家族[79]。
而针对木糖结合基序的改造有助于木糖相关工程酶的改造。如Chomvong等[80]通过基于CRISPER建立染色体文库筛选发现了纤维二糖磷酸化酶(cellobiose phosphorylase)的Y47H氨基酸突变影响了对木糖的结合能力,并进一步通过计算机分析发现该突变影响了纤维二糖磷酸化酶二聚体的构象并提示了可能涉及到结合木糖的相关基序。Ribeiro等[81]利用随机非同源重组策略融合了枯草芽孢杆菌的GH11木聚糖酶(XynA)与大肠杆菌的XylF蛋白,设计了一种嵌合酶用以提高木聚糖的降解。通过木糖刺激筛选高效酶,最后通过分子动力学模拟方法指出了相应的木糖结合域。
4 、木糖应用前景
木糖在人体内发挥着重要的生物学功能,在参与糖链尤其是糖胺聚糖的形成方面更是不可或缺,因此在纤维化、炎症、糖尿病并发症等疾病中,木糖修饰也涉及了分子信号识别等重要作用。尽管目前木糖研究已取得了一些成果,但仍有一些问题需要进行深入研究。如现有研究基本以动物模型、细胞系实验为主,人体试验结果如何还不确定,大多还处于推测阶段,后期研究可针对纤维化等疾病中木糖相关的变化,分析木糖糖链组成、来源及分布,进一步揭示木糖在动物尤其是人体中相关的生物学功能。另外,鉴于现有木糖与木糖结合蛋白检测手段还较为薄弱,因此进一步开发相关技术将为木糖研究提供有力的保障,对木糖在糖链中涉及的重要功能以及木糖与蛋白质的相互作用具有重要意义。
参考文献
[1]魏晨.木糖糖基化改性对卵白蛋白功能特性的影响[D].吉林:吉林大学,2019:17
[2]徐勇,王荥,朱均均,等.木糖高效生物转化的新出路.中国生物工程,2012,32(5):113-119
[3]Pauly M,Albersheim P,Darvill AG,et al.Molecular domains of the cellulose/xyloglucan network in the cell walls of higher plants.Plant J,1999,20(6):629-639
[4]Durand C,Vicregibouin M,Folletgueye ML,et al.The organization pattern of root border-like cells of arabidopsis is dependent on cell wall homogalacturonan.Plant Physiol,2009,150(3):1411-1421
[5]Jensen JK,Sorensen S,Harholt J,et al.Identification of a xylogalacturonan xylosyltransferase involved in pectin biosynthesis in arabidopsis.Plant Cell,2008,20(5):1289-1302
[6]Barpeled M,Griffith CL,Doering TL,et al.Functional cloning and characterization of a UDP-glucuronic acid decarboxylase:the pathogenic fungus Cryptococcus neoformans elucidates UDP-xylose synthesis.Proc Natl Acad Sci USA,2001,98(21):12003-12008
[7]Karr DB,Liang R,Reuhs BL,et al.Altered exopolysaccharides of Bradyrhizobium japonicum mutants correlate with impaired soybean lectin binding,but not with effective nodule formation.Planta,2000,211(2):218-226
[8]Fletcher CM,Coyne MJ,Bentley D,et al.Phase-variable expression of a family of glycoproteins imparts a dynamic surface to a symbiont in its human intestinal ecosystem.Proc Natl Acad Sci USA,2007,104(7):2413-2418
[9]Thorsheim K,Siegbahn A,Johnsson RE,et al.Chemistry of xylopyranosides.Carbohydr Res,2015,11(418):65-88
[10]Gotting C,Kuhn J,Kleesiek K,et al.Human xylosyltransferases in health and disease.Cell Mol Life Sci,2007,64(12):1498-1517
[11]Jeppsson M,Bengtsson O,Franke K,et al.The expression of a Pichia stipitis xylose reductase mutant with higher KM for NADPH increase set hanol production from xylose in recombinant Saccharomyces cerevisiae.Biotechnol Bioeng,2006,93(4):665-673
[12]Kuhad RC,Gupta R,Khasa YP,et al.Bioethanol production from pentose sugars:current status and future prospects.Renew Sust Energ Rev,2011,15(9):4950-4962
[13]Scalcinati G,Otero JM,Van JR,et al.Evolutionary engineering of Saccharomyces cerevisiae for efficient aerobic xylose consumption.FEMS Yeast Res,2012,12(5):582-597
[14]Liu L,Zhang L,Tang W,et al.Phosphoketolase pathway for xylose catabolism in Clostridium acetobutylicum revealed by 13C metabolic flux analysis.J Bacteriol,2012,194(19):5413-5422
[15]Tanaka K,Komiyama A,Sonomoto K,et al.Two different pathways for D-xylose metabolism and the effect of xylose concentration on the yield coefficient of L-lactate in mixed-acid fermentation by the lactic acid bacterium Lactococcus lactis IO-1.Appl Microbiol Biotechnol,2002,60(1):160-167
[16]Stephens C,Christen B,Fuchs T,et al.Genetic analysis of a novel pathway for D-xylose metabolism in caulobacter crescentus.J Bacteriol,2007,189(5):2181-2185
[17]刘维喜.微生物木糖代谢途径改造制备生物基化学品.生物工程学报,2013,29(8):1161-1172
[18]Wise MB,Barrick ER,Wise GH,et al.Effects of substituting xylose for glucose in a purified diet for pigs.J Anim Sci,1954,13(2):365-374
[19]Longstaff MA,Knox A,Mcnab JM.Digestibility of pentose sugars and uronic acids and their effect on chick weight gain and caecal size.Br Poult Sci,1988,29(2):379-393
[20]Diebold,G,Mosenthin,R,Piepho,HP,et al.Effect of supplementation of xylanase and phospholipase to a wheat-based diet for weanling pigs on nutrient digestibility and concentrations of microbial metabolites in ileal digesta and feces.J Anim Sci,82(9):2647-2656
[21]尤新,朱路甲.无热量甜味料--结晶木糖的性质功能和应用前景.中国食品添加剂,2009(1):52-56
[22]Cloetens L,Broekaert WF,Delaedt Y,et al.Tolerance of arabinoxylan-oligosaccharides and their prebiotic activity in healthy subjects:a randomised,placebo-controlled cross-over study.Br J Nutr,2010,103(5):703
[23]Sheu WH,Lee I,Chen W,et al.Effects of xylooligosaccharides in type 2 diabetes mellitus.J Nutr Sci Vitaminol (Tokyo),2008,54(5):396-401
[24]Chung YC,Hsu CK,Ko CY,et al.Dietary intake of xylooligosaccharides improves the intestinal microbiota,fecal moisture,and pH value in the elderly.Nutr Res,2007,27(12):756-761
[25]Wang J,Cao YP,Wang CT,et al.Wheatbran xylooligosaccharides improve blood lipid metabolism and antioxidant status in rats fed a high-fat diet.Carbohyd Polym,2011,86(3):1192-1197
[26]Sarma SM,Singh DP,Singh P,et al.Finger millet arabinoxylan protects mice from high-fat diet induced lipid derangements,inflammation,endotoxemia and gut bacterial dysbiosis.Int J Biol Macromol,2018,106:994-1003
[27]Volman JJ,Ramakers JD,Plat J,et al.Dietary modulation of immune function byβ-glucans.Physiol Behav,2008,94(2):276-284
[28]Cao L,Liu X,Qian T,et al.Antitumor and immunomodulatory activity of arabinoxylans:a major constituent of wheat bran.Int J Biol Macromol,2011,48(1):160-164
[29]Rocha J,Popescu A,Sacorreia I,et al.Cloning,expression,purification,crystallization and preliminary crystallographic studies of BceC,a UDP-glucose dehydrogenase from Burkholderia cepacia IST408.Acta Crystallogr Sect F Struct Biol Cryst Commun,2010,66(3):269-271
[30]Puvanesarajah V,Schell FM,Gerhold D,et al.Cell surface polysaccharides from Bradyrhizobium japonicum and a nonnodulating mutant.J Bacteriol,1987,169(1):137-141
[31]Ginsburg V,Neufeld EF,Hassid WZ.Enzymatic synthesis of uridine diphosphate xylose and uridine diphosphate arabinose.Proc Natl Acad Sci USA,1956,42(6):333-335
[32]Csaky TZ,Lassen UV.Active intestinal transport of D-xylose.Biochim Biophys Acta Mol Cell Biol Lipids,1964,82(1):215-217
[33]Gu X,Lee SG,Barpeled M,et al.Biosynthesis of UDP-xylose and UDP-arabinose in Sinorhizobium meliloti1021:first characterization of a bacterial UDP-xylose synthase,and UDP-xylose 4-epimerase.Microbiology,2011,157(1):260-269
[34]Freeman DE.In vitro concentrative accumulation of D-xylose by jejunum from horses and rabbits.Am J Vet Res,1993,54(6):965-969
[35]Nichole FH,John FP.Xylose:absorption,fermentation,and post-absorptive metabolism in the pig.J Anim Sci Biotechnol,2018,9(1):1-9
[36]Christiansen PA,Kirsner JB,Ablaza J,et al.D-xylose and its use in the diagnosis of malabsorptive states.Am JMed,1959,27(3):443-453
[37]Hele MP.The phosphorylation and absorption of sugars in the rat.1.Hexokinase activity in the intestinal mucosa.Biochem J,1953,55(5):857-863
[38]Maki KC,Gibson GR,Dickmann RS,et al.Digestive and physiologic effects of a wheat bran extract,arabinoxylan-oligosaccharide,in breakfast cereal.Nutrition,2012,28(11):1115-1121
[39]Anderson JW,Bridges SR.Short-chain fatty acid fermentation products of plant fiber affect glucose metabolism of isolated rat hepatocytes.Exp Biol Med(Maywood),1984,177(2):372-376
[40]Rolston DD,Mathan VI.Xylose transport in the human jejunum.Dig Dis Sci,1989,34(4):553-558
[41]Ohkohchi N,Himukai M,Igarashi Y,et al.Mechanism of D-xylose transport in human small intestine.J Pediatr Gastroenterol Nutr,1986,5(3):372-378
[42]Verstegen MW,Schutte JB,Hel WV,et al.Dietary xylose as an energy source for young pigs.J Anim Physiol Anim Nutr (Berl),1997:180-188
[43]Wyngaarden JB,Segal S,Foley JB,et al.Physiological disposition and metabolic fate of infused pentoses in Man.J Clin invest,1957,36(10):1395-1407
[44]Weser E,Laster L.Metabolism of d-xylose and d-xylonic acid in vivo and in vitro by the guinea pig.Biochem Med,1968,2(1):53-69
[45]Kiani C,Chen L,Wu Y,et al.Structure and function of aggrecan.Cell Res,2002,12(1):19-32
[46]Mizumoto S,Yamada S,Sugahara K,et al.Human genetic disorders and knockout mice deficient in glycosaminoglycan.Biomed Res Int,2014:495764-495764
[47]Castellani AA,Benferoni B,Ronchi S,et al.Light chondromucoprotein from metaphysis cartilage of newborn pigs.Ital J Biochem,1962,11(4):187-195
[48] Ponighaus C,Ambrosius M,Casanova JC,et al.Human xylosyltransferase II is involved in the biosynthesis of the uniform tetrasaccharide linkage region in chondroitin sulfate and heparan sulfate proteoglycans.J Biol Chem,2007,282(8):5201-5206
[49]Wilson IB.Thenever-ending story of peptide O-xylosyltransferase.Cell Mol Life Sci,2004,61(7-8):794-809
[50]Gotting C,Kuhn J,Sollberg S,et al.Elevated serum xylosyltransferase activity correlates with a high level of hyaluronate in patients with systemic sclerosis.Acta Derm Venereol,2000,80(1):60-61
[51]Hwang H,OlsonSK,Brown JR,et al.T h e Caenorhabditis elegans genes sqv-2 and sqv-6,which are required for vulval morphogenesis,encode glycosaminoglycan galactosyltransferase II and xylosyltransferase.J Biol Chem,2003,278(14):11735-11738
[52]Grebner EE,Hall CW,Neufeld EF,et al.Incorporation of D-xylose-C14 into glycoprotein by particles from hen oviduct.Biochem Biophys Res Commun,1966,22(6):672-677
[53]Yu Y,Linhardt RJ.Xylosyltransferase 1 and the GAGattachment site.Structure,2018,26(6):797-799
[54]David CB,Erhard H.Structural basis for the initiation of glycosa minogly can biosyn thesis by human xylosyltransferase 1.Structure,2018,26(6):801-809
[55]Bui C,Huber C,Tuysuz B,et al.XYLT1 mutations in Desbuquois dysplasia type 2.Am J Hum Genet,2014,94(3):405-414
[56]Schreml J,Durmaz B,Cogulu O,et al.The missing“link”:an autosomal recessive short stature syndrome caused by a hypofunctional XYLT1 mutation.Hum Genet,2014,133(1):29-39
[57]Lee J,Kim H,Park Y,et al.Mutations in DZIP1 and XYLT1 are associated with nonsyndromic early onset high myopia in the Korean population.Ophthalmic Genet,2017,38(4):395-397
[58]Munn s CF,Fahiminiya S,Poudel NS,et al.Homozygosity for frameshift mutations in XYLT2 result in a spondylo-ocular syndrome with bone fragility,cataracts,and hearing defects.Am J Hum Genet,2015,96(6):971-978
[59]Kuhn J,Gotting C,Beahm BJ,et al.Xylosyltransferase II is the predominant isoenzyme which is responsible for the steady-state level of xylosyltransferase activity in human serum.Biochem Biophys Res Commun,2015,459(3):469-474
[60]Ponighaus C,Ambrosius M,Casanova JC,et al.Human xylosyltransferase II is involved in the biosynthesis of the uniform tetrasaccharide linkage region in chondroitin sulfate and heparan sulfate proteoglycans.J Biol Chem,2007,282(8):5201-5206
[61]Moloney DJ,Shair LH,Lu FM,et al.Mammalian Notch1 is modified with two unusual forms of o-linked glycosylation found on epidermal growth factor-like modules.J Biol Chem,2000,275(13):9604-9611
[62]Lee TV,Sethi MK,Leonardi J,et al.Negative regulation of notch signaling by xylose.PLoS Genet,2013,9(6):e1003547
[63]Shi X,Huang T,Wang J,et al.Next-generation sequencing identifies novel genes with rare variants in total anomalous pulmonary venous connection.EBioMedicine,2018,38:217-227
[64]Yoshida A,Kobayashi K,Manya H,et al.Muscular dystrophy and neuronal migration disorder caused by mutations in a glycosyltransferase,POMGnT1.Dev Cell,2001,1(5):717-724
[65]Yoshidamoriguchi T,Willer T,Anderson ME,et al.SGK196 is a glycosylation-specific o-mannose kinase required for dystroglycan function.Science,2013,341(6148):896-899
[66]Kanagawa M,Kobayashi K,Tajiri M,et al.Identification of a post-translational modification with ribitol-phosphate and its defect in muscular dystrophy.Cell Rep,2016,14(9):2209-2223
[67]孟彩彩.哺乳动物O-甘露聚糖的化学酶法合成研究[D].济南:山东大学,2019:39-41
[68]Praissman JL,Willer T,Sheikh MO,et al.The functional O-mannose glycan onα-dystroglycan contains a phospho-ribitol primed for matriglycan addition.Elife,2016,5,e14473
[69]Inamori K,Yoshidamoriguchi T,Hara Y,et al.Dystroglycan function requires xylosyl-and glucuronyltransferase activities of LARGE.Science,2012,335(6064):93-96
[70]Kimura Y,Harada T,Matsuo S,et al.Purification and some chemical properties of 30 kDa ginkgo biloba glycoprotein,which reacts with antiserum againstβ1→2 xylose-containing N-glycans.Biosci Biotechnol Biochem,1999,63(3):463-467
[71]Yang G,Cui T,Wang Y,et al.Selective isolation and analysis of glycoprotein fractions and their glycomes from hepatocellular carcinoma sera.Proteomics,2013,13(9):1481-1498
[72]周柔丽.哺乳动物凝集素及其生物学作用.生命的化学,1995,16(1):12-15
[73]Erbeznik M,Strobel HJ,Dawson KA,et al.The D-xylosebinding protein,XylF,from Thermoanaerobacter ethanolicus 39E:cloning,molecular analysis,and expression of the structural gene.J Bacteriol,1998,180(14):3570-3577
[74]Lam VM,Daruwalla KR,Henderson PJ,et al.Protonlinked D-xylose transport in Escherichia coli.J Bacteriol,1980,143(1):396-402
[75]Davis EO,Henderson PJ.The cloning and DNAsequence of the gene xylE for xylose-proton symport in Escherichia coli K12.J Biol Chem,1987,262(29):13928-13932
[76]Wisedchaisri G,Park MS,Iadanza MG,et al.Protoncoupled sugar transport in the prototypical major facilitator superfamily protein XylE.Nat Commun,2014,5:4521
[77]Li Z,Fischer MB,Satkunarajah M,et al.Structural basis of Notch O-glucosylation and O-xylosylation by mammalian protein-O-glucosyltransferase 1(POGLUT1).Nat Commun,2017,8(1):185
[78]Zhong Y,Sun X,Zhang P,et al.Identification and localization of xylose-binding proteins as potential biomarkers for liver fibrosis/cirrhosis.Mol Biosyst,2016,12(2):598-605
[79]Coutinho PM,Henrissat B.Carbohydrate-active enzymes:an integrated database approach[M].Cambridge:The Royal Society of Chemistry,1999:3-12
[80]Chomvong K,Lin E,Blaisse M,et al.Relief of xylose binding to cellobiose phosphorylase by a single distal mutation.ACS Synth Biol,2017,6(2):206-210
[81]Ribeiro LF,Tullman J,Nicholes N,et al.A xylosestimulated xylanase-xylose binding protein chimera created by random nonhomologous recombination.Biotechnol Biofuels,2016,9(1):119