摘 要: 常规聚合酶链式反应对反应条件的要求很高,需要在多个温度下进行循环,而核酸等温扩增仅需在恒定温度下就能进行核酸的高效快速扩增。离心式微流控芯片技术具有微型化、集成化、高通量、自动化等优势,可实现实时、低成本生化检测分析。本文介绍了离心微流控芯片技术在核酸扩增前处理和核酸等温扩增中的应用,主要包括核酸提取、试剂预存储和核酸等温扩增等方面,并且对离心微流控芯片技术用于核酸等温扩增中存在的问题与未来的发展方向进行分析讨论。
关键词: 离心微流控; 核酸提取; 核酸等温扩增; 实时检验;
Abstract: Conventional polymerase chain reaction requires high reaction conditions and needs to be cycled at multiple temperatures,while isothermal nucleic acid amplification only needs to perform efficient and rapid nucleic acid amplification at a constant temperature. Centrifugal microfluidic chip technology has the advantages of miniaturization,integration,high throughput,automation,etc.,and can realize real-time,low-cost biochemical detection and analysis. In this paper,the applications of centrifugal microfluidic chip technology in the pre-processing of nucleic acid amplification and nucleic acid isothermal amplification were introduced,mainly including nucleic acid extraction,reagent pre-storage and nucleic acid isothermal amplification. Furthermore,the problems existing in the application of centrifugal microfluidic chip technology in nucleic acid isothermal amplification and the future development direction were analyzed and discussed.
Keyword: centrifugal microfluidic; nucleic acid extraction; isothermal nucleic acid amplification; real-time detection;
食品安全在现代社会引发越来越广泛的关注,出现许多由食源致病菌的污染食品造成频发的食品安全事件,而早期对致病菌进行分子诊断可有效防止后期产生严重损害。在致病菌检测早期,标志物的检测水平通常非常低[1],需要采用核酸扩增技术来扩增脱氧核糖核酸(Deoxyribo Nucleic Acid,DNA)和核糖核酸(Ribonucleic Acid,RNA),拷贝大量目标核酸,显着提高反应灵敏度[2]。核酸扩增技术包含常规聚合酶链式反应[3](Polymerase Chain Reaction,PCR)、核酸等温扩增等技术。其中,核酸等温扩增技术操作简单,仅需要一个恒温平台,便能使样品进行高效、快速的核酸扩增反应,但仍需要专业的检测人员操作,不宜在现场及基层推广[4]。

微流控技术是将传统实验室的基本功能整合到一个只有几平方厘米的芯片上,仅通过皮升或微升体积的微量流体,便能实现生化分析的各个步骤。此方法具有微型化、集成化、高通量、自动化的优势,为实现现场检测、低成本的生化分析提供了一条经济简便的检测技术途径。目前微流控检测芯片已广泛应用于血液检测[5,6]、药物筛选[7,8]、核酸分析[9,10]、水质分析[11,12]及食品检测[13,14]等方面。微流控芯片的驱动方式分为机械驱动及非机械驱动。机械驱动主要是利用自身部件的运动来达到驱动的目的,包括各种微泵驱动[15]、磁珠驱动[16]和离心力驱动[17]等,非机械驱动方式包括毛细管作用力驱动[18],电动驱动[19]等。离心力驱动芯片是机械驱动中的一种,与微泵驱动、磁珠驱动等机械驱动的不同在于,其不需要连接外部任何其他接口,可实现分析系统的集成性及简便性。由于离心重力场的作用,离心式芯片可以简便去除可能干扰测定的任何气泡,并且通过调节通道的长度及旋转速度,实现不同大小的离心力,仅通过简单主轴电机即可驱动数十或者数百个独立的结构单元,可在芯片上对样品进行分子诊断及检测分析[20]。
近年来,越来越多的研究表明将离心微流控芯片技术与核酸等温扩增技术结合,具有微量化、集成化、自动化等特点,在食品安全、环境保护、医疗卫生等领域展现巨大的发展潜力。本论文介绍了离心微流控芯片技术用于核酸等温扩增的研究进展,包括离心微流控芯片技术用于核酸提取、试剂的预存储,重组酶聚合酶扩增(Recombinase Polymerase Amplification,RPA)、环介导等温扩增(Loop-mediated Isothermal Amplification,LAMP)、依赖核酸序列扩增(Nucleic Acid Sequence-dependent Amplification,NASBA)三种核酸等温扩增方法中的应用。最后,对离心微流控技术用于核酸等温扩增存在的问题和可能的发展方向进行了分析。
1 、离心微流控芯片技术用于核酸扩增前处理
1.1 、核酸提取
在进行核酸扩增检测之前,首先要进行样品中的核酸提取。提取样品中的核酸,真核细胞或细菌需要进行裂解,使核酸易于纯化或浓缩,提取高质量的DNA、RNA是检测成功的关键[21,22,23,24]。离心式芯片上DNA的提取及纯化常采用磁珠或二氧化硅珠机械裂解法。该方法需要三个主要步骤:样品DNA与珠子相的结合、珠子洗涤以及DNA纯化、DNA的洗脱。
STUMPF F等[25]使用磁珠在芯片上进行核酸提取,磁珠为固定相。如图1A所示,将磁珠预存储于芯片腔室(c)中,并将结合液、裂解液、洗涤液1、洗涤液2、洗脱液通过铝复合箔棒状包装预存储于(b)从右至左的五个不同腔室内。样品从进样腔(a)加入,在电机频率为55 Hz的条件下将裂解液、洗涤液1、洗涤液2、洗脱液RNA提取缓冲液从棒状包装中释放出并分别转移至裂解结合腔(c)、洗涤腔1(d)和洗涤腔2(e)和洗脱腔(f)。调节转速为80 Hz将结合液包装破裂并添加至裂解结合腔(c)裂解样品中,使RNA与磁珠结合。通过使用外部移动磁铁的方法依次通过核酸提取腔室(c-f)得到纯化后的RNA。最后提取出纯化后的RNA驱动到微流体通道区域(g)中,使用10 Hz的频率使洗脱液泵送到等分结构(h)中,然后转移至反应腔(i)中进行后续扩增检测。
另一方法,使用二氧化硅珠以提取核酸,硅珠为固定相。JUNG J H等[26]研究出将硅珠以低凹结构填充在微通道中,不论旋转速度和方向如何,这种珠床都是固定的。如图1B所示,将样品加入进样腔(a)中,由于芯片的亲水性,样品自动流入含有硅珠的微通道(b)中,硅珠将RNA样品及一些杂质捕获。洗涤液、洗脱液和RT-LAMP反应混合液分别装入洗涤腔(c)、洗脱腔(d)及RT-LAMP存储腔(e),以5 000 r/min的速度离心10 s,先释放洗涤液,去除残留在硅珠上的盐、蛋白质,通过虹吸阀的设计再释放洗脱液,洗脱硅珠上纯化后的RNA,然后以5 000 r/min的速度逆时针离心290 s完全干燥微珠中的任何残留乙醇,核酸提取的废弃液体由驱动力移动至废液腔(g)。将驱动设备停止30 s,在进样腔(a)中加入无核酸酶水,RT-LAMP存储腔(e)中的反应混合液释放至虹吸阀,以5 000 r/min的速度顺时针旋转90 s,纯化后的RNA与RT-LAMP混合液转移至反应腔(f)并进行后续扩增检测。离心式芯片需要精密设计的微通道和腔室才能够仅通过主轴电机进行核酸的提取及纯化。
1.2 、试剂的预存储
试剂的预存储能够有效避免来自不同生产批次的试剂的混合,有助于减少交叉污染,增强检测效果,减少在检测过程中手动添加试剂。预存储可细分为干燥试剂和液体试剂的存储,由于预存储试剂(例如缓冲液和溶剂)需要低温、隔氧、避光保存等性质,其长期预存储是一个巨大的挑战。
使用干燥形式进行试剂的预存储,通常是在芯片封装之前将预存储试剂添加到聚合物芯片反应室内,然后将试剂进行冷冻干燥,之后再对芯片进行封装。通过优化合适的冷冻干燥参数,冻干试剂能够长期在室温下稳定存储。对于液体试剂,可以预先存储在单独的容器中,也可以直接注入离心式芯片的腔室中。STUMPF F等[25]提出了由不透气的铝复合箔制成微型包装,能够在制造过程中改变微型包装的密封参数,实现在不同的离心力下分批次破裂释放缓冲液,可用于PCR试剂补充液或缓冲液的释放(图1C)。LUTZ S等[27]证明了用于DNA提取的液体试剂的长期稳定预存储。将RPA缓冲液封装在玻璃包装中进行密封,然后将其放在芯片内。当进行检测时,首先将玻璃瓶手动压碎将试剂释放到微流体结构中,再进行后续检测(图1D)。
2 、离心微流控芯片技术用于核酸等温扩增
核酸等温扩增技术能够使用恒定温度对DNA、RNA进行扩增,操作过程较PCR技术简单很多,在现场检测的研究中展现出良好的应用前景。下面介绍离心微流控芯片技术在重组酶聚合酶扩增(RPA)、环介导等温扩增(LAMP)、依赖核酸序列扩增(NASBA)三种核酸等温扩增方法中的应用。
2.1 、重组酶聚合酶扩增(RPA)
重组酶聚合酶扩增(RPA)仅需要一种能够结合单链核酸(寡核苷酸引物)的重组酶,单链DNA结合蛋白(SSB)与被取代的DNA链结合,DNA聚合酶在室温或37℃的最佳温度下均能进行具有活性的链置换反应[28]。反应的第一步是在重组酶和引物之间形成复合物,该复合物与双链DNA中同源序列的互补DNA结合。一旦引物与同源序列结合,就会发生链交换反应,启动DNA合成,并以指数方式扩增模板上的靶区域,取代的DNA链与SSB结合以防止进一步取代[29]。在该系统中,合成反应由两个相对的引物引发,整个过程在10 min内获得可检出水平的扩增产物。这种方法由于反应温度相对较低,不会出现液体蒸发的问题。
图1 离心式微流控芯片的前处理
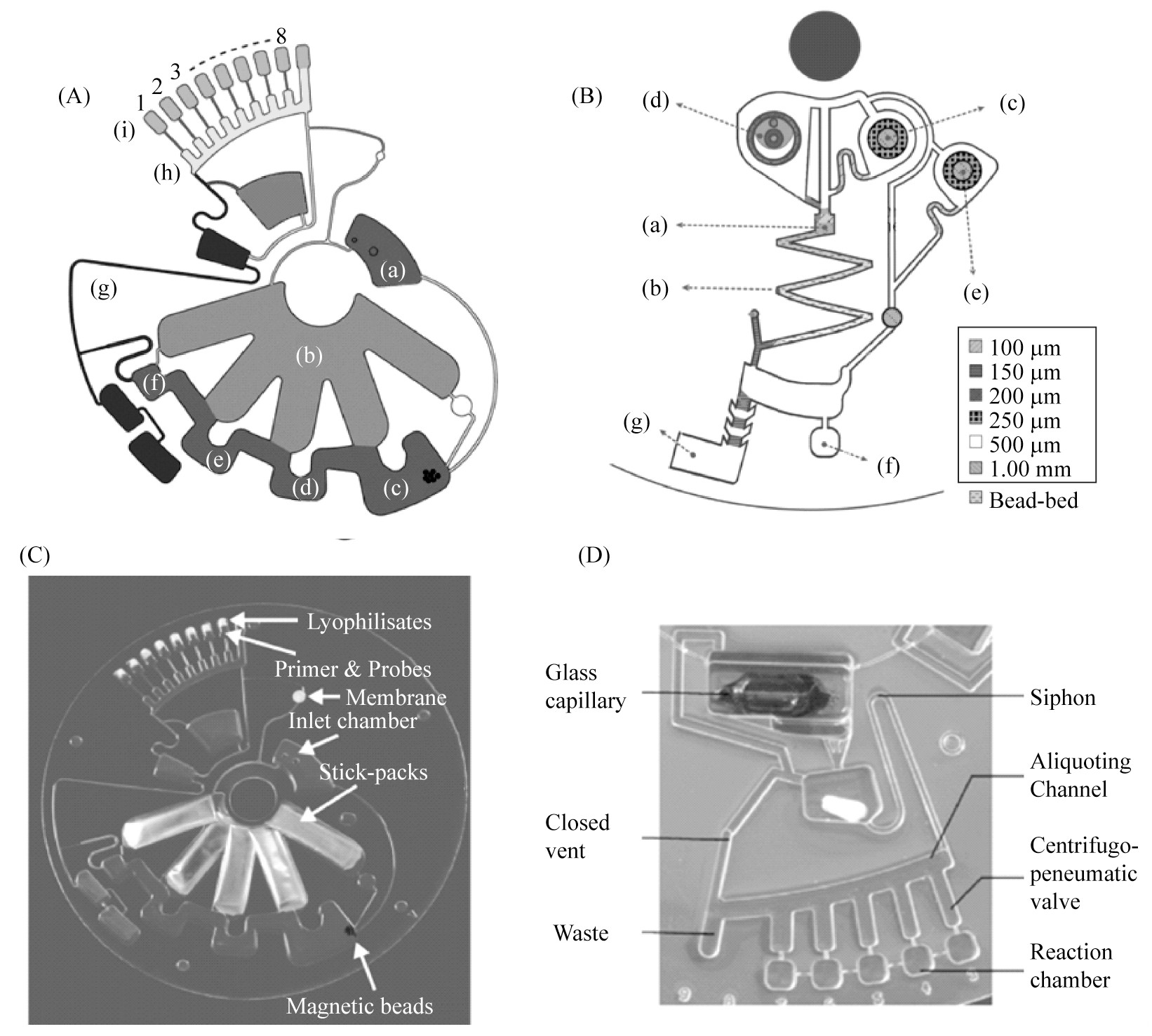
(A)磁珠吸附法[25](B)二氧化硅吸附法[26](C)铝复合箔包装[25](D)玻璃包装[27]
CHOI G等[30],研发出集成性的离心式芯片及配套检测仪器。能够在单个离心式芯片中进行牛奶细菌的裂解,试剂的精准分装,RPA扩增以及实时荧光检测。单个离心式芯片包含一式三份相同功能单元,每个单元含有四个反应腔;每部分芯片由两层组成,包括RPA试剂注入顶层和含有食源性致病菌的加标牛奶样品装入底层。芯片的操作流程如图2A所示:首先将细菌样品添加到芯片的样品入口(a),RPA试剂添加至试剂入口(b),通过800 r/min转速使细菌样品进入等分腔(c)将样品等分为四份,再调节至3 000 r/min转速,顶层的RPA试剂通过微通道流入至缓冲液腔(d)。最终以5 000 r/min的速度将等分腔(c)中的细菌样品和缓冲液腔(d)的RPA试剂同时加载到每个反应腔(e)中混合,再进行RPA扩增后续检测。此方法可以在39℃恒温30 min,通过荧光变化同时检测牛奶样品中三种食源致病菌,并且可直接对样品进行检测无需提取DNA。
CHEN J等[31],研发出一种便携式过滤移液器,可从尿液样本中检测出五种不同的致病菌。芯片的操作流程如图2B所示:首先将磁力搅拌子与氧化锆珠预封装于芯片裂解腔(b)内,通过芯片的入口(a)将细菌悬浮液添加到裂解腔(b),RPA混合溶液添加至储存腔(c)中,并将所有的进出口都用胶带密封。随后把芯片放在定制的磁力搅拌器上,用芯片磁珠裂解法将细菌裂解。其次RPA混合物以100r/min的转速流动到第一个虹吸阀(Ⅰ),再将细菌裂解物以3 000 r/min流动到定量室(d)中。将转速降低至50 r/min,RPA混合溶液流动到第二个虹吸阀(Ⅱ)中,同时裂解物也流动至虹吸阀(Ⅲ)中,同时进入混合腔(e)。调节转速500 r/min至4 000r/min使细菌裂解物与RPA混合液在混合腔进行混合。最终调节1 000 r/min的转速使溶液在等分腔(f)中等分,再以4 000 r/min的转速分配到各反应腔室(g)中进行实时RPA扩增及荧光检测。此方法能够在39℃下反应30 min从尿液样品中成功检测到大肠杆菌,变形杆菌,铜绿假单胞菌和金黄色葡萄球菌。
图2 离心式芯片与等温扩增相结合
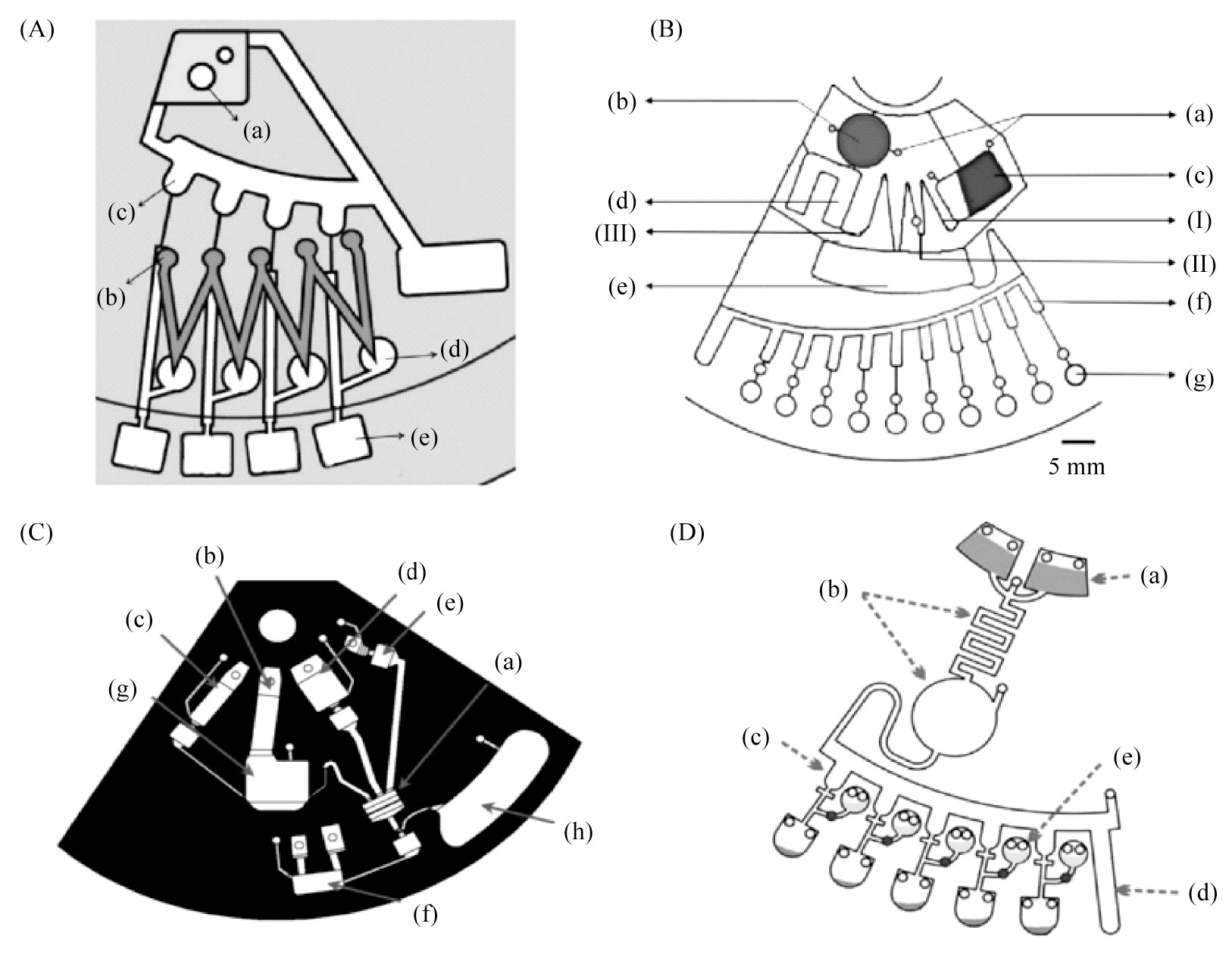
(A)食源性致病菌的检测[30](B)致病菌的检测[31](C)单病原菌检测[35](D)病原菌的检测[36]
KIM T H等[32]研发出一种离心微流控驱动检测设备。在等温扩增步骤中,可以通过单个激光二极管用于阀门驱动、细胞裂解和非接触无线控制的加热功能,研发出紧凑而小型的系统。其能够将DNA提取、等温重组酶聚合酶扩增和检测的三个主要步骤一体化,可用于微量沙门氏菌核酸分析系统。
离心式微流体平台与RPA结合使用时,RPA具有高灵敏度,故需要对于不同基因的引物和探针序列进一步优化防止非特异性产物扩增或检测样品被污染。由于离心式芯片添加样品及检测样品的量均很小,需要考虑到扩增、检测方法的可行性及重复性。
2.2、 环介导等温扩增(LAMP)
环介导等温扩增(LAMP)使用一对设计的引物(前向和后向内引物)来生成两端都带有环的模板,借助前向和后向外部引物,使该双端环状模板将靶DNA序列置换。通过使用前向和后向内部引物复制并延长两端环状模板,将其用于下游扩增[33]。由于复制和延伸可以同时进行,DNA扩增的速度增加。反应使用四种引物和具有高抑制剂耐受性的Bst DNA聚合酶,仅需在60 min内,60℃至70℃恒定温度范围内下发生反应[34],可显着提高了扩增效率和特异性。
LOO J F C等[35]研究出集成的离心式核酸等温扩增芯片,包括DNA提取、LAMP反应和实时荧光检测。其设计创新点在于使用微球油脂被动阀来控制流体的存储和释放。芯片的操作流程如图2C所示:首先将微球、硅胶膜及蛋白酶K预存储于芯片中(a)及加热部分(g),依次在进样腔(b)、结合液添加腔(c)、洗涤液添加腔(d)、洗脱液添加腔(e)、LAMP反应添加液腔室(f)加入对应溶液,每个腔室均使用各种具有不同开启压力的微球油脂阀。其次调节300 r/min的转速释放样品到(g),与预存储的蛋白酶K混合并加热到56℃,实现细菌裂解。转速增加至600 r/min,使结合液释放到(g)与裂解样品混合,并流动至硅胶膜,DNA与硅胶膜结合;转速增加至900 r/min,释放洗涤液洗涤纯化在二氧化硅上的DNA;转速增加至1 200 r/min释放洗脱液,将DNA从硅胶膜洗脱;最后,转速增加至1 500 r/min,使纯化的DNA流动到LAMP反应位点(f),同时将LAMP反应物与DNA进行混合,在反应腔(f)进行LAMP扩增及后续检测反应,其他缓冲液进入废液腔(h)。此芯片能够在2 h内检测到痰液和血液中结核分枝杆菌和鲍曼不动杆菌且最小检测线为103和102CFU。但此方法的检测平台在通量方面具有局限性,运行一次只能检测一种样品的一种目标细菌,并且微球和油脂被动阀的稳定性较差,需要在实验中最大程度地减少油脂对分子诊断影响。
SAYAD A等[36]开发了适用于单病原体检测的离心式芯片,此芯片将LAMP与自动无线终点检测系统相结合。该离心式芯片设计包含一式六份的相同的功能单元,每个单元含有五个反应腔对三种不同食源性病原体检测。芯片的操作流程如图2D所示:首先将蜡及密封材料(如石蜡油)分别注入蜡阀及密封材料腔(e),并将DNA样品及引物分别加入(a)的进样腔和缓冲液腔;以400 r/min的转速将样品与缓冲液通过微通道至混合腔中(b)进行混合,再以600 r/min的转速将混合好的试剂进入等分腔(c)等分,过量的液体进入废液腔(d)。最终调节1 200 r/min转速将液体转移至反应腔进行LAMP反应。由于LAMP反应可能产生气溶胶污染,因此采用融化蜡阀使密封材料腔(e)中液体流出,密封LAMP反应环境。此芯片使用钙黄绿素比色法检测,仅需60℃下反应60 min便能通过蓝牙无线技术将检测结果传输至智能手机,该检测方法的最低检测限为3×10-5ng/μL。
ZHANG L等[37]报告了一种手动离心操控的离心式芯片,通过手工拉动一组啮合齿轮实现芯片的离心旋转。此芯片将核酸纯化与LAMP方法整合在一起,该芯片分为四层,包含一式八份的相同的检测单元,每个检测单元由四个检测腔组成。此芯片采用将沸石预存储于芯片内方便核酸纯化,再设计毛细管阀控制样品与各腔室的连接,最终通过离心速度的调节逐级流动。手动离心机可将样品通过不同离心力旋转进入检测腔,使用无电方式同时检测六种病原体。
离心式芯片与LAMP结合可有效实现集成化,小型化检测,LAMP方法可在一个离心式芯片上实现多目标检测,此设计将具有重大价值,拥有很高的应用前景。但LAMP引物多且设计复杂,需要进一步的研究来改善引物特异性,并且其扩增产物是一条长DNA链,不适合鉴定目标核酸的其他分子,且通用性较PCR低。
2.3 、依赖核酸序列扩增(NASBA)
依赖核酸序列扩增(nucleic acid sequence-based amplification,NASBA)是一种以单链RNA为模板,在恒温条件下,通过逆转录酶、RNase H、T7 RNA聚合酶、正向引物和反向引物来模拟体内逆转录病毒的复制机制,对目标RNA进行扩增,90 min内可以将靶标扩增至1012,其产物长度为100 bp~250 bp,灵敏度可达检测单个拷贝的靶标分子[38],通过调整NASBA扩增程序可以用于DNA的检测,但需要反复开管加入不同阶段所需要的组分[39]。
DEIMAN B等[40]提出了使用非接触加热和荧光检测技术来实现核酸体外扩增的离心式芯片。通过实施基于核酸序列的扩增(NASBA)反应,对流感嗜血杆菌的tm RNA转录,证明了离心式芯片功能。该系统实施非接触式红外加热,在变性和扩增步骤中将NASBA反应加热至所需的目标温度。该控制系统使用磁场进行腔室定位,在所需位置进行加热和荧光检测。流感嗜血杆菌tm RNA在系统上执行的NASBA测定范围为102~104个。
由于NASBA反应需要两个不同的温度,RNA二级结构的变性需要65℃,反应孵育需要41℃,因此RPA反应(37℃~42℃)和LAMP反应(60℃~65℃)更常应用于离心式芯片。且此方法扩增步骤多,反应体系较复杂,需要多次添加缓冲不易开发集成性离心式检测芯片。
3 、总结及展望
离心微流控芯片不需要其它外部连接,能够降低了样品检测过程中出现交叉污染的风险,有效避免了处理生物危害性样品的危险,避免了扩增后产物释放有毒有害物质等情况。因为离心微流控检测仪体积小,方便携带,检测时间短,测量精准等优势,已经研究出在食品、医疗、环境等方面的离心式芯片。将离心微流控技术与核酸等温扩增相结合,为现场短时间核酸检测提供可能。
为了实现离心微流控技术在核酸等温扩增一体化系统集成应用,还需要一些改进研究。第一,在离心式芯片样品制备中,最新技术仅允许从少量、简单的样品中提取核酸,但不能处理更复杂的样品(组织等),因此,在芯片上处理复杂的样品仍是一个紧迫的问题;第二,在检测过程中,许多步骤仍需手动进行样品及缓冲液的添加,且对于部分液体试剂,缺乏芯片上长期稳定有效的预存储方法;第三,目前离心式芯片制作需要微通道,预存储,阀门设计,珠粒填充等步骤,需要高紧密度和准确性,难以确保产业化的可重复性;第四,离心式芯片的自动化程度还不高,应开发相应检测程序软件帮助进一步实现更便捷、快速、准确的测试结果。
未来微流控技术用于核酸检测的发展趋势在于:核酸检测人员不需要经过仔细的样品收集和专门操作基本仪器的培训,便能够准确检测出结果;规模化制造具有低成本、高质量的商业离心式芯片检测产品,自动化完成一系列测试反应,后期能够轻松进行数据分析,报告,保存和导出的集成性产品。
参考文献
[1] WANG F,ELBAZ J,ORBACH R,et al. Amplified analysis of DNA by the autonomous assembly of polymers consisting of DNAzyme wires[J]. J Am Chem Soc,2011,133(43):17149-17151.
[2]吴海平.食源性致病菌高通量检测方法及应用[J].工业微生物,2012,42(2):64-68.
[3] KANG T S. Basic principles for developing real-time PCR methods used in food analysis:A review[J]. Trends in Food Sci Technol,2019,91:574-585.
[4] BRENNAN D,COUGHLAN H,CLANCY E,et al. Development of an on-disc isothermal in vitro amplification and detection of bacterial RNA[J]. Sensors and Actuators B:Chemical,2017,239:235-242.
[5] WOO H K,SUNKARA V,PARK J,et al. Exodisc for Rapid,Size-Selective,and Efficient Isolation and Analysis of Nanoscale Extracellular Vesicles from Biological Samples[J]. ACS Nano,2017,11(2):1360-1370.
[6] MOON J M,KIM D M,KIM M H,et al. A disposable amperometric dual-sensor for the detection of hemoglobin and glycated hemoglobin in a finger prick blood sample[J]. Biosens Bioelectron,2017,91:128-135.
[7] BEN-YAKAR A. High-content and high-through put in vivo drug screening platforms using microfluidics[J]. Assay and Drug Development Technologies,2019,17(1):8-13.
[8]蔡颖,陈阳,洪战英,等.浓度梯度微流控芯片平台的构建及其应用于抗白念珠菌药物快速筛选研究[J].药学学报,2020,55(2):323-329.
[9] LIU R,MCONNELL E M,LI J,et al. Advances in functional nucleic acid based paper sensors[J]. Journal of Materials Chemistry B,2020,8(16):3213-3230.
[10] CHEN L,MANZ A,DAY P J R. Total nucleic acid analysis integrated on microfluidic devices[J]. Lab Chip,2007,7(11):1413-1423.
[11] NOWBAHAR A,WHITAKER K A,SCHMITT A K,et al.Mechanistic Study of Water Droplet Coalescence and Flocculation in Diluted Bitumen Emulsions with Additives Using Microfluidics[J]. Energy Fuels,2017,31(10):10555-10565.
[12] CHENG J,SHAO J W,YE Y F,et al. Microfluidic Preconcentration Chip with Self-Assembled Chemical Modified Surface for Trace Carbonyl Compounds Detection[J]. Sensors(Basel),2018,18(12):4402-4410.
[13]周新丽,申炳阳,高丽娟,等.用于五种动物源性成分快速检测的离心式微流控芯片系统研制[J].食品与发酵工业,2020,46(3):229-234.
[14] AN X S,ZUO P,YE B C. A single cell droplet microfluidic system for quantitative determination of food-borne pathogens[J].Talanta,2020,209:120571-120671.
[15] LI D,ZHAO Z,CHANG H L. Chip-based nanoflow liquid chromatography for on-chip detection of glycated haemoglobin levels[J]. Sensors Actuators B:Chemical,2019,291:433-440.
[16] LI Y,BURKE D T,KOPELMAN R,et al. Asynchronous Magnetic Bead Rotation(AMBR)Microviscometer for Label-Free DNA Analysis[J]. Biosensors(Basel),2014,4(1):76-89.
[17] LAW I L G,LOO J F C,KWOK H C,et al. Automated realtime detection of drug-resistant Mycobacterium tuberculosis on a lab-on-a-disc by Recombinase Polymerase Amplification[J]. Anal Biochem,2018,544:98-107.
[18] MURDOCK R C,GALLEGOS K M,HAGEN J A,et al. Development of a point-of-care diagnostic for influenza detection with antiviral treatment effectiveness indication[J]. Lab Chip,2017,17(2):332-340.
[19] LU Y,GAO J,ZHANG D D,et al. Single cell antimicrobial susceptibility testing by confined microchannels and electrokinetic loading[J]. Anal Chem,2013,85(8):3971-3976.
[20] ZEHNLE S,SCHWEMMER F,BERGMANN R,et al. Pneumatic siphon valving and switching in centrifugal microfluidics controlled by rotational frequency or rotational acceleration[J].Microfluidics and Nanofluidics,2015,19(6):1259-1269.
[21] CAO G J,KONG J L,XING Z F,et al. Rapid detection of CALR type 1 and type 2 mutations using PNA-LNA clamping loop-mediated isothermal amplification on a CD-like microfluidic chip[J]. Anal Chim Acta,2018,1024:123-135.
[22] OH S J,PARK B H,JUNG J H,et al. Centrifugal loop-mediated isothermal amplification microdevice for rapid,multiplex and colorimetric foodborne pathogen detection[J]. Biosens Bioelectron,2016,75:293-300.
[23] LIU Q,ZHANG X L,CHEN L P,et al. A sample-to-answer labdisc platform integrated novel membrane-resistance valves for detection of highly pathogenic avian influenza viruses[J]. Sensors and Actuators B:Chemical,2018,270:371-381.
[24] PARK B H,OH S J,JUNG J H,et al. An integrated rotary microfluidic system with DNA extraction,loop-mediated isothermal amplification,and lateral flow strip based detection for point-ofcare pathogen diagnostics[J]. Biosens Bioelectron,2017,91:334-340.
[25] STUMPF F,SCHWEMMER F,HUTZENLAUB T,et al. LabDisk with complete reagent prestorage for sample-to-answer nucleic acid based detection of respiratory pathogens verified with influenza A H3N2virus.[J]. Lab Chip,2016,16(1):199-207.
[26] JUNG J H,PARK B H,OH S J,et al. Integrated centrifugal reverse transcriptase loop-mediated isothermal amplification microdevice for influenza A virus detection[J]. Biosens Bioelectron,2015,68:218-224.
[27] LUTZ S,WEBER P,FOCKE M,et al. Microfluidic lab-on-afoil for nucleic acid analysis based on isothermal recombinase polymerase amplification(RPA)[J]. Lab Chip,2010,10(7):887-893.
[28] DAHER R K,STEWART G,BOISSINOT M,et al. Recombinase Polymerase Amplification for Diagnostic Applications[J].Clin Chem,2016,62(7):947-958.
[29]安娜,柳方方,董美,等.基于PCR技术的DNA分析测试关键要素[J].基因组学与应用生物学,2019,38(2):624-629.
[30] CHOI G,JUNG J H,PARK B H,et al. A centrifugal direct recombinase polymerase amplification(direct-RPA)microdevice for multiplex and real-time identification of food poisoning bacteria[J]. Lab Chip,2016,16(12):2309-2316.
[31] CHEN J,XU Y C,YAN H,et al. Sensitive and rapid detection of pathogenic bacteria from urine samples using multiplex recombinase polymerase amplification[J]. Lab Chip,2018,18(16):2441-2452.
[32] KIM T H,PARK J,KIM C J,et al. Fully integrated lab-on-adisc for nucleic acid analysis of food-borne pathogens[J]. Anal Chem,2014,86(8):3841-3848.
[33] FANG X E,LIU Y Y,KONG J L,et al. Loop-mediated isothermal amplification integrated on microfluidic chips for point-of-care quantitative detection of pathogens[J]. Anal Chem,2010,82(7):3002-3006.
[34] KIM J H,YOO I S,AN J H,et al. A novel paper-plastic hybrid device for the simultaneous loop-mediated isothermal amplification and detection of DNA[J]. Materials Letters, 2018, 214:243-246.
[35] LOO J F C,KWOK H C,LEUNG C C H,et al. Sample-to-answer on molecular diagnosis of bacterial infection using integrated lab-on-a-disc[J]. Biosens Bioelectron,2017,93:212-219.
[36] SAYAD A,IBRAHIM F,UDDIN S M,et al. A microdevice for rapid,monoplex and colorimetric detection of foodborne pathogens using a centrifugal microfluidic platform[J]. Biosens Bioelectron,2018,100:96-104.
[37] ZHANG L,TIAN F,LIU C,et al. Hand-powered centrifugal microfluidic platform inspired by the spinning top for sample-toanswer diagnostics of nucleic acids[J]. Lab Chip,2018,18(4):610-619.
[38] BRINK A A,VERVOORT M B,MIDDELDORP J M,et al. Nucleic acid sequence-based amplification,a new method for analysis of spliced and unspliced Epstein-Barr virus latent transcripts,and its comparison with reverse transcriptase PCR[J]. J Clin Microbiol,1998,36(11):3164-3169.
[39] MALEK L,SOOKNANAN R,COMPTON J. Nucleic acid sequence-based amplification(NASBA)[J]. Methods Mol Biol,1994,28:253-260.
[40] DEIMAN B,VAN AARLE P,SILLAKENS P. Characteristics and Applications of Nucleic Acid Sequence-Based Amplification(NASBA)[J]. Mol Biotechnol,2002,20(2):163-179.