摘 要: 构成天然蛋白质的氨基酸为L构型,D构型氨基酸虽然不是构成蛋白质的基本结构单元,但许多植物、微生物甚至在人体中都有D-氨基酸的存在。DNA聚合酶链式反应广泛发生在生物体内及PCR实验中,首次探究手性氨基酸及其与金属离子协同条件下对Taq-DNA聚合酶催化下的DNA链式聚合反应的影响情况,为进一步研究手性氨基酸及金属离子对生物体的影响提供实验依据。变性聚丙烯酰胺凝胶电泳结果表明,酸性氨基酸对于DNA链式聚合反应有抑制作用,极性不带电荷氨基酸其L构型对引物延伸的抑制作用大于D构型氨基酸,而极性带正电荷的氨基酸D构型与L构型的作用则与其相反。在加入Na+、K+、Ca2+等9种金属离子及手性氨基酸的实验当中,铝盐及锆盐溶液对PCR实验几乎完全抑制;镍、铜、钙对其影响次之。加入手性氨基酸金属络合物之后,其影响结果部分发生改变。
关键词 : 手性氨基酸;金属离子; DNA链式聚合; Taq-DNA聚合酶,
Abstract: The amino acids that make up natural proteins are L-conformation. Although Dconformation amino acids are not the basic structural units of proteins, many plants,microorganisms,and even human bodies have D-amino acids. DNA polymerase chain reaction occurs widely in organisms and in PCR. In this paper, the effect of chiral amino acids and their coordination with metal ions on DNA chain reaction catalyzed by Taq-DNA polymerase was investigated for the first time. It provides experimental basis for further study of the effects of chiral amino acids and metal ions on organisms. Denaturing polyacrylamide gel electrophoresis showed that acidic amino acids had inhibitory effect on DNA chain polymerization,and the polar uncharged amino acids. The inhibition of primer extension by L configuration was greater than that of D configuration amino acids,whereas the D structure of polar positively charged amino acids was opposite to that of L configuration. In the experiments of adding 9 metal ions such as Na+,K+,Ca2+,and chiral amino acids,the PCR was almost inhibited by aluminium and zirconium salts,followed by nickel,copper and calcium. When chiral amino acid metal complexes were added,the influence of chiral amino acid metal complexes on the results was partly changed.
Keyword: chiral amino acids; metal ions; DNA chain polymerization; Taq-DNA polymerase;
手性是生物化学和医学等各个领域中热点问题之一[1,2]。DNA作为生命体中重要的遗传物质,通过转录合成m RNA进而控制氨基酸合成蛋白质[3]。而氨基酸作为构成蛋白质的基本单位,广泛存在于生命体内。在20种组成人体蛋白质的氨基酸当中,构成蛋白质的天然氨基酸为L构型(L-AAs),这确保了蛋白质的一级结构,使蛋白质达到预期的功能[4]。非天然的D型氨基酸(D-AAs)虽然不是构成蛋白质的基本结构单元,但在许多植物、微生物甚至是人体中都有存在。这些D-AAs主要是L-AAs的非生物酶的外消旋产物或由其他D-AAs的氨基转移酶合成的产物获得的[5,6]。DNA聚合反应在DNA聚合酶的作用下进行,来自水生嗜热杆菌的DNA聚合酶I[7](TaqDNA聚合酶)在聚合酶链式反应(PCR)的生物技术中起着重要作用[8,9]。

D-氨基酸体外来源有服用一些药物和日常食物含有的D-氨基酸,某些药物如由微生物制得的某些抗生素就会有D-缬氨酸、D-丝氨酸等[10],也有些药物如利尿药、低血糖、低血钙药物能抑制D-氨基酸氧化酶的合成,使体内D-氨基酸水平增加。
D氨基酸对人体的影响一直有所争议,D-AAs通常在羊水或脑脊液中含量最低(低于相应的L-AAs的1%)。而尿液中含量最高(通常为10%以下)[11]。D-天冬氨酸(Asp)和D-丝氨酸(Ser)残基在不同的衰老组织中均有特异性检测;例如,在视网膜、结膜、角膜[12,13]、牙齿、骨骼[14]、动脉壁、韧带、大脑[15]、皮肤[16]中都发现了D-Asp残基,而在大脑中也发现了D-Ser残基[17,18]。人眼因D氨基酸含量增多而失去光泽甚至病变;在老年痴呆的人的大脑中发现D氨基酸的含量增加[19];据报道D-谷氨酸浓度的增加会对酵母细胞的生长产生较强的抑制作用[20]。但也有研究发现添加D-氨基酸混合物可提高乳酸链球菌的耐酸能力,提高乳酸链球菌内酯的产率[21];在皮肤屏障功能受损时,促进细胞间脂质的生成,加快屏障功能恢复。在真皮纤维母细胞(FB)中,D-天冬氨酸能够减轻因自由基产生源的增加而引起的氧化毒性。另外,D-蛋氨酸亦显示出对于FB的紫外线损伤有抑制效果。D-氨基酸目前已被应用至护肤品当中[22]。游离型D-丝氨酸局部存在于成熟哺乳动物的前脑(大脑皮质、海马区等),与神经传导的调节有关[23,24,25]。
Taq-DNA聚合酶由于其优异的热稳定性是PCR中常用酶之一。金属离子如Ca2+、Ni2+、Cr3+已被报道影响DNA聚合酶的活性[26,27]。铁钴(II)单、双链小分子螯合物抑制转录过程的发生[28]。环烯醚萜、马鞭草苷及其衍生物对TaqDNA聚合酶有抑制作用[29]。还有一些抑制剂包括双脱氧核苷酸、磷脂、脂肪酸、类黄酮、三萜类、喜树碱、花青素和椭圆苷类已被用于临床试验[30,31,32,33]。但目前手性氨基酸及其与金属离子配合物对DNA聚合反应的影响仍未见报道。
本文是在Taq-DNA聚合酶作用下进行的DNA链式聚合反应,同时加入手性氨基酸、手性氨基酸与金属离子共混液、金属离子等,改变DNA链式聚合反应体系的反应环境。通过变性聚丙烯酰胺凝胶电泳将产物进行分离,使用Image Lab软件进行条带含量分析,通过分析反应条带百分比和统计学显着性水平验证确定手性氨基酸等因素对DNA链式聚合反应的影响。同时进行手性氨基酸对DNA链式聚合反应影响的时间动力学分析、手性氨基酸与金属离子的共同作用等实验,进一步验证手性氨基酸对DNA链式聚合反应的影响情况。
1 、实验部分
1.1 、材料与试剂
实验所用的药品是分析纯。所有溶液用超纯水配制。DL-丙氨酸(DL-Ala),DL-缬氨酸(DL-Val)等手性氨基酸均购于上海阿拉丁生化科技股份有限公司。氯化钠(Na Cl)、氯化铝(Al Cl3)、氯化钾(KCl)、氯化钙(Ca Cl2)等金属盐购于北京化工厂。d NTP、转录模板链和5'-FAM标记引物订购于上海生工生物股份有限公司。Taq DNA聚合酶及10×Taq Buffer购于北京天根生化科技有限公司。
1.2 、主要仪器与设备
仪器使用Thermo Nano DropTMOne超微量紫外分光光度计、Bio-Rad Chemi Doc XRS高灵敏化学发光成像系统、Bio-Rad凝胶电泳仪及PCR仪。
1.3 、手性氨基酸浓度的确定
手性氨基酸溶液均由超纯水配制成50 mmol/L水溶液,使用Thermo Nano Drop超微量紫外分光光度计全波长(200~900 nm)扫描确定手性氨基酸的紫外吸收峰强度。由测量结果(表1)可知,同种手性氨基酸的吸收强度基本一致,即DL两种构型氨基酸浓度相同,符合实验条件。20种氨基酸在可见光区域均无光吸收,在近紫外区只有3种氨基酸有光吸收能力,这3种氨基酸是苯丙氨酸(Phe)、酪氨酸(Tyr)、色氨酸(Try),因为它们的R基含有苯环共轭双键系统。
表1 手性氨基酸(50 mmol/L)超微量全波长扫描表
1.4、 手性氨基酸影响下的DNA引物延伸
手性氨基酸作用下的DNA链式聚合反应结果是通过检测产生的引物延伸的量来测定的。其反应体系包括T-25 (5'-GACACGCTCTATAGTGAGTCGTATT-3')模板及P-17(5'-AATACGACTCACTATAG-3')荧光标记引物,通过羧基荧光素标记的引物在488 nm波长激发下会发出荧光信号,当模板与引物发生链式聚合反应,即T-25与P-17发生结合并进行引物延伸,25 bp处会出现相应的荧光信号。通过检测分析25 bp处荧光信号强弱来确定DNA链式聚合的反应情况。取模板与引物各1μL(10μmol/L)溶解于2μL 10×Taq Buffer中,95℃下高温退火5 min,降至室温后,进行平行实验。手性氨基酸及各个金属盐溶液(Na Cl、Al Cl3、KCl、Ca Cl2、Fe Cl2、Fe Cl3、Ni Cl2、Cu Cl2、Zr Cl4)均配置成50 mmol/L溶液,并按体积比2∶1混合均匀,室温下放置24 h,待手性氨基酸与金属离子充分作用后进行实验。反应体系中加入1μL(10 mmol/L)的d NTP,用dd H2O补齐至20μL反应体系。最后同时加入0.5 U的Taq DNA聚合酶在55℃恒温孵育30 min。反应完成后加入同等体积的指示剂缓冲溶液(90%去离子甲酰胺,25 mmol/L EDTA,0.02%溴酚蓝)混合均匀后放入-20℃冰箱内冷藏,使所有实验组反应停止时间一致。取4μL样品注射到含有7 mol/L尿素的20%变性聚丙烯酰胺凝胶中,150 V电泳1 h,电泳缓冲液为1×TBE缓冲液。经Bio-Rad的Chemi Doc XRS化学发光凝胶系统成像,通过Image Lab软件进行条带分析。其反应条带百分比(Bypass)为模板与引物反应生成产物的量与该泳道剩余引物及产物之和的比值。
1.5、 DNA引物延伸时间动力学测定
与手性氨基酸影响下的DNA引物延伸实验类似,加入Taq DNA聚合酶在55℃恒温孵育后,分别在0、5、10、15、20、25、30 min时间点进行取样。将样品加入同等体积的缓冲液混合均匀后放入-20℃冰箱内,确保停止反应。取4μL反应溶液加入至20%变性聚丙烯酰胺凝胶泳道中,进行150 V电泳1 h。通过化学发光凝胶成像仪进行成像,使用Image Lab软件进行条带分析。
2 、结果与讨论
2.1 、非极性手性氨基酸对DNA链式聚合反应的影响
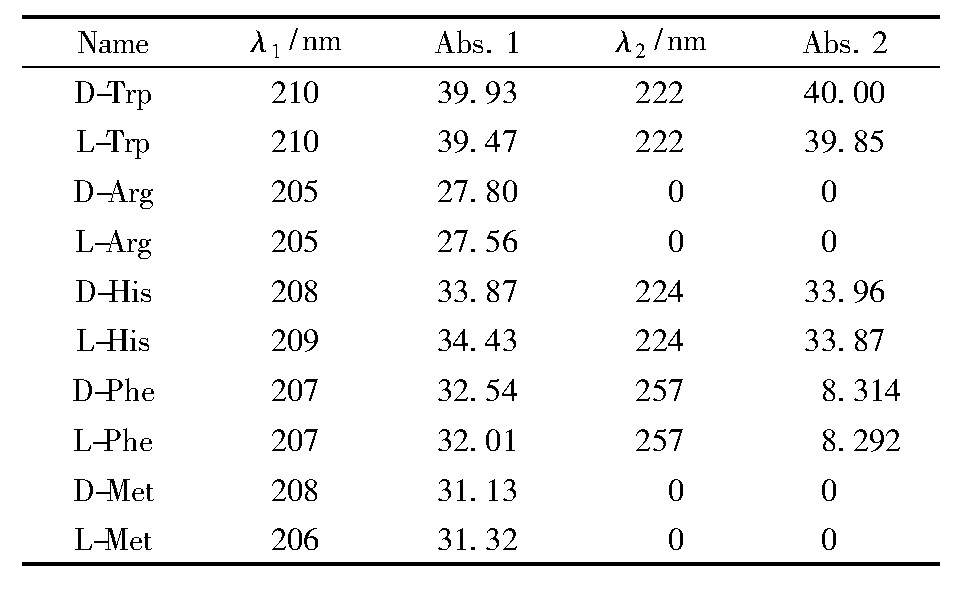
非极性氨基酸共有9种,其中非极性脂肪族R基氨基酸有甘氨酸(Gly)、丙氨酸(Ala)、缬氨酸(Val)、亮氨酸(Leu)、甲硫氨酸(Met)、异亮氨酸(Ile);非极性芳香族R基氨基酸有苯丙氨酸(Phe)、酪氨酸(Tyr)、色氨酸(Try)。除甘氨酸无手性对映体外,其余氨基酸均有D、L两种手性构型。选取丙氨酸、缬氨酸、亮氨酸、甲硫氨酸、苯丙氨酸以及色氨酸进行实验,选取重复实验3次结果作图,并计算氨基酸与空白组及手性氨基酸D、L构型之间的显着性水平(P-Value)。其中10 mmol/L非极性手性氨基酸对DNA链式聚合反应30 min条件下的影响结果见图1。
图1 非极性手性氨基酸对DNA链式聚合反应产物影响
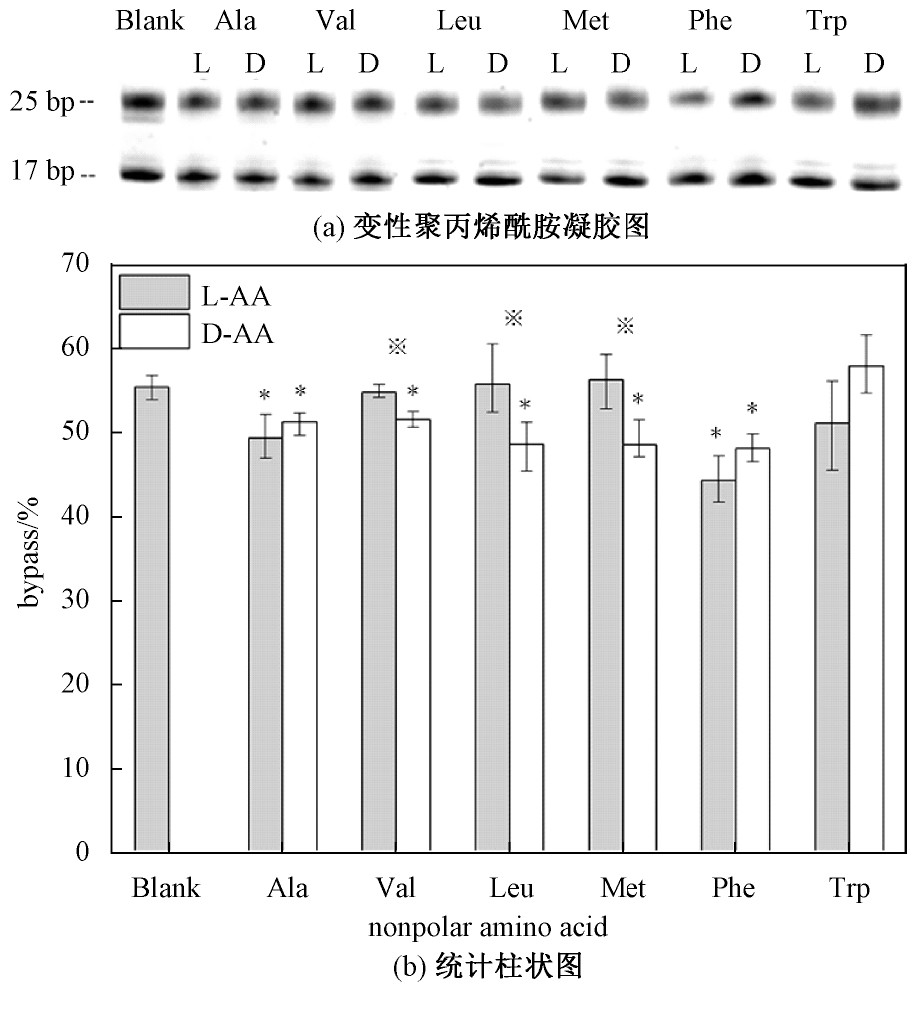
Fig.1 The effect of nonpolar chiral amino acids on the products of DNA chain polymerization
*为氨基酸与空白组间存在显着性差异(P≤0.05),※为手性氨基酸DL构型间存在显着性差异(P≤0.05)。下图均同。
通过显着性差异分析,显着性水平P值越小,两者差异性越显着,一般认为P≤0.05时差异有显着性。从图1可以看出L-苯丙氨酸对DNA链式聚合反应的抑制作用大于其他非极性氨基酸,L-丙氨酸抑制作用次之,L-缬氨酸、L-亮氨酸、L-蛋氨酸、L-色氨酸对DNA链式聚合反应的影响不明显。此外除D-色氨酸外,其余D构型非极性氨基酸均不同程度地抑制DNA链式聚合反应,其中缬氨酸、亮氨酸、甲硫氨酸的D构型抑制作用大于其L构型。
2.2 、极性氨基酸对DNA链式聚合反应的影响
极性氨基酸共有11种,分为极性不带电荷(中性)氨基酸、极性带负电荷(酸性)氨基酸和极性带正电荷(碱性)氨基酸。其中极性不带电荷氨基酸有脯氨酸(Pro)、天冬酰胺(Asn)、丝氨酸(Ser)、苏氨酸(Thr)、半胱氨酸(Cys)、谷氨酰胺(Gln)。通过实验得出极性不带电荷氨基酸在10 mmol/L浓度下对DNA链式聚合反应30 min的影响见图2。
图2 极性不带电荷手性氨基酸对DNA链式聚合反应产物影响
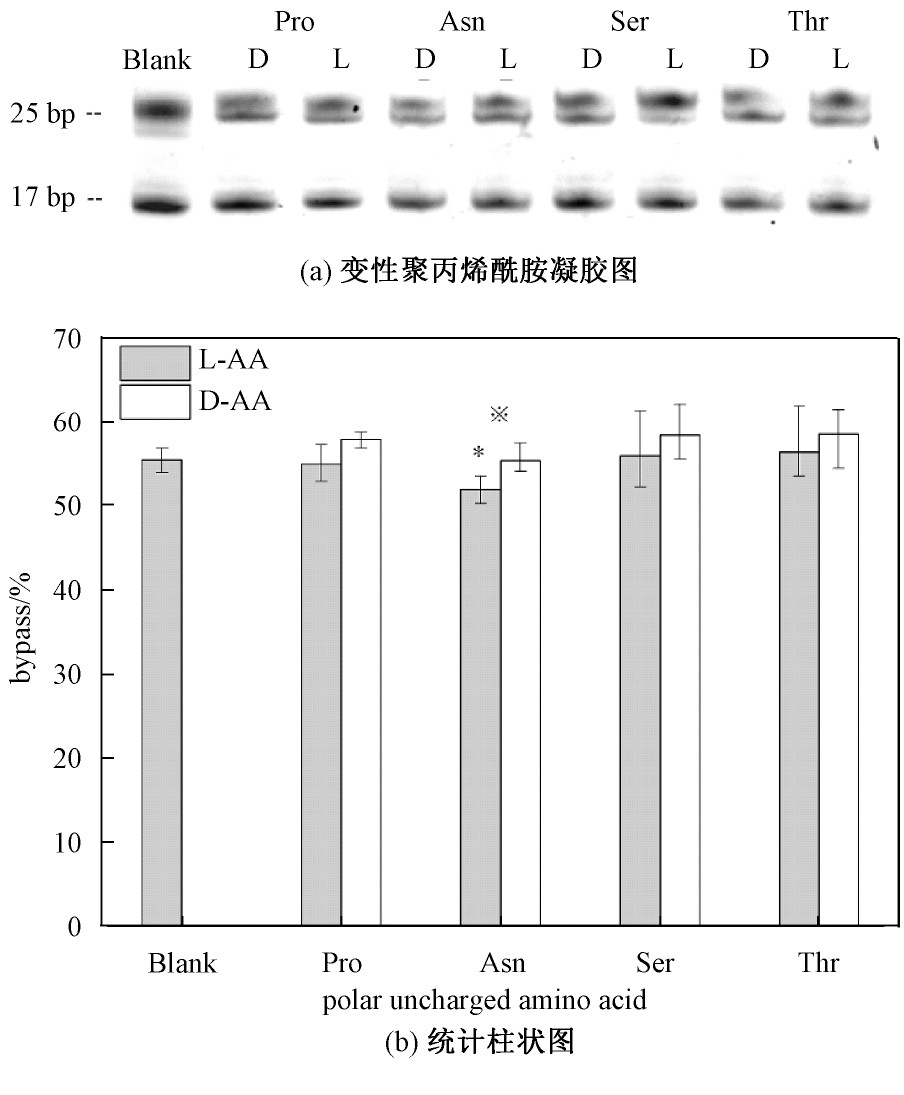
Fig.2 The effect of polar uncharged chiral amino acids on the products of DNA chain polymerization
从图2中可以看出L-天冬酰胺对DNA链式聚合反应有一定抑制作用,其余L构型氨基酸基本无影响。其对应极性不带电荷D构型氨基酸与L构型相比,均在不同程度上对DNA链式聚合反应起到促进作用。
极性带负电荷的氨基酸有天冬氨酸(Asp)、谷氨酸(Glu);极性带正电荷氨基酸有赖氨酸(Lys)、精氨酸(Arg)、组氨酸(His)。其中在极性带电荷手性氨基酸浓度为10 mmol/L时对DNA链式聚合反应30 min的影响如图3所示。
从图3中可以看出,酸性氨基酸较碱性氨基酸抑制作用更明显,并且谷氨酸的作用强于其他极性带电荷氨基酸。极性带正电荷氨基酸对DNA链式聚合反应影响不明显。
在极性带电荷的氨基酸中,通过DL构型对比可以发现,除谷氨酸外,其余极性带电荷氨基酸的D构型对DNA链式反应的负影响均大于L构型。并且带有负电荷的天冬氨酸与谷氨酸的抑制作用大于带有正电荷的赖氨酸、组氨酸、精氨酸。极性带电荷与极性不带电荷氨基酸相比,DL构型的影响呈现出相反的趋势。由于部分引物延伸过程未反应完全,其质量介于未反应的17 bp及聚合反应完全完成的25 bp双链DNA之间。故17~25 bp之间存在其他条带。
图3 极性带电荷手性氨基酸对DNA链式聚合反应产物影响
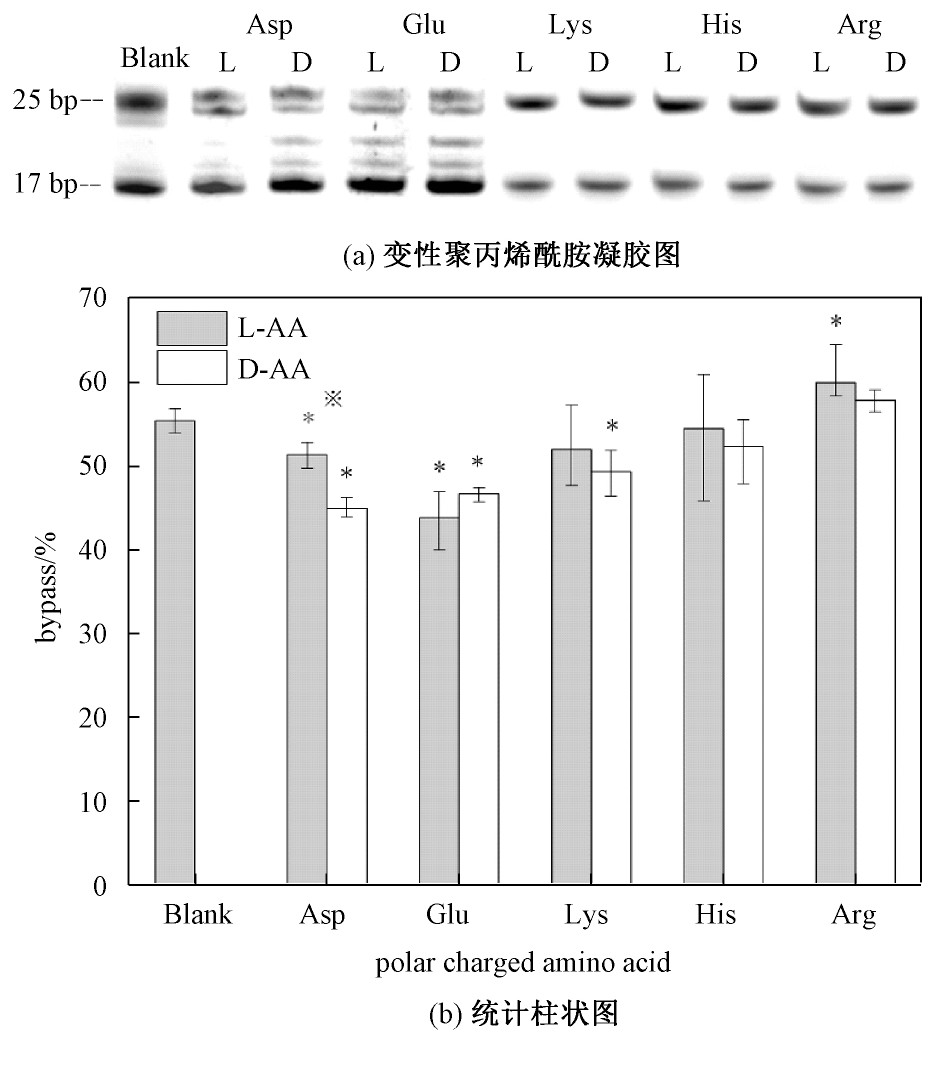
Fig.3 The effect of polar charged chiral amino acids on the products of DNA chain polymerization
2.3 、手性精氨酸及苯丙氨酸对DNA链式聚合反应的影响时间动力学分析
精氨酸作为碱性氨基酸,是人体生长发育必不可少的氨基酸。能促使氨转变成为尿素,从而降低血氨含量。从上述实验得知精氨酸会促进DNA链式聚合反应的进行。通过分析在0、5、10、15、20、25、30 min时间梯度的反应情况,得到图4。
从图4中可以看出,DNA结合速率是随着时间的增加而逐渐降低的,并且手性影响差别规律明显,呈现线性相关趋势。在相同实验条件下,D构型的精氨酸对DNA链式聚合反应的促进作用小于其L构型,符合之前实验结果。精氨酸等带正电荷的碱性氨基酸会促进DNA链式聚合反应的进行,而谷氨酸等带负电荷的酸性氨基酸会轻微抑制。说明由于电荷作用,氨基酸对酶和核酸的结合产生一定的影响。
苯丙氨酸是人体必需氨基酸之一,属芳香族氨基酸。在体内大部分经苯丙氨酸羟化酶催化作用氧化成酪氨酸,并与酪氨酸一起合成重要的神经递质和激素,参与机体糖代谢和脂肪代谢[34]。从上述实验得知苯丙氨酸会抑制DNA链式聚合反应的进行。手性苯丙氨酸在0、5、10、15、20、25、30 min时间梯度反应情况见图5。
图4 手性精氨酸对DNA链式聚合反应影响的时间梯度反应情况
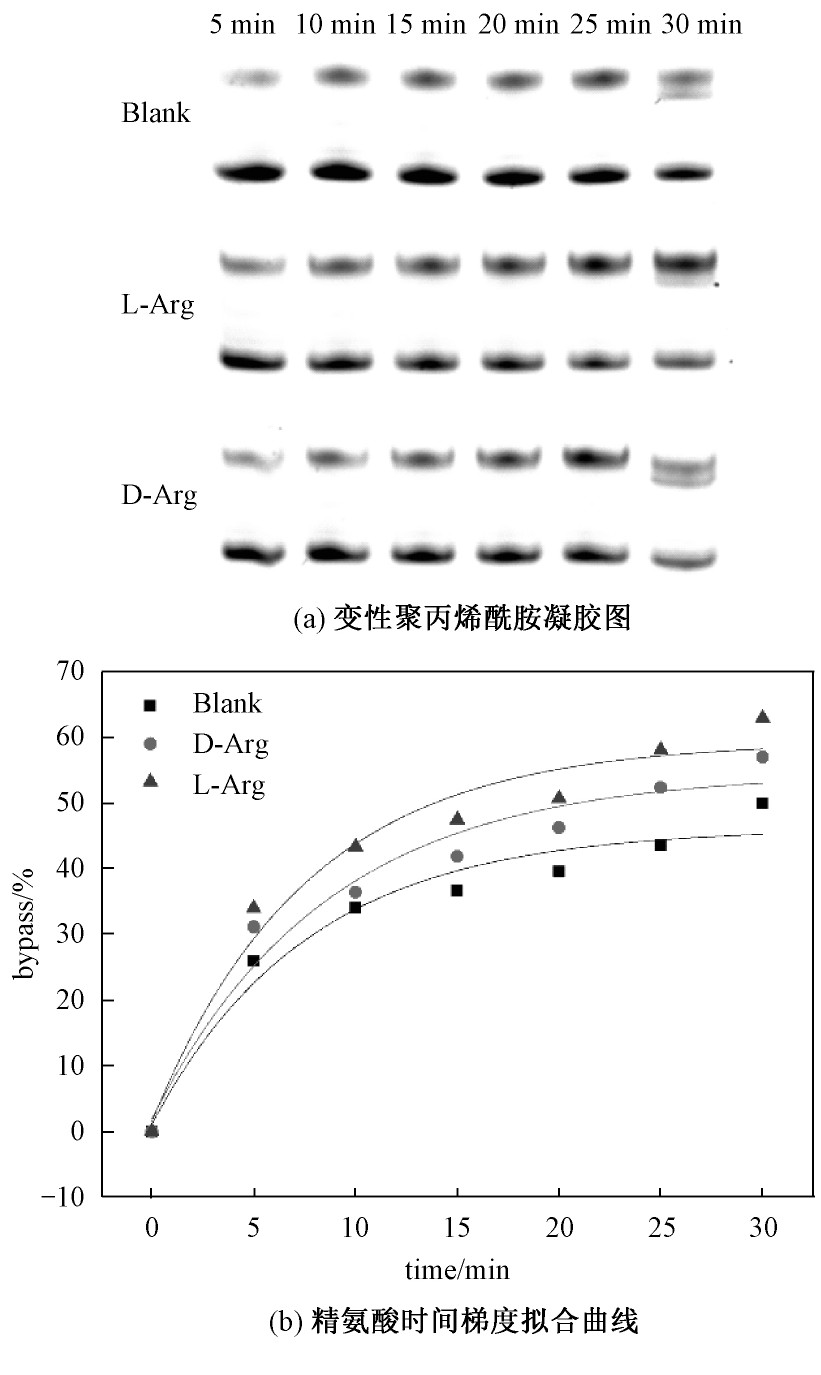
Fig.4 Time gradient reaction of the effect of chiral arginine on DNA chain polymerization
由图5苯丙氨酸动力学拟合曲线可知,作为抑制DNA链式聚合反应的苯丙氨酸其动力学趋势也与之前实验相符。苯丙氨酸抑制DNA链式聚合反应速率并且L-苯丙氨酸抑制作用较强于D-苯丙氨酸。
2.4 、手性精氨酸及苯丙氨酸与金属离子对DNA链式聚合反应的影响
非极性的苯丙氨酸和极性的精氨酸分别对DNA链式聚合反应起到明显的抑制和促进作用,为了进一步探究其在金属离子存在条件下的影响,故加入手性精氨酸及其与Na Cl、Al Cl3、KCl、Ca Cl2、Fe Cl2、Fe Cl3、Ni Cl2、Cu Cl2、Zr Cl4金属盐共混溶液进行PCR实验,实验结果如图6所示。
图5 手性苯丙氨酸对DNA链式聚合反应影响的时间梯度反应情况
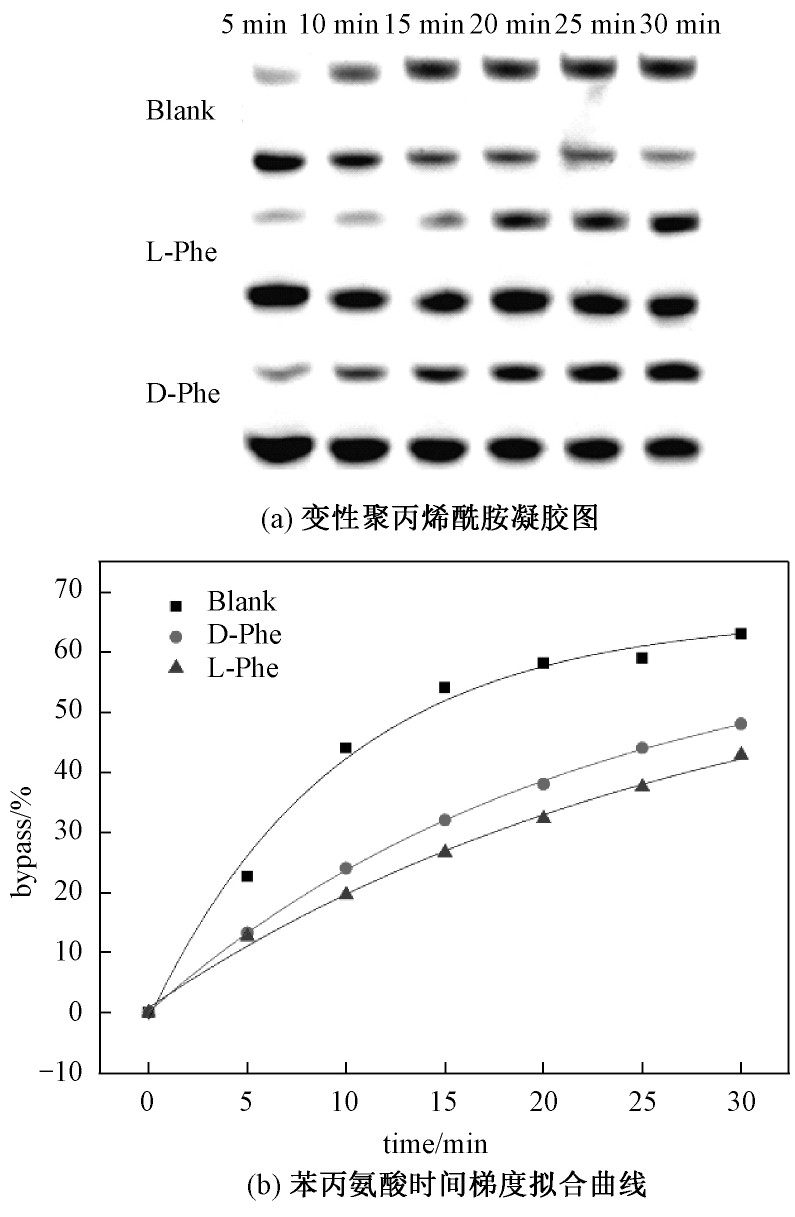
Fig.5 Time gradient reaction of the effect of chiral phenylalanine on DNA chain polymerization
图6 手性精氨酸与金属离子对DNA链式聚合反应的影响
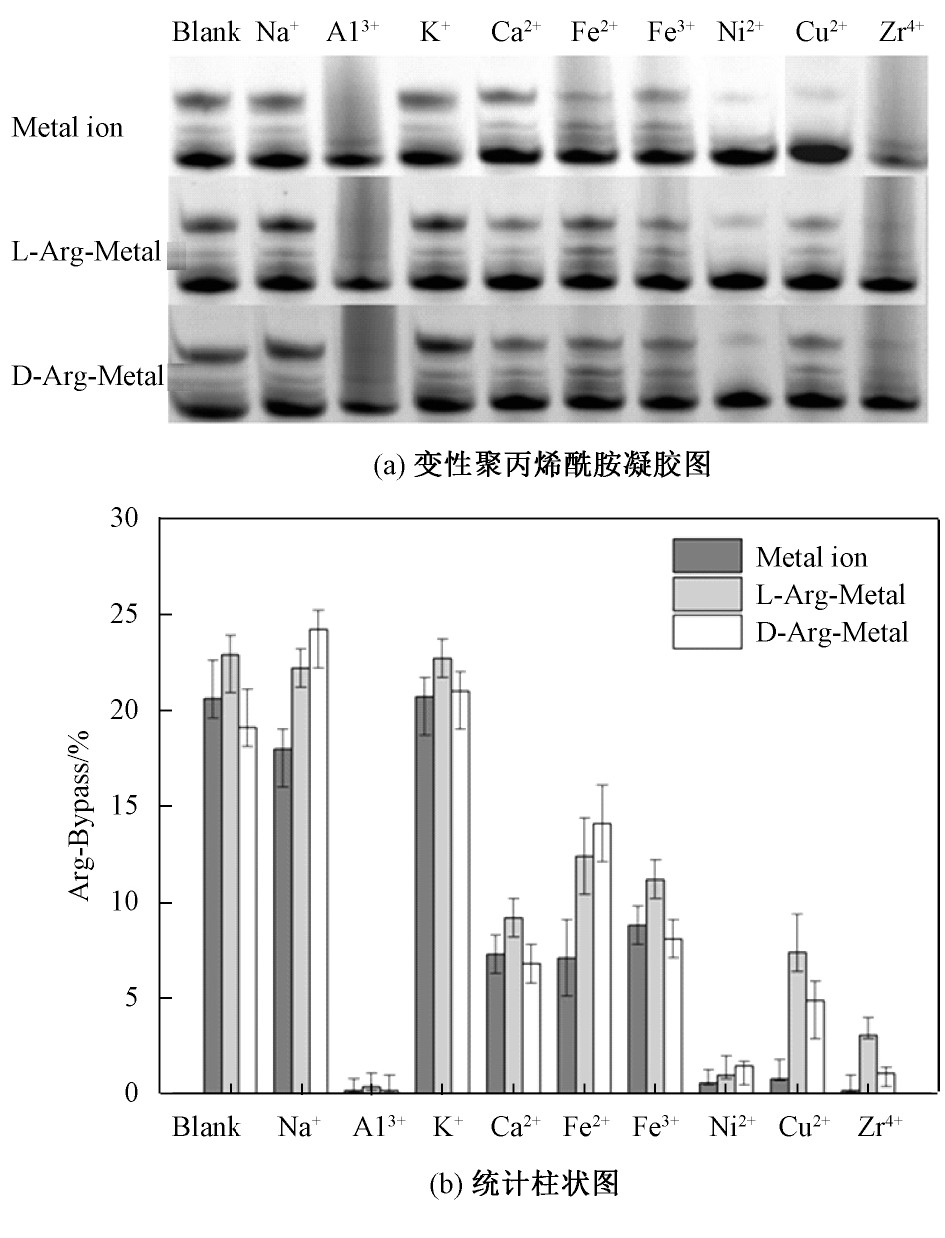
Fig.6 The effect of chiral arginine and metal ions on DNA strand polymerization
从图6可以看出,手性精氨酸对DNA链式聚合反应起促进作用,并且在浓度为5 mmol/L金属离子存在的情况下,这一特性及手性规律基本不变。精氨酸对Na+、Fe2+及Cu2+的促进作用影响较大,对Al3+、Ni2+、Zr4+无明显作用。精氨酸的加入改善了金属离子对DNA链式聚合反应的影响,并且在精氨酸与某些金属盐溶液共混过程中,发现其容易产生络合物并析出。所以推测由于精氨酸与金属离子发生相互作用,从而减弱了金属离子对DNA或聚合酶的影响。
作为抑制DNA链式聚合反应的苯丙氨酸,其含有芳香族R基团。在相同的实验条件下,同样加入其手性氨基酸与Na Cl、Al Cl3、KCl、Ca Cl2、Fe Cl2、Fe Cl3、Ni Cl2、Cu Cl2、Zr Cl4金属盐共混溶液进行PCR实验,通过变性聚丙烯酰胺凝胶进行条带分离并进行数据分析,其实验结果如图7所示。
图7 手性苯丙氨酸与金属离子对DNA链式聚合反应影响
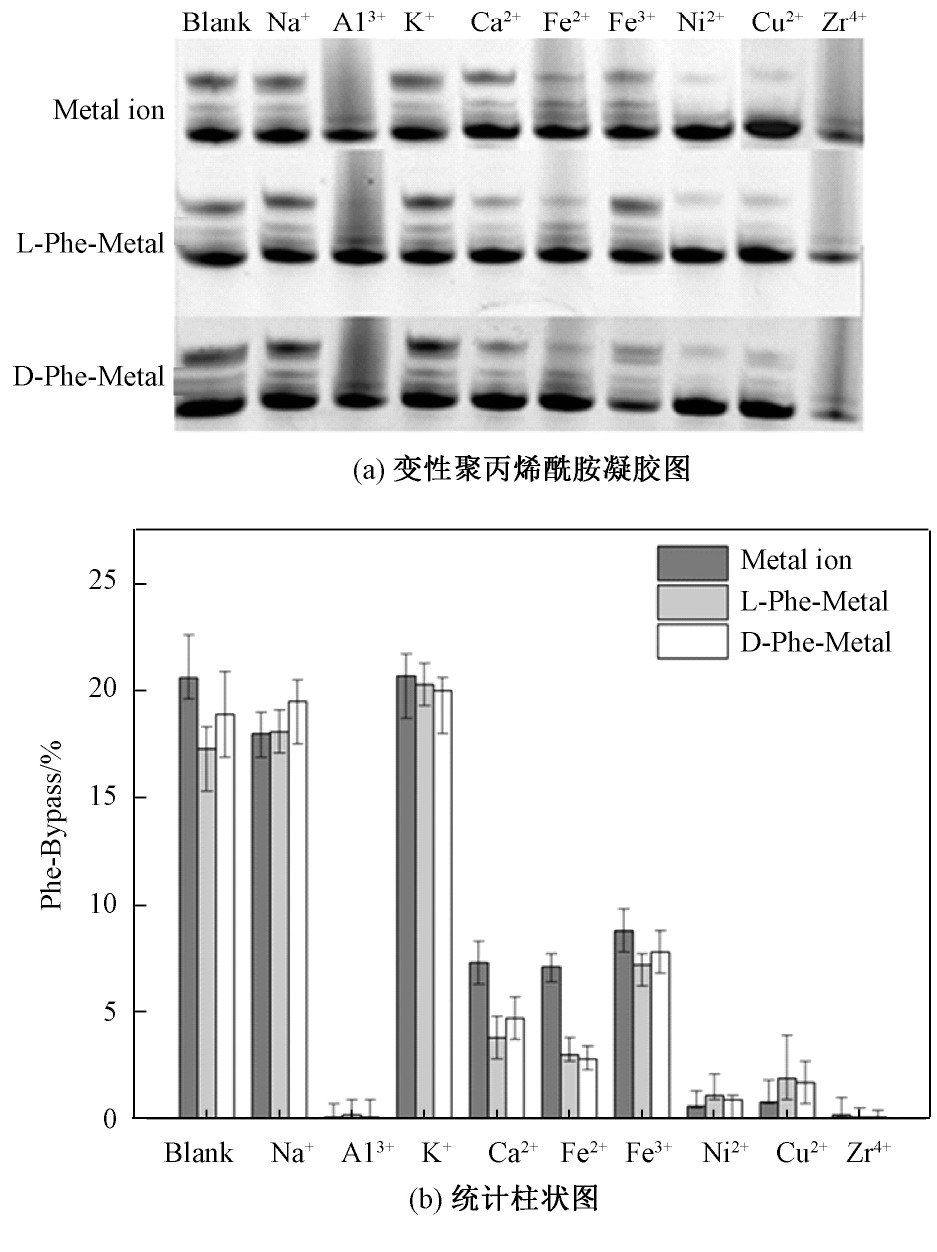
Fig.7 The effect of chiral phenylalanine and metal ions on DNA strand polymerization
从图7可以看出,手性苯丙氨酸对DNA链式聚合反应起抑制作用,但在金属离子存在的情况下,其抑制程度发生变化。苯丙氨酸与Na+、Cu2+共同作用时会较单独加入金属离子时起到轻微促进的作用。苯丙氨酸与Ca2+、Fe2+协同对DNA链式聚合反应抑制较大。手性苯丙氨酸对Al3+、Zr4+几乎完全抑制DNA链式聚合反应的影响无明显改变。
3、 结论
手性氨基酸中D构型与L构型对于DNA链式聚合反应的影响并不完全一致,但不同种类氨基酸对其影响呈现一定的规律。非极性氨基酸中除苯丙氨酸抑制DNA链式聚合反应外其余氨基酸对其影响不大。极性不带电荷氨基酸整体对链式聚合反应无明显影响,但其存在D构型氨基酸的反应速率均大于L构型氨基酸。极性带负电荷(酸性)氨基酸对DNA链式聚合反应起到轻微抑制作用,极性带正电荷(碱性)氨基酸对于链式聚合反应一定程度上起到促进作用。Na+、K+、Ca2+等9种金属离子及与手性氨基酸共同作用中,铝盐及锆盐溶液对PCR实验几乎完全抑制;镍、铜、钙对其影响次之。手性氨基酸与金属离子协同作用会在一定程度上促进或抑制其单独作用于DNA链式聚合反应,并且保持一定的手性影响规律。
参考文献
[1]Pirkle W H,Pochapsky T C Considerations of chiral recognition relevant to the liquid chromatographic separation of enantiomers([J] .Cheminform, 1989,20(31):347-362。
[2]Shirotani D,Yamanari K Kuroda R,et al. Chiroptical spectra of tetrakis (+)-3-Heptafluorobutylrylcamphorate Ln(I) complexes with an encapsulated alkali metal ion:solution structures as revealed by chiroptical spectra[J] Chirality,2012,.24(12): 1055-1062.
[3]Patel S S,Wong I,Johnson K A,et al.Pre-steady-state kinetic analysis of processive DNA replication including complete characterization of an exonuclease-deficient mutant[J].Biochemistry,1991,30(2)-511-525.
[4]Prior A.SInchez-Hern二ndez L,Sastre-Toran桢o J,et al. Enantioselective analysis of proteinogenic amino acids in cerebrospinal fluid by capillary electrophoresis-mass spectrometry[J]. Electrophoresis,2016,37(17/18).2410-2419.
[5]Friedman M. Chemistry,nutrition, and microbiology of D-amino acids[J]J Agric Food Chem,1999,47 (9):3457-3479 .
[6]Radkov A D,Moe L A. Bacterial synthesis of D-amino acids[J] .Applied Microbiol Biotechnol,2014.98(12)-5363-5374.
[7]Saiki R K,Gelfand D H,Stoffel S,et al. Primer- directed enzymatic amplification of DNA with a thermostable DNA-polymerase[J] Science, 1988,239(4839):487-491.
[8]Modeste E,Mawby L,Miller B,et al A molecular dynamics investigation of the thermostability of cold-sensitive 1707LKlenTaq1 DNA polymerase and its wild-type counterpart[J]Journal of Chemical Information and Modeling,2019,59(5):2423-2431
[9]Ai Y B,YuL L,Tan X,et al.Discovery of covalent ligands via noncovalent docking by dissecting covalent docking based on a"steric-clashes alleviating receptor (SCAR)"strategy[J].Journal of Chemical Information and Modeling 2016 ,56(8):1563-1575.
[10]Fuji N,Takata T,Fuiji N,et al.D-Amino acids in protein:the mirror of life as a molecular index of aging[J] BBA-Proteins Proteomics ,2018, 1866(7):840-847.
[11]Armstrong D W,Gasper M,Lee S H,et al.D-amino-acid levels in human physiological fluids[J] Chirality, 1993, 5(5):375-378.
[12]Fuji N,Kawaguchi T,Sasaki H,et al. Simultaneous stereoinversion and isomerization at the asp-4 residue inβB2-Crystallin from the aged human eye lenses[J]. Biochemistry,2011,50(40):8628-8635.
[13]Fuji N,Sakaue H,Sasaki H,et al.A rapid comprehensive liquid chromatography-mass spectrometry (LC-MS)-based survey of the asp isomers in crystallins from human cataract lenses[J]. Journal of Biological Chemistry,2012,287(47):39992-40002.
[14]Norman P. PDE4 inhibitors 2001.Patent and literature activity 2000-September 2001[J] Expert Opinion on Therapeutic Patents ,2002,12(1):93-111.
[15]Friedrich M G.Hancock S E,Raftery M J,et al.lsoaspartic acid is present at specific sites in myelin basic protein from multiple sclerosis patients:could this represent a trigger for disease onset?[J] .Acta Neuropathologica Communications,2016, 4(1):83-95
[16]Mori Y,Aki K Kuge K,et al.UVB-irradiation enhances the racemization and isomerizaiton of aspartyl residues and production of N-carboxymethyl lysine (CML) in keratin of skin[J].Journal of Chromatography B-Analytical Technologies in the Biomedical and Life Sciences ,2011,879(29)-3303-3309.
[17]Hooi M Y S,Truscott R J W.Racemis ation and human cataract. d-Ser,d-Asp/Asn and d-Thr are higher in the lifelong proteins of cataract lenses than in age-matched normal lenses[J]. Age,2011,33(2):131-141.
[18]Hooi M Y S,Raftery M J,Truscott R J W. Age-dependent racemization of serine residues in a human chaperone protein[J] Protein Science 2013,22(1):93- 100.
[19]余鹏飞,陈丽华,许欢,等. D-氨基酸在生物膜分散中的作用研究进展[J] .中国病原生物学杂志,2015, 10(4).377-380.
[20]刘庆菊,何裕建,吴丽, 等. D-氨基酸诱导的酿酒酵母细胞内活性氧的累积[J] .中国科学院大学学报, 2018,35(4).473-480.
[21]乔建军,薛二淑,昊,等.添加D-氨基酸混合物培养基及其制备方法与应用:中国, 201910068905.5[P/OL].(2019-05-17)[2019-08 20] httpll :www doc88 com/p-999975723390.html.
[22]东条洋介,冈村智惠子,高濑华代,等. D-氨基酸的新见解具有维持皮肤稳态及屏障恢复等功能的新型氨基酸群[C]1中国香料香精化妆品工业协会.第十届中国化妆品学术研讨会论文集.杭州,2014:6-12.
[23]Hashimoto A,Nishikawa T,Hayashi T,et al.The presence of free d-serine in rat brain[J].Febs Letters, 1992,296(1):33-36.
[24]Hashimoto A.Nishikawa T,Oka T,et al. Endogenous dserine in rat-brain.n-methyl-d-aspartate receptor-related distribution and aging[J]Journal of Neurochemistry, 1993.60(2)-783-786.
[25]Snyder S H,Kim P M.D-amino acids as putative neurotransmitters.focus on D-serine[J].Neurochemical Research,2000 ,25(5):553-560.
[26]Nishio A,Uyeki E M.Inhibition of DNA synthesis by chromium compounds[J]. Journal of Toxicology and Environmental Health,Part A, 1985,15(2):237-244.
[27]Zwierzchowski L, Rynca J,Grochowska l.Role of calcium in the insulin-dependent stimulation of DNA synthesis in mouse mammary gland in vitro.[J] Experimental Cell Research,1984, 152(1):105-116.
[28]Varzatski O A,Vologzhanina A V,Novikov V V, et al. Inhibition of DNA synthesis in the transcription system of Taq DNA polymerase by various iron and cobalt() tris-dioximate clathrochelates.in vitro study and X-ray structure of leader inhibitors,the carboxy-terminated macrobicyclic complexes[J]Inorg Chim Acta,2018,482:90-98 .
[29]Garro H A,Garcia C,Martin V S,et al.A new iridoid,verbascoside and derivatives with inhibitory activity against Taq DNA polymerase[J] .Bioorg Med Chem Lett,2015,25(4):914-918
[30]Hamdi H K,Castellon R. Oleuropein,a non-toxic olive iridid,is an anti-tumor agent and cytoskeleton disruptor[J] Biochemical and Biophysical Research Communications,2005,334(3):769-778.
[31]Konoshima T,Takasaki M,Tokuda H,et al. Cancer chemopreventive activity of an iridoid glycoside,8-acetylharpagide from Ajuga decumbens[J] Cancer Letters 2000,157(1):87-9
[32]Mizushina Y,lida A,Ohta K, et al.Novel triterpenoids inhibit both DNA polymerase and DNA topoisomerase[J] Biochemical Journal, 2000 ,350(Pt3):757-763.
[33]0rtiz de Deurbina A V,Martin M L, FernCndez B,et alin vitro antispasmodic activity of peracetylated penstemonoside ,aucubin and catalpol[J]. Planta Medica,1994,60 (6)-512-5