摘 要: 在生物化学分析中系统研究样本与不同浓度组分间的相互作用是至关重要的。微流控芯片技术能够在微米级的通道内完成精确的液体控制,近年来被普遍应用于生物化学分析领域。微流控浓度梯度芯片是一种能够快速构建稳定生物化学浓度梯度的工具,能够与大多数细胞培养、化学分析等技术相结合,为传统的生化分析提供新平台。本文综述微流控浓度梯度芯片的形成机制及其在生物化学等领域的应用,为拓宽浓度梯度相关应用研究提供新思路。
关键词 : 微流控浓度梯度芯片;药物筛选;毒性分析;材料合成;综述;
Abstract: It is important to systematically study the interactions between samples and different concentrations of components in biochemical analysis. Microfluidic chip technology has been widely used in biochemical analysis in recent years, because it can realize accurate liquid control in micron-sized channel. Microfluidic concentration gradient chip is a tool that can rapidly construct stable biochemical concentration gradient and can be combined with most cell culture, chemical analysis and other techniques, offering a new platform for traditional biochemical analysis. Herein the formation mechanism of microfluidic concentration gradient chip and its application in biochemistry and other fields are reviewed, thereby providing a new idea for broadening the application research related to concentration gradient.
Keyword: microfluidic concentration gradient chip; drug screening; toxicity analysis; chemotaxis; materials synthesis; review;
前言
细胞的应激响应与多种生物过程紧密相关,微流控浓度梯度芯片能够构造与生理环境接近的、具有浓度梯度刺激源的体外微环境,进而揭示生物体对不同生物化学刺激的响应,探究调控细胞生物学行为的决定因素[1,2]。微流控浓度梯度芯片由于设计灵活易于调节的特点,能够快速制备稳定的浓度梯度,实现高通量反应。得益于浓度梯度芯片微米级的通道尺寸,能够将其集成到含有样品前处理与检测单元的微流控系统中。生物分子在体内的浓度梯度已经被证实在癌症转移、伤口愈合以及生长发育过程中发挥重要作用[3,4]。基于微流控浓度梯度及芯片细胞培养等技术,有助于实现细胞水平的药物筛选和趋化性以及毒性分析等研究。本文综述近3年浓度梯度芯片的开发及其在生物化学领域的应用研究。

1、 微流控芯片中浓度梯度的形成
1.1 、微流控浓度梯度芯片的出现
宿主防御、创伤愈合、胚胎发生和癌症转移等生物学过程涉及许多可扩散化学物质的浓度梯度[5]。浓度梯度和浓度排列在细胞生物学、趋化因子、生物化学、表面微加工等研究中的作用也日趋重要。传统上,移液管、凝胶等主要用于稀释样品和研究细胞在浓度梯度作用下的行为。然而,这些技术在生成复杂形状的空间稳定梯度时并不有效[6]。因此,迫切需要一种技术来产生并维持可预测的长期复杂样品浓度梯度,用于检测样品浓度梯度与细胞应答之间的相关性,实现高通量分析(如免疫分析和酶分析)和组合化学的高效多维筛选[7]。早在2000年,Jeon等[8]提出微流控浓度梯度的概念,基于低雷诺数条件下层流扩散混合的原理设计了经典的“圣诞树模型”且沿用至今,通过控制输入流体的相对流速,梯度的形状可以连续改变。这一技术为研究依赖浓度梯度的生物化学现象提供了一个新平台[9]。近年来,包括层流扩散的微流控网络在内的多种类型浓度梯度生成芯片被广泛用于高通量药物筛选[10],化学物质毒性分析以及趋化性研究且收获颇丰。微流控浓度梯度芯片的主要优势在于能够通过灵活的通道网络设计形成不同形状的浓度梯度,适应需求,且能够维持浓度梯度的稳定。微流控浓度梯度芯片的发展历程见图1。
图1 微流控浓度梯度芯片的发展历程
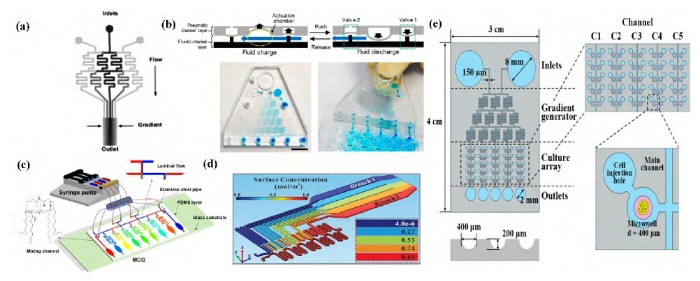
Fig.1 Development history of microfluidic concentration gradient chip
a:Jeon等[8]提出的“圣诞树模型”浓度梯度芯片;b:改进的手压式驱动的“圣诞树模型”浓度梯度芯片[11];c:基于体积配比混合的新型微流控浓度梯度芯片[12];d:基于微混合构造的新型微流控浓度梯度芯片设计[13];e:浓度梯度芯片在药物筛选中的应用[14]
1.2 、微流控浓度梯度芯片的开发
1.2.1 、传统“圣诞树模型”的发展与改进
多数基于浓度梯度芯片的应用仍旧沿用“圣诞树模型”,但从芯片的设计制造方面都做出了较大的努力以更适用于特定的应用需求。Chen等[15]采用有限元方法对双入口及3入口的浓度梯度发生器进行模拟,得到可控的任意近似线性曲线和任意二次方曲线的浓度分布,有助于不同生化样本中细胞和分子的趋化性研究。类似地,Wang等[16]介绍了采用激光加工微通道的方式制备的一种聚甲基丙烯酸甲酯浓度梯度发生器,可产生近似线性和二次型浓度梯度曲线输出。为了改进“圣诞树模型”注射泵进液的方式,Park等[11]提出了一种通过按钮驱动的微泵单元产生恒定体积的流体驱动样本,能够在两种不同的样品溶液之间产生6种浓度的线性梯度,该装置不需要外部泵,更利于其与微型装置(如96孔板)相集成,且流量可以通过手指按压进行调整。该装置通过生成硝基苯磷酸底物的线性浓度梯度实现碱性磷酸酶的检测。Ebadi等[17]介绍了一种名为树状浓度梯度发生器设计工具的软件设计方法,这对于微加工、光刻和3D打印制造的浓度梯度芯片有很大帮助。通过改变软件参数即可改变浓度梯度芯片输出的浓度分布类型,且采用罗丹明-B和食用染料的梯度形成实验验证了软件设计的可靠性。这对于大规模的芯片设计与制造是有益的,能够提升高通量目标物筛选的效率。
大多数现有的浓度梯度芯片只能在微米大小的尺寸中产生所需的浓度梯度。Rismanian等[18]将改进的圣诞树模型与一个微混合器相结合,设计了一种能够在毫米大小尺寸中产生多种试剂(如药物)的连续浓度梯度的芯片,实验证明该装置可以产生两种试剂的连续浓度梯度,并将它们的所有可能的浓度组合传递到毫米大小的样品。Shimizu等[19]提出了一种基于细胞外基质的梯度发生器,构造了具有由组织流动产生的连续化学浓度梯度的培养表面,利用3D打印水溶性牺牲模具的牺牲成型技术,快速制备了含有梯度发生器和微混合器的明胶基微通道。当荧光染料溶液被引入通道时,微混合器增强了两种溶液在连接处的混合。此外,通道中产生的浓度梯度通过细胞外基质多孔性质的间隙扩散到器件的培养表面。在表面培养的人脐静脉内皮细胞对微通道间质流产生的组胺浓度梯度做出了收缩反应,这表明该装置可以用于细胞对化学刺激反应的基础生物学研究和药物体外实验平台。Hu等[20]介绍了一种低成本的类似圣诞树模型的浓度梯度芯片,采用热键合聚甲基丙烯酸甲酯(PMMA)技术分别制作了具有2个和3个进口的浓度梯度发生器,该方法可以在不同流速下产生不同的浓度梯度,微通道的结构设计为S形左右对称,2进口和3进口浓度梯度发生器的浓度梯度分布分别呈近似线性和二次曲线。上述研究进展表明,在经典圣诞树模型基础上,针对具体应用对象需要调整浓度梯度生成器的制造工艺、材质以及尺寸等参数,以便适应多场景的应用需求。
为了解决浓度梯度受流速影响的问题,Hoving等[21]设计了一个改进的圣诞树状微流控通道网络,输入流量可达200μL/min,最大速度约333 mm/s,比现有的报道入口流速高出两个数量级,极大地扩展了应用领域。类似地,Martin Cabaleiro等[22]报道了采用3D打印树脂制备了类似圣诞树浓度梯度发生器。通过限制在连续流梯度发生器下的流速,在到达下一个分叉之前在一个分支中实现完全混合,该浓度梯度生成器在低佩克莱特数下产生梯度的效果良好。此外,该浓度梯度生成器在混合前实现精确试剂量配比,因而生成的浓度梯度形状与流速无关。
除了利用传统的微流控芯片材料[聚二甲基硅氧烷(PDMS)、PMMA、玻璃等],纸基微流控芯片也越来越成为研究热点。由于梯度的动态形成是基于化学物质在流体中的横向扩散,在纸通道中分子的横向流动主要受机械扩散控制,这与分子扩散有本质区别,因此,在纸上设计梯度发生器需要不同于传统微流体中使用的策略。Schaumburg等[23]利用计算机模拟研究纸基微流控浓度梯度发生器的优化设计,讨论Whatman滤纸浓度梯度芯片的设计与制备,建立了二维平面纸和三维垂直纸两种新的金字塔网络模型。在纸和类似多孔基质中适当地利用机械扩散会给纸基浓度梯度芯片带来巨大潜力。
1.2.2、 新型微流控浓度梯度芯片开发
经典的“圣诞树模型”原理简单,因易于操作而具有广泛应用,然而其也存在通道冗长、梯度形成时间长、梯度易受流速影响等缺点,因此,为克服上述问题,越来越多的新型浓度梯度的设计被报道。Futai等[24]开发了一种包含窄微通道的浓度梯度生成芯片,该窄通道具有适当的流阻,既能满足试验物质的快速引入,又能长期保持梯度。该芯片能够保持Alexa萤石荧光染料浓度梯度至少48 h。生成和维持长期稳定的梯度是当前微制造系统的一个挑战。Parittotokkaporn等[25]开发了一个简单的流体驱动微流控系统,芯片采用聚二甲基硅氧烷材质通过标准软光刻技术制备而成,在1~10μL/h低流量控制下产生荧光染料梯度,梯度在1 h内形成,在2 h~5 d内能够保持稳定。Shi等[12]通过将4组进样口(样品和缓冲液)依次连接到主通道,确定进样口的位置和层流类型,建立浓度梯度。由于样本比例被事先分配好,因而浓度梯度的产生只需要将样本充分混合即可,而不受入口流速的影响。从主通道引出9个微混合通道,以有效地混合层流。将方波结构与微通道侧壁槽相结合,设计了一种比传统蛇形混合通道混合指数更高的微混合通道。在流速为2 280μL/min情况下,按照快速微混合原理,线性浓度梯度可在数秒内实现,且梯度形状与流速无关。
具有理想梯度的表面已被证明是一种强大的工具。Zhou等[13]展示了一种新型的微流控网络,可以在微流控通道内建立浓度梯度进行表面聚合或化学沉积,从而实现聚二甲基硅氧烷基底上稳定的特征梯度。该芯片可用于制备底物在蛋白质吸附和纳米粒子固定化等多个领域,实现生化分析与传感的实际应用。此外,Hong等[26]提出了一种用于复杂网络拓扑结构微流控浓度梯度发生器反设计的深度神经网络模型。该方法将浓度梯度和产生浓度梯度的设计参数分别作为深度神经网络的输入和输出,并映射它们之间的关系。此外,他们提出了一种基于替代优化和自适应采样的微流控浓度梯度发生器设计方法,以满足规定的浓度梯度[27]。在许多生化实验中,控制特定位置的浓度梯度是至关重要的。Liu等[28]基于聚二甲基硅氧烷的透气性,提出了一种可调浓度梯度发生器,该发生器由气泡通道中的声学振荡气泡驱动,位置可控。浓度梯度的调节可以通过改变气泡的数量和位置来实现。该器件制作简单、反应灵敏、生物相容性好,特别适用于对时间可控性要求较高的生物学研究。
2 、微流控浓度梯度芯片的应用
2.1 、高通量药物筛选
微流控浓度梯度芯片由于可以在芯片内部建立起稳定的浓度梯度,且可以与3D细胞培养技术相结合,因此越来越受到关注,被广泛地用于细胞水平的药物筛选研究。3D细胞培养在模拟体内肿瘤的结构和生理条件方面被认为更具临床意义。Lim等[14]开发了一种带有细胞培养装置的微流控浓度梯度发生器,可以使细胞形成球状体并在肿瘤药物梯度存在的情况下生长。当结肠癌细胞成一个单一的球状体,球状体在癌症药物梯度伊立替康的存在下培养3 d,球状体的数量、圆度和细胞存活率与药物浓度成反比。这些结果表明带有细胞培养装置的药物浓度梯度芯片有可能成为筛选肿瘤药物疗效的平台。2型糖尿病药物筛选的体外模型对制药业至关重要。Luo等[29]研制了一种基于微流控技术的环形药物浓度梯度芯片,并集成了胰岛素瘤细胞系的3D培养。在高浓度葡萄糖作用下细胞的增殖,先是促进后抑制,胰岛素分泌功能也在高浓度葡萄糖作用下先增强后抑制。这个模型可以帮助找到刺激胰岛素分泌的药物。Shen等[30]开发了一种简单紧凑的微流控芯片,可以在大流量范围内快速构建多种溶质的3个浓度梯度,生成的3个稳定、准确、可控的药物梯度可以评价对两种肿瘤细胞系(MCF-7和Hep G2)的治疗效果。
抗生素的最低抑菌浓度是确定抗生素的药剂和抑制细菌生长的最小剂量的有效值。Tang等[31]提出了一种基于离心微流控的高度自动化线性浓度梯度发生器,该装置进行了抗菌药物药敏试验。采用线性浓度梯度生成一系列浓度的氨苄青霉素,自动与大肠杆菌混合,通过测定悬浮液的光谱吸光度,确定氨苄青霉素对大肠杆菌的最低抑菌浓度值。类似地,Shi等[12]成功地利用研制的微流控浓度梯度芯片实现了抗菌药物头孢唑肟对大肠杆菌的最低抑菌浓度的筛选。Zhang等[32]利用浓度梯度芯片用于细菌快速生长和抑菌试验,可以在芯片上定量测定阿莫西林抑制细菌的生长情况,以较低的细菌初始浓度在6 h内获得最低抑菌浓度值。此外,梯度条件下微流控芯片细胞存活率与传统培养实验存活率呈线性关系。基于微流控浓度梯度芯片的药物筛选有利于个性化医疗新方法的开发。
2.2 、化学毒性分析
微流控浓度梯度芯片能够用于生成化学刺激因子的浓度梯度,利用受试物的响应评价化学刺激因子的毒性[33]。Bagheri等[34]采用微流控浓度梯度生成器进行碳量子点对单细胞真核模型生物酵母菌毕赤酵母的毒性分析,酵母细胞增殖的生长抑制和各种芽殖细胞形态的变化与碳量子点的浓度相关。研究表明微流控梯度生成器有潜力作为一种细胞水平上评估纳米材料毒性的工具。类似地,Park等[35]利用梯度发生器与3D体外细胞培养模拟体内微环境,用于检测感染尤文氏肉瘤细胞的细胞毒性。Zhang等[36]描述了一种化学梯度生成器辅助微流体细胞系统,用于在通量方式下动态研究典型环境污染物诱导的支气管上皮细胞损伤,结果证明微流控系统在精确和长期化学梯度生产中具有较高的稳定性和可靠性,对支气管的静脉曲张炎症和细胞毒性反应进行了实时监测和测量,苯并芘定向引导支气管上皮细胞出现明显的细胞萎缩,提示其对呼吸系统有明显的炎症和细胞毒性作用。基于微流控浓度梯度生成芯片的化学梯度通过与模式生物相互作用,结合多种形式的芯片检测技术(如表面增强拉曼光谱[37]),能够在环境监测和药物开发等领域有潜在的应用前景。
2.3、 趋化性研究
趋化性是细胞在化学梯度作用下,向上或向下移动以响应引诱剂或驱避剂的过程,是细胞对环境变化反应的一个主要因素。采用浓度梯度芯片有利于实现模式生物趋化行为的定量分析。Wang等[38]首次将浓度梯度芯片与微藻处理检测系统相结合,用于快速评估压载水化学处理的有效性,筛选处理的最佳时间以及试剂浓度。浓度梯度芯片可以快速生成所需的任何浓度,对微藻细胞进行驱离,同时用叶绿素的平均荧光强度检测微藻的去除效果。类似地,Wang等[39]提出了一种包含微藻细胞分离、处理和生存能力表征的微流控系统,能够快速有效地识别和分离微藻细胞,利用浓度梯度发生器,自动生成具有梯度浓度的化学试剂,筛选最佳的微藻驱离浓度。基于浓度梯度发生器和细胞检测技术,能够针对包括海洋模式生物在内的细胞进行趋化性研究,有利于在生态环境保护等分析领域的新应用。
2.4 、材料合成
微流控浓度梯度芯片还能够利用自身的优势同时形成多种材料制备的条件,在生物材料及纳米材料制备等方面有所帮助。Li等[40]设计了一种简单的三重梯度微流控芯片,用于高效筛选化学空间。该装置的筛选效率有数量级的提高,该装置筛选了溶菌酶和胰蛋白酶两种模型蛋白的结晶条件,并用X射线衍射证实了晶体结构。Liu等[41]设计一种简单可控的方法,通过结合液滴产生和梯度发生器,同时制备4种不同类型的微粒子,通过操纵聚(乳酸-二羟乙酸)浓度梯度、聚(癸内酯)/聚(乳酸-二羟乙酸)比例梯度和碳酸二甲酯/二氯甲烷比例梯度,可以产生不同大小、异质性和各向异性的微粒子。因此,基于微流控浓度梯度芯片的材料合成条件的筛选也逐渐成为其新的应用领域,能够广泛地用于材料合成和化学筛选、给药制剂、生物检测鉴别、微传感器和组织工程等领域[42]。
3 、展望
浓度梯度芯片是微流控芯片技术的一个重要分支。研究者通过优化经典的“圣诞树”模型以及开发全新的浓度梯度芯片,能够实现不受入口流速影响的浓度梯度,通过修改设计参数实现特定的梯度形状并维持数天的稳定,通过改进加工工艺以及材料,能够适用于多场景下的应用需求。得益于微流控浓度梯度芯片设计灵活、梯度稳定以及与多种检测技术相结合的优势,在肿瘤药物筛选、抗生素最低抑菌浓度筛选、药物开发、毒性分析,趋化性研究以及材料合成等领域得到充分应用。针对特定应用需求(如生物检测[8],基于可穿戴式设备的个性化医疗[43,44]等),开发新型的浓度梯度芯片将是后续发展的热点。
参考文献
[1]PEIH, LI L, HAN Z, et al. Recent advances in microfluidic technologies for circulating tumor cells :enrichment, single cell analysis, and liquid biopsy for Clinical applications[J]. Lab Chip,2020, 20(21):3854-3875.
[2] YAN S, YUAN D. Continuous microfluidic 3D focusing enabling microflow cytometry for single cell analysis[J]. Talanta, 2021, 221:121401.
[3] COURTNEY M, REN C L. Counterlow gradient electrophoresis for focusing and elution[J]. Electrophoresis, 2019, 40(5):643-658.
[4] GURUNGJ P, GEL M, BAKER M A. Microfluidic techniques for separation of bacterial cells via taxis[J]. Microbial Cell, 2020, 73):66-79.
[5] KHOO B L, GRENCI G, LIM Y B, et al. Expansion of patient-derived circulating tumor cells from liquid biopsies using a CTC microfluidic culture device[J]. Nat Protoc, 2018, 13(1):34-58.
[6] ZHAO W, ZHAO H, LI M, et al. Microfluidic devices for neutrophil chemotaxis studies[J]. J TransI Med, 2020, 18(1):168.
[7]GUO Y, GAO Z, LIU Y, et al. Multichannel synchronous hydrodynamic gating coupling with concentration gradient generator for high-throughput probingdynamic signaling of single cells[J]. Anal Chem, 2020, 92(17):12062-12070.
[8] JEON N L, DERTINGERS K, CHIUD T, et al. Generation of solution and surface gradients using microfluidic systems[J]. Langmuir, 2000, 16(22)-8311-8316.
[9] ZHAOX, YANX, LI Y, et al. Static pressure -driven microfluidic gradient generator for long-term cell culture and adaptive cytoprotection analysis[J]. Microfluid Nanofluid, 2019, 23(5):62.
[10] YINL, DU G, ZHANG B, et al. Efficient drug screening and nephrotoxicity assessment on co-culture microfluidic kidney chip[J] Sci Rep, 2020, 10(1):6568.
[11] PARK J, ROH H, PARK J K. Finger-actuated microfluidic concentration gradient generator compatible with a microplate[J]. Micromachines, 2019, 10(3):174.
[12] SHI H, HOU Z, ZHAO Y, et al. Rapid and steady concentration gradient generation platform for an antimicrobial susceptibility test[J] Chem Eng J, 2019,359:1327-1338.
[13] ZHOUB, GAO Y, TIAN J, et al. Preparation of orthogonal physicochemical gradients on PDMS surface using microfluidic concentration gradient generator[J]. Appl Surf Sci, 2019, 471:213-221.
[14] LIM W, PARK S. A microfluidic spheroid culture device with a concentration gradient generator for high-throughput screening of drug efficacy[J]. Molecules, 2018, 23(12):3355.
[15] CHENX, HU Z, ZHANG L, et al. Numerical and experimental study on a microfluidic concentration gradient generator for arbitrary approximate linear and quadratic concentration curve output[J]. Int J Chem React Eng, 2018, 16(1):20160204.
[16] WANG S, CHEN X. Simulation and experimental investigation on tree concentration gradient generator with U-shape microchannel[J].Microsyst Techno1, 2019, 25(3)1111-1119.
[17] EBADI M, MOSHKSAYAN K, KASHANINEJAD N, et al. A tool for designing tree-like concentration gradient generators for lab-on-a-chip applications[J].Chem Eng Sci, 2020, 212:115339.
[18] RISMANIAN M, SAIDI M S, KASHANINEJAD N. A microfluidic concentration gradient generator for simultaneous delivery of two reagents on a millimeter-sized sample[J]. J Flow Chem, 2020, 10:615-625.
[19] SHIMIZUA, GOH W H, ITAI S, et al. ECM-based microfluidic gradient generator for tunable surface environment by interstitial flow[J]. Biomicrofluidics,2020, 14(4):044106.
[20] HU Z. CHEN X, WANG L. Design and fabrication of concentrationgradient generators with two and three inlets in microfluidic chips[J].Chem Eng Technol, 2018, 41(3):489-495.
[21] HOEVING S, JANASEK D, NOVO P. Flow rate independent gradient generator and application in microfluidic free flow electrophoresis[J].Anal Chim Acta, 2018, 1044:77-85.
[22] MARTIN CABALEIRO J. Flowrate independent 3D printed microfluidic concentration gradient generator[J]. Chem Eng J, 2020,382:122742
[23] SCHAUMBURG F, URTEAGAR, KLERPA, et al. Design keys for paper-based concentration gradient generators[J]. J Chromatogr A,2018, 1561:83-9
[24] FUTAI N, TAMURA M, OGAWA T, et al. Microfluidic long-term gradient generator with axon separation prototyped by 185 nm diffused light photolithography of SU-8 photoresist[J]. Micromachines, 2019,10(1):9.
[25] PARITTOTOKKAPORN S, DRAVID A, BANSAL M, et al. Make it simple:long-term stable gradient generation in a microfluidic microdevice[J]. Biomed Microdevices, 2019, 21(3):77.
[26] HONG S H, YANG H, WANG Y. Inverse design of microfluidic concentration gradient generator using deep learning and physicsbased component mode[J] Microfluid Nanofluid, 2020, 24(6):44.
[27] YANG H, HONG SH, ZHG R, et al. Surrogate based optimization with adaptive sampling for microfluidic concentration gradient generator design[J]. RSC AdV, 2020, 10(23):13799-13814.
[28]LIU B, MAZ, YANG J, et al. A concentration gradients tunable generator with adjustable position of the acoustically oscillating bubbles[J]. Micromachines, 2020, 11(9):827.
[29]LUO Y, ZHANGX, LI Y, et al. High-glucose 3D INS-1 cell model combined with a microfluidic circular concentration gradient generator for high throughput screening of drugs against type 2 diabetes[J]. RSC Adv 2018, 8(45):25409-25416.
[30] SHEN S, ZHANG X, ZHANG F, et al. Three gradient constructions in a flow-rate insensitive microfluidic system for drug screening towards personalized treatment[J]. Talanta, 2020, 208:120477.
[31] TANG M, HUANG X, CHU Q, et al. A linear concentration gradient generator based on multi-layered centrifugal microfluidics and its application in antimicrobial susceptibility testing[J]. Lab Chip, 2018, 18(10):1452-1460.
[32] ZHANGXY, LI Z Y, UENO K, et al. On-chip MIC by combining concentration gradient generator and flanged chamber arrays[J]. Micromachines, 2020,1(2):207.
[33] NGUYEN B, GRAHAM P J, ROCHMAN C M, et al. A platform for high-throughput assessments of environmental multistressors[J]. Adv Sci, 2018, 5(4):1700677.
[34] BAGHERI Z, EHTESABI H, HALLAJI Z, et al. On-chip analysis of carbon dots effect on yeast replicative lifespan[J]. Anal Chim Acta,2018, 1033:119-12
[35] PARK D H, JEON H J, KIM M J, et al. Development of a microfluidic perfusion 3D cell culture system[J]. J Micromech Microeng, 2018,28(4):045001.
[36] ZHANG F, TIAN C, LIU W, et al. Determination of benzopyreneInduced lung inflammatory and cytotoxic injury in a chemical gradientintegrated microfluidic bronchial epithelium system[J]. ACS Sensors 2018, 3(12)-:2716.
[37] YAN S, CHU F, ZHANG H, et al. Rapid, one-step preparation of SERS substrate in microfluidic channel for detection of molecules and heavy metal ions[J]. Spectrochim Acta A, 2019, 220:117113.
[38] WANG J, WANG G, CHEN M, et al. An integrated microfluidic chip for treatment and detection of microalgae cells[J]. Algal Res, 2019 ,42:101593
[39] WANG Y, WANG J, ZHOU C, et al. A microfluidic prototype system towards microalgae cell separation, treatment and viability characterization[J]. Sensors, 2019, 19(22):4940.