
头孢米诺钠是第三代头孢菌素药物,由于其7-β侧链的半胱氨酸能与肽聚糖结合发挥双重抗菌作用,对格兰氏阳性菌和格兰氏阴性菌均有广谱抗菌活性,同时还具有很强的抗厌氧菌活性,从而在临床用药上占据一定的优势,被广泛用于扁桃体、呼吸道、泌尿道、胆道、腹腔、子宫等部位感染,也可用于败血症的治疗。目前头孢米诺钠的常规测定方法是高效液相色谱法(HPLC),也有荷移分光光度法及毛细管电泳法的报道。但尚未见到对其电化学性质的研究及电化学测定方法的报道。根据头孢米诺钠分子结构中具有羧基、羰基和氮、硫等杂原子,推测其在合适条件下应具有电化学活性,因此有必要研究头孢米诺钠的电化学性质,为其构效研究及有效检测提供依据。利用电化学方法进行研究还可以获得与药物相关的动力学和热力学参数,为进一步研究抗生素在人体内的药代动力学过程,以及新抗生素类药物的研制开发提供必要的理论依据。
本文研究了头孢米诺钠的电化学行为,探讨了反应机制,进而建立了单扫描极谱法测定其含量的新方法。该方法操作简便、测定快速、灵敏度高、抗干扰能力强。将拟定的方法已成功用于头孢米诺钠注射针剂及模拟血浆和尿液中含量的测定。
1、实验部分
1.1仪器与试剂
MP-2型溶出分析仪(山东电讯七厂),三电极系统:滴汞电极为工作电极,饱和甘汞电极为参比电极,铂电极为辅助电极;pHS-3C型精密酸度计。头孢米诺钠(珠海联邦制药)标准储备溶液:10.00g/L,使用时逐级稀释至所需浓度。其他试剂均为分析纯,实验用水为蒸馏水。
1.2实验方法
准确吸取一定量头孢米诺钠标准溶液于10mL容量瓶中,加入0.50mol/L磷酸溶液0.5mL,用水稀释至10mL,摇匀,转入电解池中,以起始电位-0.30V,终止电位-1.0V,扫描速率500mV/s进行阴极化扫描,记录头孢米诺钠一阶导数极谱图及其所产生的极谱峰电流Ip。
1.3色谱测定
测定条件:Hypersil ODS2色谱柱(250×4.6mm,5μm),流动相为20mmol/L乙酸铵溶液(加冰乙酸调节pH至4.5)-甲醇-0.1%三乙胺(体积比85∶10∶5),流速为1.0mL/min,柱温为25℃,检测波长为254nm,进样量10μL。
2、结果与讨论
2.1头孢米诺钠电化学行为
2.1.1可逆性试验
在磷酸底液中对浓度为200μg/mL的头孢米诺钠试液在-0.00 ~-l.00V电位范围内进行循环伏安扫描并记录其曲线,扫描过程的阳极支无氧化峰,在反扫描的过程中产生一个还原峰,说明电极反应是不可逆过程。
2.1.2吸附性
于底液中加入表面活性剂聚乙烯醇,观察其对峰电流的影响。随聚乙烯醇加入量的增多,峰电流不断降低。可能是由于表面活性剂和头孢米诺钠在滴汞电极表面发生了竞争吸附,导致其峰电流下降。由此推测,还原波具有阳离子吸附的特性。综上所述,头孢米诺钠的电极反应属于不可逆吸附还原过程。
2.1.3电极反应电子数及电子转移系数
扫描速率对峰电流IP和峰电位Ep均有影响。峰电流IP随扫描速率v的增大呈线性变化,线性方程为:Ip=0.0311v-2.186,r=0.9985,进一步表明该电极过程主要受吸附控制。另外根据Laviron E理论,当体系为峰电流受吸附控制的不可逆体系时,其EP与扫速v的关系式为:
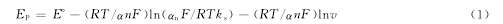
根据EP~lnv关系,Ep随扫描速率的增加而负移,且峰电位EP与lnv在一定范围内呈直线关系,Ep(V)=-0.0482lnv(mV/s)-0.4662,r=0.9978。与式(1)比较,斜率-RT/αnF=-0.0482,得αn=0.5337,因为:0.3<α<0.7,所以得n=1,α=0.53(25℃)。同样与式(1)比较,截距E°-(RT/αnF)ln(αnF/RTks)=-0.4662。作EP~v关系曲线,用外推法可求得E°=-0.6693V。代入上式可求得反应速率常数ks=0.30s-1,ks较小,表明反应是不可逆的,与循环伏安法结果一致。
2.1.4电极反应质子数
pH在0.93~1.87范围内,随着pH增加,峰电位线性负移,表明电极反应有质子参加。实验测得:Ep(V)=-0.0370pH-0.7032,r=0.9980。根据能斯特方程:Ep(V)=E°-0.059m/npH,由于n=1,求得m=0.63≈1,即参与电极反应的电子数和质子数均为1。
2.2单扫描极谱法测定头孢米诺钠方法的建立及分析应用
2.2.1底液的选择
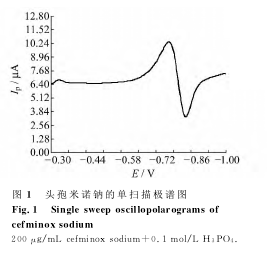
在-0.3~-1.0V范围内,对浓度为200μg/mL头孢米诺钠进行线性扫描测定,没有观察到明显的还原峰,加入不同介质并考察其电化学行为。通过对磷酸、盐酸、硫酸、硝酸、乙酸、乙酸-乙酸钠(pH 4.5)、磷酸盐缓冲液(pH 8.35)、氯化钾、氯化钠、氢氧化钠、氨水、氨水-氯化铵(pH 10)的考察,头孢米诺钠在磷酸、硫酸、盐酸、硝酸、乙酸等酸性溶液中有较好的波形和较高的极谱峰电流;而基于电化学行为的探讨,头孢米诺钠在溶液中电离失去Na+后,带负电荷的头孢米诺首先与H+结合(质子化过程),然后质子化的头孢米诺钠在滴汞阴极上还原析出(还原过程),所以酸性介质有助于头孢米诺的质子化。在几种酸性体系中,头孢米诺钠在磷酸介质中极谱峰最灵敏(图1),因此,选择磷酸作为测试底液。
2.2.2底液pH值的选择
由于头孢米诺首先要经历一个质子化的过程,而且pH值对峰电流及峰电位均有影响,所以底液的pH值是一个重要的优化参数。结果表明:随着底液pH值的减小,头孢米诺钠的峰电流逐渐增大;当pH值为1.35时,峰电流达到最大,随后峰电流反而减弱。因此实验选择底液pH为1.35,极谱峰电流达到最大,波形稳定,此时磷酸的用量为0.5mL。
2.2.3稳定性及重现性
溶液配制好后立即测定和放置2h后测定,头孢米诺的峰电流和峰电位基本不变,说明体系稳定性较好。按实验方法对200μg/mL头孢米诺钠标准溶液进行8次测定,其峰电位恒定不变,峰电流值的相对标准偏差为1.31%。
2.2.4线性范围和检出限
在优化条件下,对头孢米诺钠标准系列溶液进行测定,头孢米诺钠质量浓度在10~650μg/mL范围内与其峰电流(IP)呈线性关系:IP=0.0331c+0.9557,r=0.9995(n=10)。方法检出限(S/N=3)为2μg/mL。
2.3样品的测定
2.3.1头孢米诺钠针剂测定
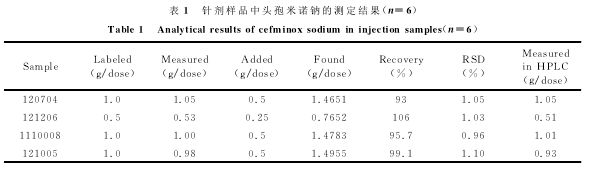
取不同产地、不同批号的头孢米诺钠针剂各一支,用水溶解,转移至1L容量瓶中。分别移取测试液各2mL,加0.5mol/L磷酸0.5mL定容到10mL,测定结果见表1。同时用高效液相色谱法(HPLC)进行对比实验,所得结果一并列入表1。两种分析方法的测定结果基本一致。同时进行了加标回收率试验,回收率在93%~106%之间,符合中国药典方法的要求。另外对针剂中常见辅料及可能的干扰物进行干扰试验。在试验条件下,对200μg/mL头孢米诺标准溶液进行测定,当相对误差在±5%时,50倍的苯甲酸钠、糊精、葡萄糖、甘露醇、Na+、K+、Cl-,20倍的麦芽糖、Mg2+、Ca2+、Zn2+,1倍Cu2+不干扰测定。
2.3.2模拟血浆及尿液中头孢米诺钠的测定
在5个10mL容量瓶中,加入0.5mL健康人血浆及头孢米诺钠贮备液,加0.5mL磷酸,保持pH为1.35,配成含200μg/mL头孢米诺钠的模拟血浆溶液。另取5个10mL容量瓶中,加入1.0mL正常人尿样及头孢米诺钠贮备液,配制成模拟尿样,按标准加入法对含头孢米诺钠的模拟血浆、尿液进行回收率试验(极谱图见图2),回收率结果在95.6%~102.3%之间,RSD为2.6%。由图2可见,血浆及尿液中的内源性共存物不干扰头孢米诺钠的测定。

由上述分析结果可知,该方法可用于头孢米诺钠相关药物的含量测定,并适用于临床上头孢米诺钠血浆、尿液浓度的测定及药代动力学研究。与测定同类项目的其他方法相比,溶出分析仪价格低廉;从所用的试剂材料看,只是普通的酸、碱、盐;从分析周期看,测定速度快;尤其是样品前处理简单,对于血浆中样品浓度的检测,采用HPLC测定时,必需先经固相萃取等前处理步骤将血浆中蛋白质等干扰物去除,再经0.45μm滤膜过滤方可进样,即便如此,共同进入色谱柱的杂质组份尚可对目标峰产生干扰。极谱法可对血浆样品直接测定,还可以排除生物样品分析中常遇到的混浊、黄疸、溶血等干扰。
3、结论
在磷酸底液(pH=1.35)中头孢米诺与1个质子结合后在滴汞阴极获得电子,产生不可逆吸附还原波。据此,建立了单扫描极谱法测定头孢米诺钠的新方法。该法具有操作简便快速、仪器简单低廉、准确度高、重现性好、选择性高、抗干扰能力强等特点,适宜对不同样品基质中头孢米诺钠含量进行测定。
参考文献:
[1]ZHENG Hou-lin(郑厚林),CHEN Yang-jian(陈阳建).Herald of Medicine(医药导报)[J],2011,30(11):1134.
[2]FENG Jia-fu(封家福),ZHANG Jin(张锦),DAI Guang-hui(代广会),ZHOU Qing(周卿),JING Shu-hua(景淑华),SHANGJing-chuan(尚京川).China Pharmaceutical(中国药业)[J],2006,15(10):14.
[3]ZHANG Tao(张涛).Tianjin Pharmacy(天津药学)[J],2006,18(5):14.
[4]CHEN Rong(陈蓉),XU Liu-hui(徐柳辉).China Pharmacist(中国药师)[J],2005,8(9):722.
[5]WEI Bao-kang(魏宝康).Strait Pharmaceutical Journal(海峡药学)[J],2004,16(4):70.
[6]XIE Zan(谢赞),JIANG Yie(蒋晔),LIU Hong-ju(刘红菊),YUAN Hong-kun(袁红坤).Chinese Journal of Anti-biotics(中国抗生素杂志)[J],2006,31(11):669.
[7]WEI Li-jing(魏立静),WU Yuan-yuan(吴远远),SUN Han-wen(孙汉文).Chin Hosp Pharm J(中国医院药学杂志)[J],2010,30(11):908.
[8]GONG Lan-xin(龚兰新),WEI Cui-mei(魏翠梅),HU Jin-bo(胡劲波),LI Qi-long(李启隆).Acta Pharmaceutica Sinica(药学学报)[J],2008,43(3):303.
[9]LIANG Rui-ling(梁瑞玲),ZHENG Li(郑利),LI Xiao-hong(李晓红),YUAN Chun-sheng(原春生).Journal ofMedical Pest Control(医学动物防制)[J],2010,26(9):808.