
世界卫生组织(WHO)发布的流行病学数据显示,甲型 H1N1 流感的易感人群、并发症和重症风险人群以年轻人及具有基础性疾病的人群为主,尤以年轻人的发病率较高[1],而接种疫苗是预防甲型 H1N1流感流行的主要措施.
甲型 H1N1 流感病毒裂解疫苗系用 WHO 推荐,WHO 合作中心分发,并经国家药品管理部门批准的甲型 H1N1 流感病毒株接种鸡胚,经培养、收获病毒液,浓缩、裂解和纯化后制成,用于预防甲型 H1N1流感.作为裂解疫苗,其中血凝素含量对疫苗的免疫效果具有重要影响,而制品的保存条件和时间会影响血凝素含量的稳定.虽然甲流疫苗与普通流感疫苗的生产工艺流程相似[2-3],但作为新毒株及新制品,其免疫原性及质量仍需进一步观察.为了考察制品的稳定性,保证疫苗的安全有效,本实验进行了甲型 H1N1 流感病毒裂解疫苗的稳定性观察,现将结果报道如下.
1 材料与方法
1. 1 疫苗 3 批甲型 H1N1 流感病毒裂解疫苗[规格为 15 μg /(0. 5 ml·瓶),批号分别为 20090701、20090704 和 20090707]和普通流感病毒裂解疫苗(作为对照疫苗,批号为 200907018,0. 5 ml / 瓶)均为本公司制备,含各型流感病毒株血凝素 15 μg.
1. 2 标准抗原 TGA(therapeutic goods administration)标准抗原购自澳大利亚治疗用品管理局;NIBSC 标准抗原购自英国国家生物制品检定所(NationalInstitutefor Biological Standards and Control).
1. 3 主要试剂 相应(亚)型流感病毒特异性免疫血清和抗体参考品均购自 NIBSC.
1. 4 热稳定性试验 根据课题组设计的甲型 H1N1流感病毒裂解疫苗 37 ℃热稳定性试验方案进行试验:将 3 批甲型 H1N1 流感病毒裂解疫苗和对照疫苗于 37 ℃分别放置 0、3、7 d,对成品项目部分检定或全部检定.
1. 5 长期稳定性试验 参照《中国药典》二部(2005版)附录ⅪⅩ C《原料药与药物制剂稳定性试验指导原则》,设计甲型 H1N1 流感病毒裂解疫苗长期稳定性试验方案:将 3 批甲型 H1N1 流感病毒裂解疫苗于 2 ~ 8 ℃分别放置 0、3、6、12、18 个月,对成品项目进行全部检定;分别于放置 1、2、4、5、7、8、9、10、11、15 个月,进行部分项目检定.检测方法和质量标准参照《甲型 H1N1 流感病毒裂解疫苗注册标准》.
1. 6 各项指标的检测
1. 6. 1 鉴别试验 用相应(亚)型流感病毒特异性免疫血清进行单向免疫扩散试验,结果应证明抗原性与推荐病毒株相一致.
1. 6. 2 外观检测 应为轻微乳白色液体,无异物.
1. 6. 3 装量检测 按《中国药典》三部(2010 版)附录ⅠA 中装量项进行,应不低于标示量.
1. 6. 4 pH 值检测 按《中国药典》三部(2010 版)附录ⅤA 进行,应为 6. 8 ~ 7. 5.
1. 6. 5 游离甲醛含量检测 按 《中国药典》 三部(2010 版)附录Ⅵ L 进行,应不高于 25 μg / ml.
1. 6. 6 血凝素含量检测 将抗原参考品和成品分别加入含有抗体参考品的琼脂糖凝胶板上,孔径为2 ~ 4 mm,于 20 ~ 25 ℃扩散至少 18 h;PBS 浸泡 1 h后,干燥、染色、脱色.测量抗原参考品和成品形成的沉淀环直径,以抗原参考品形成的沉淀环直径对其相应抗原浓度进行直线回归,得到直线回归方程,代入成品的沉淀环直径,即可得到血凝素含量.血凝素含量应为 24 ~ 36 μg / ml.
1. 6. 7 总蛋白质含量检测 按《中国药典》三部(2010版)附录Ⅵ B第二法进行,应不高于 200 μg / ml,并不得超过疫苗中血凝素总含量的 5 倍.
1. 6. 8 卵清蛋白含量检测 采用酶联免疫法(仲裁方法)或对流免疫电泳法,应不高于 100 ng / ml.
1. 6. 9 无菌检查 按《中国药典》三部(2010 版)附录Ⅻ A 进行,应符合规定.
1. 6. 10 异常毒性检查 按《中国药典》三部(2010版)附录Ⅻ F 进行,应符合规定.
1. 6. 11 细菌内毒素检查 按《中国药典》三部(2010版)附录Ⅻ E 凝胶限量试验,应小于 40 EU / ml.
1. 6. 12 硫柳汞含量检测 应为 85 μg / ml ± 15%.
2 结 果
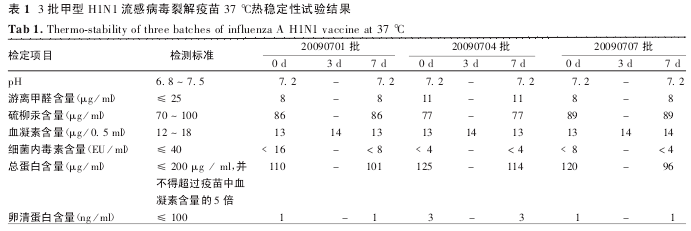
2. 1 热稳定性 检测结果显示,3 批甲型 H1N1 流感病毒裂解疫苗于 37 ℃放置 7 d,鉴别试验、外观、装量、无菌检查和异常毒性检查结果均合格,其他各项指标均符合甲型 H1N1 流感病毒裂解疫苗制造和检定规程要求,且与 0 d 结果比较无明显差异,见表1.对照疫苗于 37 ℃放置 7 d,各项指标检查结果均合格,均符合流感病毒裂解疫苗制造和检定规程要求,且与 0 d 结果比较无明显差异,见表 2.
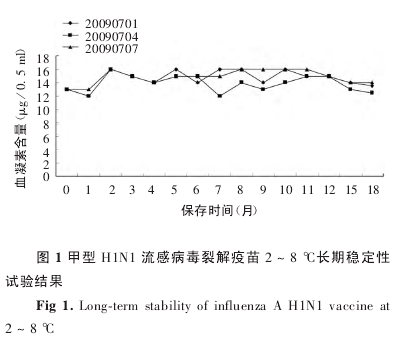
2. 2 长期稳定性 检测结果显示,3 批甲型 H1N1流感病毒裂解疫苗于 2 ~ 8 ℃放置 18 个月,鉴别试验、外观、装量、pH、硫柳汞含量、无菌检查、异常毒性检查、细菌内毒素含量、卵清蛋白含量均合格,均符合甲型 H1N1 流感病毒裂解疫苗制造和检定规程要求,且与 0 月结果比较无明显差异;血凝素含量也较稳定,与 0 月相比,无明显差异,均在正常范围(12 ~ 18 μg / 0. 5 ml)内.见图 1.

3 讨 论
流感病毒属于正黏病毒科[4],病毒体为多形性结构,核衣壳为螺旋对称,病毒表面的包膜上含有血凝素和神经氨酸酶.血凝素是一类蛋白质,病毒依靠血凝素与宿主细胞结合,因此其为流感病毒最主要的表面抗原,能诱导机体产生相应的中和抗体以中和病毒,具有保护作用.血凝素抗体为中和抗体,因此,抵抗感染的发生与血凝素抗体有关,且疫苗血凝素的含量是影响免疫接种效果的重要因素.血凝素含量是考核疫苗质量的关键指标,血凝素的稳定对疫苗的稳定性十分重要.疫苗血凝素含量较高,并在效期内相对稳定,才能保证疫苗具有良好的免疫原性.由于流感疫苗主要以血凝素含量作为效力指标,因此,血凝效价的测定是评估疫苗质量最客观、可和和重要的指标.
本实验观察的疫苗系经病毒培养、浓缩、第 1 次纯化、病毒裂解、第 2 次纯化等工艺制成.纯化保留了病毒中核蛋白和膜蛋白等内部抗原、血凝素和神经氨酸酶表面抗原等有效成分,去除了具有反应原性的病毒类脂质部分,降低了疫苗的接种副反应,并保持相对较高的免疫原性,为一种理想的流感疫苗,经临床试验证实,具有良好的安全性和有效性(尚未发表).本实验观察了该疫苗的稳定性,结果表明,甲型H1N1 流感病毒裂解疫苗热稳定性和长期稳定性均良好,在 2 ~ 8 ℃储存条件下,疫苗的效期可定为 12个月.2010 年版《美国药典》(32 版)收载了流感疫苗,并将有效期定为 1 年[5 ].本公司研制的甲型H1N1 流感病毒裂解疫苗质量稳定,达到了发达国家药典的要求.
参考文献
[1] 尉岚,高虹. 甲型 H1N1 流感危害与疫苗政策简介[J]. 中国预防医学杂志,2010(6):648-649.
[2] Chinese Pharmacopoeia Commission. Pharmacopoeia of People′sRepublic of China(Vol Ⅲ)[S]. Beijing:China Med Sci Press,2010:162-164.(in Chinese)国家药典委员会. 中国药典(三部)[S]. 北京:中国医药科技出版社,2010:162-164.
[3] 国家食品药品监督管理局. 流感病毒裂解疫苗药品注册标准[S]. WS4(-ZB-002)2011. 2011-06-01.
[4] Zhao K,Zhang YH,Li HM. Medical Biology[M]. Zn ed. Bei-jing:People′s Medical Publishing House,2007:805-816(.inChinese)赵铠,章以浩,李河民. 医学生物制品学[M]. 2 版. 北京:人民卫生出版社,2007:805-816.
[5] The United States Pharmacopeial Convention. U. S. Pharmarcopoeia 33[S]. Rockville,MD:Board of Trustees,2010:1132.