摘要:目的:SXT/R391元件是革兰阴性菌中研究最充分、已知成员最多的整合性接合元件家族,本研究的主要目的是探讨SXT/R391元件核心基因组的适应性进化规律。方法:收集数据库中及文献报道的SXT/R391家族元件数据,并利用已测序的细菌基因组序列预测该家族元件,分析元件核心基因的进化特性。结果:通过文献搜集和预测,共获得83个SXT/R391元件的基因组序列。在52个核心基因中,计算发现22个基因在进化过程中经历了重组,基因分布于SXT/R391元件的4个必需模块。此外,在7个基因中检测到了正选择信号。结论:分析了SXT/R391元件核心基因的进化机制,为了解该家族的进化和扩散奠定了基础。
关键词:SXT/R391元件; 重组分析; 正选择分析;
Bioinformatics Analysis on the SXT/R391 ICEs Core Genome
ZHANG Qi ZHOU Jing ZHOU Jiang-Lin KONG Na HU Ming-Da PENG Xiao-Chuan LI Bei-Ping LIANG Long JIN Yuan REN Hong-Guang YUE Jun-Jie
Beijing Institute of Biotechnology
Abstract:Objective: To conduct adaptive evolution analysis of core genome of SXT/R391, which is one of the largest, diverse and well-studied family of integrating conjugative elements(ICEs) among Gram-negative bacteria.Methods: We used all available SXT/R391 ICEs genomes to expound the genetic diversity at the genome level and then explore the evolutionary mechanisms contribute to its genetic diversity. Results: 83 complete genome sequences of SXT/R391 ICEs from different bacterial species and origins were collected. Among the 52 identified core genes, we found that 22 genes had recombination signals and 7 genes had significant evidence of positive selection. The results demonstrated that recombination contributed most to the diversity of SXT/R391 ICEs. Conclusion: We provide an overview of evolution in SXT/R391 ICEs, which will be helpful for understanding the evolutionary dynamics of the SXT/R391 family.
原核生物的可移动遗传元件(mobile genetic element,MGEs)可通过接合、转化、转导等方式介导遗传物质在不同种属细菌间的横向(水平)基因转移(lateral/horizontal gene transfer,LGT/HGT)。Burrus于2002年首次对那些可以从染色体上剪切并整合进宿主染色体,通过接合的方式在细菌细胞之间进行转移的遗传元件进行了归类,称之为整合性接合元件(integrating conjugative elements,ICEs)[1]。ICEs兼有质粒和噬菌体的特征,与接合性质粒相似,它可通过接合的方式进行转移;与质粒不同的是,它们不能自主复制,其复制方式与温和噬菌体相似,通过整合进宿主染色体,随宿主染色体一起复制[2]。ICEs具有吸收和传播包括毒力因子及耐药基因在内的多种特性基因进入细菌宿主细胞的功能。它们常赋予宿主细菌新的性状,如耐药性和致病性等[3]。
迄今,已在多种细菌中发现了ICEs,但目前还没有公认的ICEs分类方法。欧竑宇提出了根据整合酶序列相似性以及核心结构同线性的特征对ICEs进行分类的方法[4],按照这种方法可以把发现的大部分ICEs归为28个家族。SXT/R391是目前已知的ICEs中研究最早和最详细的一个家族[5]。
SXT元件最早发现于1992年在印度和孟加拉导致霍乱的O139群霍乱弧菌MO10的染色体上,该元件能够以整合接合的方式进入宿主菌染色体。SXT携带多种耐药基因,能够介导霍乱弧菌对磺胺甲恶唑(sulfamethoxazole,Su)、甲氧苄氨嘧啶(trimethoprim,Tm)、链霉素(streptomycin,Sm)和氯霉素(chloramphenicol,Cm)的耐药性。当时根据其携带的基因编码对磺胺甲恶唑和甲氧苄胺嘧啶的抗性而命名为SXT[6]。R391在上世纪70年代早期被鉴定为赋予抗卡那霉素的质粒,最初被认为是不相容性群质粒“IncJ”的原生代表。20多年后,很多研究表明R391和其他被称作“R因子”的遗传元件具有与SXT高度类似的基因组骨架结构以及固定的染色体插入/重组位点,它们与SXT实际上属于同一类型的整合接合元件,因此将这一类元件划分为同一个SXT/R391家族。
目前发现的SXT/R391元件基因组的大小为70~120 kb。SXT/R391元件的基因组包括核心保守区和可变区两部分[5,7,8]。SXT/R391元件的保守区编码的基因介导SXT元件的整合/切除、接合转移和ICEs生命周期所需的调控,另外一些保守基因的功能未知。SXT/R391可变区基因的编码产物主要负责宿主对抗生素的耐药性、重金属离子抗性、生物膜形成和细菌运动能力的调节,另外也编码毒素-抗毒素系统、限制性修饰系统、解旋酶、核酸内切酶等[9]。
作为多药耐药(multi-drug resistance,MDR)基因的载体,SXT元件在菌株间播散可造成新的优势菌型流行。SXT/R391元件的进化是造成其扩散能力增强的驱动力。阐明SXT/R391家族元件的进化特征有助于防止SXT元件扩散,将对致病菌防控研究起到重要的实践指导意义。
1 材料与方法
1.1 数据搜集
首先以“SXT/R391”及“ICE”为关键词在PubMed中搜索获得含有报道SXT/R391元件的文献,通过阅读文献获取SXT/R391元件的序列信息。接着进行SXT/R391元件的预测,为了保证获得完整的SXT/R391元件序列,我们从基因组序列完整度为完整基因组(Complete Genome)和染色体(Chromosome)状态的9632个细菌基因组序列中搜索SXT/R391元件。通过BLASTp软件进行比对,匹配结果中包含整合与剪切模块(integration/excision module)、DNA分泌模块(DNA secretion module)和调控模块(regulation module)等3个必需模块的蛋白区域推断为潜在的ICE,如果在一段连续区域内(70~130 kb)出现编码SXT/R391家族元件的整合酶Int、Ⅳ型分泌系统接合蛋白和调控蛋白SetR的基因,则预测该基因组存在一个完整的SXT/R391元件。最终,我们通过文献和预测获得83个SXT/R391家族元件。
1.2 研究方法
提取SXT/R391元件的52个核心基因序列,对83个元件做Blast分析,分析每个基因在83个元件上的分布和复制情况。
1.2.1 重组分析
应用分子生物学软件包RDP4[10]中的RDP、GENECONV、BootScan、MaxChi、Chimaera等5种较为常见的方法,分别探测83个SXT/R391元件的52个核心基因序列的重组事件和重组信号。其中,GENECONV的参数g-scale设置为1,允许重组片段内部的错配;其他方法的参数设置为默认值,不作修改。P≤0.01为具有统计学显着性差异。
1.2.2 正选择分析
选择在线工具Datamonkey(http://datamonkey.org/)[11]进行SXT/R391元件核心基因的正选择压力分析。首先使用MUSCLE进行序列比对,提交序列及选择运算模型。我们选择了4种模型,即随机效应似然法(REL)、固定效应似然法(FEL)、单一祖先计数法(SLAC)及混合效应进化模型方法(MEME)。依据ω值[ω=dN/dS(非同义置换率/同义置换率)]判断选择的方向。当ω>1且差异显着时判断为正向选择,0<ω<1时为净化选择,ω=1时为中性选择。
2 结果
2.1 SXT/R391元件的序列整理及菌属分布
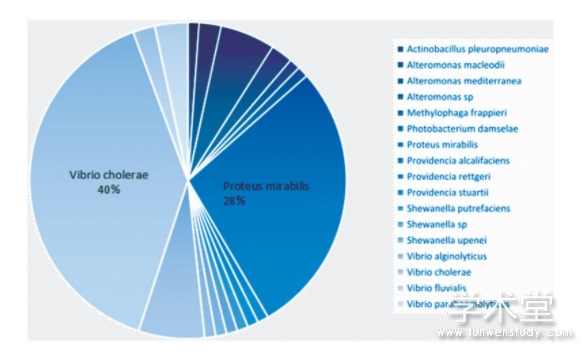
通过文献收集和预测共获得83个SXT/R391元件的基因组序列,包括从文献中提取的54个和细菌基因组序列中预测的29个,元件所在宿主基因组的分离时间为1967~2014年,地理分布包括21个国家和地区,元件宿主跨越25个菌属。在预测的29个SXT/R391ICE元件中,有12个曾经被报道,但未提取和报道元件的完整序列。SXT/R391元件的宿主广泛(图1),但分布存在较大偏性,在霍乱弧菌中发现的数量最多,奇异变形杆菌紧随其后。有趣的是,临床发现的SXT/R391元件也都集中在霍乱弧菌和奇异变形杆菌。在环境中发现的SXT/R391元件大多来自水环境。SXT/R391的菌种分布不均匀,说明元件能在宿主中存在和保藏可能需要满足一定的遗传背景。
2.2 核心基因分析
Wozniak等对13个SXT/R391元件的基因组进行了比较分析[7],发现该元件具有52个核心基因。我们提取了SXT/R391元件的52个核心基因序列,对获得全基因组信息的83个SXT/R391元件的全基因组序列进行同源搜索,分析元件的核心基因的分布情况,结果见图2。
83个SXT/R391元件中有一个特殊的成员ICEPmiChn3,该元件缺少20个核心基因,其中13个发挥接合功能。缺少的20个核心基因被一个新的由转座子和耐药基因组成的基因簇取代。实验结果表明,该元件的接合功能完全丧失[12],因而ICEPmiChn3已经不是一个具有完整组件和功能的元件。因此,后续的核心基因数量分析排除了该元件。
经过计算,52个核心基因中有39个依然出现在全部元件中。另外有6个基因仅在1个元件中缺少,这些基因可称为软核心基因(soft core)[13]。另有7个基因(rumA、s024、s025、s026、traL/E/K)在2个或2个以上元件中缺失,其中的rumA、s024、s025、s026都是SXT/R391元件扩散所需的最小功能基因集合,缺失这些基因可能会影响元件的传播扩散。以上结果说明从文献报道的13个元件中推导出的52个核心基因并不都是严格保守的核心基因,其中有一些基因属于软核心基因。
图1 SXT/R391的菌属分布
值得注意的是,83个元件的整合酶基因有2类,分别为int-1、int-2,2类间的序列相似性仅为22%。裂解酶xis基因也有2类,分别为xis-1、xis-2。我们发现在元件中,int-1与xis-1协同出现,int-2和xis-2协同出现。
另外,从图2可以看出,traFHG、eex、setC、setD、s082、s083、s084、s086、setR基因在菌株Alteromonas macleodii str.MED6-ICE的SXT/R391元件中出现了整体的基因复制。
2.3 核心基因的融合和裂解
除了基因复制,还有少数核心基因呈现了基因融合/裂解信号。全长rumB基因读框长度为1269 bp,蛋白产物为423 aa,但该基因在46个元件表现为2个及更多的片段(图3),说明rumB基因发生了基因融合/裂解,可能与位点附近发生的频繁的插入有关。
此外,trh F与tra W在一些元件中为2个基因。如在元件Proteus mirabilis MD20140901(KX243408)中,trh F读框[54557..55069],长度513 bp,蛋白产物171 aa;tra W读框[55080..56204],长度1125 bp,蛋白产物375 aa。再如,在元件Vibrio cholerae O37MZ03(JQ345361)中,trhF读框[26846..27358],长度513 bp,蛋白产物171 aa;traW读框[27369..28493],长度1125 bp,蛋白产物375 aa。但在元件Providencia stuartii ATCC33672(CP008920)中,对应的2个基因融合为1个基因,融合基因读框[1904626..1906272](基因组位置),长度1647 bp,融合蛋白产物(549 aa)为type-F conjugative transfer system pilin assembly family protein(AIN64681.1)。
图2 核心基因分布情况
图3 rumB基因在不同元件中的分布
2.4 核心基因的重组分析
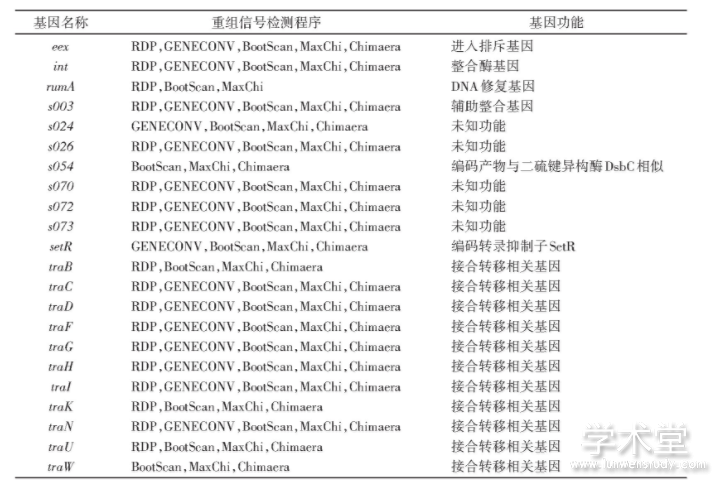
元件之间的重组能导致形成新的杂合元件,重组事件是SXT/R391元件多样性产生的动力之一。有研究报道,SXT/R391元件核心区存在基因间重组。重组除了发生在基因及基因以上水平,还可能发生在亚基因水平(sub-gene level)。为了探测SXT/R391元件的亚基因水平重组事件,我们检测了SXT/R391元件52个核心基因的基因内重组。在52个核心基因中,有22个核心基因在3种及3种以上的方法中可以检测到明显的重组信号(表1)。
图4用红色标出了重组基因在SXT/R391元件基因组上的位置,这些基因涉及元件核心基因的全部4个必需功能模块,即整合与剪切模块、DNA复制及加工模块(replication/DNA processing module)、DNA分泌模块和调控模块。分泌模块,即Ⅳ型分泌系统(typeⅣsecretion system,T4SS)有关基因簇的大部分基因都检测到了重组信号。此外,还有一些具有重组信号的核心基因为未知功能基因。
2.5 正选择分析
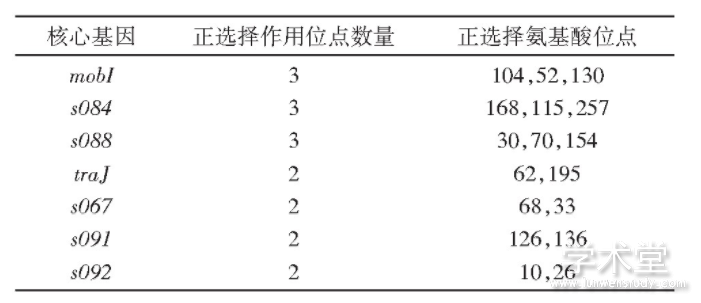
正选择(positive selection)也是微生物进化过程中独立的遗传变异驱动力,在生物的适应性进化中发挥关键作用。我们检测了SXT/R391元件基因组中基因的正选择信号。为了避免重组事件对正选择分析造成干扰,我们只在未发生重组事件的核心基因上检测正选择。计算结果显示,除去以上分析的22个发生重组的核心基因,SXT/R391元件中没有重组信号的30个核心基因中有7个检测到正选择信号(表2)。这7个基因中的mobI和traJ编码SXT/R391元件接合转移所需蛋白,其他5个基因编码未知功能蛋白,且不在SXT/R391 ICE最小功能基因集合(minimal functional SXT/R391 ICE gene set)中,它们对SXT/R391元件多样性的贡献有待进一步研究。
表1 核心基因重组信号检测
图4 22个发生重组的核心基因在SXT/R391元件骨架上的位置
表2 核心基因的正选择氨基酸数量与位点
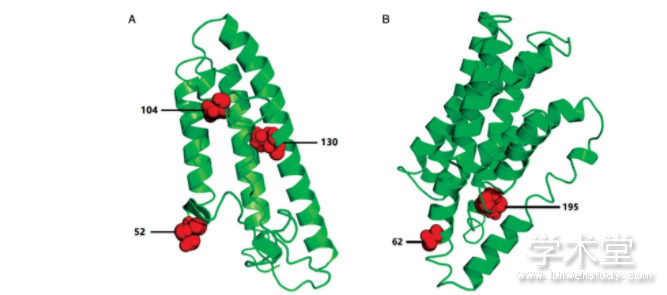
利用I-TASSER软件对mobI和TraJ基因编码的蛋白进行三维结构预测[14]。从预测的三维结构图(图5)中可以看出,mobI基因编码的蛋白上正选择位点52、104残基处于α螺旋结构的端头,130残基位于另一α螺旋结构上;TraJ基因编码的蛋白发生正选择的位点62残基正处于α螺旋结构的端头位置,195残基位于α螺旋结构上,根据预测该蛋白的191~210残基为一个跨膜结构域,正选择位点195残基处于该结构域内。以上位点所处的蛋白结构域或与转移运输有关,这些位点受到选择压力可能与元件的转移扩散相关。
图5 mobI基因(A)和traJ基因(B)编码蛋白的三维结构及正选择位点
3 讨论
作为MDR基因的载体,SXT元件在菌株间播散可造成新的优势菌型流行。SXT/R391元件的进化是造成其扩散能力增强的驱动力。阐明SXT/R391家族ICEs的进化特征、迁移模式及其散播的分子机制,有助于防止SXT元件扩散,对致病菌防控研究有重要的实践指导意义。SXT/R391元件的核心基因决定了元件的复制和转移。重组和正选择是微生物进化过程中2种独立的遗传变异驱动力,在生物的适应性进化中发挥关键作用。本研究收集了目前发现的SXT/R391元件,对核心基因的分布以及核心基因的重组和正选择两大进化特征进行了分析。
本研究表明,同源重组和正选择在SXT/R391元件核心基因的进化过程中发挥了重要作用。我们发现了22个核心基因在进化中经历了同源重组,导致了元件相当一部分核心基因的遗传变异。另外,有7个核心基因存在正选择信号,其中2个基因mobI和traJ与元件的接合转移有关。元件发生重组和正选择变异都是为了SXT/R391元件适合度的提升,从而能适应生态环境的变化。综上,我们分析了SXT/R391元件核心基因的特征及适应性进化,为了解SXT/R391元件的扩散及进化规律奠定了基础。
参考文献
[1] Burrus V, Pavlovic G, Decaris B, et al. Conjugative transposons:the tip of the iceberg[J]. Mol Microbiol,2002,46(3):601-610.
[2] Johnson C M, Grossman A D. Integrative and conjugative elements(ICEs):What they do and how they work[J]. Annu Rev Genet, 2015,49(1):577-601.
[3] Rodríguezblanco A, Lemos M L, Osorio C R. Integrating conjugative elements as vectors of antibiotic, mercury,and quaternary ammonium compound resistance in marine aquaculture environments[J]. Antimicrob Agents Chemother, 2012,56(5):2619-2626.
[4] Bi D X, Xu Z, Harrison E M, et al. ICEberg:a webbased resource for integrative and conjugative elements found in bacteria[J]. Nucleic Acids Res, 2012,40(D1):D621-D626.
[5] Carraro N, Burrus V. Biology of three ICE families:SXT/R391, ICEBs1, and ICESt1/ICESt3[J]. Microbiol Spectrum, 2014,2(6):MDNA3-0008.
[6]罗鹏,何香燕,胡超群.细菌整合性接合元件SXT/R391研究进展[J].微生物学报, 2014,54(5):471.
[7] Wozniak R A F, Fouts D E, Spagnoletti M, et al.Comparative ICE genomics:insights into the evolution of the SXT/R391 family of ICEs[J]. PLoS Genet, 2009,5(12):e1000786.
[8] Zakharova I B, Viktorov D V. Integrative conjugative elements(ICEs)of microorganisms[J]. Mol Genet Microbiol Virol, 2015,30(3):114-123.
[9] Garriss G, Burrus V. Integrating conjugative elements of the SXT/R391 family[M]//Roberts A P, Mullany P.Bacterial integrative mobile genetic elements. Landes Bioscience, 2013:217-234.
[10] Martin D P, Murrell B, Golden M, et al. RDP4:detection and analysis of recombination patterns in virus genomes[J]. Virus Evol, 2015,1(1):vev003.
[11] Pond S L K, Frost S D W. Datamonkey:rapid detection of selective pressure on individual sites of codon alignments[J]. Bioinformatics, 2005,21(10):2531-2533.
[12] Bie L, Wu H, Wang X H, et al. Identification and characterization of new members of the SXT/R391 family of integrative and conjugative elements(ICEs)in Proteus mirabilis[J]. Int J Antimicrob Agents, 2017,50:242-246.
[13] Bioteau A, Durand R, Burrus V. Redefinition and unification of the SXT/R391 family of integrative and conjugative elements[J]. Appl Environ Microbiol, 2018,84:e00485-18.
[14] Yang J, Zhang Y. I-TASSER server:new development for protein structure and function predictions[J]. Nucleic Acids Res,2015,43(W1):W174-181.