摘要 无细胞合成生物技术由于其高度可控及体外代谢途径构建方法多样, 能够完成许多体内代谢途径无法完成的工作。 其主体思想即体外多酶催化体系的构建, 通过模拟生物细胞内的多酶体系, 在体外反应系统中加入能进行顺序反应的多种酶, 使底物经过顺序的多步反应, 一次得到最终产物, 使生产过程大大简化。 将多酶催化体系进行共固定化, 可以实现多酶体系的协同反应和底物通道效应, 提高反应效率。 未来几年, 无细胞合成生物技术有望成为生物燃料、大宗化学品以及医药产品的低成本生物制造平台。
合成生物学是新出现的一门综合了分子生物学、工程学、数学等许多研究内容的交叉学科, 它借鉴工程化的思想研究生命, 目的是通过人工设计和构建高效、可控的生物系统来解决能源、材料、健康和环保等问题[1]. Scientific American 的编辑 David Biello曾经用一个简单的比喻来说明什么是合成生物技术:如果将生命比作电脑, 那么, 由许多核酸组成的程式码-基因体, 就是生命的作业系统。 合成生物技术想做的就是, 透过创造或改写基因组, 让生命表现出预期的行为, 执行预定的工作。
合成生物技术一经兴起, 便得到全世界的广泛关注。 早期合成生物技术的研究内容主要为标准调控元件的设计与合成; 现阶段的研究内容扩展为通过系统生物学指导, 理性组装各种合成生物元件, 使其成为定向执行某种生物功能的代谢通路、系统或者一种全新的细胞[2]. 经过 10 余年的探索, 细胞体内代谢途径的构建已经取得了相当大的进展, 其中的典型代表即为 Keasling 课题组[3,4]利用合成生物技术的方法在大肠杆菌和酿酒酵母中均成功构建的紫穗槐二烯(青蒿素前体物)的合成路径, 建立了有效而价廉的青蒿素合成方法。 伴随基因组学和系统生物学的不断进步, 合成生物技术将会给产品开发带来革命性的影响, 为世界带来新一轮产业发展浪潮。 中国已经制订了合成生物技术战略路线图, 规划了技术、工业应用、医学和农业等方面的中长期目标: 未来 5 年,争取建立标准元件数据库, 形成化学品和生物材料的模块化设计和生产能力; 未来 10 年, 力争形成生物系统设计、建模和验证一体化平台, 商业化生产众多自然化合物、药品、化学品和生物燃料。
但是, 在实际操作过程中, 并不是所有人工设计的代谢途径都能在宿主细胞体内表现出预期的效果,原因主要有以下几方面: 生物系统构建复杂难以预测; 许多人工合成的生物元件与宿主细胞的兼容性问题; 目标产物对宿主细胞的抑制; 生物系统的稳定性问题等[5]. 相比于调控活细胞的代谢, 体外多酶催化体系显得更具灵活性及可操作性。
无细胞的合成生物技术的核心思想为体外多酶催化体系的构建, 即模仿体内代谢途径, 在体外组合一系列酶及辅酶, 构建复杂的生化代谢网络以获得目标产物的过程[6]. 无细胞的合成生物技术近年得到很大提升, 并不断迅速发展。 这种快速的发展基于无细胞的合成生物技术平台的几个重要特点[7~9], 包括:
(1) 没有宿主细胞的生理调控系统, 反应条件更容易控制, 可以方便地进行反应条件的优化; (2) 不存在副反应和宿主细胞本身的代谢需求, 能够达到更高的产品得率和产品纯度; (3) 可以使用高负载量的酶,用于提高反应速率; (4) 宽泛的反应条件(如高温、有机相催化体系)、底物的自由选择, 解决了底物或中间产物的毒性问题; (5) 具有相当大的工业化潜力。
无细胞的合成生物技术可以看作一个基于三要素的集成式平台, 包括: 代谢途径重新构建、酶工程和反应工程[10]. 代谢途径重新构建需要以体内代谢途径为基础, 组装相应的酶和辅酶。 与体内代谢途径可以自动平衡辅酶和产生腺苷三磷酸(ATP)不同, 构建体外代谢途径必须设计辅酶再生系统和 ATP 合成体系。 此外, 需要进行详细的热力学分析, 以确保设计的代谢途径和预期相符。 酶工程经过近半个世纪的发展, 是一个相对成熟的研究领域, 涉及酶的发现、酶的大量制备、理性设计、定向进化和酶的固定化等。 反应工程包括生物反应器的设计(如膜反应器、流加反应器、连续搅拌釜式反应器)、多个反应的级联、反应条件的优化等。
多酶催化体系反应过程中, 中间产物要经分离纯化才能进行下一步产应。 中间产物在分离过程中损失较大, 产率相对较低。 对催化反应的多种酶进行理性设计, 在一定空间内实现级联催化, 可有效减少反应步骤及反应设备的初始投入, 减少中间产物的扩散阻力、增加其局部浓度, 降低中间产物在分离过程中的损失, 提高最终产物的收率。
底物通道效应(substrate channeling)指在多酶催化的代谢途径中前一个酶所催化产生的产物直接进入下一个酶的活性中心, 而不是扩散进入所在的反应体系环境中[11]. 在传统的生物催化级联过程中, 所有的酶均匀分布在反应器中, 存在酶稳定性差、产物分离复杂、酶难以回收、环境耐受性差以及中间传递效率等诸多问题, 因此, 需要发展有效的固定化酶策略来实现多酶催化的底物通道效应, 同时可以保持酶的活力稳定性及重复使用性。
多酶催化体系的固定化是酶工程领域的前沿课题之一, 探索和研究新的固定化技术, 开发适用范围广、可应用于多酶催化的固定化酶载体材料, 为多酶体系创造适宜的微环境是这一领域的基础性研究。
当前多酶催化体系的固定化主要有以下方式: 简单的多酶融合、使用支架系统进行共固定化、简单的共固定化及位置组装的共固定化等(图 1)[12~16].多酶催化体系的固定化效果与载体的选择有很大关系, 载体材料的结构和性质对固定化酶的活性有很大影响[17]. 随着固定化技术的发展, 载体材料由最初的天然高分子材料, 扩展到合成高分子材料、无机材料及现在备受关注的复合材料。 复合载体材料综合利用高分子材料和无机材料优点, 与其他载体材料相比, 具有特殊功能的复合材料有巨大优势, 因此复合材料是固定化载体材料发展的必然趋势[18,19].
基因工程领域的最新研究进展表明, 生物偶合可以提供相应的工具以更加可控的方式构建多酶催化体系, 通过人工合成的结合域, 可以将参与反应的多个酶共同固定于支架体系, 如 RNA 支架系统、DNA 支架系统、合成蛋白支架系统、自组装蛋白支架体系等。 在利用 RNA 分子作为支架系统方面,Delebecque 等[20]利用 RNA 分子适配体将产氢需要的2 种酶进行了空间组装, 利用 RNA 分子的折叠形成一维或者二维的脚手架结构从而实现酶分子的空间构建, 其中二维结构的 RNA 脚手架结构使氢的产量提高了 48 倍。 在利用 DNA 分子作为支架系统方面,Wilner 等[21]以 DNA 分子作为脚手架形成六角形结构,将葡萄糖氧化酶(GOX)和辣根过氧化物酶(HRP) 2 个酶进行固定化, 将酶分子聚集后反应速率大幅度提高。 在利用蛋白质作为支架体系方面, 不仅可以利用自然界存在的蛋白作为支架, 也可以人工构建新的蛋白支架体系。 细菌纤维小体是多种纤维素酶、半纤维素酶依靠锚定-黏附机制所形成的一种多酶体系,通过细胞黏附蛋白附着在细菌的细胞壁上。 近年来,通过模仿自然界中纤维小体的构造人工合成纤维小体得到了广泛研究, Tan 课题组[22]利用来自 Clostri-dium cellulovorans, C. cellulolyticum, C. thermocellum的锚定结构域和黏附结构域构建了人工纤维小体,通过黏附-锚定机制将降解纤维素的酶固定到酿酒酵母细胞壁的表面, 将纤维素降解后在酵母体内进一步转化生成生物乙醇。 利用这种方法, 乙醇的产量最高达到 1.4 g/L. 另外, 利用蛋白质的自组装进行多酶体系的构建也具有广阔的应用前景, 借助蛋白质的自组装完成多酶体系的构建只需要将蛋白质或者酶分子进行简单的混合而不需要进行特殊处理。 Dueber等[23]利用信号转导过程相关蛋白的一部分作为蛋白支架体系构建脚手架, 3 个支架蛋白包括 GTP 酶结合结构域(GBD)、SH3结构域(SH3)和PDZ结构域(PDZ)。
通过将催化乙酰 CoA 到甲羟戊酸的 3 个酶-乙酰CoA 硫解酶(AtoB)、HMG-CoA 合成酶(HMGS)和HMG-CoA 还原酶(HMGR)分别与 GBD, SH3, PDZ 的配基相连, 利用配基与蛋白支架之间的特异性相互作用从而将 3 种酶分子组成多酶复合体, 通过进一步优化支架体系, 调节不同支架蛋白的比例, 甲羟戊酸的产量最高提高了 77 倍。
无细胞的合成生物技术采用自下而上的设计策略, 包括生物积块的构建(单独的酶)、几种酶组合成的功能模块的构建(产物生成模块、辅酶再生模块、ATP 合成模块)和复杂代谢途径的组装及应用(以糖为底物生产氢气等)。 体内代谢途径的标准生物组件是对应的 DNA 序列, 体外代谢途径的标准生物组件则是各种酶。 通过将多个酶组合成功能模块, 再将不同的功能模块进行组装, 可以实现体外代谢途径的构建。
酶催化的生物转化反应中, 约30%是氧化还原反应, 这些反应需要辅酶/辅因子的参与, 如烟酰胺腺嘌呤二 核苷酸 /烟酰胺腺嘌呤二核苷酸磷酸(NAD(P)H)或黄素腺嘌呤二核甘酸(FAD)。 宿主细胞可以通过合成代谢和分解代谢的平衡来调节辅酶/辅因子的量, 体外多酶催化体系则需要不断补充辅酶/辅因子。 在体外构建多酶催化体系, 底物的成本需要远低于产物的价值, 因此, 通过组合积块构建廉价的辅酶再生模块显得尤为重要[24].
NADPH 是最常见的辅酶, 其在体外的再生可以通过以单个酶催化底物供氢体或级联多个酶来进行反应[25]. 单酶构建的 NADPH 再生模块已被广泛用于合成各种化合物。 3 种代表性的单酶构建的 NADPH再生模块是醇/醇脱氢酶、甲酸/甲酸脱氢酶和葡萄糖/葡萄糖脱氢酶[26,27]. 以 1 个多酶催化体系中辅酶再生模块的构建为例, 1 个由 12 个酶组成的体外多酶催化体系, 以纤维二糖为底物生成 1 个单位的葡萄糖可以产生 12 单位的 NADPH[28]. 在所有的供氢体化合物中, 成本最低的是糖类, 但以它们为底物构建辅酶再生模块需要添加较多的酶, 增加了系统的复杂性。 利用电化学反应进行辅酶再生成本较低且相对清洁无污染, 但 NADPH 在高电位时稳定性很差, 如果想在工业上应用这项技术, 必须解决现存的问题。
ATP 是所有生物体的通用能量。 与宿主细胞内可以不断合成 ATP 不同, 在体外多酶催化体系中,如果某些反应需要 ATP 参与, 需要设计 ATP 再生模块, 低成本 ATP 再生是其面临的一个最关键的障碍。
体外 ATP 再生的方法包括底物水平磷酸化、NADPH的氧化磷酸化和光诱导 ATP 合成[29,30].
目前应用最广泛的体外 ATP 再生技术是底物水平磷酸化, 常见的磷酰基供体包括乙酰磷酸、磷酸二羟丙酮和磷酸肌酸等。 这些磷酸盐的利用会导致磷酸根的积累, 从而改变 pH, 抑制体系中的酶活。 此外,过高的底物成本也导致其不能应用于大规模生产。
通过利用糖酵解途径中的反应, 葡萄糖和丙酮酸盐已作为底物用于无细胞体系中 ATP 的合成。 最近,由麦芽糖糊精磷酸化酶介导的反应以麦芽糖糊精作为底物生成 ATP, 与葡萄糖相比, 每单位麦芽糖糊精可以多生成1个ATP, 同时生成可以缓慢释放能量的化合物葡萄糖-6-磷酸, 更可能应用于大规模生产[31].
无细胞多酶催化体系的应用最初可以追溯到100 多年前。 1897 年, Eduard Buchner 使用酵母提取物将糖转化成乙醇和二氧化碳, 凭借这一成就, 他获得了 1907 年的诺贝尔化学奖。 从那时起, 无细胞多酶催化体系逐渐为人们所熟知并加以应用。 无细胞多酶催化体系的构建不仅能在一定程度上克服体内代谢途径的缺点, 还拥有产量高、纯度高以及反应速度快等优点, 目前已经成为合成高价值化合物和生物能源的一种新选择[32].
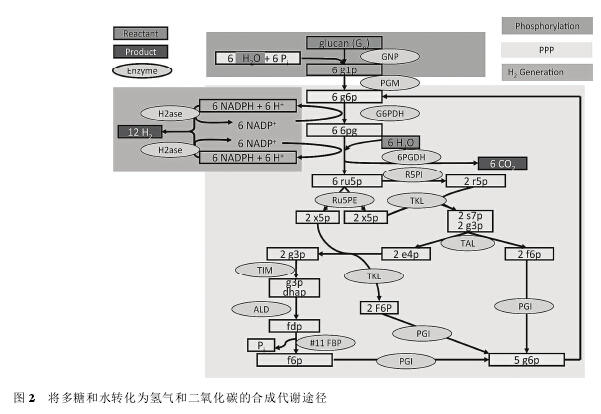
无细胞合成体系最初在生物产氢研究领域取得了较大的突破。 美国橡树岭国家实验室的 Woodward等[33]利用葡萄糖-6-磷酸作为反应底物, 在体外成功构建了 1 条生物产氢的催化途径, 最终每摩尔葡萄糖-6-磷酸经过一系列反应得到了 11.6 摩尔氢气。 然而,葡萄糖-6-磷酸作为反应底物存在几个缺点: 成本偏高; 游离的磷酸作为最终产物会结合 Mg2+, 从而影响参与反应的部分酶的活力; 磷酸积累造成 pH 波动过大, 不利于体系的平衡[34]. 弗吉尼亚理工大学的Zhang 课题组[31]为了解决这些问题, 将葡聚糖作为反应起始底物, 利用低聚的糖苷键和多糖的化学键能量, 通过添加少量可回收利用的磷酸根离子和适当的磷酸化酶, 在原有途径基础上引入了从葡聚糖到葡萄糖-6-磷酸的两步反应, 取得显着效果, 氢气产量提高到 12 mol/mol(底物), 且不需添加 ATP. 由于葡聚糖价格更低(约 0.15 $/kg)、更易获得, 因此新途径能有效降低生产成本(图 2)。 2013 年, Zhang 课题组[35]在体外构建了利用木糖产氢气的无细胞合成体系(图 3)。 可以预见, 通过使用更为廉价的底物可以进一步降低成本, 为生物产氢工业化奠定基础。
纤维素是地球上含量最丰富的有机化合物之一,并且是可再生能源的一种理想原材料来源。 如今, 它还能够解决人类的温饱问题。 在一项新的研究中,Zhang 课题组[36]找到了一种将纤维素转化为淀粉的新途径。 为了实现这种转化, 他们选择了植物、真菌和细菌来源的内切葡聚糖酶-纤维二糖水解酶、纤维二糖磷酸化酶和a-葡聚糖磷酸化酶, 通过基因设计与优化, 人工合成具有大肠杆菌密码子偏好性的基因序列, 在大肠杆菌中表达, 最终得到了需要的酶,并在体外构建了多酶催化体系(图 4)。 与将纤维素完全分解为葡萄糖, 再重新将其组装为淀粉不同, 他们首先将纤维素分解为纤维二糖, 随后将纤维二糖分解为葡萄糖及G-1-P, G-1-P起到构建直链淀粉模块的作用。 通过这种体外多酶催化体系, 他们可将高达30%的纤维素转化为淀粉, 剩下的纤维素水解为葡萄糖, 通过酵母的转化在同一生物反应器中生产乙醇。
丁醇是一种高品质的汽油替代燃料, 与传统的乙醇燃料相比有很大优势: 能量密度高, 接近于汽油;亲水性低, 能与汽油高比例混合; 可以使用现有石油管道进行运输等。 此外, 丁醇还是一种重要的大宗化工产品, 每年全球市场需求达 50 万吨左右。 近几年来, 美国 UCLA 的 Liao 课题组[37]对异丁醇的生物制造进行了深入研究。 通过利用支链氨基酸的生物合成途径和 Ehrlich 途径, 在大肠杆菌等模式生物中构建了异丁醇的生物合成途径, 可以把糖转换为异丁醇。 但异丁醇的体内合成面临诸多限制因素, 其中之一即为使用重组大肠杆菌生产异丁醇, 当产量达到1%~2% (v/v)时, 异丁醇即对宿主产生毒性作用, 从而降低了宿主的生长速率和产物收率。 TUM的 Sieber课题组[38]设计了一种体外的多酶催化体系可以将葡萄糖转化为异丁醇或乙醇。 他们人工构建了最小化的糖酵解级联反应, 反应只需要添加一种辅酶(图 5略)。在耐受性试验中, 无细胞的多酶催化体系在异丁醇产率高达 4% (v/v)时反应速率仍不受到影响。
抗生素是由微生物或高等动植物所产生的具有抗病原体或其他活性的一类次级代谢产物。 目前临床常用的抗生素很多是由基因工程菌发酵得到, 在体外构建多酶催化体系生产抗生素, 可以避免基因工程菌在合成抗生素时产生的自我抑制情况, 具有很好的发展前景。 加州大学圣地亚哥分校的 Moore课题组[39]2007 年首次在体外构建了 II 型聚酮类化合物的合成途径, 该体系利用苯甲酸及丙二酰 CoA 作为反应底物, 在外源补加ATP及NADPH的条件下得到了天然抗生素-肠球菌素(图 6)。
除此之外, 无细胞多酶催化体系也已经应用于其他领域, 如精细化工合成[40]、生物闭合电路构建[41]、无细胞蛋白合成[42]和各种单糖或多聚糖合成[43].
无细胞合成生物技术由于其高度可控及构建体外代谢途径的方法多样, 正逐渐成为一个强大的技术平台, 能够完成许多体内代谢途径无法完成的工作。 相对于传统的微生物发酵生产, 无细胞多酶催化体系拥有诸多优势, 但其未来的应用仍存在相当大的挑战, 即其应用存在一定的局限性。 这种局限性表现在两个方面: (1) 缺乏通用的积块(酶或辅酶), 使其成本偏高。 现代工业化生产最重要的就是标准化和规模化, 只有通过基因工程手段构建大量热稳定的、价格低廉的酶, 并发展仿生辅酶类似物, 才能大幅降低无细胞合成生物技术的成本, 使其可以与传统的微生物发酵进行竞争; (2) 反应速率仍有待大幅提高。 可以通过优化多酶体系的催化模型、代谢流分析、增加底物浓度、增加酶装载量、提高反应温度等手段加快反应速率、提高催化效率。 对于无细胞的合成生物技术, 现阶段的发展目标是在低成本和工业化大规模的基础上构建可控的、高效的多酶催化体系。
可以充分挖掘无细胞系统的潜能, 实现更好的学习、控制和调节。 随着酶制备成本的降低及酶工程技术的不断提高, 相信在不远的将来, 无细胞的合成生物技术将越来越多地应用于生物制造业。
1 宋凯。 合成生物学导论。 北京: 科学出版社, 2012.
2 王俊姝, 祁庆生。 合成生物学与代谢工程。 生物工程学报, 2009, 25: 1296–1302.
3 Ro DK, Paradise EM, Ouellet M, Fisher KJ, Newman KL, Ndungu JM, Keasling JD. Production of the antimalarial drug precursorartemisinic acid in engineered yeast. Nature, 2006, 440: 940–943.
4 Martin VJ, Pitera DJ, Withers ST, Newman JD, Keasling JD. Engineering a mevalonate pathway in Escherichia coli for production ofterpenoids. Nature, 2003, 21: 796–802.
5 Forster AC, Church GM. Towards synthesis of a minimal cell. Mol Syst Biol, 2006, 2: 45.
6 Zhang YHP. Production of biocommodities and bioelectricity by cell-free synthetic enzymatic pathway biotransformations: challenges andopportunities. Biotechnol Bioeng, 2010, 105: 663–677.
7 Zhang YHP, Sun J, Zhong JJ. Biofuel production by in vitro synthetic enzymatic pathway biotransformation. Curr Opin Biotechnol, 2010,21: 663–669.
8 Wang Y, Huang W, Sathitsuksanoh N, Zhu Z, Zhang YHP. Biohydrogenation from biomass sugar mediated by in vitro synthetic enzymatic pathways. Chem Biol, 2011, 18: 372–380.
9 Jewett MC, Calhoun KA, Voloshin A, Wuu JJ, Swartz JR. An integrated cell-free metabolic platform for protein production and syntheticbiology. Mol Syst Biol, 2008, 4: 220.
10 Zhang YHP, Myung S, You C, Zhu Z, Rollin JA. Toward low-cost biomanufacturing through in vitro synthetic biology: bottom-up design. JMater Chem, 2011, 21: 18877–18886.
11 Zhang YHP. Substrate channeling and enzyme complexes for biotechnological applications. Biotechnol Adv, 2011, 29: 715–725.
12 Jung GY, Stephanopoulos G. A functional protein chip for pathway optimization and in vitro metabolic engineering. Science, 2004, 304:428–431.
13 Hanson Lee, DeLoache W C, Dueber J E. Spatial organization of enzymes for metabolic engineering. Metab Eng, 2012, 14: 242–251.
14 El-Zahab B, Donnelly D, Wang P. Particle-tethered NADH for production of methanol from CO2catalyzed by coimmobilized enzymes.Biotechnol Bioeng, 2007, 99: 508–514.
15 Mei L, Xie R, Yang C, Ju XJ, Wang JY, Zhang Z, Chu LY. Bio-inspired mini-eggs with pH-responsive membrane for enzymeimmobilization. J Membrane Sci, 2013, 429: 313–322.
16 Vafiadi C, Topakas E, Christakopoulos P. Preparation of multipurpose cross-linked enzyme aggregates and their application to productionof alkyl ferulates. J Mol Catal B: Enzym, 2008, 54: 35–41.
17 张蕾。 生物粘合与生物矿化启发下多酶催化系统的构建。 博士学位论文。 天津: 天津大学, 201018 Liang X, Xu B, Kuang S, Wang X. Multi-functionalized inorganic-organic rare earth hybridmicrocapsules. Adv Mater, 2008, 20: 3739–3744.
19 Kreft O, Prevot M, M?hwald H, Sukhorukov GB. Shell-in-shell microcapsules: a novel tool for integrated, spatially confined enzymaticreactions. Angew Chem Int Ed, 2007, 46: 5605–5608.
20 Delebecque CJ, Lindner AB, Silver P , Aldaye FA. Organization of intrcellular reactions with rationally designed RNA assemblies. Science,2011, 333: 470–473.
21 Wilner OI, Weizmann Y, Gill R, Lioubashevski O, Freeman R, Willner I. Enzyme cascades activated on topologically programmed DNAscaffolds. Nat Nanotechnol, 2009, 4: 249–254.
22 Fan LH, Zhang ZJ, Yu XY, Xue YX, Tan TW. Self-surface assembly of cellulosomes with two miniscaffoldins on Saccharomycescerevisiae for cellulosic ethanol production. Proc Natl Acad Sci USA, 2012, 109: 13260–13265.
23 Dueber JE, Wu GC, Malmirchegini GR, Moon TS, Petzold CJ, Ullal AV, Keasling JD. Synthetic protein scaffolds provide modular controlover metabolic flux. Nat Biotechnol, 2009, 27: 753–758.
24 Straathof AJJ, Panke S, Schmid A. The production of fine chemicals by biotransformations. Curr Opin Biotechnol, 2002, 13: 548–556.
25 a) Wichmann R, Vasic-Racki D. Cofactor regeneration at the lab scale. In: Kragl U, Ed. Technology Transfer in Biotechnology. BerlinHeidelberg: Springer Berlin Heidelberg, 2005. 225–260; b) Mertens R, Liese A. Biotechnological applications of hydrogenases. Curr OpinBiotechnol, 2004, 15: 343–348.
26 Vrtis JM, White AK, Metcalf WW, van der Donk WA. Phosphite dehydrogenase: a versatile cofactor-regeneration enzyme. Angew Chem IntEd, 2002, 41: 3257–3259.
27 Johannes TW, Woodyer RD, Zhao H. Efficient regeneration of NADPH using an engineered phosphite dehydrogenase. Biotechnol Bioeng,2007, 96: 18–26.
28 Wang Y, Huang W, Sathitsuksanoh N, Zhu Z, Zhang YHP. Biohydrogenation from biomass sugar mediated by in vitro synthetic enzymaticpathways. Chem Biol, 2011, 18: 372–380.
29 Pennathur S, Eijkel JCT, van den Berg A. Energy conversion in microsystems: is there a role for micro/nanofluidics? Lab Chip, 2007, 7:1234–1237.
30 Wendell D, Todd J, Montemagno C. Artificial photosynthesis in ranaspumin-2 based foam. Nano lett, 2010, 10: 3231–3236.
31 Wang Y, Zhang YHP. Cell-free protein synthesis energized by slowly-metabolized maltodextrin. BMC Biotechnol, 2009, 9: 58.
32 Hirao I, Ohtsuki T, Fujiwara T, Mitsui T, Yokogawa T, Okuni T,Yokoyama S. An unnatural base pair for incorporating amino acid analogsinto proteins. Nat Biotechnol, 2002, 20: 177–182.
33 Woodward J, Orr M, Cordray K, Greenbaum E. Biotechnology: enzymatic production of biohydrogen. Nature, 2000, 405: 1014–1015.
34 Jewett MC, Swartz JR. Mimicking the Escherichia coli cytoplasmic environment activates long-lived and efficient cell-free proteinsynthesis. Biotechnol Bioeng, 2004, 86: 19–26.
35 Martín del Campo JS, Rollin J, Myung S, Chun Y, Chandrayan S, Pati?o R, Zhang YHP. High-yield production of dihydrogen from xyloseby using a synthetic enzyme cascade in a cell-free system. Angew Chem Int Ed, 2013, 52: 4587–4590.
36 You C, Chen H, Myung S, Sathitsuksanoh N, Ma H, Zhang XZ, Zhang YHP. Enzymatic transformation of nonfood biomass to starch. Proc Natl Acad Sci USA, 2013, 110: 7182–7187.
37 Atsumi S, Hanai T, Liao JC. Non-fermentative pathways for synthesis of branched-chain higher alcohols as biofuels. Nature, 2008, 451:86–89.
38 Guterl JK, Garbe D, Carsten J, Steffler F, Sommer B, Rei?e S, Sieber V. Cell-free metabolic engineering: production of chemicals byminimized reaction cascades. ChemSusChem, 2012, 5: 2165–2172.
39 Cheng Q, Xiang L, Izumikawa M, Meluzzi D, Moore BS. Enzymatic total synthesis of enterocin polyketides. Nat Chem Biol, 2007, 3:557–558.
40 Bruggink A, Schoevaart R, Kieboom T. Concepts of nature in organic synthesis: cascade catalysis and multistep conversions in concert. OrgProcess Res Dev, 2003, 7: 622–640.
41 Andrianantoandro E, Basu S, Karig DK, Weiss R. Synthetic biology: new engineering rules for an emerging discipline. Mol Syst Biol, 2006,2: 2006.0028.
42 Shimizu Y, Kuruma Y, Ying BW, Umekage S, Ueda T. Cell-free translation reconstituted with purified components. Nat Biotechnol, 2001,19: 751–755.
43 Babich L, Peralta JL, Hartog AF, Wever R. Synthesis of non-natural carbohydrates from glycerol and aldehydes in a one-pot four-enzymecascade reaction. Green Chem, 2011, 13: 2895–2900.