摘 要: 目的 探讨阿托伐他汀降低急性脑梗死出血转化后癫痫发作的风险。方法 选取2012年1月至2017年1月在延安大学威阳医院收治的首发急性脑梗死后出血转化的患者660例,按照是否应用阿托伐他汀钙胶囊及其剂量分为4组,0 mg/d组(未应用组)、10 mg/d组、20 mg/d组、40 mg/d组,各165例。比较发病后2年各组卒中后癫痫发生率、发作类型及用药安全性。结果 未应用组发生癫痫12例(7.2%),10 mg/d组9例(5.4%),20 mg/d组5例(3.0%),40 mg/d组2例(1.2%),差异具有统计学意义(P<0.05)。各组症状性脑出血量増加及脑水肿加重、肝肾功明显异常、肌酶明显异常发生率比较差异无统计学意义,且各组均未发生致死性脑出血量增加。结论 在卒中发病24 h内应用阿托伐他汀可以降低急性脑梗死出血转化后癫痫发作的风险,在一定范围内(0~40 mg/d),随着阿托伐他汀钙剂量的增加,卒中后癫痫发生率降低,且各不同剂量均相对安全。
关键词: 急性脑梗死后出血转化; 卒中后癫痫发作; 阿托伐他汀;
Abstract: Objective To explore the effect of Atto vastatin on the risk of epilepsy after acute cerebral infarction hemorrhage transformation.Methods According to whether or not to use Atto vastatin calcium capsule and its dosage,660 patients who were treated in Xianyang Hospital of Yan' an University from January 2012 to January 2017 were divided into four groups:0 mg/d group(non-application group),10 mg/d group,20 mg/d group and 40 mg/d group,with 165 cases in each group.The incidence,seizure type and drug safety of post-stroke epilepsy in each group were compared 2 years after onset.Results 12 cases of non-application group(7.2%),9 cases of 10 mg/d(5.4%),5 cases of 20 mg/d(3.0%) and 2 cases of40 mg/d(1.2%).The difference was statistically significant(P<0 05).There was no significant difference in the amount of symptomatic cerebral hemorrhage,the aggravation of brain edema,the obvious abnormality of liver and kidney function and the abnormal incidence of muscle enzyme in each group,and there was no increase in the amount of fatal cerebral hemorrhage in each group.Conclusion The use of Atto vastatin within 24 hours of stroke can reduce the risk of epilepsy after acute cerebral infarction.Within a certain range(0-40 mg/d),with the increase of the dose of statins,the incidence of post-stroke epilepsy decreased,and different doses were relatively safe.
Keyword: Hemorrhage after acute cerebral infarction into epileptic; Seizures after stroke; Atto vastatin;
脑卒中、缺血性心脏病与恶性肿瘤为大多数国家的三大致死性疾病,其高发病率、高死亡率、高致残率、高复发率给社会、家庭带来沉重的负担[1]。其中脑梗死(缺血性脑卒中)占70%,急性脑梗死后出血转化是急性脑梗死后缺血区血管重新恢复血流灌注后导致的出血,是急性脑梗死自然病程的一部分,也是改善血流疗法的常见并发症,其不仅与脑梗死预后不良相关,也是上述有效疗法明显使用不足的重要原因[2],脑卒中后,脑组织发生出血,导致形成的血肿周围脑组织缺血缺氧、低糖,导致代谢紊乱刺激神经元引发痫性放电;卒中后胶质细胞增生、瘢痕形成、脑组织粘连等导致神经元异常放电等均可引起癫痫发作。
卒中后癫痫发作等并发症,为该病的治疗及预防增加了难度和成本,且降低了患者的生活质量。他汀类药物已经成为治疗脑梗死的主要用药,但是对急性脑梗死出血转化后癫痫发作的作用报道较少。周东[3]研究发现他汀药物的使用与卒中后早发型癫痫发作风险降低有关,而与卒中后晚发型癫痫发作无显着相关性,但是其研究中没有统一他汀类药物的种类。而Motika[4]认为只有少数患者会发展至卒中后癫痫,难以鉴定他汀类药物与预防癫痫的直接因果联系,且他汀类药物类型与剂量不一,建议采用大样本随机双盲试验来提高论证可信度。付凤霞[5]研究发现用立普妥(阿托伐他河)预处理能有效降低K+诱导的癫痫发作活动、海马神经元死亡、单核细胞浸润和促炎基因表达,所以,本研究旨在探讨阿托伐他汀降低急性脑梗死出血转化后发作的风险。

1、 资料与方法
1.1 、临床资料
选取2012年1月至2017年1月在延安大学咸阳医院收治的首发急性脑梗死后出血转化且既往无癫痫病史及癫痫发作史的患者660例,所有符合入组标准者均采用S0MATOM Defintion FlashCT平扫或者3.T奥泰医疗MRI平扫、flair或DW1,确诊癫痫者用常规脑电图或者24 h动态脑电图检查,患者均由临床经验丰富的神经内科医师做出诊断,急性脑梗死后出血转化诊断标准及分型详见《中国急性脑梗死后出血转化诊治共识2019》。卒中后癫痫发作诊断标准详见《2017年国际抗痫联盟(ILAE)》。所有患者及家属均对本研究知情同意,经本院伦理委员会审核通过。
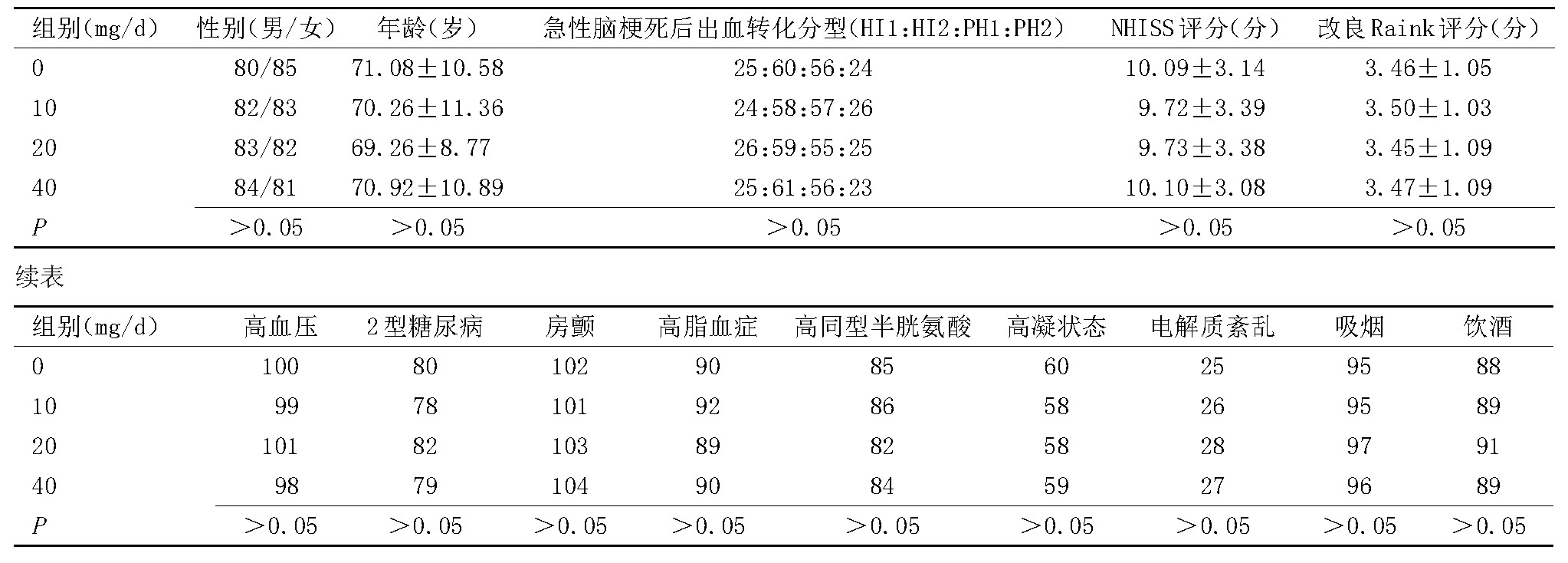
共有660例患者符合纳入及排除标准,除急性脑梗死后出血转化规范治疗外,根据是否应用阿托伐他汀钙胶囊及应用剂量将其分为4组:0 mg/d(未应用)、10 mg/d、20 mg/d、40 mg/d,均在发病24 h内给药,给药1个月,各组临床资料比较差异无统计学意义,见表1。
表1 各组临床资料比较
1.2、 纳入及排除标准
纳入标准:(1)符合急性脑梗死后出血转化诊断,并经头颅CT/MRI等证实为首次急性脑梗死后出血转化患者,脑卒中后癫痫发作符合2017年国际抗痫联盟(1LAE)卒中后癫痫发作诊断标准;(2)急性起病,发病24 h入院;(3)既往无脑卒中、癫痫发作、神经系统外伤及手术病史;(4)发生癫痫发作后行脑电图检查明确卒中后癫痫发作者。排除标准:(1)脑出血、TIA、蛛网膜下腔出血、颅内静脉血栓形成等引起的癫痫发作[3];(2)低血糖、低血钙等引起的痫性发作[5];(3)严重精神障碍不能配合者;(4)严重心肺、肝肾等疾病患者;(5)对他汀类药物过敏者。
1.3 、研究方法
除急性脑梗死后出血转化规范治疗外,根据根据分组剂量应用阿托伐他汀钙胶囊(天方药业有限公司,国药准字H20051984)。
1.4 、观察指标
(1)各试验组卒中后癫痫发作发生率;(2)各试验组癫痫发作类型:全面强直阵挛发作、癫痫持续状态、单纯局灶发作、复杂局灶发作;(3)怀疑有癫痫发作时行脑电图或长程视屏脑电图检查,急性脑梗死后1周发生的癫痫发作为早发型癫痫发作,1周后为晚发型癫痫发作[6];(4)各试验组不良反应发生情况:症状性脑出血量增加及脑水肿加重、肝肾功能明显异常、肌酶明显异常。
1.5、 统计学方法
本研究数据均用SPSS 20.0统计软件处理,计量资料采用表示,组间比较采用t检验,计数资料用例数(n)表示,计数资料组间率(%)的比较采用c2检验,P<0.05为差异有统计学意义。
2、 结果
2.1、 各组急性脑梗死出血转化后癫痫发生率比较
早发型癫痫发作与晚发型癫痫发作比较差异无统计学意义,见表2。
表2 各组急性脑梗死出血转化后癫痫发生率比较[n(%)]
![表2 各组急性脑梗死出血转化后癫痫发生率比较[n(%)]](http://www.xueshut.com/uploads/allimg/200330/36-200330134QbM.jpg)
2.2、 各组卒中后癫痫发作的类型比较
早发型癫痫发作与晚发型癫痫发作比较差异无统计学意义,均以全面强直阵挛发作为主,见表3。
2.3 、各组患者不良反应比较
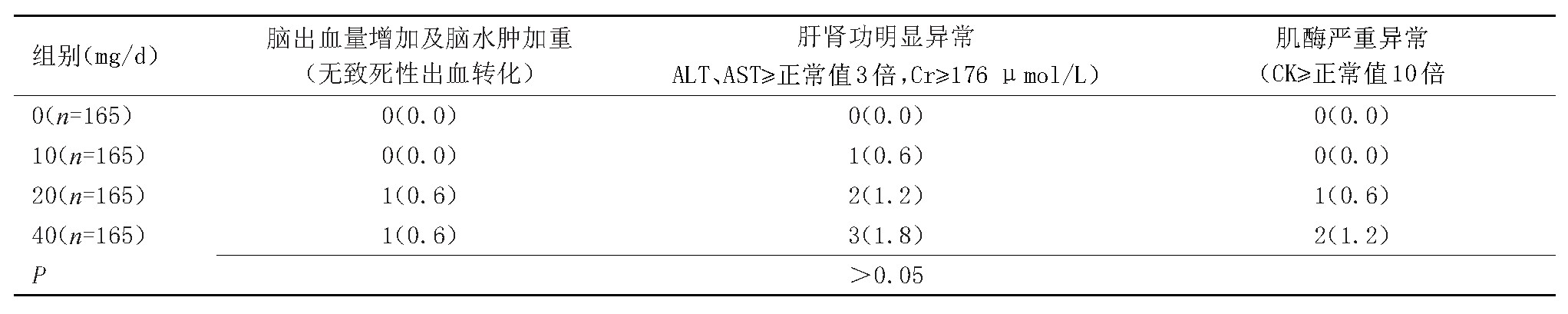
各组症状性脑出血量增加及脑水肿加重、肝肾功能明显异常、肌酶严重异常发生率比较差异均无统计学意义,且各组均未发生致死性脑出血量增加,见表4。
3、 讨论
脑梗死是基于病理学、影像学、其他客观证据和/或临床证据证实的缺血导致的脑细胞死亡,是导致残疾的第1位原因,同时也是我国居民的第2位死因[7],发病率约占全部脑卒中的70%。脑梗死急性期的神经系统并发症,如脑水肿、出血转化、癫痫发作等,即使不危及生命,但这些并发症可能会导致功能恢复差,住院时间延长。急性脑梗死后出血转化是急性脑梗死后缺血区血管重新恢复血流灌注后导致的出血,是急性脑梗死自然病程的一部分,也是改善血流疗法的常见并发症,其不仅与脑梗死后预后不良相关,也是上述有效疗法明显使用不足的重要原因[2],脑卒中后癫痫发作指脑卒中前无癫痫病史,在脑卒中后一定时间内出现癫痫发作并排除脑部和其他代谢性病变[8,9,10]。脑卒中后痫性发作可分为早发型癫痫发作和晚发型癫痫发作。根据最新ILAE指南,用7 d来区分早发型癫痫发作和晚发型癫痫发作,而国内为14 d。既往研究表明,卒中后癫痫发生率高达5%~15%[11,12],其中早发型癫痫发作集中在卒中后24 h内[6,13],发病率为2%~16%,通常表现为局灶性发作,而晚发型发作高峰在卒中后6~12个月[6,13],发病率为2%~11%,以全面强直-阵挛发作较为常见[14,15,16,17],Arboix等[6,18]报道脑梗死后48 h内早发型癫痫发作的发生率为2.2%,而Oseemann等[6,19]报道脑梗死后48 h内早发型癫痫发作的发生率为0.8%~5.5%。Ryvlin等[6,20,21]报道脑梗死后早发型癫发作发生率为2%~23%,晚发型癫痫发作发生率为3%~67%。缺血性卒中后早发型癫痫发作发生率为1.2%~4.2%,晚发型癫痫发作发生率为6%~9%,出血性卒中后早发型痫发作发生率为7.3%~16.2%,晚发型癫痫发作发生率为10%~15%。各研究发生率不同的原因可能是:(1)不同研究对患者的随访时间不同;(2)多数文献采用回顾性分析,样本量不同;(3)患者纳入标准不同,有些研究只关注首次发生卒中患者的卒中后癫痫发病率,有些则只关注同时行EEG和CT/MRI检查的患者;(4)由于EEG未被列入卒中后常规检查,大部分研究资料只关注具有明显临床发作病史的患者,这就造成部分患者资料未被统计。对于急性脑梗死出血转化后癫痫发作发生率目前尚无研究定论。脑卒中后继发的癫痫发作能够进一步增高颅内压,加重脑水肿及脑组织缺血缺氧等,对患者预后产生不利影响,甚至可能引发脑疝导致患者死亡等。是否对出血性脑梗死患者应用进行预防性抗痫治疗,目前大多数指南认为:不必对卒中患者进行预防性抗癫痫治疗[22],对于卒中后癫痫发作的患者早发型可短期药物治疗(<6个月),而对于晚发型卒中后癫痫发作的患者,应进行长期药物治疗(2~5年)
表3 各组卒中后癫痫发作的类型比较

表4 各组患者不良反应比较
他汀类药物(羟甲基成二CoA还原酶抑制剂),具有改善血脂、抗炎、抗氧化、改善内皮功能、抑制SMC(平滑肌细胞)增殖、抑制血小板聚集、稳定及逆转斑块、神经保护等作用。最新研究表明,他汀类药物除了具有上述作用外,还有抗癫痫、抗惊厥,从而发挥神经保护等作用[23]。近年来研究发现他汀类药物具有抗癫痫作用,但具有剂量依赖性,小剂量用药时,剂量每增加1 mg,因痫性发作住院的风险降低5%;而大剂量用药(50 mg/kg)则可以增加痫性发作频率(大剂量用药以小鼠为实验模型)。Lee JK等[24]研究发现用立普妥(阿托伐他汀)预处理能有效降低K+诱导的发作活动、海马神经元死亡、单核细胞浸润和促炎基因表达,阿托伐他汀是脑梗死治疗的基础用药,如能明确其预防卒中后癫痫发作的作用,可以提高大家对阿托伐他汀的重视程度,将减少卒中后癫痫发生率,改善患者预后。所以本研究旨在探讨阿托伐他汀降低急性脑梗死出血转化后癫痫发作的风险。
研究表明,在未应用阿托伐他汀的165例急性脑梗死后出血转化患者中,12例(7.2%)发生卒中后癫痫发作,其中6例(3.6%)为早发型,6例(3.6%)为晚发型。随着阿托伐他汀应用剂量从10 mg/d增加至40 mg/d,急性脑梗死出血转化后癫痫发作的发生率从5.5%降至1.2%,说明阿托伐他汀的应用与急性脑梗死出血转化后癫痫发作的发生率减少相关且具有量效关系,未应用阿托伐他汀组与应用阿托伐他汀各组早发型急性脑梗死出血转化后癫痫发作与晚发型急性脑梗死出血转化后癫痫发作均由3.6%下降至0.6%,差异无统计学意义,说明阿托伐他汀可以减少急性脑梗死出血转化后早发型及晚发型痫发作的发生风险。研究表明,他汀类药物通过以下机制发挥作用:(1)神经元胆固醇的合成,降低NMDA受体功能,减少胞内钙离子信号,从而降低神经元的兴奋性起到抗癫痫作用;(2)抑制海马回的炎症因子细胞介素、肿瘤坏死因子的表达、胶质细胞的增生、齿状回苔藓样纤维的异常增殖、减少异常棘波发放频率等,起到抗癫痫作用;(3)降低胆固醇的水平使卒中发生风险下降,从而使癫痫发作风险降低[25]。
在发生卒中后癫痫发作的28例患者中,13例(1.9%)为早发型,其中7例(53.8%)为全面强直阵挛发作,15例(2.3%)为晚发型,其中9例(60.0%)为全面强直阵挛发作,两者比较差异无统计学意义。在发生急性脑梗死出血转化后癫痫发作早发型与晚发型均以全面强直阵挛发作为主。早发型癫痫发作可能的发病因素[26]:(1)卒中导致脑组织缺血缺氧、梗死等,引起钠泵衰端,脑组织钠离子大量内流,出现过度去极化,从而引起痫性放电;(2)脑卒中后,脑组织发生出血,导致形成的血肿周围脑组织缺血缺氧、低糖,导致代谢紊乱刺激神经元引发痫性放电;(3)脑卒中后脑组织水肿、内压增高影响了神经元正常放电引起痫性放电;(4)脑卒中后引起体内酸碱代谢紊乱从而引起痫性放电;(5)脑出血急性期血液成分含铁血黄素等致痫性放电;(6)脑出血后血管痉挛,缺血缺氧,谷氨酸释放引起痫性放电;(7)应激致激素水平变化引起痫性放电。晚发型发作可能的发病因素[26,27]:(1)脑卒中后胶质细胞增生、瘢痕形成、脑组织粘连等导致神经元异常放电;(2)脑梗死后囊腔的直接刺激;(3)脑梗死后神经元逐渐变性坏死,导致梗死区域过度兴奋;(4)脑卒中后血流动力学的改变与高血糖可能与迟发性发作有关。
另外,未应用阿托伐他汀组未发生症状性脑出血量增加及脑水肿加重、肝肾功明显异常(ALT、AST≥正常值3倍,Cr≥176μmol/L)、肌酶明显异常(CK≥正常值10倍);应用10 mg/d组发生严重肝肾功异常者1例(0.6%),未发生症状性脑出血量增加及脑水肿加重、肌酶明显异常;应用20 mg/d组发生症状性脑出血量増加1例(0.6%),未发生脑水肿加重,肝肾功能明显异常2例(1.2%),肌酶明显异常1例(0.63%);应用40 mg/d组发生症状性脑出血量增加1例(0.6%),未发生脑水肿加重,肝肾功能明显异常3例(1.8%),肌酶明显异常2例(1.2%)。各组症状性脑出血量增加及脑水肿加重、肝肾功能明显异常、肌酶明显异常发生率比较差异无统计学意义且各组均未发生致死性脑出血量增加。
综上所述,在卒中发病24 h内应用阿托伐他汀可以降低急性脑梗死出血转化后癫痫发作的风险,在一定范围内(0~40 mg/d),随着他汀剂量的增加,卒中后癫痫发生率降低,且不同剂量均相对安全。
本研究存在的不足之处:(1)样本量少,且卒中后癫痫发病率偏低;(2)本研究仅纳入急性脑梗死后出血转化分型中的日HT、HT2型,对于未纳入的PH1、PH2型是否有同样的结论尚需进一步研究。故需要更多大样本多中心研究进一步证实。
参考文献
[1] 贾建平,陈生弟,崔丽英.神经病学:脑血管疾病[M].北京:人民卫生出版社,7版.2013:170.
[2] 刘鸣,崔丽英.中国急性脑梗死后出血转化诊治共识2019[J].中华神经科杂志,2019,52(4):1006-7876.
[3] 周东.他汀降低卒中后痴发病风险的研究[R].实用医院临床杂志,第六届CAAE癫痫国际论坛.
[4]Motika PV. Can statins prevent seizures after stroke[J].Neurology, 2015,85(8):e66-e68.
[5] 付风霞.出血性卒中急性期并癫痫临床治疗分析[J].中国实用医药,2011,6(6):1673-7555.
[6]Mul ticentre Acute Stroke Trial-italy(MAST-I)Group. Randomised controlled trial of streptokinase aspirin, and combination of both in treatment of acute ischemic stroke[J]. Lancet, 1995, 346(8989):1509-1514.
[7] 宋泽涵,潘玉君.脑梗死后癫痫发作时间的研究进展[J].脑与神经疾病杂志,2019,27(6):1006-351X.
[8]Yang H, Guo A, Wang Y, et al. The pathogenesis of post stroke seizure and epilepy[J]. J Clin Neurol,2016,29:389-392.
[9] 刘震,尚伟.卒中后癫痫发作与卒中后癫痫[J]. Chin J Stroke, 2017,12(4):1673-5765.
[10]Myint PK, Staufenberg EF, Sabanathan K. Post-stroke seizures and post-stroke epilepsy[J]. Postgrad Med J, 2006,82:568-572.
[11] 杨永忠.脑卒中后癫痫的临床研究[J].世界最新医学信息文摘,2016,16(89):1671-3141.
[12] 张文军.脑卒中后癫痫发病危险因素的荟萃分析[J].中医药导报,2017,23(18):1672-1951.
[13]Brndziar T, Sedova P, Kramer MM, et al. Seizures following ischemic stroke:freqenecy of occurrence and impact on outcome in a long term populationbased study[J]. Stroke Cerebrovascular Dis, 2016,25(1):150-156.
[14] 苏璐,王政,董强.卒中和癫痫的研究进展[J].解放军预防医学杂志,2018,36(2):1001-5248.
[15]Beghi E, Carpio A, Forsgren L, et al. Recommen dation for a definition of acute symptomatic seizure[J].Epilepsia, 2010,51(4):671.
[16]Bladin CF, Alexandrov AV, Bellavance A, et al.Seizures after stroke:A prospective multicenter study[J]. Arch Neurol, 2000,57(11):1617-1622.
[17]Camilo O, Goldstein LB. Seizures and epilepsy afterischemic stroke[J]. Stroke, 2004,35(7):1769-1775.
[18]Arhoix A, Comes E, Gareiaeroles L, et al. Prognostic value of very early seizures for in-hospital mortality in atherothrombotic infarction[J]. EurNeurol, 2003,50(2):78-84.
[19]Ossemann M. Seizures and vascular epilepsy:clinicalelectroencephalographic and scanographic features[J]. Revue Neurologique, 2002,158(2):2-56.
[20]Ryvlin P, Montavont A. Nighoghossian N Optimizing therapy of seizures in stroke patients[J]. Neurology, 2006,67(12 Suppl 4):S3-S9.
[21]Camilo 0, Goldstein LB. Seizures and epilepsy after ischemic stroke[J]. Stroke, 2004,359(7):1769-1775.
[22]Olsen TS, Langhorne P, Diener HC, et al. Guidence for adult stroke recommendations for stroke management:Up-date 2003[J]. Cerebrovase Dis, 2003,16(4):311-337.
[23] 林冠,杨志荣.他汀类药物对痴痫的作用进展及机制研究[J].Journal of Clinical and Experimental Medicine, 2016,17(35):1671-4695.
[24]Lee JK. Statin inhibits kainic acid-induced seizure and associated inflammation and hippocampal cell death[J]. Neurosci Lett, 2008,440(3):260-264.
[25] 王乔利,孙红斌.他汀与痫研究进展[J].实用医院临床杂志,2016,13(2):1672-6170.
[26]Ibat tagl ia D, Pasca MG, C Estrin L, et al. Epi lepsy in shunted posthemorrhagic infantile hydrocephalusowing to pre-or perinatal intra-or periventricular hemorrhage[J]. Child Neurol, 2005,20(3):219-225.
[27] 李开奇.脑卒中后继发性癫痫75例临床分析[J].中国医药指南,2014,12(10):1671-8194.