摘要:磁性微球是一种具有磁性的新型材料, 在磁场作用下可定向运动到特定部位, 迅速从周围介质中分离出来.人类活动排放出的放射性污染物进入水体, 随着食物链进入人体后, 很难通过新陈代谢排出体外, 水中放射性物质影响人类的健康和社会环境.总结了目前文献报道的各类型磁性微球在处理放射性水污染中90Sr、137 Cs、60 Co和镧系、锕系等放射性元素的应用情况, 并对磁性微球在水污染处理方面未来的发展方向进行了展望.
关键词:磁性微球; 吸附; 放射性废水;

Application of magnetic microspheres in radioactive water pollution
LI Shuang MA Ji-ping WU Ge-ge
School of Environmental & Municipal Engineering, Qingdao University of Technology
Abstract:
Magnetic microspheres are a new type of material with magnetic properties which can be directed to a specific location under the action of a magnetic field, and then are rapidly separated from the surrounding medium.Radioactive pollutants are emitted into the environmental water body with human activities.Radioactive pollutants can enter the human body with the food chain.However, radioactive substances are difficult to excrete through the metabolism, so as to harm human health and social environment.This paper summarizes the removal of radioactive elements including 90 Sr, 137 Cs, 60 Co, lanthanide and actinides in water with various types of magnetic microspheres reported in literatures.Furthermore, the future development direction of magnetic microspheres in radioactive water pollution treatment is also discussed.
Keyword:
magnetic microspheres; adsorbent; radioactive waste water;
核能不像化石燃料那样产生大量的空气污染, 是一种清洁能源.但是, 各国核电站的建立、矿业开采、同位素追踪监测、核医疗应用、核战争、核工业等会产生核污染的问题.自切尔诺贝利核电厂泄漏[1]和日本福岛核电站泄漏[2]事故以来, 放射性元素以及放射性水污染的处理受到了人们的关注.90Sr、137 Cs、60 Co、Th (IV) 、Eu (III) 和U (VI) 等放射性核素是核电站放射性废物的重要组成部分.其中, 90Sr、137 Cs是半衰期较长的两种放射性核素, 占核燃料裂变产物总量的98%以上[3].60 Co是核反应装置中的中子活化产物[4], 具有极强的辐射性, 会严重损害人体血液内的细胞组织, 造成白血球减少, 引起血液系统疾病, 严重的会使人患上白血病, 甚至死亡.微量的镧系、锕系Th (IV) , Eu (III) , U (VI) 是放射活性较长的核素, 主要来源于铀矿开采、金属冶炼行业废水, 进入动植物体内后, 发生蜕变并产生放射线影响动植物的生长;进入人体后, 则会导致放射性疾病[5,6].除此之外, 放射性核素具有慢性作用, 潜在的危险很大, 会遗留后患, 遗传给子孙后代.
在放射性三废中, 放射性废水所占的比例最大, 因此对放射性废水的处理尤其受到重视.目前针对水中放射性元素的去除方法[7]主要包括化学沉淀法、离子交换法、膜分离法、吸附法.但是它们在实际应用中也存在一定的问题.例如, 化学沉淀法需要消耗大量药剂, 会造成二次污染, 反应过程易受溶液的pH、温度等条件的影响, 处理后产生大量污泥, 废水难以达标;离子交换法只适用于放射性离子浓度较低的废水, 处理废水的能力有限, 易产生离子交换树脂的中毒与处置问题;膜分离法对原水水质要求高, 通常需要与其他废水处理技术结合使用;在这些方法中, 吸附法[8]是最为高效和实用的方法, 目前可选的吸附剂有硅胶、活性氧化铝、活性炭、分子筛等, 但是这些吸附剂仍然存在比表面积小、吸附量低、可再生性差、不易于分离的问题.因此, 研制具有大比表面积、高吸附容量、可再生的新型吸附剂具有重要意义.
多孔磁性微球是由1个磁性核和1个多孔外壳组成的, 由于其结合了磁性核和多孔壳的双重功能, 最近几十年多孔磁性微球受到了科学工作者们广泛的关注.磁性微球具有高稳定性、大比表面积、高分散性, 使相分离更容易, 不存在内部扩散阻力, 显示出很好的去除污染物的性能, 为分析物提供更好的动力学和更高的吸附能力.此外, 一些磁性微球具有的功能基团, 如-OH, -COOH, -CHO, -NH2, -SH, 使其对目标化合物的选择性更强.磁性微球在样品前处理、毒素的降解、磁共振成像、靶向载药和污水处理等方面已有一些应用[9,10,11].本课题组在磁性微球用于样品预处理及污水处理方面做过一些研究[12,13,14,15].李保强等[16]综述了磁性壳聚糖微球制备及在放射性水污染应用中的研究进展.
磁性微球种类很多, 除了磁性壳聚糖, 磁性多壁碳纳米管、磁性金属有机骨架材料等目前也受到广泛关注.本文对于目前报道的磁性多壁碳纳米管、磁性壳聚糖、磁性金属有机骨架、磁性海泡石、磁性膨润土等磁性微球对于水中放射性元素去除的研究进行综述, 目前少有相关综述报道.
1 放射性水污染中应用的磁性微球种类
最早出现的磁性微球主要是Fe3O4磁性纳米粒子, 它具有比表面积大、高效、易于实现分离等优点.但是, Fe3O4磁性纳米粒子易团聚、易氧化、易受pH的影响.复合磁性纳米粒子可以通过在磁性Fe3O4纳米粒子表面引入不同的功能基团, 改变其理化性质, 提高颗粒的化学稳定性和选择性, 大大提高了吸附性能[17].目前用于放射性元素去除的磁性微球主要有磁性多壁碳纳米管、磁性壳聚糖、磁性金属有机骨架材料、磁性膨润土等, 以下分别介绍它们在放射性水污染中的应用研究.
1.1 磁性多壁碳纳米管
碳纳米管 (CNTs) 是指尺寸大小在1~100nm之间的一种新型纳米碳质材料, 由单层石墨平面卷曲形成单壁碳纳米管 (SWNTs) , 多层石墨平面卷曲形成多壁碳纳米管 (MWNTs) .由于碳纳米管材料具有纳米级的中空管状结构和巨大的比表面积[18], 能强烈吸附一些金属及有机化合物.磁性多壁碳纳米管既具有多壁碳纳米管高比表面积、良好的化学、机械稳定性和热稳定性等优点, 并且经多种官能团功能化后, 解决了Fe3O4磁性纳米粒子不耐酸碱的问题, 由于表面有多种修饰基团, 适用于更多类型化合物的富集, 羟基、羧基的引入增强了碳纳米管的亲水性, 使其在水中的分散性更好;同时具备磁性纳米粒子的超顺磁性, 通过外加磁场的吸引可以很容易地从溶液中分离出来.CHEN等[19]制备并表征了磁性多壁碳纳米管, 研究了磁性多壁碳纳米管对水中90Sr、63 Ni的去除影响因素.WANG等[20]制备了磁性多壁碳纳米管/铁氧化物复合材料, 并研究了其对60Co的去除.
1.2 磁性壳聚糖
壳聚糖 (Chitosan) 又称脱乙酰甲壳素, 是由自然界广泛存在的几丁质经过脱乙酰作用得到的, 化学名称为聚葡萄糖胺 (1-4) -2-氨基-B-D葡萄糖.磁性壳聚糖微球是由壳聚糖包裹磁性粒子形成的具有球状结构的粒子, 壳聚糖为壳, 磁性粒子为核, 由于磁性壳聚糖微球表面大量氨基、羟基的存在, 使得磁性壳聚糖表现出良好的吸附性能[21].金玉仁等[22]研究了磁性壳聚糖对三价锕系和镧系元素的吸附性能;KOJI等[23]用苯基砷酸改性壳聚糖树脂吸附放射性U (VI) , 去除率可达到100%;贾亮[24]采用磁性羟肟化壳聚糖, 将其经碱浸泡处理后用作吸附剂, 去除水中的U (VI) ;周利民等[25]采用乙二胺改性磁性壳聚糖微球去除水中的U (VI) 离子, 考察了在不同pH下其对水溶液中的含铀离子吸附性能;CHEN等[26]将合成的磁性壳聚糖应用于放射性水污染中90Sr的去除, 饱和吸附容量为11.58mg/g;ZHU等[27]合成磁性PVA-壳聚糖复合材料去除60Co, 其饱和吸附容量为14.39mg/g;YIN等[28]采用磁性壳聚糖去除90Sr, 饱和吸附容量达到81.96mg/g.
1.3 磁性金属有机骨架材料
金属有机骨架材料 (Metal Organic Frameworks, MOFs) 是一类以金属离子或金属簇为配位中心, 与含氧或氮的有机配体通过配位作用形成的多孔配位聚合物[29].与多孔碳、无机沸石和MCM介孔材料等传统多孔材料相比, MOFs材料合成条件温和, 结构多样, 性能优越, 骨架规模大小可变, 孔道具有伸缩性和空间构型可控的特点, 尤其是一般的MOFs材料都比传统多孔材料具有更高的比表面积.MOFs己经在气体储存、气体提纯、分离、催化等应用领域取得了很大的进展, 近几年也被用于环境中污染物的富集及水中污染物的去除中[30,31].本课题组制备了磁性MOFs材料, 将其作为磁固相萃取吸附剂富集了环境水样中的吡唑吡咯类农药[32], 并综述了MOFs在分析化学中作为萃取吸附剂的应用研究进展[33];童敏曼等[34]综述了MOFs用于废水处理中的应用;李小娟等[35]综述了MOFs吸附去除环境污染物的应用;王孝娃等[36]综述了金属-有机骨架材料用于放射性核素吸附的研究进展.
磁性金属有机骨架材料有两种形式, 一种是原位磁性功能化, 即MOFs材料与磁性材料分别制备, 通过静电作用相结合为磁性复合吸附材料, 主要采用超声法制备;另一种是将MOFs材料包覆在Fe3O4外层形成壳核结构的吸附材料, 主要采用逐步合成法.将磁性MOFs用于水中污染物去除已有一些文献报道, 但目前将磁性MOFs用于放射性污染物的去除研究报道并不多见.SHAKIBA等[37]制备了两种类型的磁性MOFs材料MOF/KNiFC和MOF/Fe3O4/KNiFC用于吸附水溶液中的137Cs (I) , 45min内达到最大吸附, 最大吸附量分别为153和109mg/g.
1.4 磁性膨润土
膨润土是以蒙脱石为主要矿物成分的非金属物质, 磁性膨润土因具备良好的吸附性、可膨胀性、阳离子交换性和易分离性而被应用于环境领域中[38].吴连生[8]采用经过在聚丙烯酸钠溶液中共聚制备得到的磁性聚丙烯酸钠改性有机膨润土纳米复合材料吸附Th (IV) 、U (VI) 、Eu (III) ;陈亮[39]采用磁性膨润土去除污水中的60Co (II) , 最大吸附量为9.13mg/g, 且可重复使用.
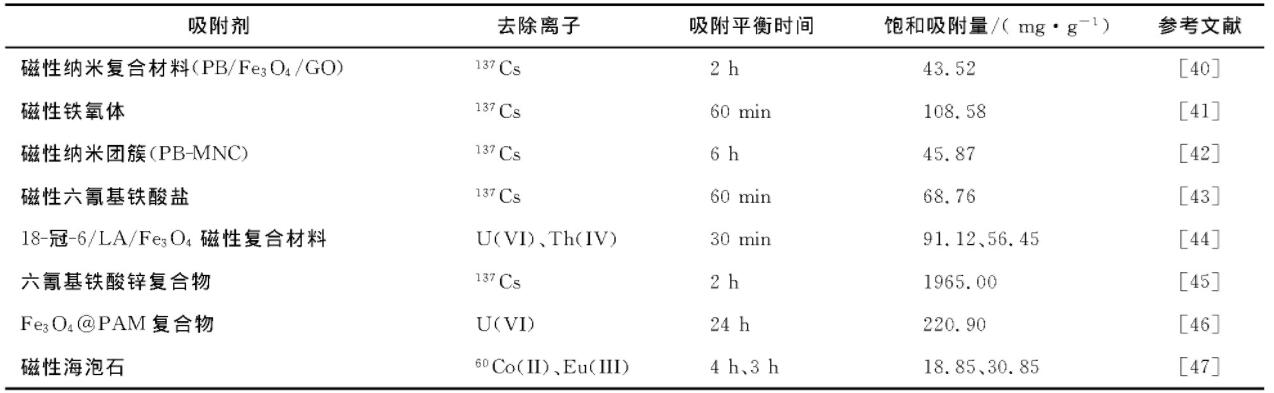
除以上磁性材料, 还有一些磁性复合材料被用于水中放射性物质的去除研究 (表1) .
表1 复合Fe3O4磁性纳米粒子应用于水中放射性元素去除研究
2 磁性微球在放射性水污染中的应用研究
放射性废水中含有的核素种类多、浓度高、具有放射性, 对环境有极大的危害.从根本上讲, 放射性核素只能靠自然衰变来降低从而消除放射性, 所以, 废水的处理方法有贮存和扩散两种.对于高水平放射性废物, 一般妥善地贮存起来, 进行隔离;对于中低水平放射性废物, 需经过适当的方法处理后, 将放射性废物浓缩, 再贮存起来.下文从去除放射性水污染中不同种类核素的角度, 分别介绍各种磁性微球应用的实例.
2.1 去除放射性水污染中的90Sr
ARMIN等[48]采用磁铁矿-SiO2复合材料, 25℃时去除90 Sr (II) , 3d达到吸附平衡, 磁性微粒对90Sr (II) 的吸附行为符合Langmuir吸附等温模型.材料在pH值为1~3之间的条件下可再生.使用BET方法, 测得复合材料比表面积为84m2/g, 是纯磁铁矿比表面积的40倍.与纯磁铁矿相比, 磁铁矿-SiO2复合材料对90Sr (II) 的吸附能力增加.
CHEN等[19]研究多壁碳纳米管/磁性氧化铁复合物对90Sr (II) 的吸附.磁性微粒对90Sr (II) 的吸附行为符合Langmuir吸附等温模型, 说明磁性微粒的表面由大量吸附活性中心组成, 每个活性中心只能吸附1个离子, 当吸附中心达到吸附饱和状态时, 磁性微粒表面便会形成类似单分子层结构的离子吸附层.多壁碳纳米管/磁性氧化铁复合物对90Sr (II) 的去除率较高, 在pH>7时, 约为85%, 而多壁碳纳米管和铁氧化物对90Sr (II) 的去除率却分别为30%和25%.
CHEN等[26]采用制备的磁性壳聚糖去除90 Sr (II) , 在吸附6h后达到平衡, 最大吸附量为11.58mg/g, 当pH=8.4时去除率达到最大, 磁性微粒对90Sr (II) 的吸附行为符合Langmuir吸附等温模型.傅里叶变换红外光谱 (FTIR) 研究表明, 磁性壳聚糖表面的-NH2主要参与对90Sr (II) 的吸附.当吸附剂用量从0.67g/L增加到10g/L时, 去除效率从11.16%增加到96.56%.
YIN等[28]采用经过酿酒酵母改性后的磁性壳聚糖微球在30℃下去除90Sr (II) .当pH=8时, 吸附量达到最大为81.96mg/g, 磁性微粒对90Sr (II) 的吸附行为符合Freundlich吸附等温模型.
刘峰等[49]采用共沉淀法制备的Fe3O4磁性纳米粒子在45℃下吸附90Sr (II) , 60min达到吸附平衡, pH=8时吸附量达到最大, 为0.962mmol/g.用Langmuir等温模型、假二级动力学模型研究了Fe3O4纳米磁性微粒对90Sr (II) 的吸附机理, 结果表明, 该过程是单离子层吸附过程.
ABDEL等[50]采用合成的磁性纳米沸石材料去除水中90Sr (II) , 90Sr (II) 在pH=8时, 通过表面吸附和离子交换作用2h后达到饱和吸附, 磁性微粒对90Sr (II) 的吸附行为符合Langmuir吸附等温模型.实验结果表明, 去除效率随着温度的升高和pH的增大而逐渐增大.
2.2 去除放射性水污染中的137Cs
ARMIN等[48]采用80%磁铁矿-SiO2复合材料去除137Cs (I) , 在25℃下, 经过3d达到吸附平衡, 符合Langmuir吸附等温模型, 80%磁铁矿-SiO2复合材料对137Cs (I) 的吸附主要是表面络合作用.
SHEHA等[41]采用磁性材料铁氧体在60 min内对137 Cs (I) 的吸附达到吸附平衡, 最大吸附量为108.58mg/g.吸附符合Langmuir吸附等温模型及伪二阶吸附模型, 吸附过程是离子交换过程.
ZHANG等[43]制备粒径小于100nm的复合材料磁性钾钛铁氰化物 (Magnetic Potassium Titanium Hexacyanoferrate, M-PTH) 用于去除水中的137Cs (I) .M-PTH对137Cs (I) 吸附等温线与Langmuir模型吻合良好, 最大吸附量达到0.517mmol/g, 约为沸石材料的1.5倍.吸附过程遵循伪二阶吸附模型.
SHEHA[45]采用磁性六氰基铁酸盐纳米复合材料去除水中的137 Cs (I) , 吸附在2h后达到吸附平衡, 最大吸附量达到1965mg/g.吸附等温线与Langmuir模型吻合良好, 动力学性能遵循伪二阶吸附模型.
ZOHREH等[51]对磁赤铁矿聚乙烯醇 (polyvinyl alcohol, PVA) -藻酸盐去除水中的137Cs (I) 进行了研究, 在pH=8时, 可以达到91%的去除率.磁性微粒对137Cs (I) 的吸附行为符合Freundlich吸附等温模型, 动力学性能遵循伪二阶吸附模型.
最近, SHAKIBA等[37]制备了钾镍铁氰化物改性的磁性金属有机骨架材料MOF/Fe3O4/KNiFC, 用于水中137Cs (I) 的去除.45min达到吸附平衡, 最大吸附量为153mg/g.在K+和Na+存在下, 吸附剂表现出对137Cs (I) 的良好选择性.吸附剂的再生实验表明, 至少5次再生循环后仍可使用.对137 Cs (I) 的吸附遵循伪二阶吸附模型, 而吸附等温线遵循Langmuir模型, 证实137 Cs (I) 在吸附剂上是单层均匀覆盖的且完成了化学吸附过程.
ABDEL等[50]采用合成的磁性纳米沸石材料, 去除水中的137 Cs (I) , 在pH=6时, 通过表面吸附和离子交换作用2h后达到饱和吸附, 磁性微粒对137Cs (I) 的吸附行为符合Langmuir吸附等温模型.
AVINASH等[52]制备果胶改性的磁性石墨烯氧化物普鲁士蓝复合纳米材料, 在30℃下, 吸附24h可以去除水中的137Cs (I) .当pH=7时, 材料的吸附量达到最大, 为1.609mmol/g.吸附复合Langmuir吸附等温模型及伪二阶动力学模型, 该过程是化学吸附过程.
除了上述的研究以外, HUSNAIN等[53]采用磁性介孔碳去除137Cs (I) , 在5min之内可以基本完成吸附过程, 最大吸附量达到205mg/g.吸附符合Langmuir吸附等温模型, 该过程是化学吸附过程, 材料中的羧基、酚羟基有利于与137Cs (I) 螯合.
2.3 去除放射性水污染中的60Co
刘峰等[49]采用共沉淀法制备Fe3O4纳米磁性微粒, 研究其对水中60Co (II) 的去除.在45℃下, 60min达到吸附平衡, pH=7时, 吸附量达到最大为1.794mmol/g.吸附符合Langmuir等温模型及假二阶动力学模型, 吸附过程是单离子层吸附过程.
WANG等[20]合成了磁性多壁碳纳米管/氧化铁复合物去除水中60 Co (II) , 材料结构上的羧基有利于吸附60Co (II) , 最大吸附量为2.88mg/g.吸附符合Langmuir吸附等温模型和伪二阶吸附模型.吸附量随pH的增加而增加, 在pH>8.5时, 吸附过程主要是表面络合过程;在pH<8.5时, 吸附过程主要是离子交换和表面络合过程.
ZHU等[27]制备了PVA/壳聚糖磁性复合材料, 用于水中60 Co (II) 的去除.通过对材料用傅里叶变换红外光谱 (FTIR) 和扫描电镜 (SEM) -能量色散X射线 (EDAX) 的分析, 显示官能团-NH2和-OH在60Co (II) 吸附过程中起主要作用.在pH=6.0, 30℃下吸附, 吸附符合Langmuir模型及伪二阶方程.经过18h后达到吸附平衡, 最大吸附容量为14.39mg/g.
邱勇[47]采用磁性海泡石去除60Co (II) , 磁性海泡石比表面积为106.33m2/g, 平均孔径为11.3nm.4h后达到吸附平衡, 最大吸附量为18.85mg/g.吸附符合Langmuir等温模型.当pH<7.0时, 主要是靠离子交换和外层表面络合作用吸附;当pH>10.0时, 以内层表面络合和表面沉淀作用为主.
陈亮[39]采用磁性膨润土复合材料去除60Co (II) , 吸附6h后达到吸附平衡, 最大吸附量为9.13mg/g.吸附符合Langmuir吸附等温模型, 高温有利于吸附.在pH<8.0时, 吸附过程主要是离子交换和外层络合过程;在pH>8.0时, 吸附过程主要是表面沉淀和内层络合过程.
2.4 去除放射性水污染中的镧系、锕系元素
黄芬[44]制备了18-冠-6/油酸 (LA) /Fe3O4复合磁性纳米颗粒, 研究了其对水中U (VI) 和Th (IV) 的去除.对U (VI) 吸附的结果表明, 在45℃、pH=5.5的条件下, 吸附30min效果最佳, 饱和吸附容量为91.12mg/g, 吸附过程符合假二阶动力学模型、Freundlich等温线;对Th (IV) 吸附的结果表明, 在60℃、pH=3.8的条件下, 吸附30min效果最佳, 去除率为99.8%, 饱和吸附量为56.45mg/g, 吸附过程符合假二阶动力学模型、Freundlich等温线模型.
SONG等[46]采用Fe3O4@聚丙烯酰胺 (PAM) 复合材料作为吸附剂, 从水中去除U (VI) .吸附符合Langmuir吸附等温线, Fe3O4@PAM在pH=5.0和35℃时对U (VI) 的饱和吸附量为220.9mg/g.根据U (VI) 吸附前后Fe3O4@PAM的X-射线光电子能谱 (X-ray photoelectron spectroscopy, XPS) 分析, Fe3O4@PAM表面的含氮官能团与U (VI) 结合.吸附在Fe3O4@PAM上的U (VI) 可以在酸性溶液中有效解吸, 再生吸附剂的吸附能力在5个循环后仍能保持高水平去除.
贾亮[24]制备了磁性羟肟化壳聚糖, 在30℃, pH=6.0的条件下, 30min完成了对U (VI) 的吸附, 吸附过程符合Langmuir吸附等温线, 属于单分子层吸附.采用0.1mol/L的NaOH溶液可以将其解吸, 4次解吸过程后, 去除率从97.86%降至92.44%.
邱勇[47]对放射性核素在磁性海泡石上的吸附性能进行研究发现, 对Eu (III) 的吸附机理以化学吸附和表面络合过程为主, 3h达到吸附平衡, 饱和吸附量为30.85mg/g.
吴连生等[54]采用化学共沉淀法制备了磁性富羧基碳复合材料来吸附U (VI) , 结构式上的羟基和羧基有利于吸附U (VI) .其比表面积为45.4m2/g, 饱和磁化强度为30.68A·m2/kg.当磁性富羧基碳投加量0.4g/L, 25℃, 72h达到吸附平衡, 饱和吸附量为92.13mg/g, 吸附等温线符合Langmuir模型.
李云开[55]合成磁性有序介孔复合材料CoFe2O4@MCM-48, 对含U (VI) 放射性废水进行模拟吸附研究.结果发现, 在pH=6.0时, 投入0.03g复合材料, 经过3h可以达到吸附平衡, 可以去除91.16%的铀酰离子, 饱和吸附量达到217.97mg/g.又制备了具有空腔结构的磁性有序介孔复合材料CoFe2O4@C-MCM-48, 可以在25℃, pH=6时, 去除96.42%的铀酰离子, 饱和吸附量达到230.45mg/g.
3 结论及展望
磁性微球作为一种新型的吸附介质, 已应用于水中放射性元素的去除研究, 并取得了一些进展.磁性微球去除水中放射性元素目前仍处于发展阶段, 要很好地用于实际样品的分析还有许多问题亟待解决, 主要包括:
1) 应着重开发研制新型磁性微球, 使其具有更大的饱和吸附容量及短的吸附平衡时间, 进一步提高吸附剂对放射性元素的去除率及循环使用次数.
2) 目前, 磁性材料去除水中放射性元素的研究报道主要为实验室的吸附去除机理研究, 并未应用于实际放射性废水, 因此, 进一步降低吸附剂制备的成本, 使其能应用于实际废水中也是未来应关注的主要研究内容.相信随着磁性微粒在放射性元素去除领域研究的不断深入, 必将吸引越来越多的环境科学与工程工作者从事这方面的研究, 这将使磁性材料获得更为广泛的应用.
参考文献
[1]王恒德.切尔诺贝利核事故及其后果[J].辐射防护通讯, 2000, 20 (4/5) :38-41.
[2]陈达.核能与核安全:日本福岛核事故分析与思考[J].南京航空航天大学学报, 2012, 44 (5) :597-602.
[3]王兰, 侯晨曦, 樊龙, 等.矿物固化含Sr、Cs放射性废物研究进展[J].材料学报, 2017, 31 (2) :106-111.
[4]冯金金, 聂文信.钴的毒性动力学[J].国外医学 (医学地理分册) , 2000, 21 (2) :90.
[6]HAN H, JOHNSON A, KACZOR J, et al.Silica coated magnetic nanoparticles for separation of nuclear acidic waste[J].Journal of Applied Physics, 2010, 107 (9) :520.
[7]李雅婕.浅谈放射性废水处理技术[J].化工技术与开发, 2011, 40 (10) :62-64.
[8]吴连生.铀 (VI) 、钍 (IV) 和铕 (III) 在磁性富羧基复合物上的吸附行为研究[D].兰州:兰州大学, 2012.
[9]MANUEL A, RODRIGO F P, IBARRA M R, et al.Magnetic nanoparticles for drug delivery[J].Nanotoday, 2007, 2 (3) :22-32.
[10]ZHANG L Y, ZHU X J, SUN H W, et al.Control synthesis of magnetic Fe3O4-chitosan nanoparticles under UV irradiation in aqueous system[J].Current Applied Physics, 2010, 10:828-833.
[11]孔丝纺, 文秀芳, 皮丕辉, 等.磁性微球的制备及其在水处理中的应用[J].应用化工, 2007, 36 (5) :496-500.
[12]MA J P, JIANG L H, WU G G, et al.Determination of six sulfonylurea herbicides in environmental watersamples by magnetic solidphase extraction using multi-walledcarbon nanotubes as adsorbents coupled with high-performanceliquid chromatography[J].Journal Chromatography A, 2016 (1466) :12-20.
[13]XIAO S W, LIU R, MA J P, et al.Adsorption of Cu2+on epichlorohydrin-modified magnetic Fe3O4microspheres prepared by one-step solvothermal synthesis[J].Adsorption Science&Technology, 2015, 33 (1) :25-35.
[14]MA J P, YAO Z D, HOU L W, et al.Metal organic frameworks (MOFs) for magnetic solid-phase extraction of pyrazole/pyrrole pesticides in environmental water samples followed by HPLC-DAD determination[J].Talanta, 2016, 161:686-692.
[15]侯丽玮, 马继平, 姜莲华.基于离子液体的磁性富集技术及其在分析化学中的应用进展[J].分析测试学报, 2015, 34 (6) :715-723.
[16]李保强, 贺全志, 罗阳, 等.磁性壳聚糖微球制备及在放射性水污染应用研究进展[J].水处理技术, 2010, 36 (6) :10-13.
[17]芮翠平, 马继平.复合Fe3O4磁性纳米粒子的制备及在环境领域的应用研究进展[J].青岛理工大学学报, 2012, 33 (2) :80-88.
[18]王宗花, 罗国安.碳纳米管在分析化学领域的研究进展[J].分析化学评述与进展, 2003, 31 (8) :1004-1009.
[19]CHEN C L, HU J, SHAO D D, et al.Adsorption behavior of multiwall carbon nanotube/iron oxide magnetic composites for Ni (II) and Sr (II) [J].Journal of Hazardous Materials, 2009, 164:923-928.
[20]WANG Q, LI J X, CHEN C L, et al.Removal of cobalt from aqueous solution by magnetic multiwalled carbon nanotube/iron oxide composites[J].Chemical Engineering Journal, 2011, 174:126-133.
[21]LI B, JIANG Y, HUANG K, et al.Preparation and properties of magnetic Fe3O4-chitosan nanoparticles[J].Journal of Alloys and Compounds, 2008, 466:451-456.
[22]金玉仁, 李冬梅, 张宝川.磁性壳聚糖的制备及其对三价锕系和镧系元素的吸附性能研究[J].离子交换与吸附, 1999, 15 (2) :177-181.
[23]KOJI O, KENJI S, AKHMAD S, et al.Synthesis of chitosan resin possessing aphenylarsonic acid moiety for collection/concentration of uranium and its determination by ICP-AES[J].Analytical and Bioanalytical Chemistry, 2008, 390:1927-1932.
[24]贾亮.磁性羟肟化壳聚糖 (MHKCTS) 的制备及其对U (VI) 、Cr (VI) 的吸附性能及机理研究[D].衡阳:南华大学, 2014.
[25]周利民, 王一平, 黄群武.乙二胺改性壳聚糖磁性微球吸附Hg2+和UO22+[J].现代化工, 2007, 29 (3) :184-188.
[26]CHEN Y W, WANG J L.Removal of radionuclide Sr2+ions from aqueous solution using synthesized magnetic chitosan beads[J].Nuclear Engineering and Design, 2012, 242:445-451.
[27]ZHU Y H, HU J, WANG J L.Removal of Co2+from radioactive wastewater by polyvinyl alcohol (PVA) /chitosan magnetic composite[J].Progress in Nuclear Energy, 2014, 71:172-178.
[28]YIN Y N, WANG J L, YANG X Y, et al.Removal of strontium ions by immobilized saccharomyces cerevisiae in magnetic chitosan microspheres[J].Nuclear Engineering and Technology, 2017, 49 (1) :172-177.
[29]LONG J L, YAGHI O R.The pervasive chemistry of metal-organic frameworks[J].Chemical Society Reviews, 2009, 38:1213-1214.
[30]CYCHOSZ K A, MATZGER A J.Water stability of microporous coordination polymers and the adsorption of pharmaceuticals from water[J].Langmuir, 2010, 26 (22) :17198-17202.
[31]姜宁, 邓志勇, 王公应, 等.金属有机框架材料的制备及在吸附分离CO2中的应用[J].化学进展, 2014, 26 (10) :1645-1654.
[32]MA J P, YAO Z D, HOU L W, et al.Metal organic frameworks (MOFs) for magnetic solid-phase extraction of pyrazole/pyrrole pesticides in environmental water samples followed by HPLC-DAD determination[J].Talanta, 2016, 161:686-692.
[33]吴阁格, 马继平, 侯丽玮, 等.MOFs在分析化学中作为萃取吸附剂的应用[J].青岛理工大学学报, 2017, 38 (2) :72-79.
[34]童敏曼, 赵旭东, 解丽婷, 等.金属-有机骨架材料用于废水处理[J].化学进展, 2012, 24 (9) :1646-1655.
[35]李小娟, 何长发, 黄斌, 等.金属有机骨架材料吸附去除环境污染物的进展[J].化工进展, 2016, 35 (2) :586-594.
[36]王孝娃, 汪勇, 涂彧.金属-有机骨架材料用于放射性核素吸附[J].科学通报, 2014, 59 (34) :3353-3361.
[37]SHAKIBA N, HOSSEIN F.Performance of novel adsorbent prepared by magnetic metal-organic framework (MOF) modified by potassium nickel hexacyanoferrate for removal of Cs+from aqueous solution[J].Separation and Purification Technology, 2017, 175:255-265.
[38]周海.膨润土矿物凝胶的制备及其性能研究[D].合肥:合肥工业大学, 2011.
[39]陈亮.磁性膨润土复合材料吸附重金属离子及放射性核素的研究[D].合肥:合肥工业大学, 2012.
[40]YANG H J, LI H Y, ZHAI J L, et al.Magnetic prussian blue/graphene oxide nanocomposites caged in calcium alginate microbeads for elimination of cesium ions from water and soil[J].Chemical Engineering Journal, 2014, 246:10-19.
[41]SHEHA R R, METWALLY E.Equilibrium isotherm modeling of cesium adsorption onto magnetic materials[J].Journal of Hazardous Materials, 2007, 143:354-361.
[42]YANG H M, JANG S C, HONG S B, et al.Prussian blue-functionalized magnetic nanoclusters for the removal of radioactive cesium from water[J].Journal of Alloys and Compounds, 2016, 657:387-393.
[43]ZHANG H X, ZHAO X, WEI J Y, et al.Sorption behavior of cesium from aqueous solution on magnetic hexacyanoferrate materials[J].Nuclear Engineering and Design, 2014, 275:322-328.
[44]黄芬.18-冠-6/LA/Fe3O4复合磁性纳米离子的制备及对铀 (VI) 、钍 (IV) 吸附性能研究[D].衡阳:南华大学, 2012.
[45]SHEHA R R.Synthesis and characterization of magnetic hexacyanoferrate (II) polymeric nanocomposite for separation of cesium from radioactive waste solutions[J].Journal of Colloid and Interface Science, 2012, 388:21-30.
[46]SONG W C, LIU M C, HU R, et al.Water-soluble polyacrylamide coated-Fe3O4magnetic composites for high-efficient enrichment of U (VI) from radioactive wastewater[J].Chemical Engineering Journal, 2014, 246:268-276.
[47]邱勇.重金属离子和放射性核素在磁性海泡石上的吸附性能研究[D].合肥:合肥工业大学, 2013.
[48]ARMIN D, JAMES A R, JAMES D.Adsorption of cesium, strontium and cobalt ions on magnetite and a magnetite-silica composite[J].Industrial&Engineering Chemistry Research, 2001, 40:1615-1623.
[49]刘峰, 杨枝, 刘和连, 等.Fe3O4纳米磁性微粒对钴和锶的吸附[J].核化学与放射化学, 2008, 30 (1) :56-60.
[50]ABDEL O A M, IBRAHIM H A, ABDELMONEM N, et al.Thermodynamic analysis for the sorptive removal of cesium and strontium ions onto synthesized magnetic nano zeolite[J].Microporous and Mesoporous Materials, 2016, 223:187-195.
[51]ZOHREH M, ANI I.Evaluation of cesium removal from radioactive waste water using maghemite PVA-alginate beads[J].Chemical Engineering Journal, 2015, 262:372-382.
[52]AVINASH A K, JISEON J, LEE D S.Facile synthesis of pectin-stabilized magnetic graphene oxide Prussian blue nanocomposites for selective cesium removal from aqueous solution[J].Bioresource Technology, 2016, 216:391-398.
[53]HUSNAIN S M, UM W Y, CHANG Y Y, et al.Recyclable superparamagnetic adsorbent based on mesoporous carbon for sequestration of radioactive cesium[J].Chemical Engineering Journal, 2017, 308:798-808.
[54]吴连生, 牛智伟, 刘福强, 等.磁性富羧基碳复合材料的制备及对Pb (II) 、Ni (II) 、Hg (II) 和U (VI) 的吸附[J].核化学与放射化学, 2013, 35 (2) :65-73.
[55]李云开.磁性MCM-48复合材料的制备及其对水相中铀酰离子的吸附[D].南京:南京理工大学, 2015.