摘 要: 目的:探讨坍塌反应调节蛋白2(CRMP2)对海马神经元树突野形成的作用.方法:培养大鼠海马神经元,用基因转染的方法检测CRMP2蛋白的作用,免疫荧光显示树突,全细胞膜片钳检测微小兴奋性突触后电流(mEPSCs).结果:过表达CRMP2促进树突的生长以及分支形成,而敲减CRMP2抑制树突的生长和形成新的分支,CRMP2基因促进树突野的形成,促使树突野变得复杂(P<0.05);全细胞膜片钳检测显示:CRMP2促进形成的树突能够表达AMPA受体,而且可以诱导出mEPSCs,而敲减CRMP2抑制树突AMPA受体,以及降低mEPSC的幅度和频率,其改变有统计学差异(P<0.05).结论:CRMP2促进功能性树突形成,并提高树突野的复杂性.
关键词: 坍塌反应调节蛋白; 树突野; 突起生长; 神经元;
Abstract: Objective:To investigate the effect of collapsin response mediator protein 2(CRMP2) on the formation of dendritic field in hippocampal neurons. Methods: Rat hippocampal neurons were cultured and the effect of CRMP2 was detected by gene transfection. Immunofluorescence showed dendrites and the whole cell patch clamp was used to detect miniature excitatory postsynaptic currents(mEPSCs). Results: Overexpression of CRMP2 promoted dendritic outgrowth and branch formation, while knockdown of CRMP2 inhibited dendritic outgrowth and formation of new branches. The results showed that CRMP2 promoted the formation of and complexity of dendritic field(P<0.05). The results detected by the whole cell patch clamp showed that CRMP2-promoted dendrites was able to express AMPA receptors and induce more mEPSCs, while knockdown of CRMP2 inhibited expression of α-amino-3-hydroxyl-5-methyl-4-isoxazole propionic acid(AMPA) receptors in dendrites and decreased amplitude and frequency of mEPSCs with significant differences(P<0.05). Conclusion:CRMP2 promotes the formation of functional dendrites and increases the complexity of dendritic fields.
Keyword: collapsin response mediator proteins; dendritic field; neurite outgrowth; neuron;
坍塌反应调节蛋白(collapsin response mediator proteins, CRMPs)是一类微管结合蛋白,在神经组织中表达丰富,除了崁合于微管侧壁稳定微管促进微管组装之外,还作为细胞内信号分子参与细胞迁移、分化、突起生长、可塑和再生等病理生理过程[1,2].由于微管能极化神经元并维持其基本形态,CRMP2蛋白通过聚合微管促进突起生长的作用受到关注,包括轴突和树突的形成和生长[3,4].树突的轴突化是CRMP2蛋白的一个重要功能,如果在发育阶段切断轴突,其中一个树突则会发育成轴突,但是如果敲减CRMP2基因,轴突和树突的生长则受到抑制,神经元之间无法形成稳定的神经环路[1].对神经再生的研究也显示[5],CRMP2蛋白能够重建损伤的神经纤维,促进功能恢复.目前对CRMP2蛋白与轴突的形成研究较为充分[6],然而对树突的研究较为薄弱,并没有CRMP2蛋白调控树突野形成完整的资料.树突是神经元接受信息的结构,敲减CRMP2基因树突棘形成减少以及诱导突触传递减弱,其原因一部分是由于神经元之间的连接减少,另一个原因是负载突触结构的树突形成受到抑制所导致的.本研究用基因转染的方法明确CRMP2蛋白对原代海马神经元树突野形成的作用,分析树突野的复杂性和功能,以期确定CRMP2蛋白能否促进神经元树突的生长和分支形成,所形成的树突是否具有重建神经元的功能.
1 、材料与方法
1.1 、实验动物
SPF级新生24 h的SD大鼠,购于中山大学中山医学院实验动物中心(动物许可证号为SYXK粤2017-0081).
1.2 、主要试剂
DMEM 培养基、DMEM/F12 培养基、谷氨酰胺、Neurobasal-A 培养基和B27添加剂均为Gibco产品;胎牛血清购自HyClone;胰蛋白酶购自USB;多聚赖氨酸购自BD Biosciences 公司.抗CRMP-2单克隆抗体购自Cell Signaling technology;抗MAP2单克隆抗体购自Sigma公司;免疫印迹用二抗购自ZYMED;免疫荧光用二抗为Life产品.化学发光底物试剂及PVDF膜购自Pierce;封片剂购自EMS;预染蛋白Marker 购自NEB;封闭用驴血清购自Jackson;电生理用试剂均购自Sigma.
1.3 、实验方法
1.3.1、 siRNA序列设计与合成
设计合成并筛选出特异性针对CRMP2的siRNA, 5′-GAUGGGUUGAUCAAGCAA-3′;同时设计了阴性对照(打乱序列的siRNA),均由上海吉玛制药技术有限公司化学合成.
1.3.2 、HEK293 细胞的培养、转染及Western blot检测
传代后的HEK293 细胞用含质量分数为10% 胎牛血清的DMEM 培养基接种,置37 ℃、体积分数为5% CO2培养箱.待细胞达到70%~80% 融合度时,用磷酸钙的方法将siCRMP2及GFP标签载体共转染HEK293细胞.37℃培养箱孵育4 h后,洗去沉淀,换含质量分数为5%胎牛血清的DMEM培养基继续培养,24~48 h 后,用Suspension Buffer收集细胞.取出100 μL细胞裂解液用BCA法进行定量.Western blot 对蛋白表达进行检测.简要过程如下:用SDS-PAGE分离细胞裂解物,电泳转移至PVDF膜.将膜在含有质量分数为5%牛奶和质量分数为0.05%Tween的Tris缓冲液中封闭,4 ℃一抗孵育过夜.洗涤后,用辣根过氧化物酶结合的二抗孵育,ECL显色.
1.3.3、 原代海马神经元培养和转染
新生1 d的SPF级SD大鼠,去除颅骨和大脑皮质,取海马并用解剖液清洗剪成小块,入15 mL离心管,质量分数为0.125%的胰酶37 ℃、体积分数为5% CO2中消化10 min.终止消化,用抛光的玻璃吸管吹打10 次,800 r/min 离心5 min,弃上清,含质量分数为10%胎牛血清DMEM/F12 培养液重悬细胞,400目筛网过滤,调整细胞密度并接种到PDL包被过的载玻片上,24 h后全量换质量分数为2% B27的Neurobasal-A无血清培养液,以后每隔3 d半量换液,之后用磷酸钙法转染.
1.3.4 、免疫荧光染色
神经元转染24~48 h后用质量分数为4%PFA固定,行免疫荧光染色,简要步骤如下:首先用TBST漂洗,之后用含质量分数为3%驴血清的TBS封闭1 h,CRMP2或MAP2(V一抗∶V抗体稀释液=1∶500一抗孵育过夜,标记Fluor555的二抗孵育(V二抗∶V抗体稀释液=1∶1 000);TBST洗脱后,用含Fluoro GelII和DAPI封片剂封片.用LSM710共聚焦显微镜成像,荧光采集通道分别为488 nm和555 nm.之后对神经元的树突进行长度、分支数目进行测量,树突的复杂性用Sholl分析.
1.3.5 、电生理检测
用全细胞膜片钳记录微小兴奋性突触后电流(miniature excitatory post-synaptic current, mEPSC)检测神经元树突的功能.取转染的海马神经元,置入含细胞外液的浴槽.细胞外液含:128 mmol/L NaCl,5 mmol/L KCl,2 mmol/L CaCl2,1 mmol/L MgCl2,15 mmol/L glucose,20 mmol/L HEPES,1 mmol/L TTX和100 μmol/L picrotoxin.选取胞体饱满,边界清楚,突起丰富且稀疏一致的神经元,用充满电极内液的玻璃电极钳制细胞.细胞内液含:147 mmol/L KCl, 5 mmol/L Na2-phosphocreatine, 2 mmol/L EGTA, 10 mmol/L HEPES, 2 mmol/L MgATP and 0.3 mmol/L Na2GTP.用Multiclamp 700 B放大器和Clampex 10.5软件在电压钳位模式下室温记录,钳制电压-70 mV.串联电阻低于30 MΩ,数据采集于10 kHz及1 kHz滤波.用MiniAnalysis软件分析mEPSC的频率和幅度.
1.4、 统计学分析
所有数据用均数±标准误(x?±s)(x?±s)表示,用SPSS 13.0 软件进行统计学分析,组内和组间比较分别用单因素方差分析和t检验,以P<0.05表示数据差异的统计学意义.
2、 结果
2.1、 过表达CRMP2蛋白促进海马神经元树突野的形成
为了明确CRMP2蛋白如何改变神经元树突野的形成,首先用钙磷转染法把CRMP2真核质粒导入培养4 d的海马神经元,之后继续培养48 h,进行免疫荧光化学染色,MAP2标记树突,结果显示,培养6 d后,海马神经元分化出丰富的树突,表达较为丰富的MAP2;在导入CRMP2质粒后,神经元的树突及其分支数明显增多(图1A).对树突长度和分支数目的统计分析显示,导入CRMP2质粒的神经元无论是树突的长度和分支均较对照组细胞明显增多(图1B,C).进一步对树突野的复杂性进行sholl分析,在距离胞体800 μm的范围内,转染CRMP2质粒的神经元的树突交叉点均明显增多,树突野的复杂性增高(图1D).说明过表达CRMP2蛋白通过促进树突的生长以及分支形成而增加树突野的复杂性.
图1 过表达CRMP2增加海马神经元树突野的复杂性
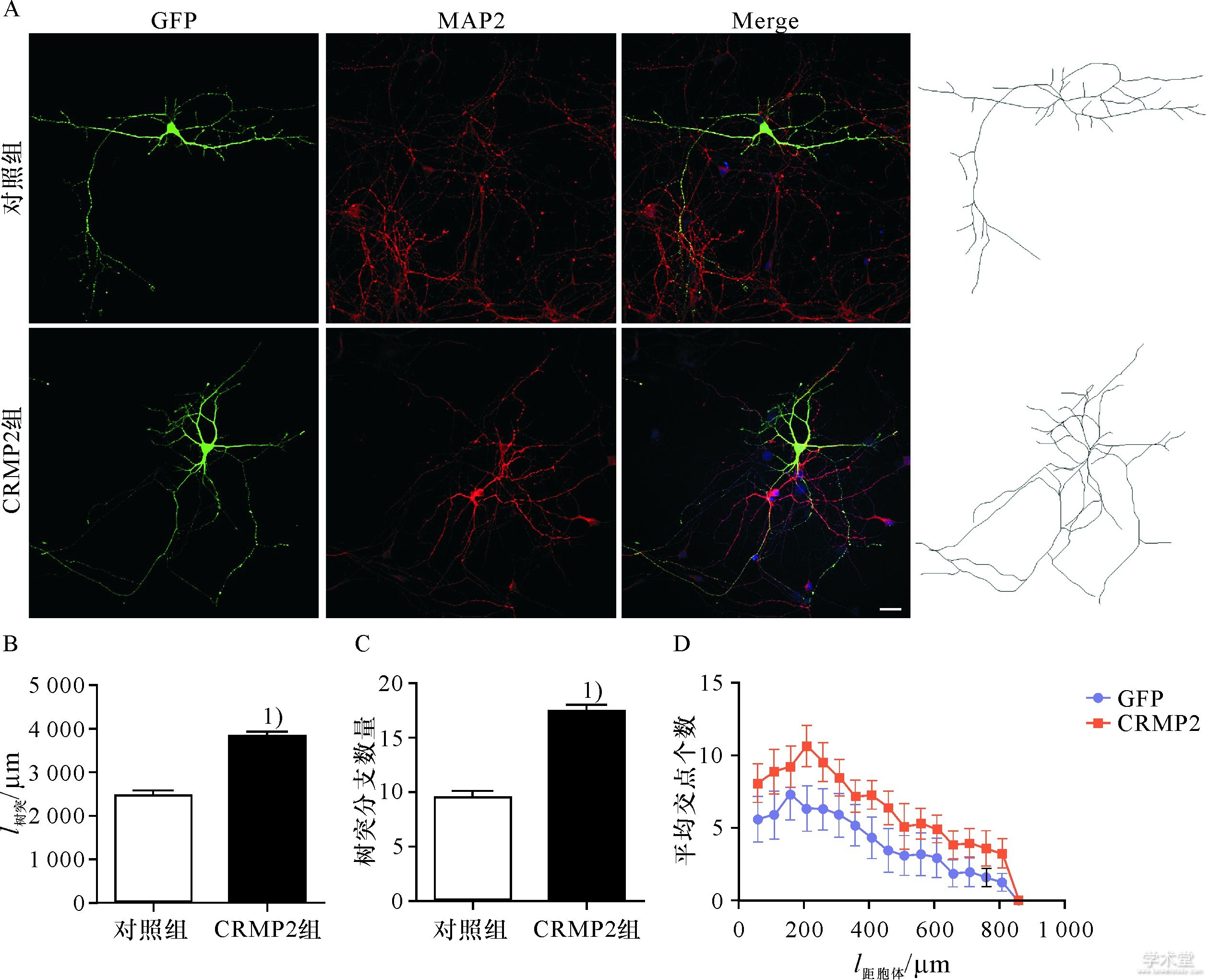
Fig.1 Overexpression of CRMP2 increases the complexity of dendritic field in hippocampal neurons
A.转染4 d的海马神经元,MAP2标记树突;B,C.神经元树突长度及分支的统计分析;D.树突交叉点的Sholl分析.1)P<0.05,标尺:50μm.
A.Hippocampal neurons transfected with CRMP2 for 4 d,MAP-2 antibody immunofluorescence showing dendrite;B.The length of dendrite per neuron;C.The number of branch tips of dendrite per neuron;D.Sholl analysis of dendritic intersections.The data were shown in ±s.1)above data bar indicates P<0.05 vs.control group.Scale bar:50μm.
2.2、 敲减CRMP2基因抑制海马神经元树突野的形成
为了明确敲减CRMP2基因是否能够抑制树突野形成,把设计的siRNA片段转染至HEK293细胞,用Western blot检测对CRMP2蛋白的干扰效果,显示设计的siRNA-CRMP2片段能有效抑制CRMP2蛋白的表达(图2A).进一步转染至神经元,24~48 h 后免疫荧光检测CRMP2蛋白的表达,转染siRNA-CRMP2神经元的CRMP2蛋白相对荧光强度明显低于对照组(图2B,C).证明siRNA-CRMP2有效降低了神经元内源性CRMP2蛋白的表达.
进一步分析敲减CRMP2基因抑制神经元树突野的形成,通过磷酸钙转染方法把siCRMP2导入培养4 d的神经元,继续培养24~48 h后,进行免疫荧光染色,MAP2标记树突,结果显示,敲减CRMP2基因明显抑制神经元树突的生长,而且树突的分支也明显减少(图3A);树突长度的统计学分析显示,敲减CRMP2基因突起的长度以及分支的数目显着减少(图3B,C);对树突及其分支的sholl分析显示,在800 μm半径的范围内,交叉点的数目明显低于对照细胞(图3D).说明敲减CRMP2基因后树突野的形成及其复杂性受到抑制.
图2 si CRMP2抑制蛋白表达的效果
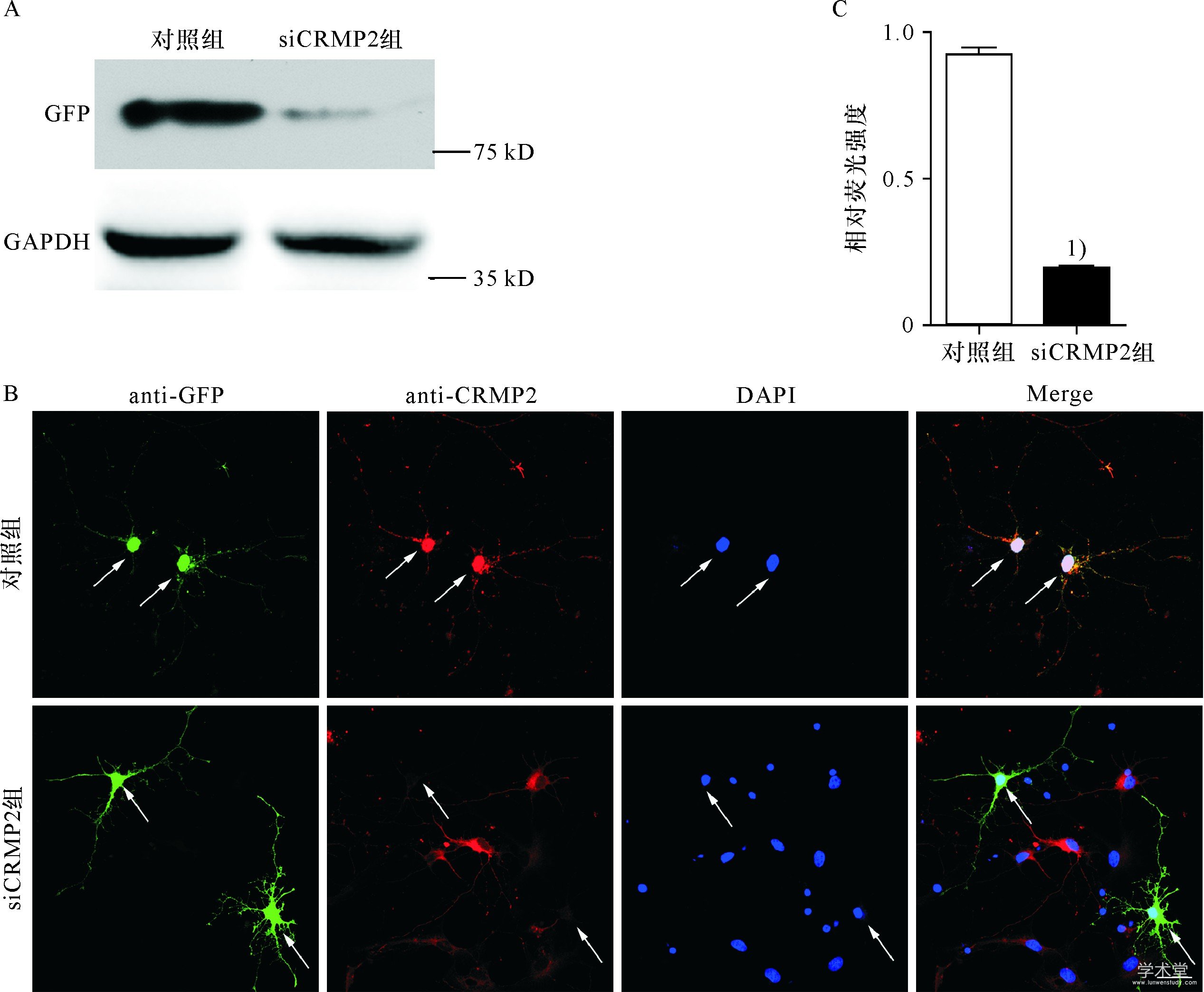
Fig.2 Knockdown of CRMP2 inhibits CRMP2 protein expression
A.si CRMP2抑制293T细胞中CRMP2蛋白表达的Western blot检测;B,C.敲减CRMP2基因后神经元内CRMP2蛋白表达受到抑制,相对荧光强度明显低于阴性对照组;1)P<0.05,标尺:20μm.
A.Western blotting results in 293T cells transfected with si-CRMP2;B,C.Knockdown of CRMP2 gene was achieved in DIV5 hippocampal neurons transfected with si-CRMP2.It caused inhibition of CRMP2 expression and the relative fluorescence intensity was obviously lower than that in control group.1)above data bar indicates P<0.05 compared with control group.Scale bar:20μm.
2.3 、CRMP2促进形成的树突具有接受信息的功能
形成的树突是否具有接受信息的功能取决于能否形成树突棘并募集到AMPA受体[7].为了证明CRMP2促进形成的功能性的树突,用免疫荧光检测树突GluA1亚基表达,用全细胞膜片钳检测能否诱导出mEPSC.免疫荧光染色显示,过表达CRMP2蛋白的神经元培养至8 d,全细胞丰富表达AMPA受体,树突表面可见GluA1免疫阳性染色,可以记录到明显的mEPSC,而敲减CRMP2基因,虽然神经元仍有较丰富的AMPA受体阳性染色,但树突GluA1表达较少(图4A);对GluA1表达的灰度分析显示,过表达CRMP2蛋白神经元的GluA1荧光强度增加,而敲减CRMP2基因后GluA1的荧光强度减弱,有统计学差异(图4B);进一步对树突的功能全细胞膜片钳检测显示,过表达CRMP2蛋白的神经元能够诱导出幅度和频率明显增多的mEPSC,而敲减CRMP2基因后诱导的mEPSC频率和幅度均明显减少(图C,D,E);说明CRMP2蛋白促进形成的树突是具有功能的树突,敲减CRMP2基因不仅抑制树突的形成,而且AMPA受体的表达也受到抑制.
图3 敲减CRMP2基因抑制海马神经元树突野形成
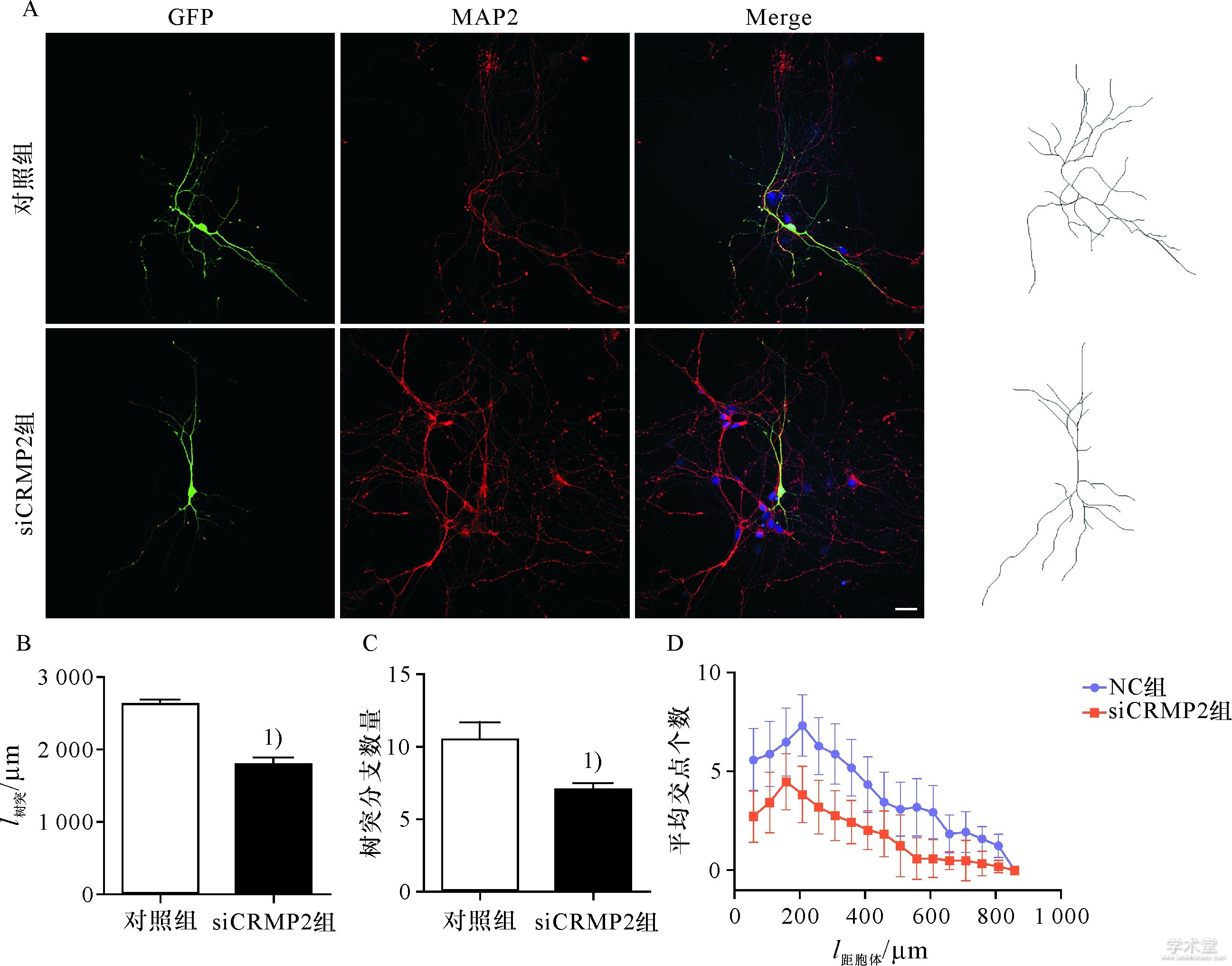
Fig.3 Knockdown of CRMP2 inhibited dendritic field formation in hippocampal neurons
A.转染4 d的海马神经元,MAP2标记树突;B,C.敲减CRMP2基因抑制突起生长和分支形成;D.敲减CRMP2基因抑制树突野复杂性;1)P<0.05,标尺:50μm.
A.Hippocampal neurons transfected with si CRMP2 for 4 d,MAP-2 antibody immunofluorescence showing dendrite;B.The length of dendrite per neuron;C.The number of branch tips of dendrite per neuron;D.Knockout of CRMP2 inhibited dendritic field complexity.1)above data bar indicates P<0.05vs.control group.Scale bar:50μm.
3 、讨论
利用基因转染技术分析CRMP2蛋白是否能调控海马神经元树突野的形成?研究结果显示,CRMP2蛋白促使树突生长、分支增多,能够增加树突野的复杂性;进一步的全细胞膜片钳检测显示,CRMP2蛋白促进树突AMPA受体表达增加,诱导出幅度和频率均增加的mEPSC;敲减CRMP2基因后树突野的复杂性降低,AMPA受体的表达减少,mEPSC的幅度和频率降低;说明CRMP2蛋白不仅参与轴突的生长和分支,对树突的形成也是一样,是树突野形成及其是否具有传递信息功能的关键分子.
神经元的基本特征是具有一个长的轴突和多个树突,轴突把神经元的信息传递给其他细胞,而树突则负责接收外部的信息并加以整合[8].神经元树突野的大小决定着神经元接受信息的范围,由于其表面丰富的树突棘,树突野的复杂性也决定着神经环路是否能有效整合信息.一个神经元树突野的形成经历了确立、维持和修剪3个不同的阶段,涉及的因素众多,最终目标与特定区域、特定神经元及特定的功能相适应[9].神经元自身决定树突野形成的因素很多,主要涉及[10,11]以下方面(1)生长因子:包括生长因子和生长抑制因子,以及由此启动的细胞内信号分子;(2)黏附因子:细胞黏附因子启动细胞之间的接触以及与周围结构的物理接触;(3)相邻的树突:相邻树突的竞争性抑制.虽然本实验并未涉及各种生长粘附因子以及相邻树突之间的相互影响,然而CRMP2蛋白是细胞内与突起生长的关键分子,本实验至少明确了CRMP2蛋白在树突野形成过程中的作用.首先,CRMP2蛋白是一种微管相关蛋白(microtubule-associated protein,MAP),与Tau和MAP等锚定于微管表面发挥稳定微管的作用不同,CRMP2蛋白与微管蛋白结合的同时促进微管的组装,还参与微管对物质的运输[1].树突野的形成伴随着突起长度的增加以及新的分支形成,本研究结果显示CRMP2蛋白促进树突生长,敲减CRMP2基因后树突生长受到抑制,表明CRMP2蛋白正是通过促进微管聚合发挥促进树突生长的作用[12].其次,树突野的形成离不开树突分支的形成,而分支的生长不仅涉及微管的聚合,还存在微管的切割,本研究在分析分支形成的时候,发现CRMP2蛋白与一种微管切割蛋白spastin结合[13],说明分支的形成可能不是CRMP2蛋白单独完成的,还需要微管切割蛋白的帮助.最后,突起生长是一个不断生长和被修剪的修正过程[14],CRMP2蛋白的作用也不例外,虽然本研究实验并未涉及这个问题,但相关资料显示[1,15],CRMP2蛋白的磷酸化修饰是一种重要的调控模式,各种细胞外因子,包括生长因子和抑制因子,通过受体启动细胞内信号通路后,能够激活各种磷酸激酶.CRMP2蛋白的C末端有Rho激酶、CDK5和GSK-3β等磷酸化修饰位点,而CRMP2蛋白磷酸化后与微管脱离,并影响到与其他蛋白的相互作用,无法促进微管聚合[16],可能是树突野调控的主要方式.
图4 CRMP2促进树突Glu A1表达并诱导产生m EPSC
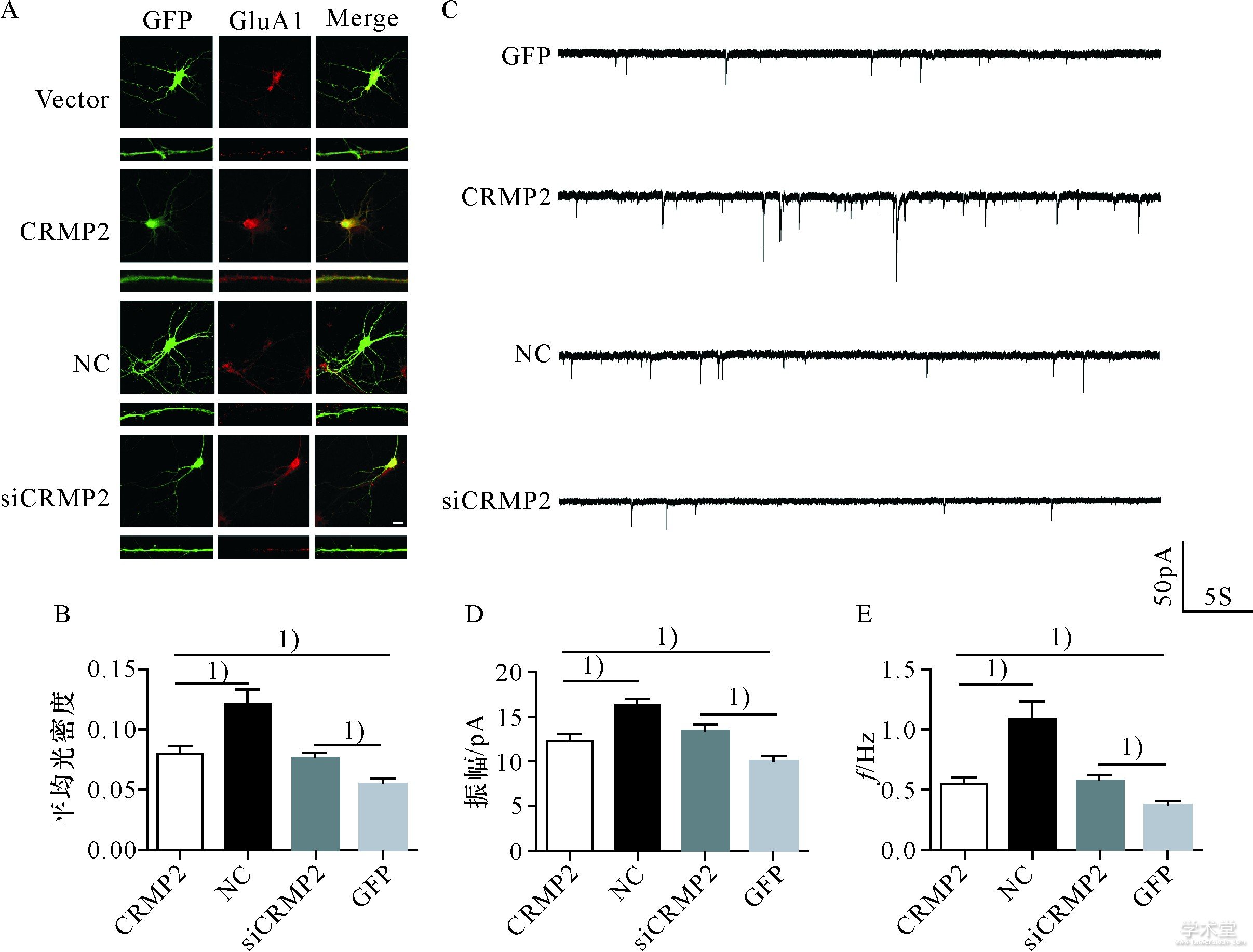
Fig.4 CRMP2 promoted the expression of dendritic Glu A1 and induced the production of m EPSC
A.过表达CRMP2蛋白和敲减CRMP2基因后海马神经元Glu A1的免疫荧光染色;B.过表达CRMP2蛋白后Glu A1的光密度增加,敲减CRMP2基因后光密度减少;C,D,E.过表达CRMP2蛋白促进m EPSC形成,幅度和频率增加,敲减CRMP2基因抑制m EPSC形成,幅度和频率减少;1)P<0.05,标尺:20μm.
A.Immunofluorescence staining of Glu A1 in hippocampal neurons after overexpression and knockdown of CRMP2.B.The optical density of Glu A1increased after overexpression of CRMP2 and decreased after knockdown of CRMP2.C.Representative traces from neurons in neurons transfected with wildtype or siRNA fragments of CRMP2.D.E.m EPSC amplitude and frequency evoked in patched neuron were shown as mean±SEM.1)above horizontal line indicates P<0.05 vs.control group.Scale bar:20μm.
形成的树突是否具有接受和处理信息的功能,主要取决于是否募集到足够的AMPA受体,比如神经元损伤后如果再生的突起是无功能,仍然难以避免被修剪的命运[17],所以形成的突起是否是功能性的突起,对于神经环路的重建至关重要.本研究结果显示,CRMP2蛋白促进形成的树突能够表达AMPA受体,而且可以诱导出mEPSC,说明CRMP2蛋白促进形成的树突野具有接受信息的功能.然而,实验中CRMP2蛋白促进树突AMPA受体表达的现象,提示CRMP2蛋白还具有转运AMPA受体的功能.综上所述,CRMP2蛋白能够促进神经元树突的形成,增加树突野的复杂性,其机制有待进一步探讨.
参考文献
[1] YOSHIMURA T,KAWANO Y,ARIMURA N,et al.GSK-3beta regulates phosphorylation of CRMP-2 and neuronal polarity[J].Cell,2005,120(1):137-149.
[2] IP J P,FU A K,IP N Y.CRMP2:Functional roles in neural development and therapeutic potential in neurological diseases[J].Neuroscientist,2014,20(6):589-598.
[3] SCHMIDT E F,STRITTMATTER S M.The CRMP family of proteins and their role in sema3A signaling[J].2007,600:1-11.DOI:10.1007/978-0-387-70956-7_1.
[4] PONNUSAMY R,LOHKAMP B.Insights into the oligomerization of CRMPs:crystal structure of human collapsin response mediator protein 5[J].J Neurochem,2013,125(6):855-868.
[5] ZHANG Jian-nan,JAN C.Koch.Collapsin response mediator protein-2 plays a major protective role in acute axonal degeneration[J].Neural Regen Res,2017,12(5):692-695.
[6] INAGAKI N,CHIHARA K,ARIMURA N,et al.CRMP-2 induces axons in cultured hippocampal neurons[J].Nat Neurosci,2001,4(8):781-782.
[7] BERRY K P,NEDIVI E.Spine dynamics:Are they all the same?[J].Neuron,2017,96(1):43-55.
[8] ALBRIGHT T D,JESSELL T M,KANDEL E R,et al.Neural science:a century of progress and the mysteries that remain[J].Cell,2000,25(Suppl):S1-S55.
[9] IRWIN S A,IDUPULAPATI M,GILBERT M E,et al.Dendritic spine and dendritic field characteristics of layer V pyramidal neurons in the visual cortex of fragile-X knockout mice[J].Am J Med Genet,2002,111(2):140-146.
[10] PARRISH J Z,EMOTO K,KIM M D,et al.Mechanisms that regulate establishment,maintenance,and remodeling of dendritic fields[J].Annu Rev Neurosci,2007,30:399-423.
[11] LIU J,SANES J R.Cellular and molecular analysis of dendritic morphogenesis in a retinal cell type that senses color contrast and ventral motion[J].J Neurosci,2017,37(50):12247-12262.
[12] FUKATA Y,ITOH T J,KIMURA T,et al.CRMP-2 binds to tubulin heterodimers to promote microtubule assembly[J].Nat Cell Biol,2002,4(8):583-591.
[13] LINDEBOOM J J,NAKAMURA M,HIBBEL A,et al.A mechanism for reorientation of cortical microtubule arrays driven by microtubule severing[J].Science,2013,342(6163):1245533.
[14] FLYNN K C.The cytoskeleton and neurite initiation[J].Bioarchitecture,2013,3(4):86-109.
[15] LIU W,ZHOU X W,LIU S,et al.Calpain-truncated CRMP-3 and - 4 contribute to potassium deprivation-induced apoptosis of cerebellar granule neurons[J].Proteomics,2009,9(14):3712-3728.
[16] CHAE Y C,LEE S,HEO K,et al.Collapsin response mediator protein-2 regulates neurite formation by modulating tubulin GTPase activity[J].Cell Signal,2009,21(12):1818-1826.
[17] HERZMANN S,KRUMKAMP R,RODE S,et al.PAR-1 promotes microtubule breakdown during dendrite pruning in Drosophila[J].EMBO J,2017,36(13):1981-1991.
坍塌反应调节蛋白(collapsin response mediator proteins, CRMPs)是一类微管结合蛋白,在神经组织中表达丰富,除了崁合于微管侧壁稳定微管促进微管组装之外,还作为细胞内信号分子参与细胞迁移、分化、突起生长、可塑和再生等病理生理过程....