
1 脂解酶简介
1.1 脂解酶根据其催化特性分类
1.1.1 非特异性脂解酶(non-specificlipase)。此类脂解酶并不对三酸甘油酯的酯键有选择性,即脂解酶对三个酯键均可以进行反应(如水解、转酯化反应)。
1.1.2 1,3特异性脂解酶(1,3-specificlipase)。此类脂解酶只会对三酸甘油酯上之第1、3位之酯键进行反应,第2位之酯键则否。以水解三酸甘油酯为例:当1,3特定位脂解酶将三酸甘油酯水解成1,2或(2,3)-diglycerides,此时第2位酯键会自发性进行酰基转移(acyl migration)至第1或(3)位,进而再被1,3特异性脂解酶水解。
1.1.3 特定脂肪酸脂解酶(fatty acid specificlipase)。如Geotricbum candidium生产之脂解酶只对特定结构之脂肪酸有活性。此脂解酶只对三酸甘油酯中,第九个碳上有顺式双键的不饱和脂肪酸进行反应。对于饱和脂肪酸(无双键)、第九个碳上为单键则无反应。
1.2 生理及物理之特性
1.2.1 微生物脂解酶通常比植物或动物脂解酶更具稳定性。
1.2.2 嗜热微生物脂解酶在高温与不利的化学环境下较为稳定,极具工业应用之潜力。
1.2.3 由于酵素的专一性,不必要的副产物可以减少。
脂解酶是水解酵素的成员之一,作用于羧酸酯键。
其生理角色是水解三酸甘油酯产生双酸甘油酯、单酸甘油酯、脂肪酸、甘油。除了可水解羧酸酯键,脂解酶亦可在非水相环境下催化酯化反应、内酯化反应、转酯化反应。因此,多元化的催化能力使得脂解酶可以应用于食品、清洁剂、制药、皮革、纺织、化妆品、造纸工业等(Hasan et al.,2006)。
2 Pseudomonas cepacia脂解酶介绍
在醇解反应中探讨不同微生物来源之脂解酶,其中Pseudomonas cepacia脂解酶催化醇解反应并加入油重1~20wt%之水分,反应90h后脂肪酸甲酯含量超过80%.当水含量低时,Candida rugosa及P.fluorescens脂解酶其反应速度显着下降,显示水可避免甲醇使这些酵素失活。另外,P.cepacia脂解酶于醇解反应中醇油莫耳比高达2∶1或3∶1时,仍能达到高甲基酯含量,故P.cepacia脂解酶较其他微生物来源之脂解酶对醇类耐受性较高。
以X-ray结晶法分析P.cepacia脂解酶在无抑制剂下之结晶结构,结构显示脂解酶含有α/β水解酶折迭以及三个具催化活性之残基Ser87、His286、Asp264.此酵素与同源之P.glumae脂解酶及Chromobacterium viscosum脂解酶在结构上有数个共通点,其中包含Ca2+结合位。此脂解酶呈现openconformation,其中包含溶剂可接触之活性位;相较于P.glumae脂解酶,其活性位隐藏于关上之“lid”之下。P.cepacia脂解酶之open conformation显示此酵素可在油水接口活化,活化时应伴随二级结构之调整使“lid”开启,将活化位暴露于外。
3 包覆相脂解酶活性分析
(1)包覆相脂解酶活性测量方法是将810μL的50mMTris HCl buffer,pH8.0(含有0.4% TritonX-100及0.1%arabic gum)、90μL pNPL与100μL包覆相脂解酶溶液混合;(2)将此反应置于hybridization oven中反应温度37℃,50rpm,反应10min;(3)离心5min后抽取上清液,以去离子水稀释10倍后在A410下测量其吸收,再利用pNP标准曲线计算活性。
4 制备包覆相脂解酶
(1)取228μL tetramethoxysilane(TMOS)并加入1272μL 1mM HCl,于室温下反应15min使其水解,最终浓度为1M.由于水解后之TMOS长时间储存会凝结成胶,故每次包覆前均需准备全新之TMOS水解溶液;(2)包覆之反应溶液中包含7.5mL 0.1M KH2PO4(pH7.8,含有0.1NNaOH)、1.5mL 1M TMOS、1.5mL500mg/mL脂解酶与1.5mL去离子水,最后加入3mL 5mMPAA以起始反应;(3)于室温下反应5min后,以离心(×100g,2min)进行固液分离并抽出上清液,接着使用15mL去离子水清洗包覆相脂解酶两次,悬浮于去离子水中,最后将其冷冻干燥备用;(4)包覆效率系以下列公式计算:【1】
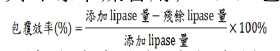
残余脂解酶量系指上清液及清洗液中脂解酶之含量,测定其脂解酶之活性,并由脂解酶浓度-活性标准曲线计算;(5)活性回收系以下列公式计算:【2】

5 包覆相脂解酶之特性
本研究中包覆效率(包覆相酵素质量/添加酵素质量)为93%±9%.未包覆脂解酶其比活性为24±11U/mg,包覆相脂解酶之比活性为15±8U/mg;平均活性回收(包覆相脂解酶比活性/液相脂解酶比活性)为58±5%,以上实验次数均为5次。先前研究中以TMOS将P.cepacia脂解酶包覆;其包覆率为96%,活性回收为51%,与本研究实验结果相近。而McAuliffe等人(2005)以polyethyleneimine(PEI)催化仿生氧化硅形成,用以包覆脂解酶,其活性回收低于10%;明显较本研究为低。
经钼硅酸盐比色法之结果显示,以PAA为形成氧化硅之模板,其氧化硅产量为每100μl反应体积产生0.73±0.09mg(N=3),可换算出酵素承载量为6.7±0.8g脂解酶/g SiO2(N=3)。Pencreac'h与Baratti指出Amano公司之商业化脂解酶,经过Lowry法之检测,脂解酶粉末所含之蛋白质约只占其质量6%(60mg/g powder,6%),水分约占2.3%.相较于Chen等人之研究结果,其氧化硅产量为每100μL反应体积产生0.24mg;其原因可能为本研究采用PAA之浓度为5倍(5mM vs.1mM),先前研究指出氧化硅生成量与催化剂使用浓度有关。
6 转酯化条件
无论有无包含脂解酶或经冷冻干燥处理,其形态并无明显之差异,均为颗粒与颗粒彼此相互融合或团聚而形成之结构。为准确控制含水量,采经冷冻干燥后之包覆相脂解酶进行生质柴油转化。
进行转酯化反应时,许多条件均会影响转酯化之结果,如反应温度、反应时间、醇油莫耳比、甲醇批次添加与否、含水量、酵素添加量等。以上诸多因子中选取有影响性之因子,再以反应曲面法探讨因子间之交互关系并找出最适化之反应条件。
制备生质柴油最常以蔬菜油为原料,但其成本过于高昂又有与民争食之疑虑,因此,选择成本较低廉之废食用油是为经济又环保的做法。
大豆油与废食用油之酸价分别为0.3±0.1、1.4±0.1mg KOH/g(N=3),显示废食用油于使用过程中可能发生氧化及水解,使酸价较大豆油高约5倍。而本研究所使用之大豆油及废食用油之皂化价分为175及195mg KOH/g,两者无明显差距。
7 结语
温度是决定酵素反应速率的因素之一,在一定的温度范围内酵素活性随温度升高而增加。高于此温度范围后,酵素之构型改变造成不可逆之活性丧失;低温时,酵素作用减缓,然其活性可藉由升温再度回复。
Noureddini等人研究固定化P.cepacia脂解酶之最适温度,发现于35℃时有最佳之转酯化活性。以反应曲面法探讨生质柴油之反应温度(40℃、50℃、60℃),结果最佳温度为52.1℃。
本研究以鲤鱼和七水合硫酸锌为实验材料制备多肽锌螯合物,即将鲤鱼肌肉蛋白经过风味蛋白酶和木瓜蛋白酶复合酶解获得多肽,并将此多肽与七水合硫酸锌按一定的条件进行螯合以制备相应的多肽锌螯合物。...
生物酶固定化技术是指选择适当的固定化方法将游离酶固定在便于回收的载体上的一种生物技术。固定化载体、反应介质、制备条件、酶分子性质及有机溶剂等均会影响生物酶的固定化效果。...