摘 要: 目的 建立地拉罗司分散片的微生物限度检查方法。方法 根据中国药典2015年版四部通则1105非无菌产品微生物限度检查中的微生物计数法, 通则1106非无菌产品微生物限度检查中的控制菌检查法和通则1107非无菌药品微生物限度标准进行方法适用性试验。微生物限度检查方法学适用性试验采用常规法筛查了抑菌性, 然后利用稀释和中和原理改进供试液的制备, 即将中和剂3%聚山梨酯-80、0.3%卵磷脂添加至pH 7.0氯化钠-蛋白胨缓冲液作为稀释液, 需氧菌总数计数 (稀释成1∶500) 及霉菌和酵母菌总数计数 (稀释成1∶50) 均采用平皿法, 控制菌检查法采用培养基稀释法 (500 mL TSB) 。结果 5种试验菌的回收试验结果均在0.5~2.0之间。结论 该方法适用于地拉罗司分散片微生物限度的检查。
关键词: 地拉罗司分散片; 微生物限度检查; 方法验证;
Abstract: OBJECTIVE To establish a microbial limit test method of Deferasirox Dispersible tablets. METHODS According to the fourth volume of Chinese Pharmacopoeia (the 2015 Edition) , general rule 1105: microbial counting method for microbial limit test of non-sterile products, general rule 1106: the control bacteria examination method for microbial limit test of non-sterile products, general rule 1107: the test method for suitability of microbiological limits for non sterile drugs. Several methods were tried in the suitability of microbial limit test. When the samples were diluted in pH 7.0 sodium chloride buffer-peptone solution (containing 3% Tween-80, 0.3% lecithin) and were made a 1 in 500 dilution (the total aerobic microbial count) , 1 in 50 (the total yeast and mold count) . A plate method was used in the total aerobic microbial count and the total yeast and mold count. The direct inoculation method was used for the detection of Escherichia coli (500 mL TSB) . RESULTS The recoveries of the five strains were from 0.5 to 2.0. CONCLUSION The method is suitable for the microbial limit examination of Deferasirox Dispersible tablets.
Keyword: Deferasirox Dispersible tablets; microbial limit; verification and evaluation of methodology;
地拉罗司化学名为4-[3, 5-二 (2-羟基苯基) -1, 2, 4-三唑-1-基]苯甲酸, 是由瑞士诺华制药公司研究开发的铁螯合剂产品, 于2005年11月获得FDA的上市批准。
地拉罗司为1日1次的口服铁螯合剂, 用于治疗2岁及以上慢性贫血患者在治疗过程中因输血而导致的铁过载[1,2]。地拉罗司几乎不溶于水, 生物利用度较低, 为了改善其生物利用度及临床疗效, 可制备为地拉罗司分散片。分散片除具备普通片剂稳定性好、易于制备等优点外, 还具有崩解迅速、吸收快、生物利用度高、服用便捷等特性, 特别适合老人、小孩及吞咽困难者服用, 可以很好地改善患者的用药依从性[3]。地拉罗司分散片属于口服制剂, 根据中国药典2015年版四部制剂通则0101片剂要求, 片剂在生产和贮存期间微生物限度应符合要求, 因此, 本实验建立了地拉罗司分散片的微生物限度检查方法。中国药典2015年版四部[4]药品微生物限度检查法与欧美标准接轨[5,6], 其标准规定特别是方法适用性试验的规定与2010年版[7]相比有重大改变。本研究根据中国药典2015年版四部非无菌产品微生物限度检查方法 (通则1105、通则1106) , 建立适合该产品的微生物限度检查方法, 对3批产品进行方法适用性试验, 结果表明, 该方法有效、可行。
1 仪器与材料
1.1 仪器
DL-CJ-2ND超净工作台 (哈东联) ;1300SERIES A2生物安全柜 (Thermo) ;MIR-254型生化培养箱 (SANYO) ;电热脉动真空灭菌器 (山东新华) ;PL2002电子天平 (梅特勒) ;Max Q 6000恒温摇床 (Thermo) 。
1.2 试药
地拉罗司分散片 (国内A厂家, 批号:108/109/903;规格:500 mg) 。
1.3 培养基
胰酪大豆胨液体培养基 (批号:151210) 、胰酪大豆胨琼脂培养基 (TSA, 批号:151210) 、沙氏葡萄糖液体培养基 (批号:151210) 、沙氏葡萄糖琼脂培养基 (SDA, 批号:151210) 、麦康凯液体培养基 (批号:151210) 、麦康凯琼脂培养基 (批号:151210) 均购自北京陆桥技术有限责任公司;pH 7.0氯化钠-蛋白胨缓冲液 (稀释剂, 北京陆桥技术有限责任公司, 批号:141213) ;0.9%氯化钠注射液 (石家庄四药, 批号:1501273201) ;pH 7.0氯化钠-蛋白胨缓冲液 (含3%聚山梨酯80和0.3%大豆卵磷脂, 批号:151217) 。以上培养基的批号均为配制批号。

1.4 菌种
金黄色葡萄球菌Staphylococcus aureus[CMCC (B) 26003]、铜绿假单胞菌Pseudomonas aeruginosa[CMCC (B) 10104]、枯草芽孢杆菌Bacillus subtilis[CMCC (B) 63501]、白色念珠菌Candida albicans[CMCC (F) 98001]、黑曲霉Aspergillus niger[CMCC (F) 98003]、大肠埃希菌Escherichia coli[CMCC (B) 44102]均为第3代, 均购自中国食品药品检定研究院。
2 方法与结果
2.1 菌液制备
按照中国药典2015年版要求, 接种金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、大肠埃希菌的新鲜培养物至10 m L胰酪大豆胨液体培养基中, 33℃培养24 h;接种白色念珠菌的新鲜培养物至10 mL沙氏葡萄糖液体培养基中, 23℃培养24 h。上述培养物用0.9%氯化钠注射液分别稀释制成每1 m L含菌数为50~100 cfu和5 000~10 000 cfu的菌悬液。接种黑曲霉的新鲜培养物至沙氏葡萄糖琼脂斜面培养基上, 23℃培养7 d, 加入含0.05%聚山梨酯80的0.9%氯化钠注射液3 mL, 将孢子洗脱, 过滤菌丝吸出孢子悬液至无菌试管内, 用含0.05%聚山梨酯80的0.9%氯化钠注射液分别稀释制成每1 mL含菌数为30~60 cfu和3 000~6 000 cfu的菌悬液。
2.2 计数方法适用性试验
2.2.1 计数培养基适用性检查
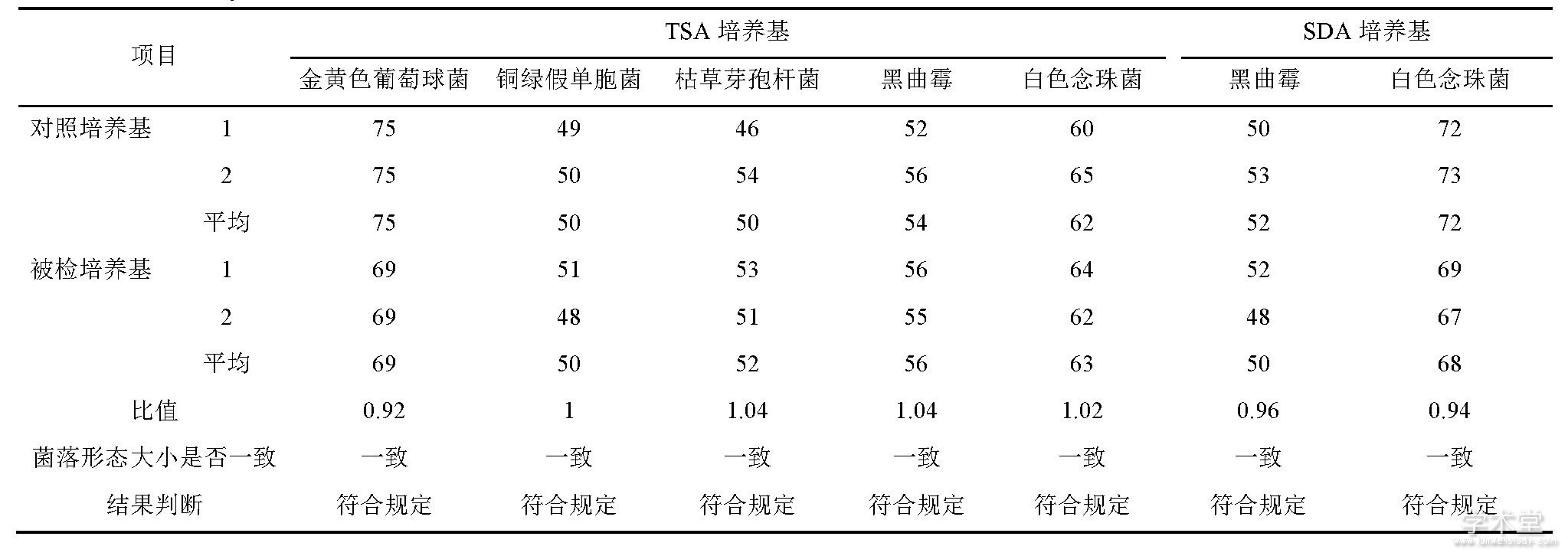
取“2.1”项下制备好的金黄色葡萄球菌、铜绿假单胞菌、枯草芽孢杆菌、白色念珠菌、黑曲霉菌液各1 mL (30~100cfu) , 分别注入无菌平皿中, 立即倾注TSA培养基, 每株试验菌平行制备2个平皿, 混匀, 凝固, 置33℃培养, 其中金黄色葡萄球菌、铜绿假单胞菌和枯草芽孢杆菌培养3 d, 白色念珠菌和黑曲霉培养5 d, 计数;取制备好的白色念珠菌、黑曲霉菌液各1 m L (30~100 cfu) , 分别注入无菌平皿中, 立即倾注SDA培养基, 每株试验菌平行制备2个平皿, 混匀, 凝固, 置23℃培养5 d, 计数;同时, 用相应的对照培养基替代被检培养基进行上述试验。若被检培养基上的菌落平均数与对照培养基上的菌落平均数的比值在0.5~2范围内, 且菌落形态大小与对照培养基的菌落一致, 判该培养基的适用性检查符合规定。测定结果见表1。
表1 培养基适用性检查结果Tab.1 Suitability methods for microbial enumeration tests-culture media
2.2.2 供试液制备
取本品10 g, 加pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL, 振摇至供试品分散均匀, 制成1∶10的供试液, 即为供试液A。取本品10 g, 加含3%聚山梨酯80和0.3%大豆卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液至100 mL, 振摇至供试品分散均匀, 制成1∶10的供试液。取1∶10的供试液20 mL, 加含3%聚山梨酯80和0.3%大豆卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液80 mL, 即为1∶50的供试液, 取1∶50的供试液10 mL, 加含3%聚山梨酯80和0.3%大豆卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液90 mL, 即为1∶500的供试液。
2.2.3 平皿法 (倾注法)
2.2.3. 1 常规法
采用常规平皿法筛查供试品有无抑制微生物生长的作用和抑制的微生物种类。
菌液对照组:取pH 7.0无菌氯化钠-蛋白胨缓冲液10 mL, 加入制备好的试验菌液0.1 mL (细菌、酵母菌500~1 000 cfu, 霉菌300~600 cfu) , 混匀, 使每1 mL稀释液中含菌量为30~100 cfu。分别取此菌液1 mL注皿, 测定其每毫升的活菌数。
试验组:取供试液A 10 m L和制备好的试验菌液0.1 mL, 混匀, 取1 mL注皿, 测定需氧菌总数。另取供试液A 10 mL和上述制备好的真菌菌液0.1 mL, 混匀, 取1 mL注皿, 测定霉菌和酵母菌总数。
供试品对照组:取“2.2.2”项下1∶10的供试液10 mL, 加入稀释剂0.1 mL, 混匀, 取1 mL注皿, 在相应的条件下培养, 测定供试品本底的需氧菌总数、霉菌和酵母菌总数。测定结果见表2。
试验组菌落数减去供试品对照组的数值与菌液对照组菌数的比值应在0.5~2.0内, 由表2可以看出, 采用上述方法进行本品的微生物计数, 金黄色葡萄球菌、枯草芽孢杆菌和白色念珠菌的计数结果不符合中国药典2015年版四部通则1105的要求, 说明该品种对微生物有抑制作用。
2.2.3. 2 稀释法和中和法联用
中国药典2015年版规定消除供试品抑菌性的主要方法包括稀释法、中和法、薄膜过滤法以及上述方法的联用。为了便于操作, 本试验仅改进了供试液的制备, 选择了稀释法和中和法联用, 即将中和剂聚山梨酯80和大豆卵磷脂添加到稀释液中, 结合供试品的微生物限度标准, 将供试品稀释为1∶50和1∶500。
试验组:取1∶500的供试液10 mL和制备好的试验菌液0.1 mL, 混匀, 取1 mL注皿, 测定需氧菌总数。另取1∶50供试液10 mL和上述制备好的真菌菌液0.1 mL, 混匀, 取1 mL注皿, 测定霉菌和酵母菌总数。
供试品对照组:取“2.2.2”项下1∶500和1∶50的供试液10 m L, 加入稀释剂0.1 mL, 混匀, 取1 mL注皿, 在相应的条件下培养, 测定供试品本底的需氧菌总数、霉菌和酵母菌总数。测定结果见表3。
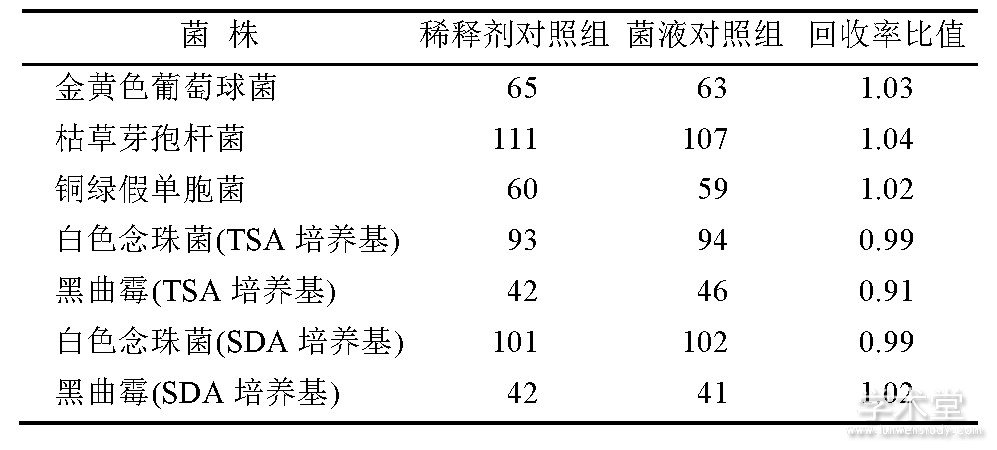
稀释剂对照组:取含3%聚山梨酯80和0.3%大豆卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液10 mL, 加入制备好的试验菌液0.1 m L (细菌、酵母菌500~1 000 cfu, 霉菌300~600 cfu) , 混匀, 使每1 mL稀释液中含菌量30~100 cfu。分别取此菌液1 mL注皿, 测定其每毫升的活菌数。测定结果见表4。
表2 菌落总数微生物方法适用性试验结果 (常规法) Tab.2 Suitability methods for microbial enumeration tests (general methods)
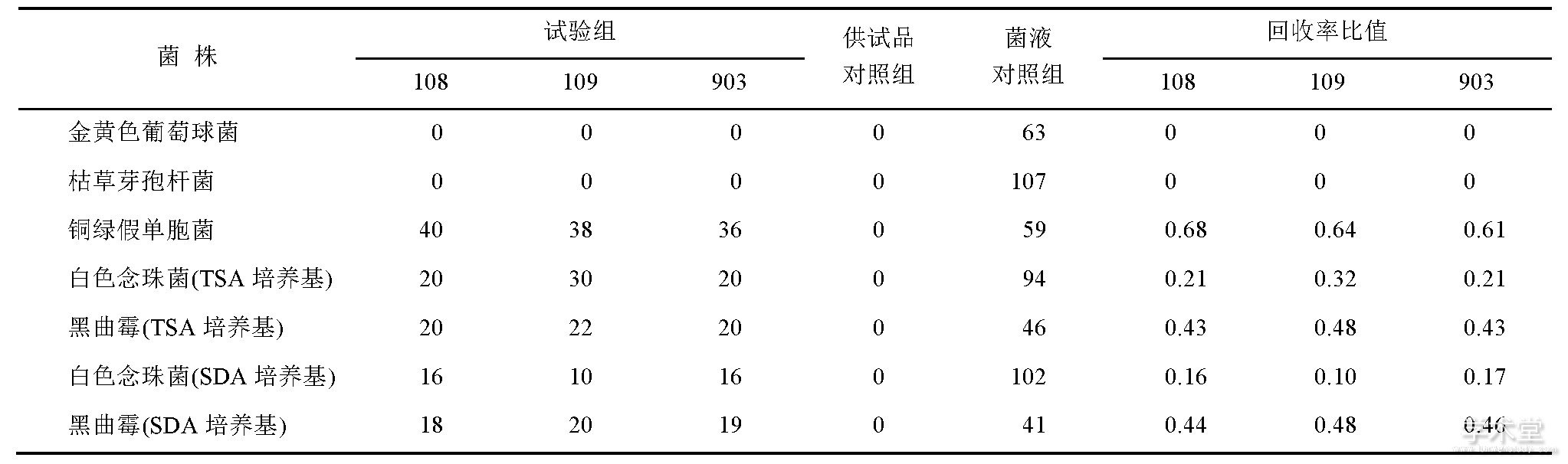
表3 菌落总数微生物方法适用性试验结果 (稀释法和中和法联用) Tab.3 Suitability methods for microbial enumeration tests (a combination of dilute method and neutralizing method)
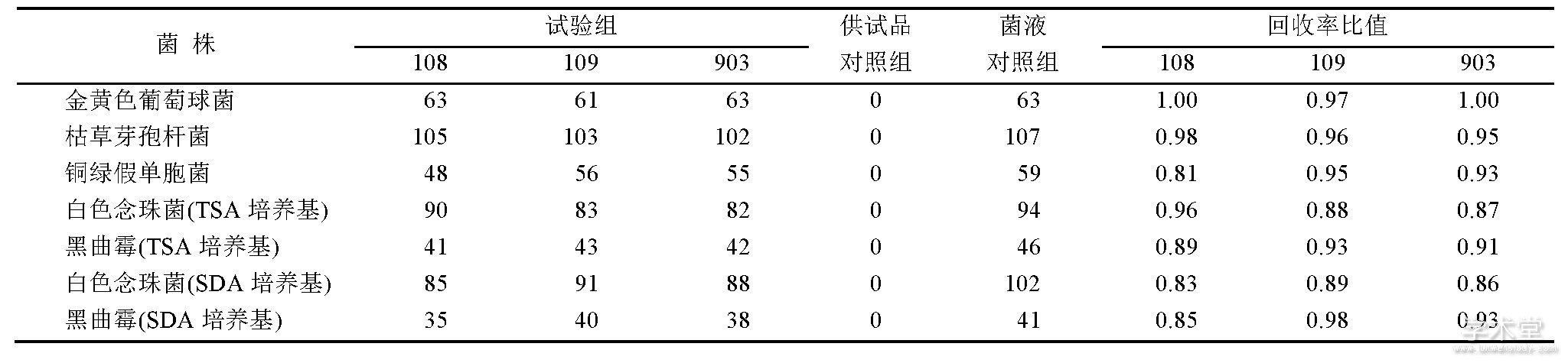
表4 稀释剂的有效性和对微生物毒性试验结果Tab.4 Efficacy and toxicity for microorganisms of neutralizing agents
2.3 控制菌检查方法适用性试验
2.3.1 控制菌检查用培养基适用性检查
麦康凯肉汤促生长能力和抑制能力检查:接种≤100 cfu的大肠埃希菌于被检培养基和对照培养基中, 在42℃培养24 h, 结果见表5。接种≥100 cfu的金黄色葡萄球菌于被检培养基和对照培养基中, 在33℃培养24 h。
麦康凯琼脂促生长能力和指示特性检查:用涂布法分别接种≤100 cfu的大肠埃希菌于被检培养基和对照培养基中, 在33℃培养24 h。
2.3.2 大肠埃希菌检查
供试品组:取1∶50供试液50 mL, 置胰酪大豆胨液体培养基500 mL中, 33℃培养24 h。
阴性对照组:取稀释液50 mL, 置胰酪大豆胨液体培养基500 mL中, 33℃培养24 h。
阳性对照组:取1∶50供试液50 mL, 置胰酪大豆胨液体培养基500 mL中, 加入≤100 cfu的大肠埃希菌, 33℃培养24 h。
分别取上述预培养物1 mL, 加至麦康凯肉汤100 mL中, 42℃培养24 h后, 再分别划线于麦康凯琼脂平板上, 33℃培养24 h, 观察结果见表6。
表5 控制菌检查用培养基适用性检查结果Tab.5 Suitability method for the control bacteria
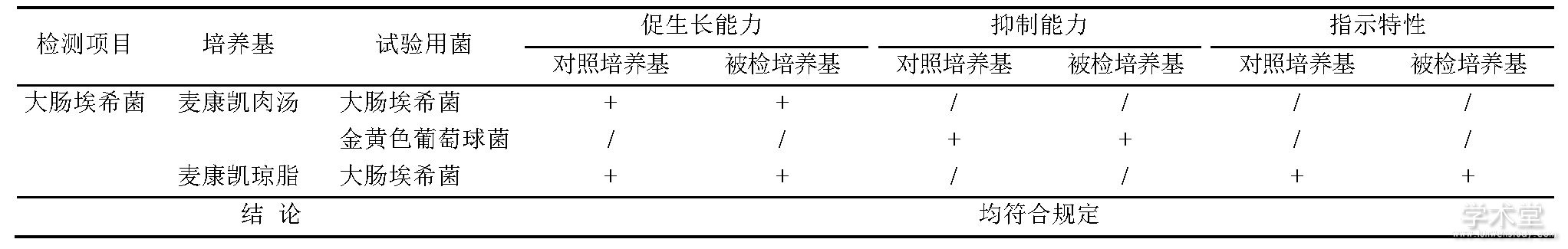
注:表中“+”表示有能力, “-”表示没有能力, “/”表示不要求做。Note:“+”means growing, “-”means not growing, and“/”means not required.
表6 大肠埃希菌微生物方法适用性试验结果Tab.6 Suitability method for the control bacteria Escherichia coli

注:1) 取1︰10供试液10 mL, 置胰酪大豆胨液体培养基100 mL中, 常规方法检测结果;2) 取1︰50供试液50 mL, 置胰酪大豆胨液体培养基500 mL中, 培养基稀释法检测结果。Note:1) The results of 10 mL 1︰10 test solution was placed in 100 mL Soybean-Casein Digest Broth;2) the results of 50 mL 1︰50 test solution was placed in 500 mL Soybean-Casein Digest Broth.
3 讨论
微生物限度检查方法学适用性试验时采取常规平皿法, 发现该药品对微生物有较强的抑制作用, 按照中国药典2015年版的要求尝试了几种方法消除抑菌性, 结合固体口服制剂的限度标准, 如果仅采用稀释法, 抑菌性不能消除, 因此本实验结合使用了中和法。
根据文献报道, 地拉罗司别称4-[3, 5-二 (2-羟基苯基) -1, 2, 4-三唑-1-基]苯甲酸, 由于化学结构的特性, 决定其具有抑菌性。由于苯甲酸本身主要用于抗真菌及消毒防腐, 在进行计数方法适用性试验时, 采用常规方法和常规的稀释剂 (pH 7.0氯化钠-蛋白胨缓冲液) 无法去除抑菌作用, 因此, 考虑使用稀释法和中和剂 (3%聚山梨酯80和0.3%大豆卵磷脂的pH 7.0无菌氯化钠-蛋白胨缓冲液) 联用的方法进行计数方法适用性试验[8], 结果各试验菌株回收率比值达到药典要求的0.5~2.0之间。
中国药典2010年版细菌、霉菌和酵母菌总数计数方法验证, 试验组采用将供试液和菌液同时加在培养基中, 然后倾注培养基, 而2015年版药典是将一定浓度的菌液加入到供试液中混匀, 再取一定量的混合液注入平皿中, 操作上更加接近药物受微生物污染的真实状态, 然后通过测定各试验菌株的回收率比值考察所采用的方法是否能够消除药物对微生物的影响, 使得药物中的微生物能够真实地显现出来。
中国药典2015年版参考美国药典对微生物限度检查方法进行了国际协调, 将细菌计数、霉菌和酵母菌计数修改为需氧菌总数、霉菌和酵母菌总数, 计数用培养基相应的修订为TSA和SDA, 与原来的营养琼脂相比, TSA既可以检测细菌也可检测霉菌和酵母菌, 检测更加科学;与原来的玫瑰红钠琼脂相比, SDA检测更加灵敏。此外, 细菌在TSA上更易于计数, 菌落生长状况优于营养琼脂[9]。
考虑到平皿法比薄膜过滤法操作方便、简捷, 因此本试验菌落计数方法采用稀释法和中和法联用, 控制菌检查采用稀释的方法进行。本研究可为不同来源的地拉罗司类产品微生物限度检查提供参考。
参考文献:
[1] MCINTYRE J.A, CASTANER J, MEALY N E.Deferasirox[J].Drugs Future, 2004, 29 (4) :331-335.
[2] FDA批准诺华公司突破性铁螯合剂产品deferasirox上市[J].世界临床药物, 2006, 27 (1) :2.
[3] LIU D, CHEN N F, CHEN N D, et al.Formulation optimization of Deferasirox Dispersible tablets[J].China Pharm (中国药房) , 2013, 24 (45)
[4] 中国药典.四部[S].2015:140-151.
[5] USP 38[S].2015:71-80.
[6] EP 8.0[S].2014:166-181.
[7] 中国药典.二部[S].2010:附录ⅪJ:107-116.
[8] ZHANG G H, YU L.Neutralization of antibacterial activity of drugs in microbial limit test by polysorbate 80 and lecithin[J].Chin J Pharm Anal (药物分析杂志) , 2008, 28 (7) :1127-1130.
[9]金菀尔, 俞年生.菌落计数时常见的几个难题[J].浙江预防医学, 2000, 12 (4) :63.