摘 要: 目的 探讨硬脊膜扩大成形术对急性脊髓损伤大鼠的疗效。方法选取成年SD大鼠42只,按随机数表法随机分为脊髓损伤组(对照组)、硬脊膜切开组和硬脊膜扩大成形组,每组各12只,剩余6只用于制备硬脊膜,术后采用BBB评分评估大鼠后肢运动功能情况,苏木精-伊红(HE)染色、劳克坚牢蓝(LFB)染色和免疫组织化学染色分别用于评估脊髓损伤空洞体积、白质剩余量及胶质纤维酸性蛋白(GFAP)表达情况。结果术后第7天和21天,硬脊膜扩大成形术组大鼠BBB评分较脊髓损伤组显着增高,差异有统计学意义(P<0.05),术后第14天和28天,硬脊膜扩大成形术组大鼠BBB评分较硬脊膜切开组显着增高,差异有统计学意义(P<0.05);硬脊膜扩大成形组大鼠脊髓损伤空洞体积较脊髓损伤组减小,差异有统计学意义(P<0.05),硬脊膜扩大成形组脊髓白质积分光密度(IOD)值高于脊髓损伤组和硬脊膜切开组,结果具有统计学意义(P<0.01),硬脊膜扩大成形组GFAP阳性(+)细胞计数较另外两组降低,差异有统计学意义(P<0.05)。结论硬脊膜扩大成形术能够促进脊髓损伤大鼠的运动功能恢复,减少脊髓空洞体积、抑制脱髓鞘变性和减轻胶质瘢痕的形成。
关键词: 脊髓损伤; 硬脊膜切开术; 硬脊膜扩大成形术; 减压术;
Abstract: Objective To explore the effect of expansive duraplasty on spinal cord injury in rat model. Methods The 42 adult SD rats were randomly pided into contusion injury group (control group), durotomy group and expansive duraplasty group, each group included 12 rats and the remaining 6 rats were used to create dural allograft. The function of the hind limbs of the animals was evaluated by BBB score. Hematoxylin-eosin (HE) staining was employed for lesion volume measurements, Luxol Fast Blue (LFB) staining were used for white matter sparing and Immunohistochemistry (IHC) analysis was performed to detect the glial fibrillary acidic protein (GFAP) expression. Results The BBB scores of rats in expansive duraplasty group were higher in comparison with contusion injury group on day 7 and 21 after surgery, the differences were statistically significant (P<0.05), the BBB scores of rats in expansive duraplasty group were higher in comparison with durotomy group on day 14 and 28 after surgery, the differences were statistically significant (P<0.05); lesion volume measurements showed a decrease in expansive duraplasty group relative to contusion injury group, and the differences were statistically significant (P<0.05), analysis of Integrated Optical Density (IOD) values showed that white matter sparing was higher in expansive duraplasty group compared with contusion injury group and durotomy group, and the differences were statistically significant (P<0.01), the average number of GFAP positive (+) cells in expansive duraplasty group was reduced when compared with the other two groups, and the differences were statistically significant (P<0.05). Conclusion Our findings suggest that expansive duraplasty following spinal cord injury may improve motor functions of the rats, reduce lesion volume, inhibit demyelination and reduce connective tissue scar formation
Keyword: spinal cord injury; durotomy; expansive duraplasty; decompression;
急性脊髓损伤(acute spinal cord injury,ASCI)是一种由于交通事故、高空坠落、运动损伤等原因所致脊髓受压,在脊髓损伤平面以下出现感觉、运动功能障碍、膀胱直肠括约肌功能丧失以及肌张力异常等相应临床症状[1,2]。根据损伤机制不同,脊髓损伤可分为原发性脊髓损伤和继发性脊髓损伤[3,4]。原发性脊髓损伤主要由机械性损伤导致,继发性脊髓损伤是指脊髓损伤后出现广泛性水肿,由于受到骨性结构的限制以及硬脊膜的压迫,脊髓内水肿加重,导致脊髓微循环障碍、血栓形成、血管痉挛和组织缺氧,引起脊髓缺血,出血以及坏死[5,6]。因此,如何减轻继发性脊髓损伤的程度是治疗的关键。
目前,临床上常采用硬膜外减压的手术方式治疗急性脊髓损伤[7,8]。但是,由于硬膜为坚韧无弹性的组织,在硬膜外减压后,硬膜组织仍会对肿胀的脊髓产生压迫,从而导致脊髓出现缺血、坏死等继发性损伤[9]。以往研究发现,由于硬脊膜切开术破坏了硬脊膜的完整性,因此不利于脊髓损伤后神经功能的恢复[10,11]。硬脊膜扩大成形术通过将硬脊膜补片覆盖在脊髓损伤部位,一方面能够为肿胀脊髓提供膨出的空间,另一方面维持了硬脊膜的完整性,因而更加有利于脊髓损伤后神经功能的恢复。因此,本研究通过建立脊髓损伤模型,对脊髓损伤的大鼠进行硬脊膜扩大成形术,观察硬脊膜扩大成形术对大鼠急性脊髓损伤的疗效,初步探讨硬脊膜扩大成形术治疗脊髓损伤的机制。
1、材料与方法
1.1、实验动物
成年SD大鼠42只,雄性,8-12周龄,体重280-300g。检验合格证编号NO.43004700061116,生产许可证号:SCXK(鄂)2019-004。动物购进后先行适应性饲养,为期1周,保持环境安静整洁,通风良好,温度22-25℃。所有动物实验均经过武汉大学人民医院动物伦理学委员会的同意和批准,动物福利审查编号第2019027号。
1.2、实验设备及仪器
瑞沃德脊髓损伤仪(瑞沃德生命科技有限公司,型号:68097),轮转切片机(上海涵飞科技公司,型号:KD-2268),HE和LFB染色试剂盒(武汉赛维尔科技公司,货号:G1005,G1103),兔源GFAP一抗(浓度1:800,武汉赛维尔科技公司,货号:GB11096),羊抗兔二抗(浓度1:300,武汉赛维尔科技公司,货号:GB12096)
1.3、实验方法
1.3.1、实验分组及硬脊膜制备
选取成年SD大鼠42只,按随机数表法随机分为脊髓损伤组(对照组)、硬脊膜切开组和硬脊膜扩大成形组,每组各12只,剩余6只用于制备硬脊膜。6只健康成年大鼠行腹腔注射10%水合氯醛溶液(350 mg/kg)进行麻醉,麻醉处死后,从大鼠脊髓组织表面剥离硬脊膜,并将硬脊膜修剪成约为1.2*1.2 cm2大小。将该新鲜硬脊膜膜置于培养皿中,室温储存于Hanks平衡盐溶液中,保持适当的表面取向。
1.3.2、脊髓损伤模型及手术过程
所有大鼠均采用10%水合氯醛溶液(350 mg/kg)腹腔注射麻醉,麻醉成功后将大鼠以俯卧位固定于手术台上,胸背部脱毛,酒精消毒,常规消毒铺巾,以T10棘突为中心,沿脊柱方向作后正中切口,长度约3.0cm。逐层切开皮肤和皮下组织,钝性分离椎旁肌肉并充分止血,再次确定并暴露T9~T11棘突,用椎板咬骨钳咬除T9下椎板及T10全部椎板,暴露硬脊膜。本研究采用Allen法[12]建立脊髓损伤模型。将大鼠固定在瑞沃德脊髓损伤仪底座上,以T10脊髓背侧血管为中心点,将套管下端垫片与中心点紧密贴附,重量为60g的砝码自30cm高处顺着套管垂直下落,形成全脊髓损伤模型。造模成功的标准:大鼠双下肢出现不同程度抽搐,尾巴开始甩动,随后出现迟缓性瘫痪。根据分组,脊髓损伤组在脊髓损伤造模成功后,逐层缝合肌肉筋膜及皮肤;硬脊膜切开组在脊髓损伤造模成功后,逐层缝合肌肉筋膜及皮肤并在饲养笼恢复6h,随后大鼠再次麻醉成功后,充分暴露损伤部位,剪开脊髓损伤部位硬膜(约1.0cm),暴露脊髓,并清除硬膜内残留的出血和血凝块,硬膜不缝合,彻底止血后逐层缝合肌肉筋膜及皮肤;硬脊膜扩大成形组重复硬脊膜切开组之前的实验步骤,与之不同的是,前者在硬膜切开后,将同种异体硬脊膜以正确的表面取向覆盖在硬脊膜切除部位的边缘,用7-0带线缝合针仔细缝合,确保移植物和宿主硬脊膜之间紧密相连,彻底止血后逐层缝合肌肉筋膜及皮肤。术后给予腹腔注射青霉素钾20000 IU以预防伤口及尿路感染,每天1次,持续3天。大鼠定时进行人工膀胱区按摩排尿,每日3次,直至大鼠可自主排尿即止。保持笼内卫生整洁,勤换垫料,保持干燥。
1.4、观察指标
大鼠后肢运动功能评分完成后,以10%水合氯醛溶液(350 mg/kg)腹腔注射麻醉,麻醉成功后处死大鼠,再次暴露脊髓损伤部位,剪断神经根,取出脊髓损伤处及周边正常的组织,多聚甲醛常温固定24h,经石蜡包埋后切片(约4um),然后进行各类组织病理染色。
1.4.1、后肢运动功能评分
采用Basso-Beattie-Bresnahan(BBB)评分对大鼠后肢运动功能进行评价[13]。BBB评分是指将大鼠放入透明玻璃箱中,轻敲箱壁,观察大鼠臀、膝、踝关节行走,躯干运动及其协调情况。所有大鼠术前3天进行适应性训练,依次记录大鼠术后1,3,7,14,21,28天的评分。数据记录由两名对实验分组未知的人员共同完成。
1.4.2、脊髓组织苏木精-伊红(
hematoxylin-eosin, HE)染色 切片二甲苯脱蜡后水化,根据苏木精-伊红染色试剂盒说明书进行染色,脱水透明后封片。用显微镜对HE切片进行连续拍照,描绘出脊髓损伤区域边界,利用Imagej软件进行三维重建,计算脊髓损伤空洞体积。
1.4.3、脊髓组织劳克坚牢蓝(
Luxol Fast Blue, LFB)染色 切片脱蜡后水化,0.1% LFB溶液密封浸染8-16h,酒精分色直至清晰显示白质、灰质界限为止,焦油紫溶液复染后,脱色透明封片。以脊髓损伤为中点,计算4mm(头尾两端各2mm)长度的脊髓LFB染色的积分光密度(integrated optical density, IOD)值,利用Ipp6.0软件计算髓鞘的IOD值。
1.4.4、脊髓组织胶质纤维酸性蛋白
glial fibrillary acidic protein, GFAP)染色 切片脱蜡后入水,采用柠檬酸抗原修复液高压修复抗原,3% H2O2封闭内源性过氧化物酶,血清封闭后滴加一抗,4℃冰箱过夜,滴加二抗,37℃孵育40分钟,滴加辣根过氧化物酶标记酶卵白素,加入DAB显色,苏木紫复染,酒精分色后自来水冲洗10分钟,梯度酒精脱水后透明封片。GFAP阳性(+)细胞计数采用显微摄像系统进行计算,每张切片选取4个不同的视野(放大倍数400倍)进行计数,计算每个视野GFAP+细胞数量后取均值。
1.5、统计学方法
采用SPSS 13.0对数据进行统计学分析,计量资料以均数±标准差(±s)表示。多组间比较采用单因素方差分析(ANOVA),组间多重比较采用LSD统计方法,重复测量资料采用重复测量的方法分析。P<0.05有统计学意义。
2、结果
2.1、动物一般情况
所有动物均造模成功,本次实验共有3只大鼠死亡,其中脊髓损伤组、硬脊膜切开组和硬脊膜扩大成形组各有1只,死亡时间主要在脊髓损伤后的3天内,死亡原因为尿路感染、伤口失血性休克和拒绝进食,每组死亡大鼠均予以补充。
2.2、后肢运动功能恢复情况
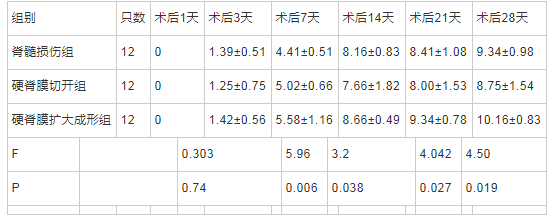
整体分析发现,组间比较、时间点比较及交互作用差异均有统计学意义(F时间×组间=4.38, P时间×组间<0.05),提示三组大鼠BBB评分在不同时间点存在显着差异。进一步两两比较,组内比较:硬脊膜扩大成形组大鼠的BBB评分随着时间的进展,呈上升趋势,脊髓损伤组和硬脊膜切开组大鼠的BBB评分随着时间的进展,上升趋势逐渐平缓;组间比较:术后第7天和21天,硬脊膜扩大成形术组大鼠BBB评分较脊髓损伤组显着增高,差异有统计学意义(P<0.05),术后第14天和28天,硬脊膜扩大成形术组大鼠BBB评分较硬脊膜切开组显着增高,差异有统计学意义(P<0.05)。硬脊膜切开组大鼠BBB评分虽然较脊髓损伤组下降,但在各时间点差异无统计学意义(P>0.05)。见表1。
表1 术后不同时间点三组大鼠BBB评分
2.3、脊髓HE染色结果
HE染色用于评估大鼠脊髓空洞体积。三组均有白质、灰质结构的破坏及空洞形成,脊髓损伤组结构更为疏松。脊髓损伤组、硬脊膜切开组和硬脊膜扩大成形组的脊髓损伤空洞体积分别为(39.71±4.08)mm3,(38.05±3.81)mm3,(36.15±4.22)mm3,差异有统计学意义(F=5.288, P=0.018)。硬脊膜扩大成形组脊髓损伤空洞体积低于脊髓损伤组,差异有统计学意义(t=2.14,P=0.04)。硬脊膜扩大成形组与硬脊膜切开组相比,差异无统计学意义(t=1.14,P=0.262)。见图1,2。
图1 脊髓组织HE染色(×50)
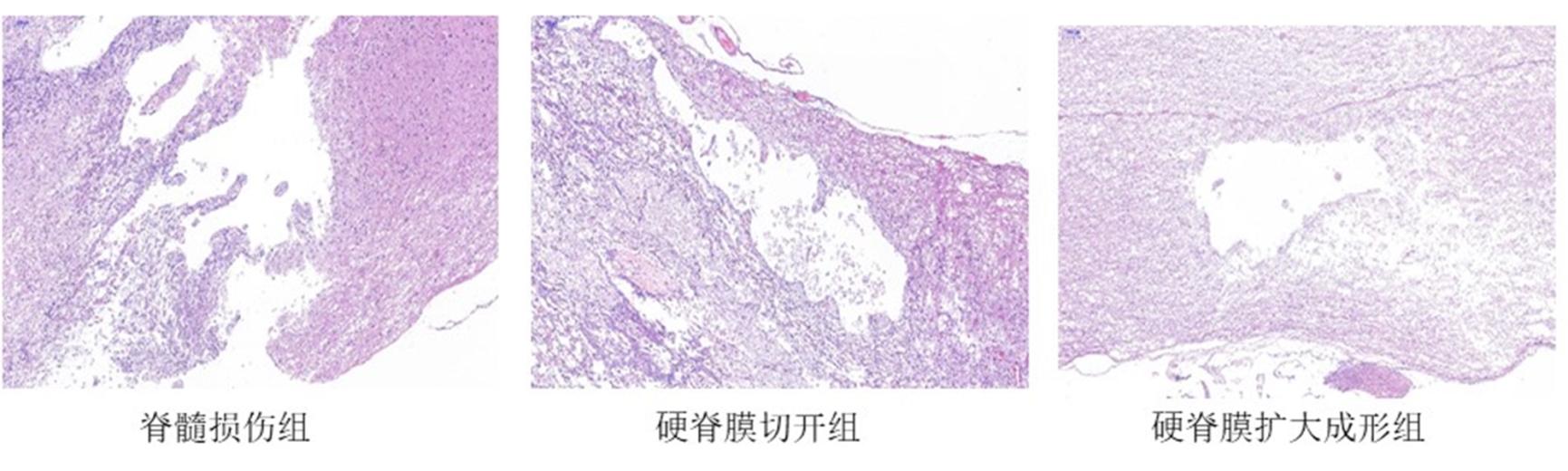
Fig. 1 HE staining of spinal cord tissue(×50)
图2 脊髓损伤空洞体积 *P<0.05
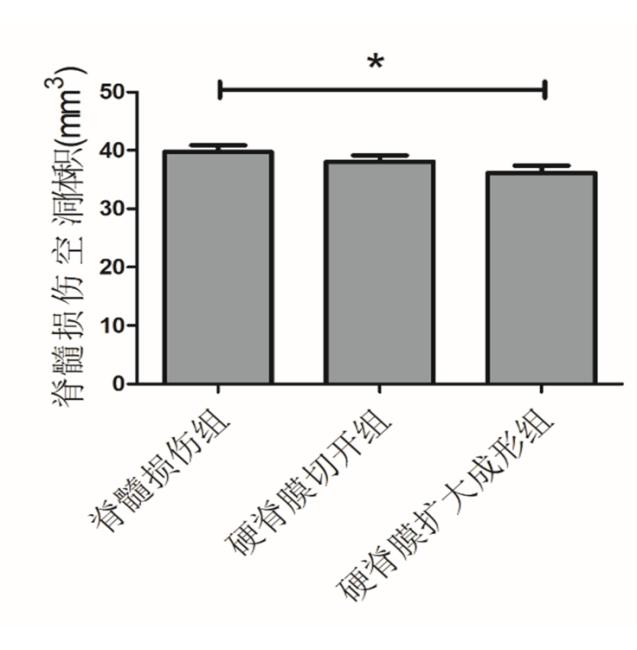
Fig. 2 Lesion volume of spinal cord injury *P<0.05
2.4、脊髓LFB染色结果
LFB染色用于评估白质剩余量,与硬脊膜扩大成形相比,脊髓损伤组白质结构疏松,脱髓鞘明显。脊髓损伤组、硬脊膜切开组和硬脊膜扩大成形组的脊髓白质IOD值分别为1.46±0.43,1.86±0.47,2.62±0.48,差异有统计学意义(F=12.867, P<0.01)。硬脊膜扩大成形组脊髓白质IOD值高于脊髓损伤组和硬脊膜切开组,差异具有统计学意义(t=4.99, P<0.01; t=3.27, P=0.004)。硬脊膜切开组IOD值较脊髓损伤组轻微增高,但差异无统计学意义(t=1.72, P=0.1)。见图3,4。
图3 脊髓组织LFB染色(×50)

Fig. 3 LFB staining of spinal cord tissue(×50)
图4脊髓白质IOD值 **P<0.01
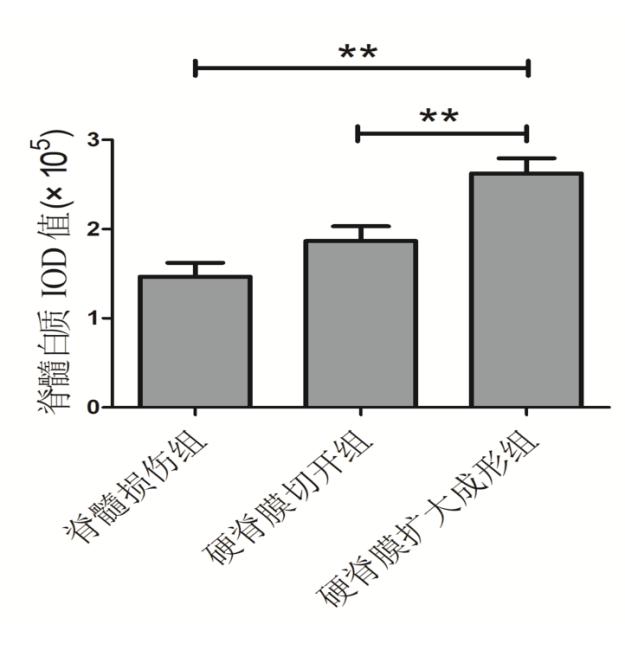
Fig. 4 IOD score of white matter of spinal cord **P<0.01
2.5、脊髓GFAP染色结果
GFAP染色用于评估星形胶质细胞增生情况,细胞染色为棕黄色,与硬脊膜扩大成形相比,脊髓损伤组星形胶质细胞胞体增大,硬脊膜切开组突触增多、延长。脊髓损伤组、硬脊膜切开组和硬脊膜扩大成形组的GFAP+细胞计数分别为(20.08±2.53),(21.16±2.28),(17.66±2.49)个,差异有统计学意义(F=6.446, P=0.004)。硬脊膜扩大成形组GFAP+细胞计数结果低于脊髓损伤组和硬脊膜切开组,差异有统计学意义(t=2.42, P=0.021; t=3.5, P=0.001)。硬脊膜切开组GFAP+细胞数目较脊髓损伤组轻微升高,但结果无统计学意义(t=1.08, P=0.286)。见图5,6。
图5 脊髓组织GFAP染色(×400)

Fig. 5 GFAP staining of spinal cord tissue(×400)
图6 GFAP+细胞计数结果 *P<0.05 **P<0.01
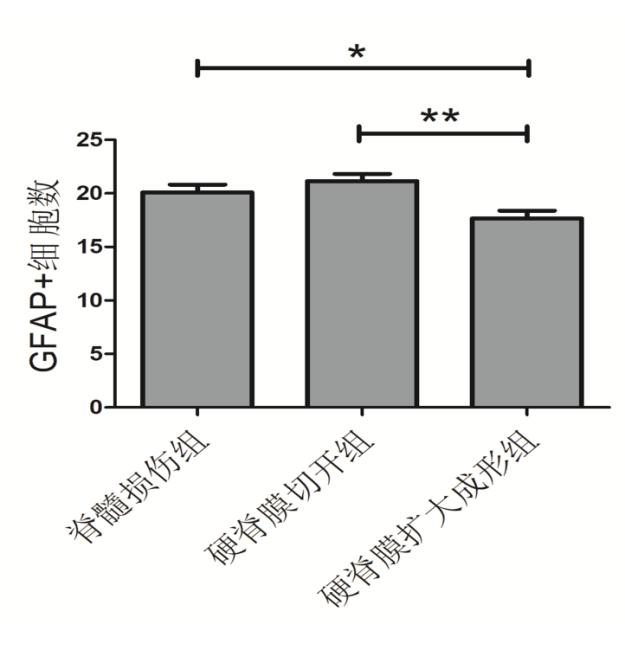
Fig. 6 The number of GFAP positive (+) cells of spinal cord *P<0.05 **P<0.01
3、讨论
急性脊髓损伤机制包括原发性脊髓损伤和继发性脊髓损伤。原发性脊髓损伤主要由于脊髓受到重击、牵拉等物理因素而产生的神经元坏死和血管结构的破坏[14,15]。继发性脊髓损伤主要包括脊髓的水肿、缺血以及脑脊液压力的改变等方面[16]。原发性脊髓损伤通常难以逆转,因此,治疗的关键在于缓解继发性损伤的程度。尽管传统的硬脊膜外减压手术能够减轻硬膜外压力、改善脊髓损伤患者的预后,但由于其无法解除硬脊膜对脊髓的压迫,脊髓仍会进一步水肿缺血,引起脑脊液压力的改变[17,18]。本研究显示,硬脊膜扩大成形术可以促进脊髓损伤大鼠运动功能的恢复,减少脊髓损伤空洞体积,抑制脊髓脱髓鞘变性,减少瘢痕组织形成。
脊髓损伤后,硬脊膜会对肿胀脊髓的产生持续性压迫,导致脊髓实质内压力增高,引起脊髓微循环障碍。增高的实质内压力会限制脊髓内微静脉回流,加剧脊髓内缺血缺氧的环境[19]。本研究发现,脊髓损伤的大鼠在硬脊膜切开后,脊髓通过硬脊膜切口向外突出形成“疝”样结构,证实脊髓损伤后会导致脊髓实质性水肿的发生。另外,脑脊液压力的改变也会对脊髓水肿和缺血产生影响[20]。脊髓损伤后,肿胀的脊髓会堵塞硬膜下间隙,阻塞正常的脑脊液的流动,造成压力梯度的改变,从而导致硬膜内压力增高,而硬膜内压力的增高会进一步导致脊髓水肿。Kwon等[18]利用脑脊液引流的方法治疗大鼠脊髓损伤,结果显示该术式能够降低硬膜内压力,改善脑脊液循环,促进脊髓损伤大鼠功能的恢复。本实验结果显示,与脊髓损伤组相比,硬脊膜扩大成形术组能够显着改善大鼠运动功能和组织学情况,推测硬脊膜扩大成形术能够为肿胀的脊髓提供向外膨出的空间,降低硬膜内压力,改善脑脊液压力梯度,从而发挥神经保护作用。
既往有研究探讨了硬脊膜完整性在脊髓损伤中的作用。Iannotti等[21]利用硬脊膜撕裂模型观察脊髓损伤的组织学反应,其结果显示,与硬脊膜撕裂组相比,成年大鼠在接受同种异体硬脊膜移植后,脊髓损伤囊性空洞面积减小,脊髓损伤部位巨噬细胞浸润减少,并改善了脑脊液循环情况,推测硬脊膜的完整性能够维持正常脑脊液的生理状态,并防止硬膜外生长抑制因子和炎症因子对神经再生的影响。在另外一项脊髓钳夹损伤模型中,Zhang等[22]发现完整的硬膜能够抑制硬膜外成纤维细胞的增殖和瘢痕组织的形成。本实验结果显示,硬脊膜扩大成形术组GFAP+细胞数显着低于硬脊膜切开组,进一步证实硬脊膜完整性对脊髓损伤的神经保护作用。
需要说明的是,本实验存在一定的局限性。本研究模型需要在脊髓损伤之前将棘突椎板切除,而临床上脊髓损伤的患者往往伴有椎体骨折移位,会对脊髓造成骨性结构的压迫,因此,该研究中所采用的脊髓损伤造模方式并不能真实还原临床上脊髓损伤的情况。另外,本次研究没有设立假手术组(即只打开椎板,不做脊髓损伤造模),关于单纯切除椎板是否会对大鼠脊髓造成损伤,仍需进一步研究。
综上所述,硬脊膜扩大成形术可以减少脊髓损伤空洞体积、抑制脱髓鞘变性及胶质瘢痕的形成,从而发挥神经保护作用。尽管本实验结果显示硬脊膜扩大成形术能够减轻继发性损伤的程度,改善神经功能恢复,但有待于更深入的基础研究以及更多的临床疗效证实其疗效。
参考文献
[1]杨俊松,郝定均,刘团江,等.急性脊髓损伤的临床治疗进展[J].中国脊柱脊髓杂志,2018,28(04):368-373.
[2]杨杰,丁明甫.脊髓损伤治疗的进展与策略[J].检验医学与临床,2016,13(08):1134-1136.
[3] James ND,Mcmahon SB, Field-Fote EC, et al. Neuromodulation in the restoration of function after spinal cord injury[J]. Lancet Neurol, 2018, 17(10): 905-917.
[4]樊洪,郝定均.急性脊髓损伤治疗的研究进展[J].中华创伤杂志,2019(4):340-347.
[5] Rouanet C,Reges D,Rocha E,et al. Traumatic spinal cord injury: current concepts and treatment update[J]. Arq Neuropsiquiatr,2017,75(6):387-393.
[6]程黎明.脊髓损伤分子病理机制研究进展与思考[J].中华创伤杂志,2020,36(05):403-407.
[7] Hogg FR A,Gallagher MJ,Chen S,et al. Predictors of Intraspinal Pressure and Optimal Cord Perfusion Pressure After Traumatic Spinal Cord Injury[J]. Neurocrit Care,2019,30(2):421-428.
[8]韩玉,尹洪娜,郭玉怀,等.脊髓损伤的临床治疗进展[J].中华中医药学刊,2019,37(05):1115-1119.
[9]汪靖宇,刘天健,王琳琳,等.急性脊髓损伤临床治疗进展[J]. 中华急诊医学杂,2017,26(04):470-472.
[10] 贺宝荣,郑博隆.中国脊髓损伤规范化治疗和修复机制研究概况[J].中华创伤杂志,2020,36(4):289-292.
[11] 刘洋,王文己. 硬膜切开减压术实施时间对急性脊髓损伤的影响[J]. 西安交通大学学报(医学版),2018,39(2):237-240.
[12]吴杨鹏,范筱,张俐.急性脊髓损伤动物模型的建立与评估[J].中国组织工程研究,2016,20(49):7341-7348.
[13] Basso DM,Beattie MS,Bresnahan JC. A sensitive and reliable locomotor rating scale for open field testing in rats[J]. J Neurotrauma,1995,12(1):1-21.
[14] Ahuja CS,Nori S,Tetreault L,et al. Traumatic Spinal Cord Injury-Repair and Regeneration[J]. Neurosurgery,2017,80(3):9-22.
[15] Anderson KD,Sharp KG,Steward O. Bilateral cervical contusion spinal cord injury in rats[J]. Exp Neurol,2009,220(1):9-22.
[16] Shank CD,Walters BC,Hadley MN. Current Topics in the Management of Acute Traumatic Spinal Cord Injury[J]. Neurocrit Care,2019,30(2):261-271.
[17] Jalan D,Saini N,Zaidi M,et al. Effects of early surgical decompression on functional and histological outcomes after severe experimental thoracic spinal cord injury[J]. J Neurosurg Spine,2017,26(1):62-75.
[18] Kwon BK,Curt A,Belanger LM,et al. Intrathecal pressure monitoring and cerebrospinal fluid drainage in acute spinal cord injury: a prospective randomized trial[J]. J Neurosurg Spine,2009,10(3):181-193.
[19] Camlar M,Turk C,Buhur A,et al. Does Decompressive Duraplasty Have a Neuroprotective Effect on Spinal Trauma?: An Experimental Study[J]. World Neurosurg,2019,126:288-294.
[20] Smith JS,Anderson R,Pham T,et al. Role of early surgical decompression of the intradural space after cervical spinal cord injury in an animal model[J]. J Bone Joint Surg Am,2010,92(5):1206-1214.
[21] Iannotti C,Zhang YP,Shields LB,et al. Dural repair reduces connective tissue scar invasion and cystic cavity formation after acute spinal cord laceration injury in adult rats[J]. J Neurotrauma,2006,23(6):853-965.
[22] Zhang J,Wang H,Zhang C,et al. Intrathecal decompression versus epidural decompression in the treatment of severe spinal cord injury in rat model: a randomized, controlled preclinical research[J]. J Orthop Surg Res,2016,11:34.