摘 要: 为了有针对性地控制冷鲜鸡中微生物的污染, 采用平板计数法进行菌相分析;采用平板划线分离法分离冷鲜鸡中主要的微生物菌群, 再根据革兰氏镜检观察、菌落形态、菌体特征观察, 以及16S r DNA测序的方法, 对冷鲜鸡中的主要腐败菌代表菌株进行鉴定。结果表明, 冷鲜鸡的腐败菌相以假单胞菌 (占比51.0%) 、乳酸菌 (占比31.5%) 为主, 其次是热杀索丝菌 (占比13.3%) 、肠杆菌 (占比4.3%) 。在对应的代表性菌株方面, J1代表荧光假单胞菌 (Pseudomonas fluorescens) , C1代表阴沟肠杆菌 (Enterobacter cloacae) , R1代表植物乳杆菌 (Lactobacillus plantarum) , S1代表热杀索丝菌 (Brochothrix thermosphacta) 。
关键词: 冷鲜鸡; 优势微生物群; 腐败菌; 生理生化鉴定; 16Sr DNA; 靶向控制; 延长货架期;

冷鲜鸡是指经检疫检验后屠宰得到的鸡胴体, 经迅速冷却使其温度在1 h内降到0~4℃, 并保持在0~4℃下加工、流通和零售的鲜鸡肉[1]。冷鲜鸡在生产、加工和储运过程中, 不可避免地会被空气、容器、包装材料、原料本身等所携带的细菌污染, 又因为其营养成分丰富和含水量高[2], 一旦条件适宜, 其携带的微生物就会迅速生长繁殖, 出现变色、变味以及表面发黏、产生臭味等不良变化[3], 从而使其货架期缩短, 这也成为限制冷鲜鸡产业发展的瓶颈。因此, 建立系列的综合保鲜技术研究就成为解决冷鲜鸡及酱鸡制品发展的关键问题, 而腐败菌的分离鉴定是这个问题得以解决的基础。
本研究采用平板划线分离方法分离纯化冷鲜鸡中的优势微生物菌群, 再通过传统的生理生化试验及16S r DNA测序的方法, 对冷鲜鸡中的主要腐败菌进行菌种鉴定, 从而为靶向控制冷鲜鸡加工过程中的微生物生长提供依据, 达到延长货架期的目的。
1、 材料与方法
1.1、 材料
活鸡, 购于当地金鑫花园菜市场, 经兽医检验检疫合格[4]。聚乙烯 (polyethylene, 简称PE) 食品包装袋, 购自江阴市永达复合包装有限公司。
1.2、 试剂
蛋白胨、酵母浸膏、葡萄糖、琼脂、无水氯化钠、无水硫酸钾、甘油、磷酸盐缓冲液、二苯胺、醋酸、柠檬酸铵、乙酸钠、吐温-80、硫酸镁、硫酸锰、Ca CO3、胆盐、H2SO4、H2O2、石蜡、中性红、结晶紫、Mg SO4、KHPO4、D-甘露醇、柠檬酸及其他化学试剂均为分析纯级别;1%酚红溶液、无菌生理盐水、革兰氏染色液、奈氏试剂、格里斯氏试剂、吲哚试剂, 为笔者自行配制;微量生化反应管, 购自杭州天和微生物试剂有限公司;Ezup柱式细菌基因组DNA抽提试剂盒, 购自生工生物工程 (上海) 股份有限公司。
1.3、 培养基及培养条件
1.3.1、 培养基的配制
(1) 平板计数琼脂 (plate count agar, 简称PCA) 培养基, 用于细菌的培养。主要配方如下:5.0 g胰蛋白胨, 2.5 g酵母浸膏, 1.0 g葡萄糖, 15 g琼脂, 1 000 m L蒸馏水, 将p H值调至7.2±0.02, 于121℃灭菌15 min。 (2) 假单胞菌计数琼脂培养基 (Pseudomonades培养基) , 用于假单胞菌的分离培养。主要配方如下:20 g蛋白胨, 5 g无水氯化钠, 1 g无水硫酸钾, 13.6 g琼脂, 10 m L甘油, 1 000 m L蒸馏水, 将p H值调至7.2, 于121℃灭菌15 min。 (3) 乳酸菌计数琼脂培养基 (MRS) , 用于乳酸杆菌的分离培养。主要配方如下:2 g柠檬酸铵, 5 g乙酸钠, 20 g葡萄糖, 1 m L吐温-80, 0.58 g硫酸镁, 0.25 g硫酸锰, 15 g琼脂, 20 g Ca CO3, 1 000 m L蒸馏水, 将p H值调至6.2~6.4, 于121℃灭菌15 min。 (4) 结晶紫中性红胆盐葡萄糖琼脂 (VRBGA) 培养基, 用于肠杆菌的分离培养。主要配方如下:3 g酵母浸膏, 7 g蛋白胨, 1.5 g胆盐, 5 g氯化钠, 10 g乳糖, 0.03 g中性红, 0.002 g结晶紫, 15 g琼脂, 1 000 m L蒸馏水, 将p H值调至7.3~7.5, 于121℃灭菌15 min。 (5) 热杀索丝菌计数琼脂培养基 (STAA) , 用于热杀索丝菌的分离培养。主要配方如下:20 g蛋白胨, 15 g甘油, 1 g Mg SO4, 2 g酵母提取物, 1 g KHPO4, 13 g琼脂, 溶于1 000 m L蒸馏水。灭菌后, 加入下列灭菌的水溶液:50μg/m L链霉素硫酸盐, 50μg/m L环己六亚胺, 50μg/m L乙酸盐。
1.3.2、 培养条件
本研究中腐败菌微生物的培养条件见表1。
1.3.3、 主要仪器与设备
3730XL型测序仪, Applied Biosystem;FR980型凝胶成像仪, 上海复日科技仪器有限公司;DYCP-31DN型DNA电泳槽, 北京六一仪器厂;DYY-5型稳压电泳仪, 北京六一仪器厂;2720thermal cycler型PCR仪, Applied Biosystems;HC-2518R冷冻高速离心机, 上海伊沐医疗器械有限公司;DK-8D型电热恒温水槽, 上海一恒科学仪器有限公司;BCD-203型冰箱, 海信 (北京) 电器有限公司;BL3-120型超声波清洗机, 上海比朗仪器有限公司;DT-200型电子天平, 常熟双杰测试仪器厂;HH-8型数显恒温水浴锅, 临安同华电器有限公司;HSX-250型恒温恒湿培养箱, 上海福玛实验设备有限公司;p HS-3C型精度p H计, 上海精密科学仪器有限公司;QYC-200型全温培养摇床, 上海福玛实验设备有限公司;XSP-13A型生物显微镜, 江南光学仪器厂;YX280B型手提式不锈钢压力蒸汽灭菌器, 上海精宏实验设备有限公司;SW-CJ-1F型单人双面净化工作台, 苏州净化设备有限公司;DHG-9148A型电热恒温鼓风干燥箱, 上海三申医疗器械有限公司。
表1 本研究中腐败菌分离、计数用培养基与培养条件

1.4、 方法
1.4.1、 样品的制备
冷鲜鸡制备步骤如下:活鸡宰杀→剃毛净膛→修整清洗→采用浓度为50 mg/L的次氯酸钠溶液[5]浸泡、淋洗→用冷却水冲洗、沥干→真空包装→4℃保藏。
1.4.2、 微生物菌相构成分析
冷鲜鸡样品于4℃储存至第10天, 样品腐败变质。于无菌条件下称取25 g样品, 剪碎后置于装有225 m L无菌生理盐水的锥形瓶中, 均质30 min, 取上清, 依次作1∶10递增稀释, 每个稀释度作3个平行, 倒入冷至45℃的选择性培养基, 放入恒温培养箱内倒置培养48 h后计数[6]。
1.4.3、 腐败菌菌种的分离纯化
从选择性培养基上挑取典型菌落, 在其相应平板上作划线分离, 分离纯化2~3次, 将代表性菌株移殖至斜面, 保藏备检[7]。
1.4.4、 菌落形态的观察
在显微镜下观察已分离纯化的单个菌落的大小、颜色、形状、隆起度、边缘结构、表面光滑或粗糙度、光泽度、透明度和质地等[8]。通过革兰氏染色、鞭毛染色及芽孢染色, 对重新培养18~24 h且长势好的单菌落进行显微镜观察。菌体形态包括细胞形态 (短杆、长杆及球状等) ;革兰氏染色分阴性和阳性[9]。
1.4.5、 生理生化试验
根据《食品微生物鉴定图谱》及《常见细菌系统鉴定手册》[10], 进行氧化酶、接触酶、葡萄糖氧化发酵、精氨酸双水解酶活性以及V-P (Voges-Proskauer) 试验, 根据菌落形态、菌体形态和生理生化试验结果, 最终将细菌初步鉴定到科和属。
1.4.6、 腐败菌的PCR检测
1.4.6. 1、 基因组DNA的提取
采用细菌DNA提取试剂盒提取细菌基因组DNA。
1.4.6. 2、 菌种鉴定基因序列扩增
以基因组DNA为模板, 进行细菌16S r DNA片段的PCR扩增, 采用通用引物扩增16S r DNA, 其中7F:5'-CAGAGTTTGATCCTGGCT-3', 1540R:5'-AGGAGGTGATCCAGCCGCA-3'。
PCR反应体系 (25μL) :0.5μL模板 (20~50 ng/μL基因组DNA) , 2.5μL 10×PCR buffer, 1μL d NTP (2.5 mmol/L) , 0.2μL酶, 0.5μL引物F (10μmol/L) , 0.5μL引物R (10μmol/L) , 加双蒸水至25μL。
PCR循环条件:94℃4 min;94℃45 s, 55℃45 s, 72℃1 min, 30个循环;72℃延伸10 min。
1.4.6. 3、 序列片段分析及发育树的构建
将序列提交至Gen Bank数据库, 在Gen Bank中使用BLAST程序进行同源性比较, 获得最相似典型菌株的DNA序列。运用MEGA 6软件进行系统发育树构建。
2、 结果与分析
2.1、 冷鲜鸡中微生物菌相的构成
将冷鲜鸡样品于4℃保藏培养第10天, 检测其菌落总数达到1.2×105CFU/g, 其腐败菌相构成如图1所示, 可见冷鲜鸡的腐败菌相以假单胞菌 (占比51.0%) 和乳酸菌 (占比31.5%) 为主, 其次是热杀索丝菌 (占比13.3%) 、肠杆菌 (占比4.3%) 。

2.2、 菌落形态特征
将纯化得到的菌种分别命名为J1、C1、R1、S1, 鉴定得到的菌落特征及菌体形态见表2。、
表2 菌落特征及菌体形态

注:“+”表示阳性, “-”表示阴性。表3同。
2.3、 腐败菌显微镜图
通过革兰氏染色试验初步分析这4种分离得到的细菌。根据菌体的形态大小、染色结果初步确定J1、S1为革兰氏阴性细菌, C1、R1为革兰氏阳性细菌。此外可以看出, 这4株菌并无芽孢 (图2) 。
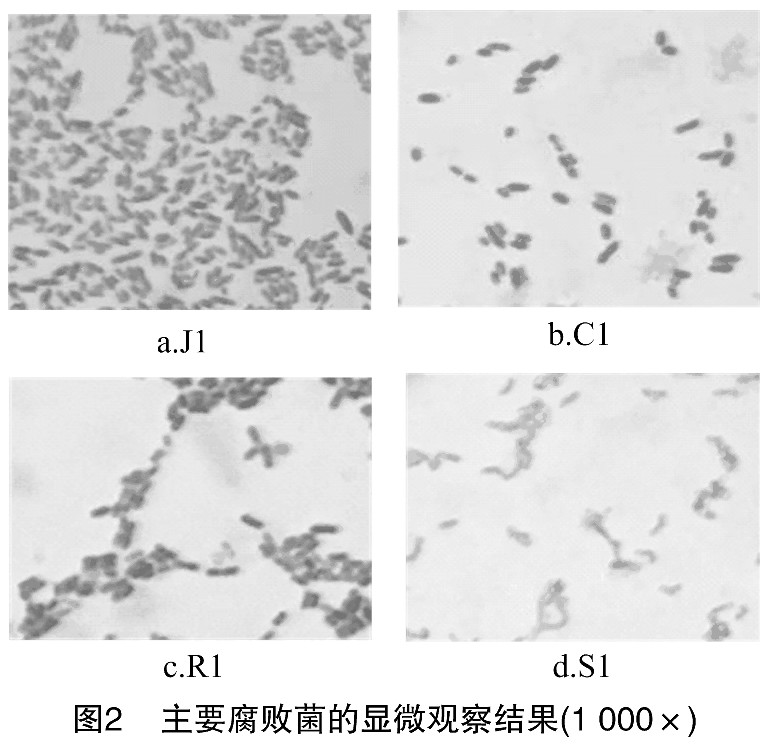
2.4、 生理生化鉴定
根据《食品微生物鉴定图谱》及《常见细菌系统鉴定手册》[10], 通过镜检各种菌在显微镜下的菌体形态、革兰氏染色情况等, 结合表3的生理生化试验结果, 初步判定J1为假单胞菌属, C1为肠杆菌科, R1为乳酸菌属, S1为环丝菌属。
表3 生理生化指标测试结果
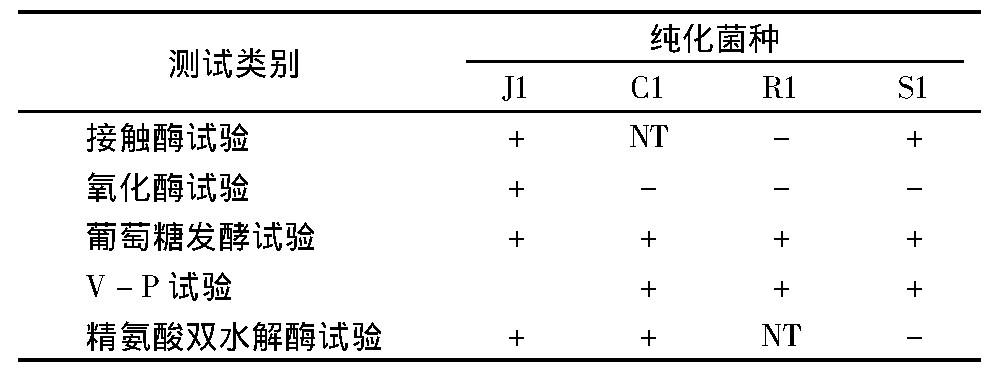
注:“NT”表示未检测。
2.5、 16S r DNA基因PCR扩增结果
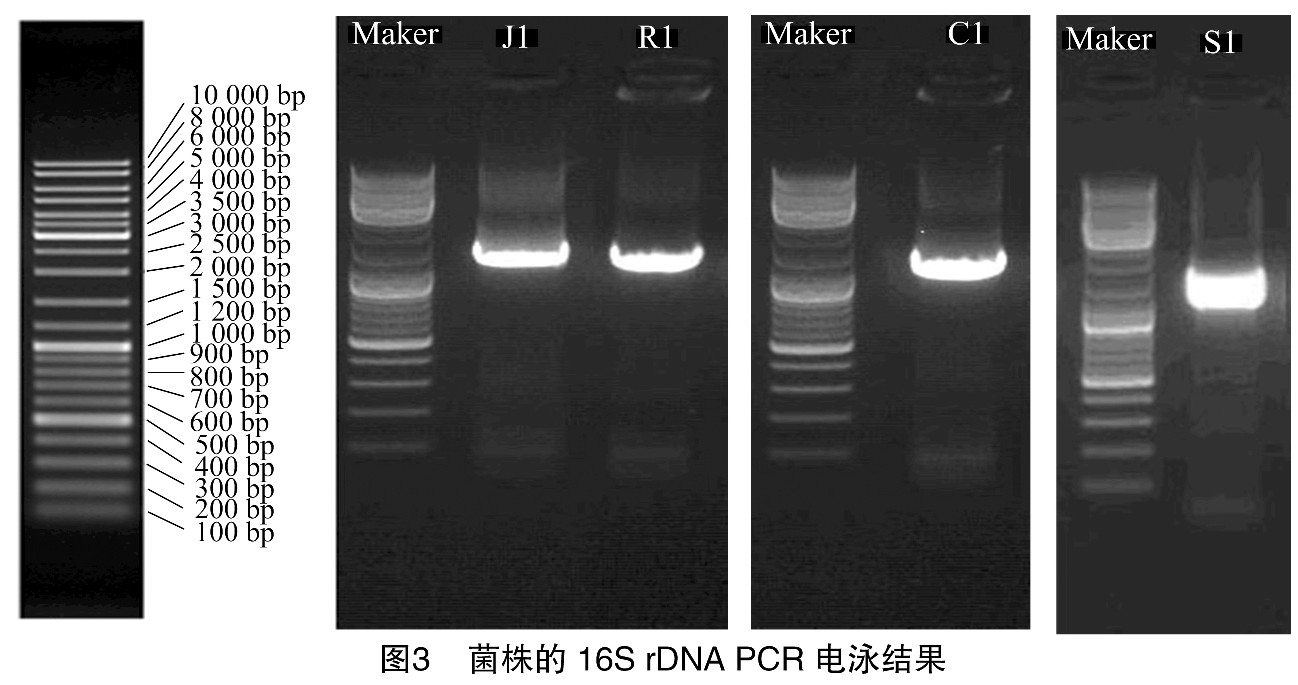
将分离出的腐败菌典型菌株的单菌落培养后提取DNA, 进行16S r DNA PCR扩增。由图3可以看出, 4株菌得出的条带大小不同, J1、R1、C1、S1条带大小分别为1 482、1 351、1 528、1 365 bp。
2.6、 系统发育树的构建
将测序所得16S r DNA序列与核酸序列数据库中已知序列进行比对, 选取相似性高的菌株序列构建系统发育树, 结果如图4和表3所示。通过同源性比较可得:J1与假单胞菌属的荧光假单胞菌 (Pseudomonas fluorescens) 同源性最高;C1与肠杆菌属的阴沟肠杆菌 (Enterobacter cloacae) 同源性最高;R1与乳杆菌属的植物乳杆菌 (Lactobacillus plantarum) 同源性最高;S1与环丝菌属的热杀索丝菌 (Brochothrix thermosphacta) 同源性最高。
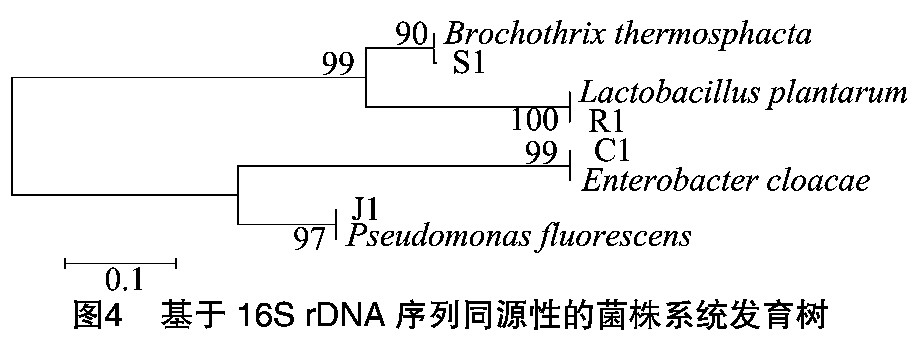
表3 各菌株测序的种属关系

荧光假单胞菌隶属于假单胞菌属。假单胞菌是导致食品腐败变质的主要微生物, 也是冷鲜鸡中存在的优势菌[11]。这是因为假单胞菌在低温条件下也能利用葡萄糖迅速生长繁殖, 使肉制品腐败变质, 从而影响其货架期。冷鲜鸡生产加工和保藏期间的温度为4℃, 有利于假单胞菌的生长繁殖。
植物乳杆菌隶属于乳杆菌属, 在有氧时生长差, 通常是无氧包装肉类食品的优势腐败菌, 广泛存在于动物、蔬菜和食品中[12]。
阴沟肠杆菌隶属于肠杆菌属。肠杆菌属普遍源于人和动物的肠道排泄物, 这可能与冷鲜鸡在生产、加工和储运过程中遭到活鸡肠道内容物的污染有关[13]。
热杀索丝菌隶属于环丝菌属, 在0~30℃下均能生长, 主要存在于肉制品中。它也是肉类食品中重要的腐败菌, 因此是引起真空包装冷鲜鸡腐败的主要微生物[14]。
3、 讨论
赵文红等从腐败冰鲜鸭中鉴定出假单胞菌属、气单胞菌属、乳酸菌属、肠杆菌属、节杆菌属、紫色杆菌属等[8]。周涛等对盐水鹅的主要腐败菌进行测序和序列比对, 得到最终的鉴定结果为蜡样芽孢杆菌 (Bacillus cereus) 、荧光假单胞菌 (Pseudomonasfluorescens) 、成团泛菌 (Pantoea agglomerans) [15]。梁慧等通过传统生理生化试验鉴定冷鲜鸡中腐败微生物的结果表明, 冷鲜鸡中腐败微生物有肠杆菌、葡萄球菌、乳酸菌及假单胞菌, 16S r DNA检测结果表明, 冷鲜鸡中腐败微生物含有肠杆菌、葡萄球菌、乳酸菌、节杆菌、克氏库克菌及假单胞菌等, 两者相对比有较多相同的微生物[16]。高磊等从变质冷鲜鸡的腿肉中分离并通过感官评价筛得到5株优势腐败菌, 经菌落特征、菌体形态、生理生化试验以及16S r DNA序列分析, 结果显示为类产碱假单胞菌、热杀索丝菌、腐生葡萄球菌、无色杆菌、液化沙雷氏菌[9]。本研究对贮藏在4℃的冷鲜鸡进行菌相分析可知, 冷鲜鸡的腐败菌相以假单胞菌 (51.0%) 和乳酸菌 (31.5%) 为主, 其次是热杀索丝菌 (13.3%) 、肠杆菌 (4.3%) 。本研究对分离出的主要腐败菌进行分离、纯化, 然后进行菌落特征、菌体形态观察及生理生化鉴定, 初步确定J1为假单胞菌属, C1为肠杆菌属, R1为乳酸菌属, S1为索丝菌属。然后提取细菌的16S r DNA, 进行PCR扩增后, 经测序和序列比对, 得到最终的鉴定结果:J1为荧光假单胞菌 (Pseudomonas fluorescens) , C1为阴沟肠杆菌 (Enterobacter cloacae) , R1为植物乳杆菌 (Lactobacillus plantarum) , S1为热杀索丝菌 (Brochothrix thermosphacta) 。
参考文献:
[1]王森, 王雪梅, 周永昌, 等.安全、高品质的冷鲜肉[J].肉类工业, 2011 (5) :50-51.
[2]郑秋闿, 范晶晶, 李帅, 等.二氢杨梅素对冷鲜肉的保鲜效果[J].上海交通大学学报 (农业科学版) , 2016 (3) :74-78.
[3]赵毓芝.冷鲜肉复合保鲜技术的研究[D].长沙:湖南农业大学, 2012.
[4]秦东方.HACCP体系下禽肉安全加工工艺研究[J].湖南城市学院学报, 2015, 24 (4) :89-91.
[5]食品安全地方标准冷鲜鸡生产经营卫生规范:DB 312022—2014[S].
[6]陈亚莉.冷却猪肉菌相分析以及生物保鲜剂的筛选[D].长沙:湖南农业大学, 2010.
[7]刘慧.现代食品微生物学实验技术[M].北京:中国轻工业出版社, 2006.
[8]赵文红, 林慧珍, 陈海光, 等.冰鲜鸭优势腐败菌的鉴定[J].现代食品科技, 2012 (7) :728-732.
[9]高磊, 谢晶, 叶藻, 等.冷鲜鸡腿肉中优势腐败菌的分离鉴定及腐败能力研究[J].食品与发酵工业, 2015, 41 (8) :48-53.
[10]东秀珠, 蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社, 2001:66-242.
[11]Olmo A D, Calzada J, Nu1ez M.Effect of lactoferrin and its derivatives, high hydrostatic pressure, and their combinations, on Escherichia coli O157:H7 and Pseudomonas fluorescens in chicken filets[J].Innovative Food Science and Emerging Technologies, 2012, 13 (13) :51-56.
[12]Geeta, Yadav A S.Antioxidant and antimicrobial profile of chicken sausages prepared after fermentation of minced chicken meat with Lactobacillus plantarum and with additional dextrose and starch[J].LWT-Food Science and Technology, 2017, 77 (77) :249-258.
[13]Schwaiger K, Huther S, H9lzel C, et al.Prevalence of antibioticresistant enterobacteriaceae isolated from chicken and pork meat purchased at the slaughterhouse and at retail in Bavaria, Germany[J].International Journal of Food Microbiology, 2012, 154 (3) :206-211.
[14]Casaburi A, De Filippis F, Villani F A.Activities of strains of Brochothrix thermosphacta in vitro and in meat[J].Food Research International, 2014, 62 (62) :366-374.
[15]周涛, 余娟, 毛杨敏.真空包装盐水鹅中腐败细菌的分离鉴定[J].食品工业科技, 2016, 37 (14) :219-222, 232.
[16]梁慧, 于立梅, 陈秀兰, 等.鸡胸肉冷藏过程中腐败菌分析及其品质变化研究[J].食品与发酵工业, 2016, 42 (10) :184-188.