摘 要: 目的应用生物信息学的方法预测地衣芽孢杆菌几丁质酶的结构与功能。方法登陆NCBI数据库搜索目标酶的氨基酸序列, 用生物信息学软件ProtParam、SIGNALIP、SWISS-MODEL等预测该酶的理化性质、信号肽及跨膜区、空间结构等。结果该酶是由693个氨基酸组成的蛋白质, 相对分子质量为77803.79, 分子式为C3483H5251N937O1059S19, 理论等电点为5.42, 不稳定系数为33.82, 亲水性系数为-0.590, 二级结构中α-螺旋、β-折叠、无规则卷曲所占比分别为15.73%、26.55%和57.72%。结论地衣芽孢杆菌几丁质酶为一种亲水性蛋白, 有磷酸化、乙酰化位点, 有信号肽, 可分泌, 可能作为一种胞外因子与其他物质共同作用, 为其进一步研究提供新方向。
关键词: 几丁质酶; 生物信息学; 预测;
地衣芽孢杆菌是一种革兰氏阳性嗜热土壤细菌, 可合成抗活性物质来阻碍致病菌增殖[1]。几丁质是乙酰氨基葡萄糖聚合成的高分子多糖, 大量存在于虾壳, 蟹壳和诸多节肢动物外壳、低等植物中。几丁质酶 (Chitinase) 作用于几丁质中的糖苷键, 水解几丁质产生N-乙酰葡糖胺, 按照催化域特征可将其分为18、19家族, 其中, 18家族几丁质酶多来自于微生物, 19家族几丁质酶的分布范围则较窄;按氨基酸序列可分为5类[2], 其中Ⅰ型和Ⅴ型来自于植物, Ⅱ型来自于真菌, Ⅲ型和Ⅳ型来自于大多数微生物和动物。几丁质酶是酶解法利用几丁质的核心, 几丁质酶可以通过水解细胞壁中的几丁质来达到生物防治的目的;自然中的几丁质储存量颇丰, 几丁质酶可水解几丁质来促进自然界碳素循环[3];几丁质的水解产物N-乙酰葡萄糖胺有多种生理活性, 如抗菌、调节机体免疫、阻止癌细胞增生等, 因而在农业、环境保护、医药、食品等诸多领域皆有应用[4]。
地衣芽孢杆菌可大量地向细胞外分泌几丁质酶, 但酶的结构与性质还未十分清楚, 本文从生物信息学的角度对地衣芽孢杆菌几丁质酶进行分析, 以期为其进一步研究与应用提供前提。
1、 数据
甘肃省植物源农药重点实验室课题组提取并保存的地衣芽孢杆菌基因组数据库获取几丁质酶基因序列 (基因检索号:NC_006270.3) , 提交NCBI数据库进行BLAST分析, 得到SefSeq信息, 翻译产物为chitinase[Bacillus licheniformis] (蛋白检索号:WP_011197522.1) , 简称为BlCHI。
2、 几丁质酶的生物信息学分析
2.1、 蛋白结构特征与进化树构建
登陆NCBI官网检索NC_006270.3, 结构域的预测可用以下网址:https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi, 再用BLAST进行序列同源性比对, 用MEGA7.0构建进化树。

2.2、 理化性质预测
用ProtParam将BlCHI的氨基酸序列进行理化性质分析, 有氨基酸的数量与种类、等电点、分子式等。网址:https://web.expasy.org/prot-param/
2.3、 蛋白质信号肽与跨膜位点预测
利用SIGNALIP4.1工具在线预测该几丁质酶有无信号肽序列及跨膜区。网址:http://www.cbs.dtu.dk/services/SignalP/
2.4、 蛋白质翻译后修饰位点预测
登陆网址http://www.dabi.temple.edu/disphos/分析蛋白质的翻译后修饰位点, 乙酰化位点可用NetNGlyc1.0Server工具进行预测。
2.5、 蛋白结构预测
将Bl CHI的氨基酸序列输入GOR4网站中, 可获得Bl CHI的二级结构组成, 再登陆SWISS-MOD-EL网站 (https://www.swissmodel.expasy.org/) , 对其进行三级结构同源建模。
2.6、 互作蛋白分析
用STRING进行在线分析, 获得BlCHI与其相互作用蛋白的关系图。网址:https://string-db.org/cgi/input.pl
3、 结果
3.1、 蛋白结构特征与分子进化分析
根据NCBI蛋白保守结构域预测, BlCHI属于Glyco_hydro_18superfamily即18家族几丁质酶, 18家族几丁质酶又可分为3个亚族[5]。按氨基酸序列分, BlCHI属于Ⅲ型几丁质酶。其氨基酸C端有一个催化功能区, 是结合几丁质的区域;氨基酸序列中有一段保守区, 该蛋白有可能参与乙酰基的转移[6]。
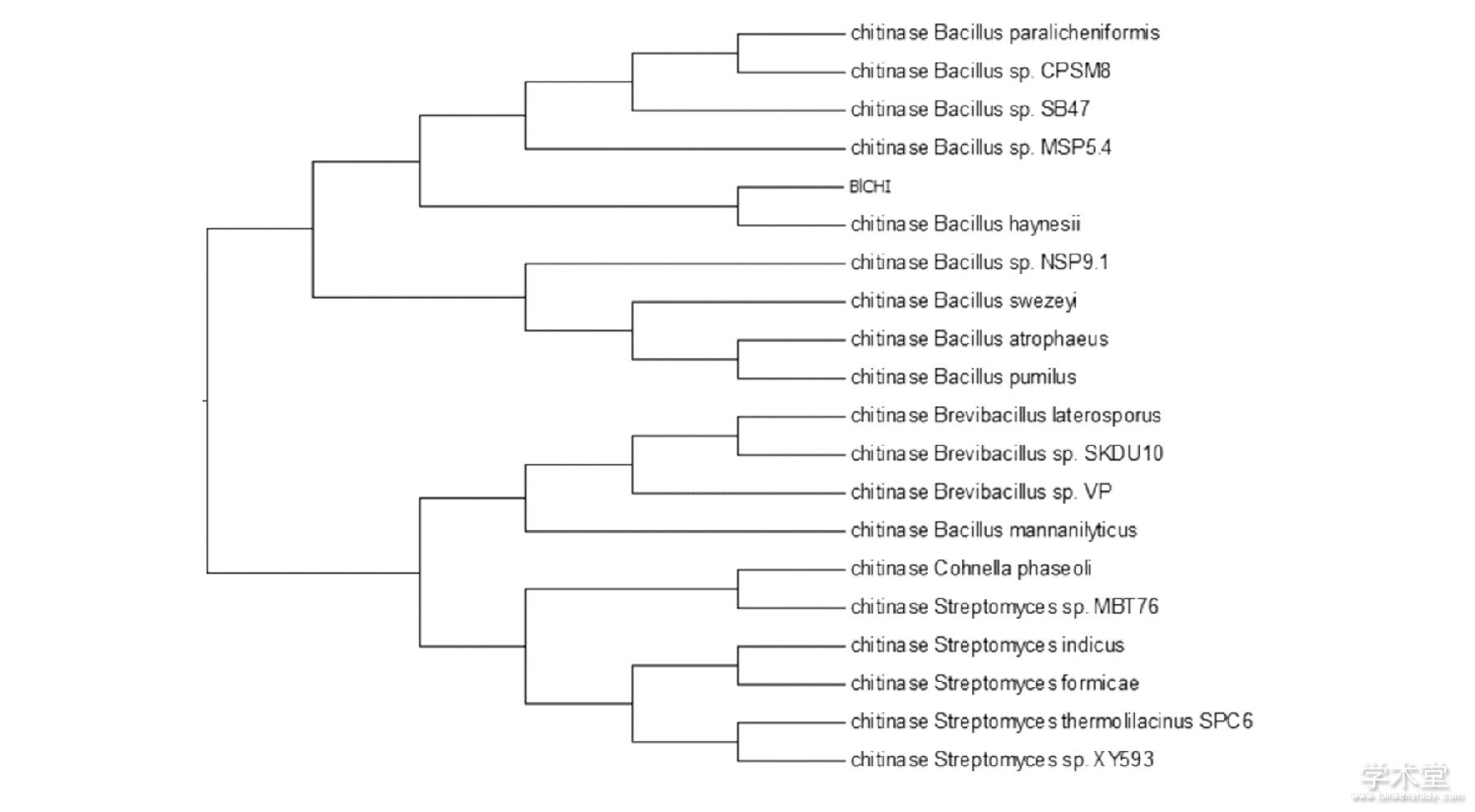
几丁质酶普遍存在于芽孢杆菌各菌株中。用BLAST进行同源分析后用MEGA7.0构建系统进化树 (图1) 。从进化角度分析, BlCHI与chitinase[Bacillus haynesii]海内氏芽孢杆菌几丁质酶的同源性最高 (96.54%) , 其次是chitinase[Bacillus paralicheniformis]副水杨芽孢杆菌几丁质酶。
图1 Bl CHI的系统进化树
3.2 、几丁质酶的理化性质分析
利用ExpasyPortParam软件进行分析, BlCHI由C、H、N、O、S五种元素构成, 分子中总原子数目为10749, 分子式为C3483H5251N937O1059S19, 理论分子质量单位为77803.79, pI值为5.42。该酶蛋白中的总氨基酸个数为693, 天冬氨酸、丙氨酸和亮氨酸的含量最高, 占氨基酸总量的7.5%、10.1%、6.9%, 带负电荷的氨基酸 (天冬氨酸与谷氨酸) 总数为94个, 带正电荷的氨基酸 (赖氨酸与精氨酸) 总数为73个;其不稳定系数为33.82 (系数的划分点是40.0) [7], 则可以判定为稳定蛋白;其脂肪族氨基酸指数为69.83。
图2 Bl CHI的Expasy疏水性分析
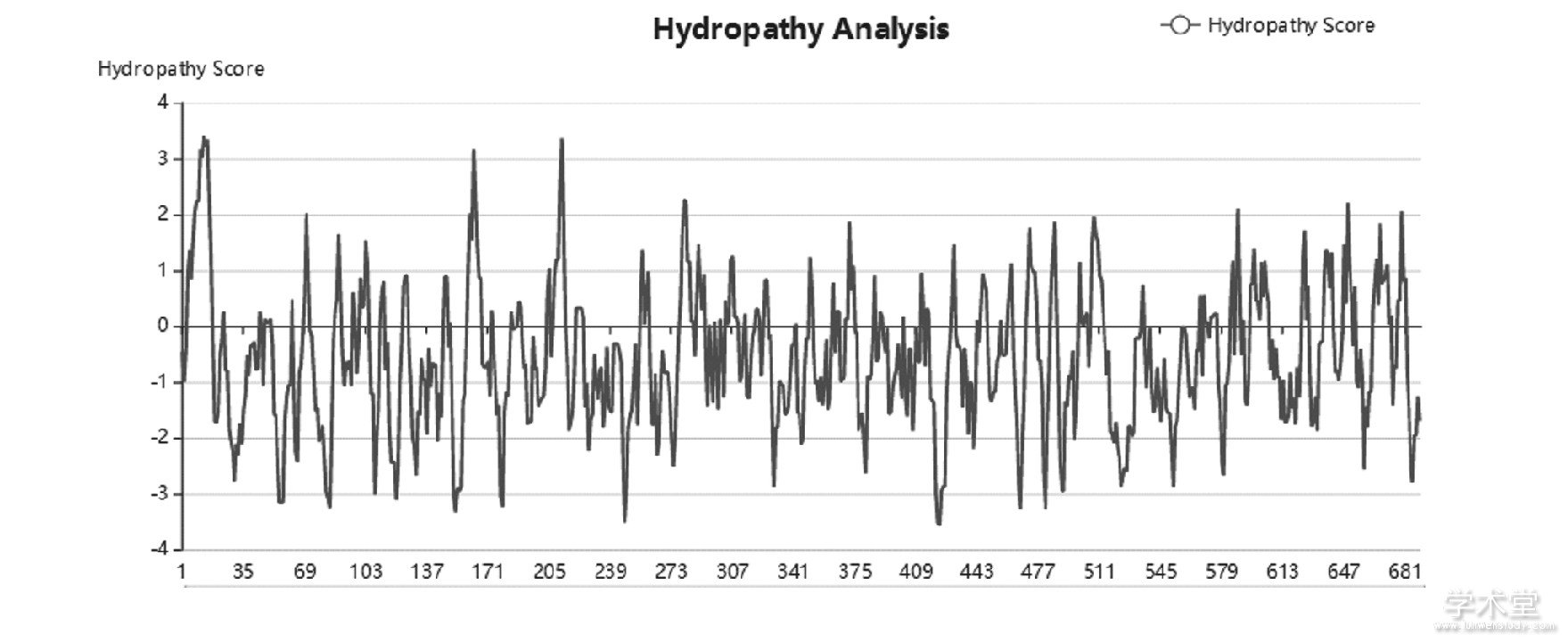
用Expasy工具对BlCHI进行亲疏水性分析, 该蛋白的亲水系数为-0.590, 根据蛋白质亲、疏水性得分判定[8]可认为该蛋白质为亲水性蛋白。其212位亮氨酸 (V) 处疏水性最大, 为3.36, 此处疏水性最强;247和421位丙氨酸 (N) 和组氨酸 (H) 的疏水性最小, 为-3.52, 此处亲水性最强。根据疏水性分析图, 可以知道该蛋白中有许多亲、疏水性区域, 但分布聚集度不高, 疏水性系数的变化范围较大, 波动明显。
3.3、 蛋白质信号肽、跨膜区及修饰位点分析
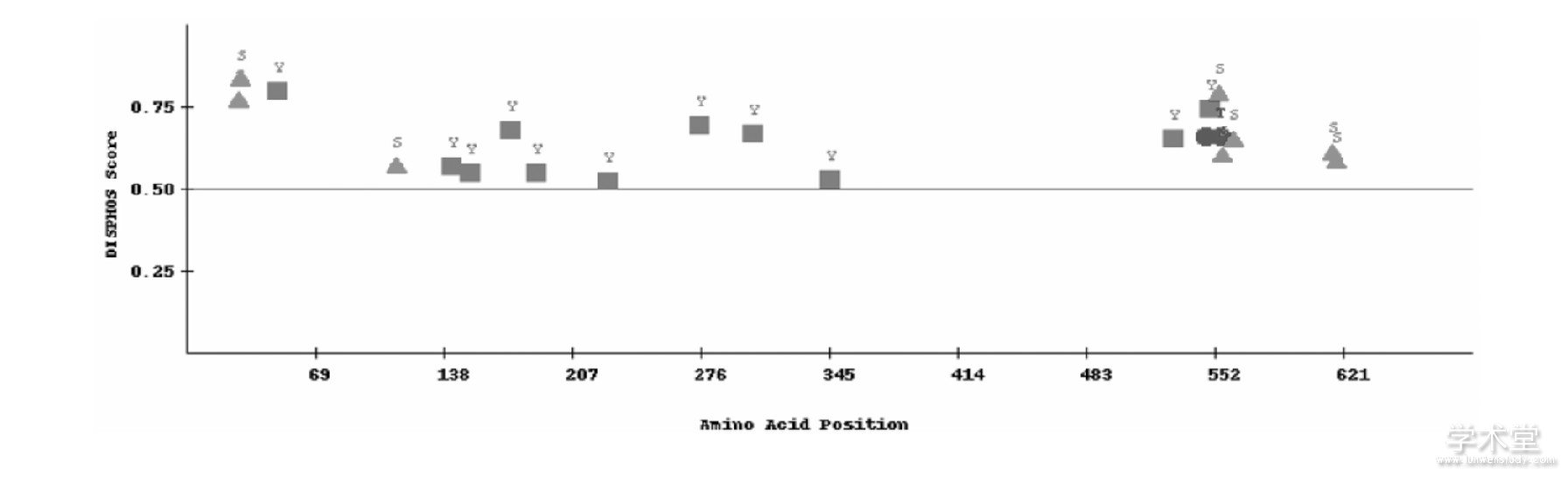
利用软件SignalP-4.1对BlCHI有无信号肽进行预测, C值表示剪切位点值、S值表示信号肽区域值、Y值表示剪切位点校准值。由图3可知该蛋白的S值区间为1~27位氨基酸, C值与Y值最大值均在第27位谷氨酸 (E) 。因此推断BlCHI含有信号肽, 可推测BlCHI为分泌蛋白。用TMHMM软件分析预测BlCHI的跨膜区进行预测, Inside表示胞内区、Outside表示胞外区、Transmembrane表示跨膜区。如图4, 图片最上方的紫色线表示氨基酸都位于膜外, 推测BlCHI无跨膜结构, 不属于膜蛋白。经NetNGlyc1.0Server分析BlCHI的翻译后修饰位点, 如图5, 结果显示该蛋白有21个磷酸化位点, 分别是11个酪氨酸、8个丝氨酸、2个苏氨酸。且在385位段的NVTG处极可能有糖基化修饰。
图3 Bl CHI的信号肽序列分析
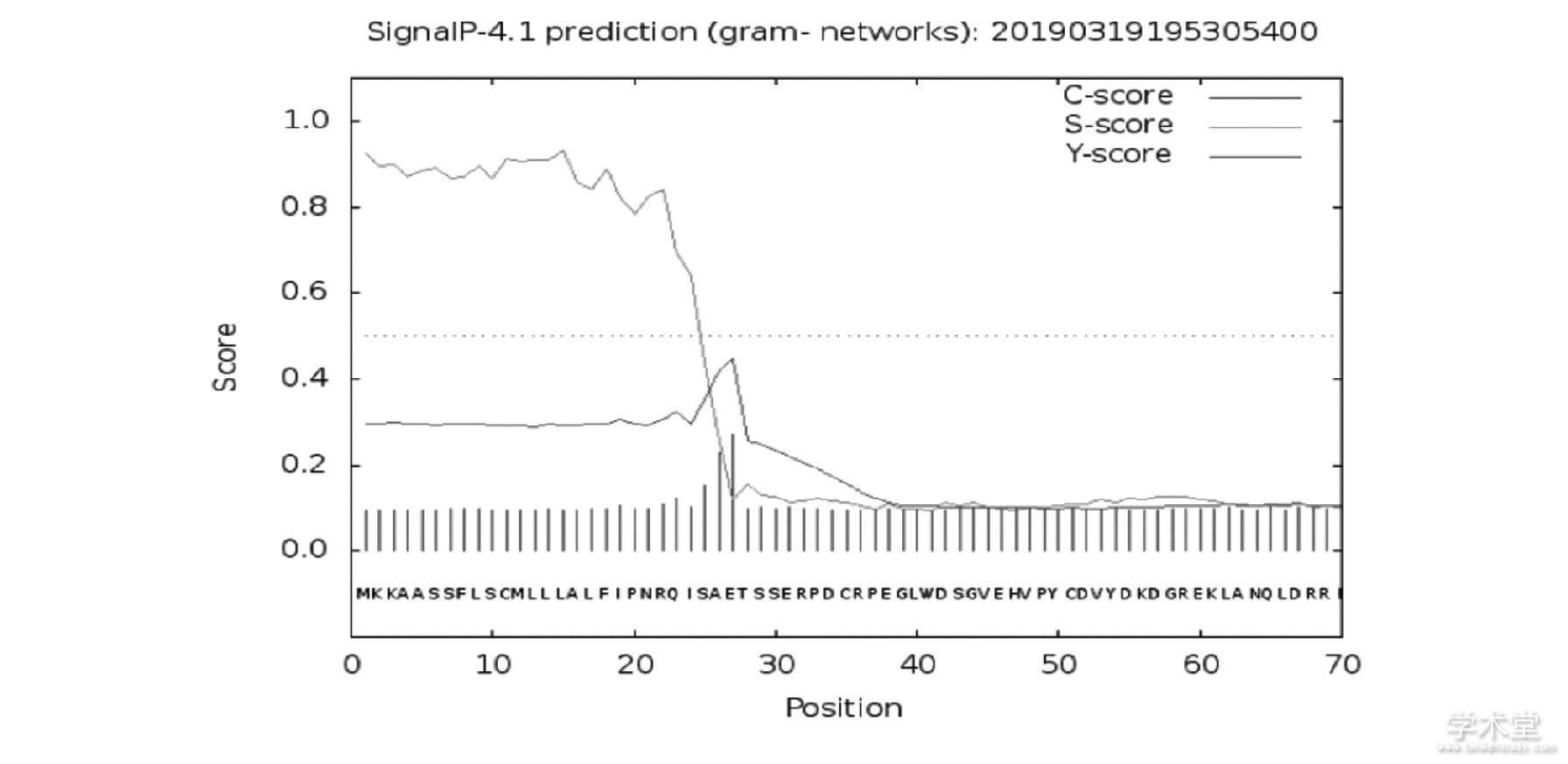
图4 Bl CHI的跨膜结构区分析
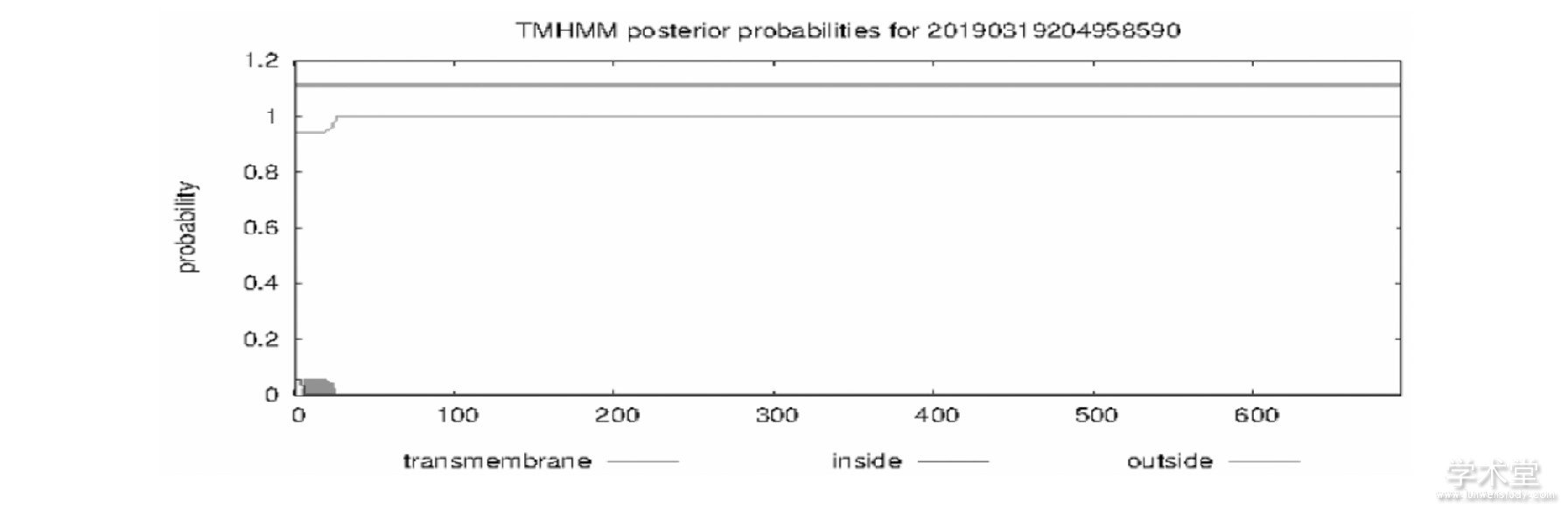
图5 Bl CHI的翻译后磷酸化修饰位点分析
3.4、 二级结构分析
用GOR4在线分析BlCHI的二级结构, 如图6, α-螺旋结构 (TH) 有109个, 占15.73%;β-折叠 (EE) 结构有184个, 占26.55%;无规则卷曲结构 (CC) 有400个, 占57.72%。其中无规则卷曲占了很大比重, 在这部分结构中很有可能存在多个活性中心, 利于提高BlCHI的催化效率。
图6 Bl CHI的二级结构分析
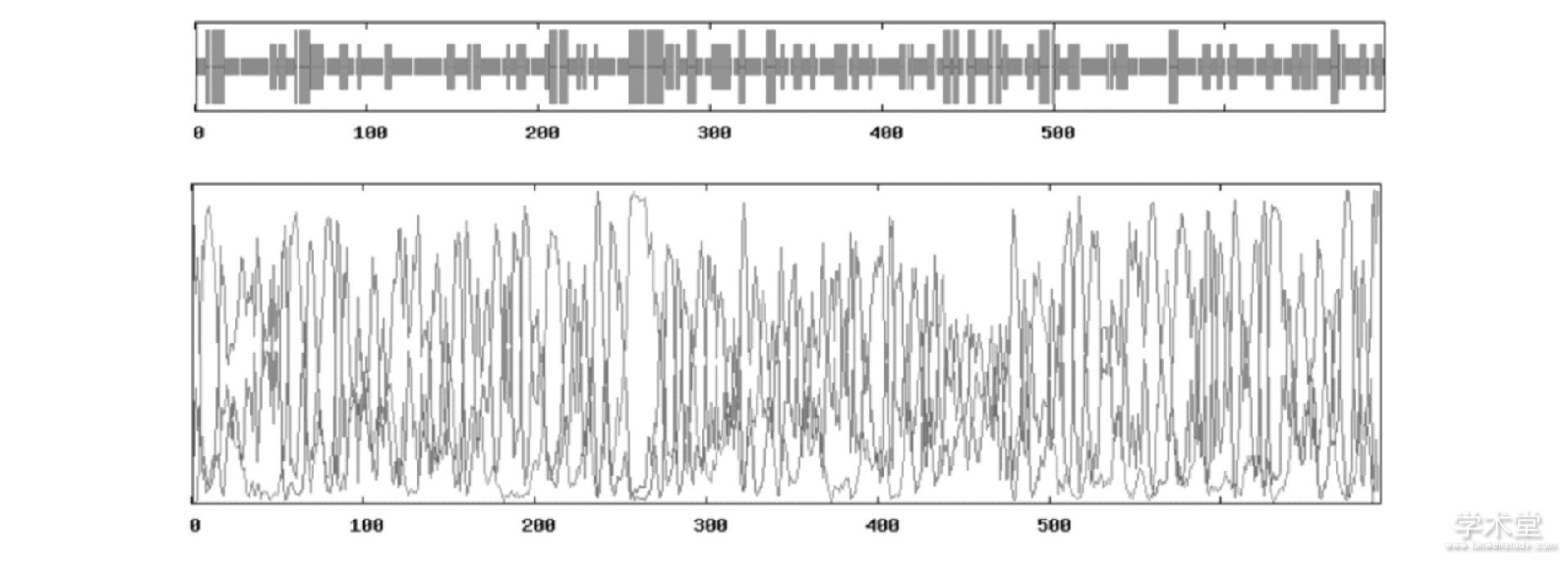
注:图中的蓝色线表示TH结构, 红色线表示EE结构, 紫色线表示CC结构
3.5、 三级结构分析
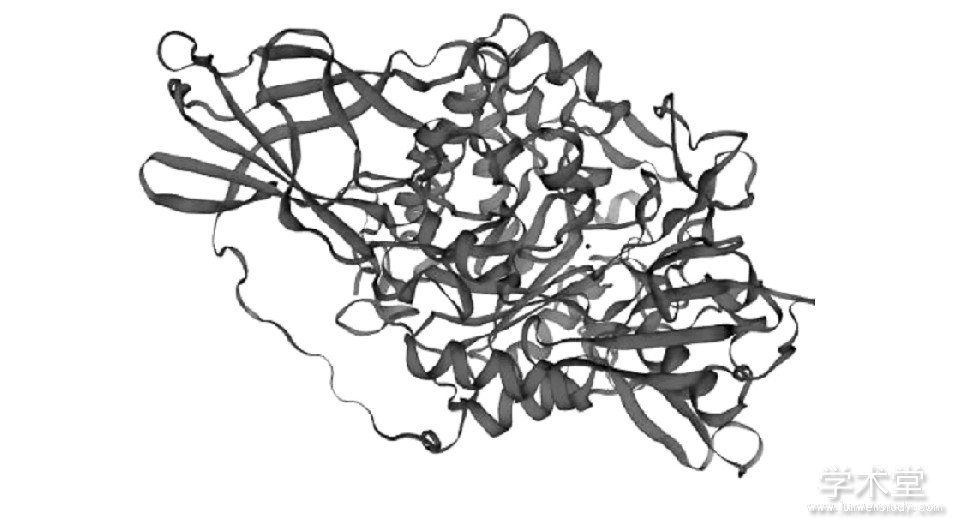
用SWISS-MOLGEL在线对BlCHI进行三级结构同源模型构建, 构建的三维结构见图7。SWISS-MOLGEL工具分析结果中有两个可以评估模型质量的值, 分别是GMQE值与QMEAN值, 其中GMQE值为0-1的一个数, 数值越大说明建立的模型越贴合实际[9];QMAN值用手势表示模型的好坏。在对BlCHI的同源建模中GMQE值为0.81, 说明该模型的构建与真实结构的契合度非常高, 也与NCBI蛋白三级结构数据库中的3D结构十分类似, QMEAN手势向上, 说明所得模型的效果良好。
图7 Bl CHI的SWISS-MOLGEL三级结构同源建模
3.6、 互作蛋白分析
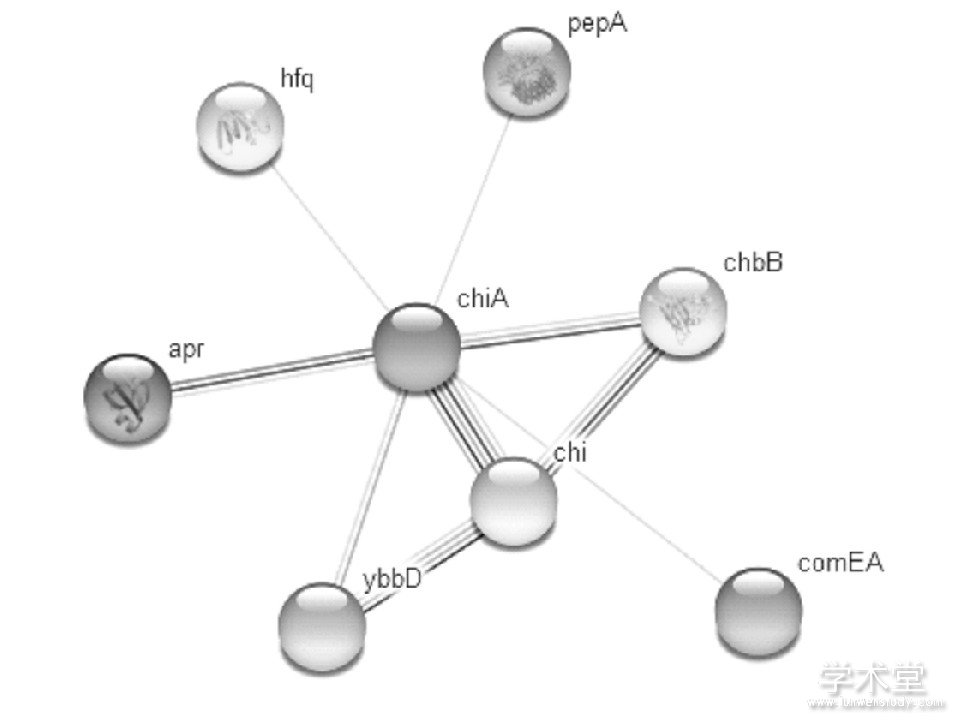
登陆STRING网站, 在线分析与BlCHI相互作用的蛋白, 结果表示其互作蛋白有hfq、pepA、arp、ybbD、chbB、chi和comEA, 从图中可以看出BlCHI即chiA处于核心位置, 与其他蛋白有紧密的协作关系。
图8 Bl CHI的STRING互作蛋白分析
4、 讨论与展望
本文运用生物信息学的方法对地衣芽孢杆菌几丁质酶BlCHI进行了结构与功能的分析, 在系统进化树中BlCHI表现与海内氏芽孢杆菌、副水杨芽孢杆菌几丁质酶较高的同源性, BlCHI中含有94个酸性氨基酸73个碱性氨基酸, 酸性氨基酸的比重较大, 使得其理论等电点偏小, 为5.42, 可归为酸性几丁质酶类[10]。BlCHI中有信号肽, pepA可能为氨基肽酶, 可以水解蛋白质N端的信号肽, 使蛋白向胞外分泌, STRING蛋白互作分析表明BlCHI与chbB几丁质结合蛋白关系密切, 研究表明chbB可利于几丁质酶与底物的结合, 提高其催化效率, chBB可能会在害虫肠道中表达, 利于BlCHI发挥作用抵制农作物病害, hfq、apr、comEA三种蛋白与BlCHI的活性调节有关, 但机制尚未清楚, 需要更进一步地研究。地衣芽孢杆菌作为一种肠道菌群, 有调节肠道菌群平衡、拮抗致病菌的作用, 地衣芽孢杆菌几丁质酶可以水解一些病原菌细胞壁从而杀灭病原菌;大量的外泌几丁质酶有利于几丁质的酶解法利用, 因此进一步对地衣芽孢杆菌的遗传改良以大量表达几丁质酶是十分重要的。
本文首次对地衣芽孢杆菌几丁质酶的结构进行了分析, 这将为地衣芽孢杆菌几丁质酶的克隆表达与定向进化方面的研究提供资料, 为BlCHI的异源表达, 与制备提供了相关依据。
参考文献
[1]王迪轩.地衣芽孢杆菌在蔬菜生产上的应用[J].农药市场信息, 2018, 633 (24) :53.
[2]姜竹峪, 陈羽, 魏锦兴等.几丁质酶研究进展[J].沈阳药科大学学报, 2016, 33 (5) :414-418.
[3]龚福明, 何彩梅, 唐小艳, et al.微生物几丁质酶的研究进展及应用现状[J].中国酿造, 2017 (08) :26-31.
[4]肖景惠.一种几丁质酶基因的克隆表达及酶解产物分析[J].微生物学通报, 2016, 43 (10) :2179-2186.
[5]PATELS, GOYALA.Chitin and chitinase:Role in pathogenicity, allergenicity and health[J].Int J Biol Macromol, 2017, 1864 (9) :1253-1259.
[6] 张德峰, 付玉荣, 伊正君.结核分枝杆菌Car D蛋白结构与功能的生物信息学分析[J].中国病原生物学杂志, 2017 (07) :17-20.
[7]孟利强, 沙长青, 张先成, et al.粘质沙雷氏菌几丁质酶基因Chi A克隆及生物信息学分析[J].微生物学杂志, 2016, 36 (1) .
[8]贺哲, 王园秀, 张圣洁, 等.猕猴桃几丁质酶基因克隆及生物信息学分析[J].现代食品科技, 2018, 40 (6) :1241-1247.
[9] 结核分枝杆菌调节蛋白Rel A的原核表达及多克隆抗体制备[J].细胞与分子免疫学杂志, 2012, 28 (2) :170-173.
[10]钟万芳, 郭慧芳, 丁少军, 等.黏质沙雷氏菌3种几丁质酶基因的克隆及功能预测[J].江苏农业学报, 2011, 27 (5) :1000-1006.
LactobacillusparaplantarumL-XM1是分离自卡萨莫迪娜那不勒斯风味萨拉米香肠的一株Ⅱb类细菌素产生菌。乳杆菌Ⅱ类细菌素的合成通常由群体感应系统调控,目前已知的主要有plnABCD、plnNC8IF-HK-D、orf4-sapK-sapR和orfY-sppK-sppR等系统。经PCR扩增,从L.parap...