摘 要: 【目的】探究番茄根系分泌物中加巴喷丁溶液运用于生产的有效浓度。【方法】通过LC/GC-MS分析番茄根系分泌物中成分;通过趋化性试验、死亡率试验来探究不同浓度的加巴喷丁溶液对J2的影响。【结果】由LC/GC-MS分析番茄根系分泌物发现加巴喷丁是一种植物源的化学物质;趋化性试验表明,在浓度为1 mM的加巴喷丁溶液对J2有排斥作用;死亡率试验发现,当浓度为1 mM时,J2的死亡率达到93%,当浓度稀释至0.01 mM时,对于J2的死亡率达到70%以上。【结论】植物源的加巴喷丁溶液在1 mM浓度时对J2在体外有明显的抑制作用,有成为新型杀线剂的可能。
关键词: 南方根结线虫; 番茄; 根系分泌物; 加巴喷丁;
Abstract: 【Objective】To investigate the inhibitory effect of gabapentin solution in tomato root exudates on the second-stage juvenile(J2) of Meloidogyne incognita.【Methods】The components of tomato root exudates were analyzed by LC/GC-MS; the effects of different concentrations of gabapentin solution on the second-stage juvenile(J2) of Meloidogyne incognita were investigated by chemotaxis experiments and mortality experiments.【Results】Analysis of tomato root exudates by LC/GC-MS revealed that gabapentin was a plant-based chemical; Chemotaxis experiments showed that the gabapentin solution at a concentration of 1 mM had a repellent effect on J2 of Meloidogyne incognita; The mortality test found that when the concentration was 1 mM, the mortality of J2 reached 93%, and when the concentration was diluted to 0.01 mM, the mortality for J2 reached more than 70%.【Conclusion】The plant-derived gabapentin solution has a significant inhibitory effect on J2 of Meloidogyne incognita in vitro at a concentration of 1 mM, and it may become a new nematicide.
Keyword: Meloidogyne incognita; tomato; root exudates; gabapentin;
根结线虫病是设施番茄生产中一种常见的土传病害,受现实条件影响,防治难度高,这导致设施中番茄根结线虫病日益加重,病害严重时甚至导致绝收[1,2]。杀线剂是现阶段防治根结线虫的有效手段之一,主要包括克百威、灭线磷、涕灭威等,但是这些药剂对人和环境造成一定伤害。随着中国环保意识的不断提高,法律规制度逐渐健全,绿色、安全的杀线剂越来越被人们关注和青睐。
近些年来,关于植物源的杀线剂正在受到人们的追捧,关于植物根系分泌物对抵抗根结线虫报道也越来越多。杨国栋等的研究发现,抗性番茄的根系分泌物对RKN排斥作用,感性番茄根系分泌物则对对RKN吸引作用[3]。王艳艳等在研究黄瓜根系分泌物时发现高抗砧木的根系分泌物可以抑制线虫的卵孵化[4]。Degenhardt等研究发现在玉米的根系分泌物中鉴定出(E)-β-石竹烯能够吸引根结线虫[5]。Hooks等研究发现菊科植物根系分泌物中的β-三联噻吩可以排斥根结线虫[6]。

经过前期的根系分泌物代谢组分析,发现番茄株系根系分泌物中含有一种叫加巴喷丁的物质,并且该化学物质可通过商业手段购得。不同浓度梯度的加巴喷丁溶液对南方根结线虫二龄幼虫(J2)进行趋化性和死亡率试验,体外筛选出对J2有抑制作用的浓度,以此来推测其运用于生产的可行性。
1、 材料与方法
1.1、 植物材料
番茄品种为CM植株,番茄株系原始种子由中国科学院遗传与发育生物学研究所(北京)李传友研究员惠赠。
1.2、 方 法
1.2.1、 番茄幼苗的培养与管理
采用温汤浸种法使种子萌发,待大部分种子“露白”后在穴盘中播种,育苗室中培养。育苗室的温光设置为:昼夜温度为26 ℃/18 ℃,光照期为16 h,暗期为8 h。根据番茄幼苗的生长状况,适时补充营养液,及时浇水通风。
1.2.2 、南方根结线虫的繁殖与管理
根结线虫为南方根结线虫(Meloidogyne incongnita),由农业应用新技术北京市重点实验室自繁。将实验室易感番茄植株根系上淡黄色卵块挑下后蒸馏水清洗干净并消毒,放置在26 ℃恒温培养箱中培育,24~72 h内不断观察,挑选活力强的J2用于趋化性和致死率试验。
1.2.3、 根系分泌物的收集及鉴定
采用浸根法收集番茄根系分泌物,用Herz等开发的方法收集根系分泌物[7]。将完整的根放在装有150 mL蒸馏水并且用锡箔纸包裹的烧杯中。每4 h更换1次水,收集1次。为了进一步分析,将渗出液过滤并浓缩至5 mL。待番茄植株长至4叶1心时进行分泌物收集试验,每处理6株重复。收集的分泌物经过过滤、浓缩后采用LC-MS与GC-MS技术鉴定、分析根系分泌物的成分组成(北京凡星博奥生物技术有限公司测定)。
通过液相色谱-质谱法进行检测。色谱方法:色谱柱为Agilent ZORBAX Eclipse Plus C18,2.1 mm×100 mm,3.5 μm。柱温35 ℃,进样量3 μL,流速0.5 mL/min。质谱方法为:电喷雾电离( ESI) 源,正负离子电离模式。离子源温度(120 ℃,脱溶剂温度500 ℃,脱溶剂氮气流600 L/h,锥孔反吹氮气50 L/ h。正负离子模式毛细管电离电压分别为3.0 kV和4.5 kV,取样锥孔电压为27 eV,萃取锥孔4 eV,四极杆扫描范围m/z 50~1 500。使用Analysis TF 1.6和MarkerView 1.2.1软件(美国AB SCIEX)进行数据收集,并使用MetaboAnalyst 3.0软件对差异化合物进行分析和筛选。差异化合物的筛选标准为FC>1.5 or <0.67,P<0.05,VIP>1。将选定的差异化合物与HMDB(人类代谢组数据库)数据库进行比较,以确定特定物质。
1.2.4、J2趋化性试验
将直径为5 cm的培养皿底部通过两个内外环划分成16部分。先在培养皿中倒入0.8 %琼脂糖约5 mL,待凝固后备用。在RE区域内加入20 μL待测的根系分泌物或加巴喷丁溶液,将20 μL内含有约30头J2悬浮液接种于中心环N区域,在26 ℃恒温培养箱中黑暗放置24 h。在显微镜下分别统计1~8区及中心N区域的根结线虫数量[8]。
吸引指数=1~8区域J2总数/(N区域J2总数-1~8区域J2总数)×100%。
1.2.5、 J2死亡率试验
在12孔板上对不同浓度(1、0.1、0.01 mM)的加巴喷丁溶液进行J2死亡率试验,每种浓度试验6次。至少进行了3次独立试验[8]。对照组由乙醇和蒸馏水组成。在加入不同浓度的加巴喷丁之前,每个孔加入20 μL含有30~50头 J2s的液滴。在26 ℃培养箱黑暗培养24 h后,用40倍显微镜计数不活动线虫数量用于计算死亡率。
死亡率=不活动线虫数量/总线虫数×100%。
2、 结果与分析
2.1、 番茄根系分泌物代谢组结果分析
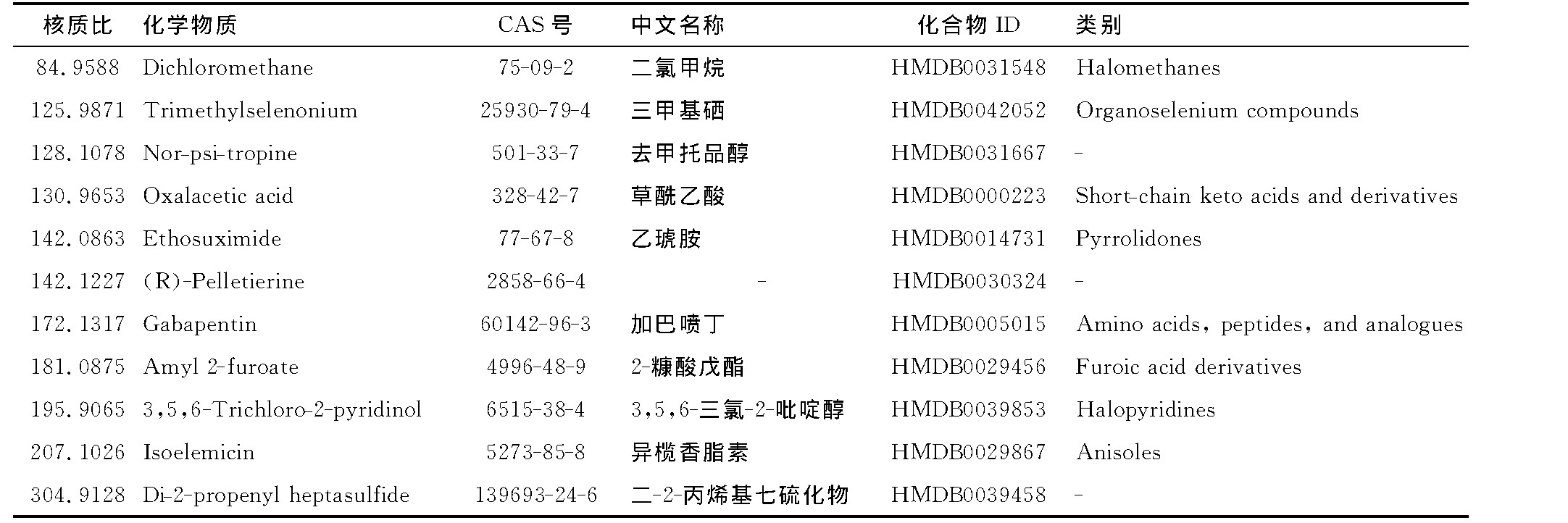
通过对收集的番茄根系分泌物进行代谢组学分析发现,在根系分泌物中含有多种成分。根系分泌物的主要成分一共检测到2 000多种物质,其中主要包含氨基酸,肽及其类似物,苯醚类,苯酚类,苯甲酸及其衍生物,β-羟基酸及其衍生物,胆汁醇、酸及其衍生物,碳水化合物及其结合物等。对这些物质进行筛选后将可购得的物质进行后续试验(表1为番茄分泌物成分部分)。其中,在根系分泌物中加巴喷丁是存在其中的,其相对含量为80.626 2。加巴喷丁在根系分泌物中并不是含量最多的物质,相对其他物质来说其含量很少,其所起的作用可能和其含量关系不大。该物质的核质比为172.131,CAS号为60142-96-3,室温下呈白色粉末至灰白色结晶粉末,其理化性质稳定。
表1 番茄分泌物代谢组部分信息
2.2、 趋化性结果分析
如表2所示,通过对南方根结线虫二龄幼虫(J2)进行趋化性试验发现,当Gabapentin溶液的浓度为1 mM时,对J2有明显的排斥作用;当浓度稀释至0.1、0.01 mM时,Gabapentin对J2无明显吸引或是排斥现象,对照表现出相同现象。
表2 根系分泌物及不同浓度加巴喷丁对J2的趋化性
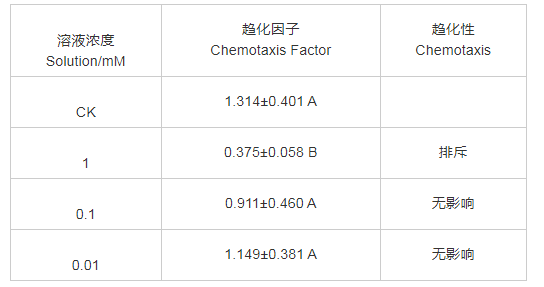
注:Cf<0.5排斥,Cf>2吸引,0.5≤Cf≤2无影响。表中数据为平均值±标准差,不同字母表示差异极显着(P<0.01)
Note: Cf<0.5 repels, Cf>2 attracts, 0.5≤Cf≤2 neutral. The data in the table are mean±standard deviation. Different letters indicate that the difference is extremely significant (P<0.01)
2.3、 J2死亡率结果分析
如图1所示,通过对J2进行死亡率试验时发现,当浓度为1 mM和0.1 mM时,24 h线虫死亡率分别达到93%、95%;当浓度为0.01 mM和0.001 mM时,24 h线虫死亡率分别为72%、75%;当浓度稀释到0.000 1 mM时死亡率下降到26%,虽然与对照相比仍有显着差异,但是由于死亡率已经低于50%,致死作用弱。
图1 不同浓度加巴喷丁对J2的致死率比较(P<0.01)
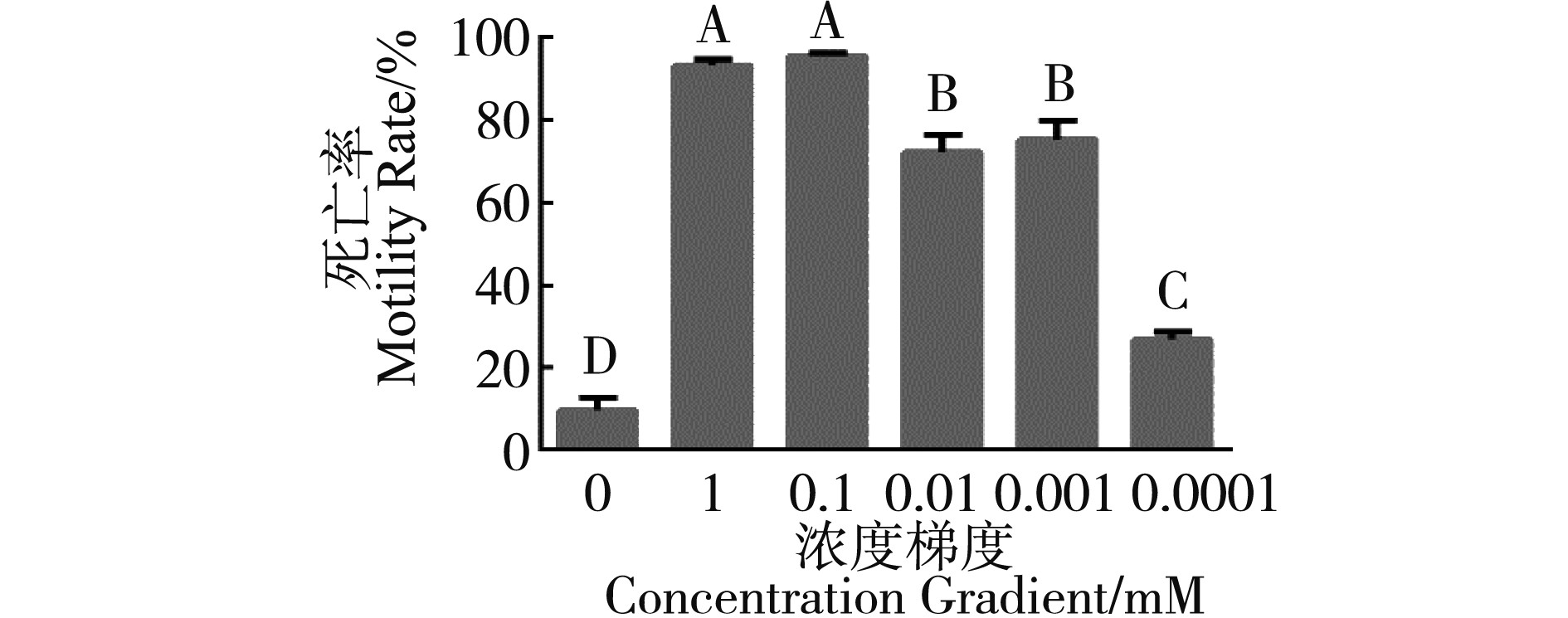
Fig.1 Comparison of lethality of gabapentin to J2 at different concentrations (P<0.01)
综上所述,通过LC/GC-MS发现在番茄根系分泌物中含有一种名为加巴喷丁的化学物质,该物质室温下化学性质稳定;通过J2体外趋化性和死亡率试验发现,当加巴喷丁溶液浓度为1 mM时,对J2有明显的排斥作用并且J2死亡率高达92 %;当浓度为0.1~0.001 mM时,加巴喷丁溶液对J2无明显排斥现象,但J2的死亡率依旧超过70%。这说明加巴喷丁溶液在浓度为1 mM时对南方根结线虫二龄幼虫(J2)有明显的抑制作用。
3、讨 论
目前来说,人们越来越重视农作物生产过程中的绿色、安全问题。有报道指出原来使用广泛的杀线剂克百威、灭线磷、涕灭威可以明显的减少线虫的迁移、侵染和取食,进而减少线虫对作物和蔬菜的危害,但是这些物质的高毒性对其它有益虫鸟有一定危害,还会对人造成二次毒害。在2018年10月1日后全面禁止克百威、灭线磷、涕灭威已禁止在蔬菜、果树、茶树、中草药材上使用[9]。随着越来越多高毒性杀线剂被禁止使用,杀线剂的研制也更多的倾向更安全可靠的的植物源化学物质上来。先正达的生物杀线虫剂 Clariva PN(活性成分:巴斯德杆菌PN1,Pasteuria nishizawaePN1) 获得巴西登记[10]。孟山都将在巴西上市杀线虫剂NemaStrike(活性成分:tioxazafen),该活性成分具有低毒性,杀线持久性的特点[10]。关于根系分泌物对根结线虫有影响的研究报道不断出现。萜类化合物(芫花萜、棉酚等)、类黄酮(黄酮醇等)、糖苷(芥子油苷等)、脂肪酸(丁酸、二烯酸等)和挥发性有机分子(香油、香叶醇、芳樟醇等)调节根结线虫二龄幼虫(J2)对植物宿主的吸引和排斥[11,12];豆科植物和玉米(Zea mays)的根系分泌物可以减缓甚至停止线虫的运动,以此来降低线虫感染植物的能力[13];易感大豆根系分泌物中所包含的谷氨酸、甘氨酸、丙氨酸、亮氨酸、赖氨酸和苯丙氨酸可吸引大豆孢囊线虫[14];柑橘根系分泌物种中的α-松萜、柠檬烯和β-松萜等萜类物质可以吸引柑橘根结线虫[15,16];将番茄与茼蒿间作,茼蒿根系分泌物中的月桂酸可以扰乱线虫中Mi-flp-18基因的表达以阻止其感染番茄[17]。当接种南方根结线虫时,L-抗坏血酸2,6-棕榈酸酯,邻苯二甲酸二丁酯,邻苯二甲酸二甲酯和2,6-二叔丁基-对甲酚四种成分显着增加,这些化合物中的每一种都能抑制南方根结线虫的卵孵化,增加了根结线虫二龄幼虫的死亡率[18]。一种植物源的物质尸胺对南方根结线虫有明显的吸引作用,该物质在番茄的根系分泌物中也有检测到,但是番茄根系分泌物对南方根结线虫并无明显吸引作用,这可能是由于番茄的根系分泌物中存在某些与之拮抗的物质导致[19]。这些研究报道为抗根结线虫病指明了研究方向。
通过这些研究以及本试验可以发现,开发植物源的化学物质用于抵抗根结线虫对番茄株系的入侵的方式是有理可据的。本试验中,在1mM浓度下植物源的加巴喷丁溶液对南方根结线虫二龄幼虫(J2)有明显的排斥作用,并且对J2的死亡率高达到90 %以上,效果是明显的。加巴喷丁这种物质还需要更严谨的田间试验来确定其真正的抗线虫能力。为了能够更加有效环保的防治根结线虫病,安全绿色的杀线剂的研究仍是人们前进的方向。
参考文献
[1] 段玉玺.植物线虫学[M].北京:科学出版社,2011
[2] 于力,朱为民,薛林宝,阎君.番茄根结线虫病的研究进展[J].中国蔬菜,2006(11):35-38
[3] 杨国栋,周宝利,毕晓华,张馨宇,滕龙,吴媛媛,王国华.不同番茄砧木的抗南方根结线虫特性及对土壤生物学活性的影响[J].沈阳农业大学学报,2015,46(5):526-531
[4] 王艳艳,魏珉,沈琼,李岩,史庆华.不同抗性黄瓜砧木对南方根结线虫侵染的生理生化反应[J].山东农业大学学报(自然科学版),2014,45(4):522-528
[5] Degenhardt J,Hiltpold I,Kollner T G,et al.Restoring a maize root signal that attracts insect-killing nematodes to control a major pest[J].Pans,2009,106:13213-13218
[6] Hooks C R R,Wang K H,Ploeg A,et al.Using marigold as a cover crop to protect crops from plant-parasitic nematodes[J].Applied Soil Ecology,2010,46:307-320
[7] Herz Katharina,Dietz Sophie,Gorzolka Karin,et al.Linking root exudates to functional plant traits[J].Plos One,2018,14:e0213965
[8] Yang G,Zhou B,Zhang X,et al.Effects of Tomato Root Exudates on Meloidogyne incognita[J].Plos One,2016,11(4):e0154675
[9] 李晓平.剧高毒杀线剂相继被禁限用将为环保低毒新杀线剂腾挪市场空间[J].农药市场信息,2018(27):30
[10] 新型杀线剂不断涌现安全环保成为主旋律[J].农药市场信息,2017(30):34
[11] Chitwood D J.Phytochemical Based Strategies for Nematode Control[J].Annual Review of Phytopathology,2002,40(1):221-249
[12] Rasmann S,Hiltpold I,Ali J.The role of root-produced volatile secondary metabolites in mediating soil interactions[M].Advances in Selected Plant Physiology Aspects.InTech,2012
[13] Hawes M C,Gunawardena U,Miyasaka S,et al.The role of root border cells in plant defense[J].Trends Plant Sci,2000,5:128-133
[14] 王雪,段玉玺,陈立杰,王媛媛.大豆根系分泌物中氨基酸组分与抗大豆胞囊线虫的相关性研究[J].沈阳农业大学学报,2008,(6):677-681
[15] Ali J G,Stelinski L L.Constitutive and induced subterranean plant volatiles attract both entomopathogenic and plant parasitic nematodes[J].Journal of Ecology,2011,99(1):26-35
[16] Castagnone S P,Mulet K,Iachia C.Tracking changes in life-history traits related to unnecessary virulence in a plant-parasitic nematode[J].Ecology & Evolution,2015,5(17):3677-3686
[17] Dong L L,Li X L,Huang L,et al.Lauric acid in crown daisy root exudate potently regulates root-knot nematode chemotaxis and disrupts Mi-flp-18 expression to block infection[J].Journal of Experimental Botany,2014,65:131-141
[18] Yang G,Zhou B,Zhang X,et al.Effects of tomato root exudates on Meloidogyne incognita[J].Plos One,2016,11(4):e0154675
[19] Oota Morihiro,Tsai Allen Yi-Lun,Aoki Dan,et al.Identification of naturally occurring polyamines as root-knot nematode attractants[J].Mol Plant,2020,13:658-665