摘 要: 在现有文献的基础上, 基于现代价键理论和分子轨道理论分别对气态和固态SO3的分子结构进行解释, 从而有助于教师对相关理论的教学, 提高学生的兴趣.
关键词: 三氧化硫; 分子轨道理论; 杂化轨道理论;
Abstract: The molecular structure of SO3in gaseous and solid phase reported in the literature is reviewed based on modern valence bond theory and molecular orbital theory, which is helpful for teachers’teaching and students’learning in inorganic structural chemistry.
Keyword: SO3; molecular orbital theory; hybridization orbital theory;
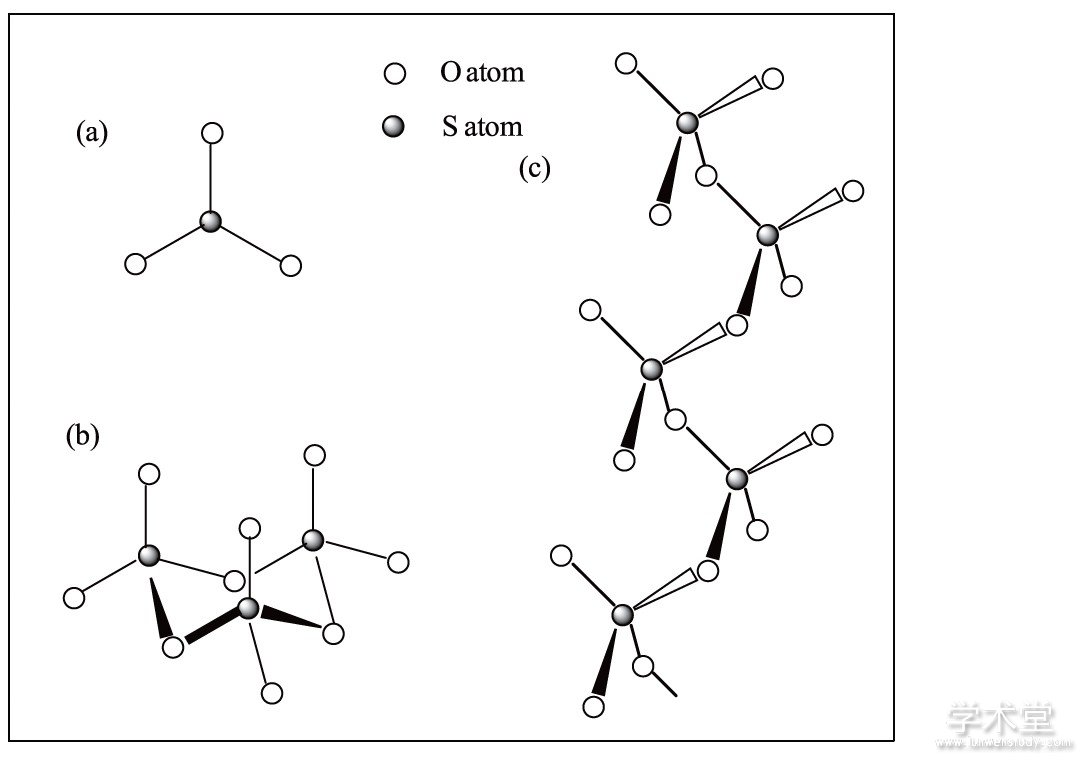
三氧化硫是常见的无机化合物, 但其分子结构和存在形式颇为复杂[1,2].三氧化硫在较稀浓度的气相状态下为单分子状态 (如图1 (a) 所示) , 分子结构属于D3h点群, 其中O—S—O键角为120°, S—O键长为142 pm.三氧化硫的气相和液相状态实际上是单体与环三聚体的平衡混合物.在熔点 (16.6℃) 以下析出了环三聚体的单晶, 为冰状无色晶体, 属斜方晶系, 称为γ-SO3 (如图1 (b) 所示) .γ-SO3中两个S原子之间的S—O键长为163 pm, 为典型的单键键长, 而端基S—O键的键长分别为137 pm和143 pm, 显然短于单键键长.若含有微量的水, 则析出白色针状晶体, 称为β-SO3 (如图1 (c) 所示) , 其分子结构为螺旋链状多聚体, 分子式可写作[SO2 (μ-O) ]n (n≈105) , 链中连接两个S原子的S—O键键长为161 pm, 端基S—O键长为141 pm.在痕量湿气或其他聚合剂存在下, 三氧化硫可能形成另外一种更稳定的形式, 称为α-SO3, 在链与链之间还存在着一些交联键
为什么同一种化合物会出现不同的分子结构?如何合理地解释这些分子结构形成的原因?这些问题是无机化学教学难点.本文拟收集整理相关资料, 梳理其中的知识点, 有助于教师对相关理论的教学, 提高学生的兴趣.
1 气态三氧化硫的分子构型及存在形式
1.1 基于杂化轨道理论的解释
目前许多无机化学教材和研究论文对气态三氧化硫分子结构的解释[3,4], 主要基于杂化轨道理论.要点是中心硫原子采取sp2杂化, 这与价层电子对互斥理论 (VSEPR) 所预测的平面正三角形分子构型的结论是一致的.然而, 在具体解释分子的成键情况时, 存在一些疑问.

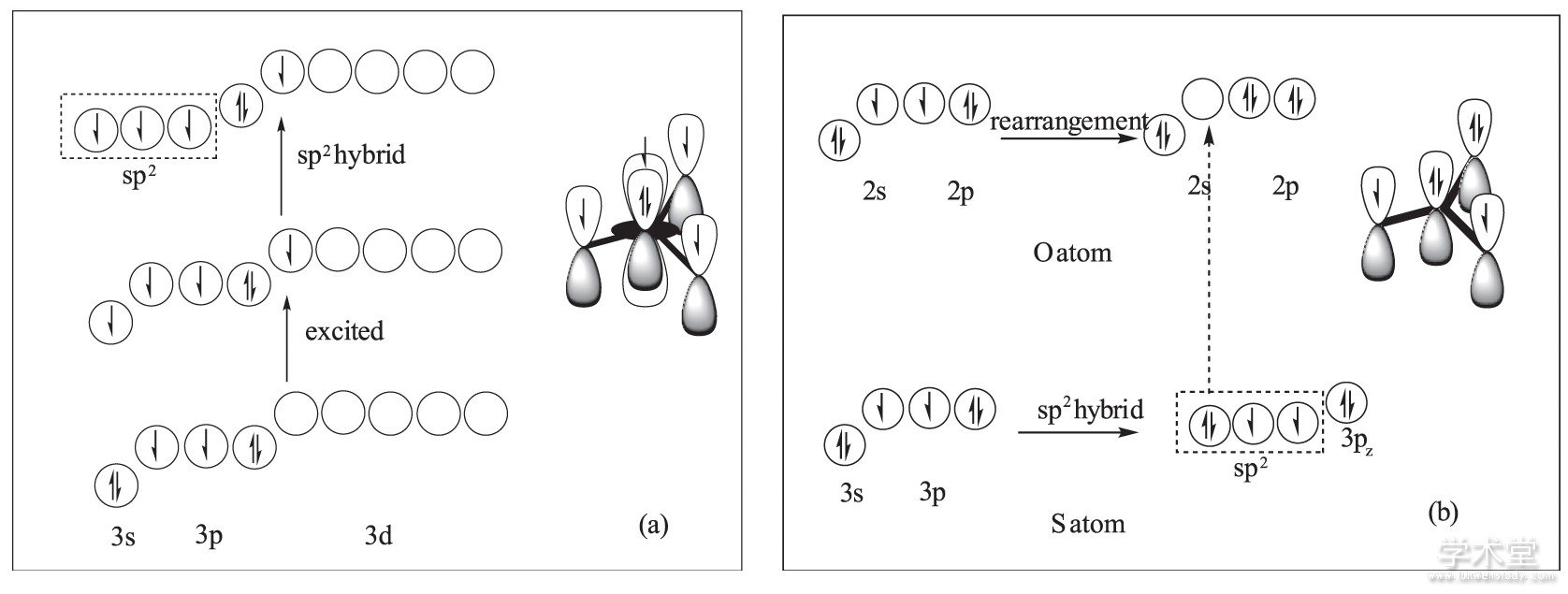
一种解释如图2 (a) 所示, 中心硫原子的基态价电子构型为3s23px13py13pz2, 为了得到3个等同的、被单电子占据的sp2杂化轨道, 需先将3s轨道上的一个电子激发到空的3dz2轨道上, 随后3s, 3px, 3py轨道进行sp2等性杂化;得到的3个杂化轨道分别与3个氧原子中被单电子占据的2p轨道各形成一个σ键, 此时硫原子中未参与杂化的3pz轨道 (成对电子占据, 垂直于分子平面) 、同方向的3dz2轨道 (单电子占据) 与3个氧原子的2pz轨道 (单电子占据) 彼此相互平行, 满足大π键形成条件, 形成π46键.这种解释中涉及了3dz2轨道参与大π键的形成, 由于S原子半径较大, “肩并肩”轨道间重合程度小, 对化学键的贡献值得怀疑.
图1 三氧化硫的单体 (a) 、三聚体 (b) 和链状多聚体 (c) 的结构示意图
另外一种解释是硫原子采取了sp2不等性杂化, 即所形成的sp2杂化轨道中的一条轨道被成对电子占据 (如图2 (b) 所示) .硫原子利用2个sp2轨道 (单电子占据) 与2个氧原子2px轨道 (单电子占据) 形成正常σ键, 同时利用剩余的被成对电子占据的sp2轨道与第三个氧原子经重排得到的空轨道形成σ配键;其后, 在垂直于分子平面的方向上, 形成σ配键的氧原子的2pz轨道提供2个电子, 另外两个氧原子的2pz轨道提供1个电子, 硫原子的3pz轨道提供2个电子, 形成了π46键.这种说法认为其中一个氧原子与硫形成σ配键而另外两个氧原子形成正常σ键, 而实际上在三氧化硫分子中的3个硫氧键是等同的, 因此仍存在疑问.
图2 杂化轨道理论对气态三氧化硫分子中化学键形成的两种解释
1.2 基于分子轨道理论的解释
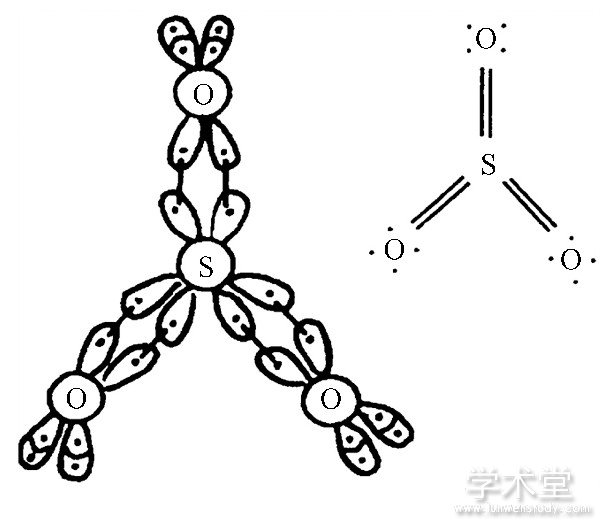
戴柏青教授课题组利用分子轨道理论自洽场法中的从头计算方法对SO3的成键性能进行了讨论[5].根据计算结果, 作者认为S原子的d轨道参与了成键, 且同时参与了π键和σ键的形成.借此反驳了简单分子轨道理论所提出的S原子d轨道不参与成键的结论.此外, 作者利用价键理论的广义价键法 (GVB) 对SO3这样的超价分子进行分析, 认为在S原子的价电子分裂成6个“单电子”, 与O原子形成3个Ω双键 (总共6个Ω键) , 这样S原子周围有12个电子 (如图3所示) .即, 在SO3分子中的双键是由等价的弯键构成的, 在能量上比 (σ+π) 键更稳定.
图3 由GVB法分析得到的SO3分子中成键情况
2 固态三氧化硫的分子构型及存在形式
2.1 基于杂化轨道理论的解释
无论是环状三聚体还是螺旋链状多聚体结构, 按照杂化轨道理论判断中心硫原子采取sp3杂化.S原子采取不等性sp3杂化获得4个杂化轨道, 其中2个被单电子占据和2个被成对电子占据;S原子利用2个被单电子占据的杂化轨道分别与2个氧原子形成正常σ键 (实际上这两个氧原子还同时与另外两个S原子形成了正常σ键, 即以作为氧桥连接了2个S原子) ;S原子利用两个被成对电子占据的杂化轨道与另外两个氧原子分别形成了2个p—dπ型反馈配键, 即端基S—O.
端基S—O的成键情况的解释类似于硫酸分子, 如图4所示.具体描述如下:首先, 假定氧原子的价电子发生重排, 形成2s22px02py22pz2的电子构型;硫原子利用一条被成对电子占据的sp3轨道与氧原子的2px空轨道形成σ型配键;而此时, 氧原子的2py轨道与硫原子的3dx2-y2空轨道以及氧原子的2pz轨道与硫原子3dz2空轨道分别满足能量相近、对称性匹配的条件, 实现一定程度的“肩并肩”重叠, 因而形成2个d—pπ型反馈配键.由于能量相差较多、重叠程度较差, 所以2个反馈π键的总键级大约只有0.5.故虽然在端基S—O间形成了1个σ型配键、2个d—pπ型反馈配键共3个化学键, 但通常仅用SO表示.
2.2 基于化学热力学计算的结果
我们可以简单地从焓效应和熵效应的角度来解释三氧化硫在固态成多聚的环状或链状结构, 而在温度较高的情况下, 在气态时以单体形式存在.在多聚的环状或链状结构中, 环上或者链上的每个氧原子分别与2个硫原子形成2根σ键.而在气态时, 相当于是这个氧原子断了一根σ键而将价电子用于参与大π键的形成, 从焓效应的角度上讲, 形成σ键所释放的能量比参与形成大π键所释放的能量更多, 所以在低温时, 固相的三氧化硫多聚.而当温度升高, 熵效应起了更加重要的作用, 多聚形式的三氧化硫解聚成单体有利于系统多样性的提升和混乱度的增大, 因此在气相中三氧化硫分子以单体形式存在.
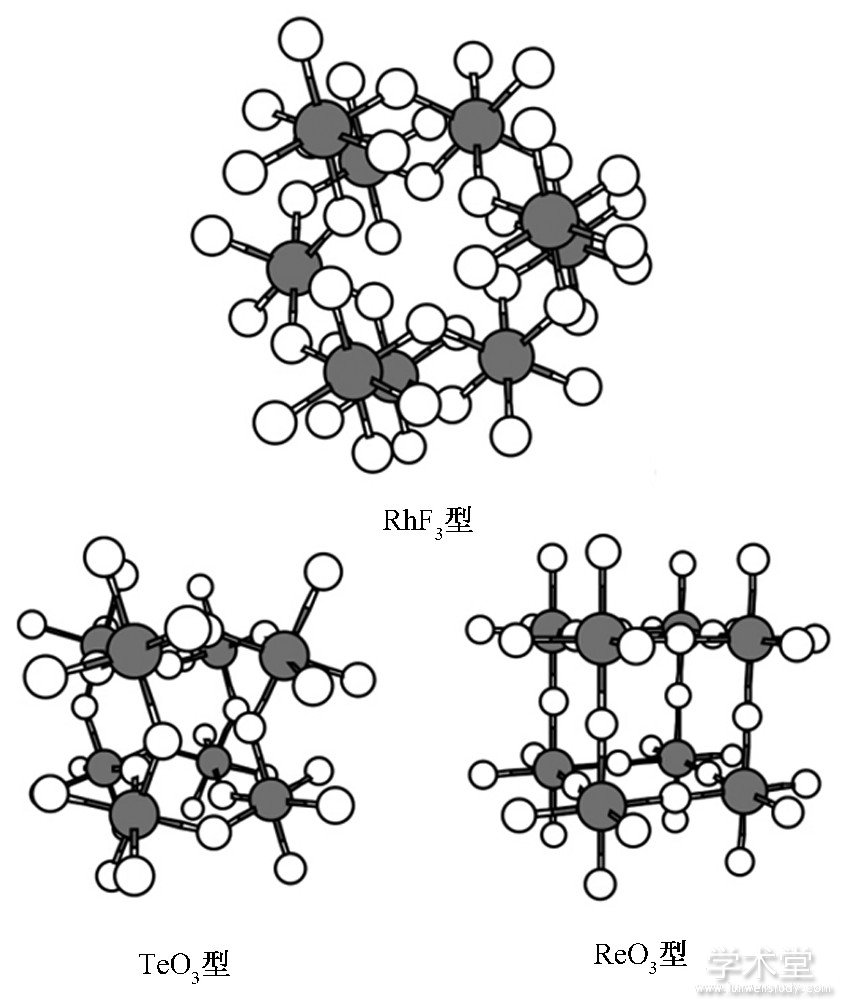
T.Tamm及其合作者[6]为了证实SO3分子中的硫原子配位数是否从3或4增加到6, 利用量化方法计算了形成几种固态SO3分子结构 (如图5所示) 的可能性.计算结果表明, 在高压条件下SO3分子有可能形成固态三维结构, 使得硫的配位数达到6, 其中形成ReO3型 (R3c) 所需要的压力最小, 大约是29 GPa.
图4 杂化轨道理论对固态三氧化硫分子中端基SO键的解释
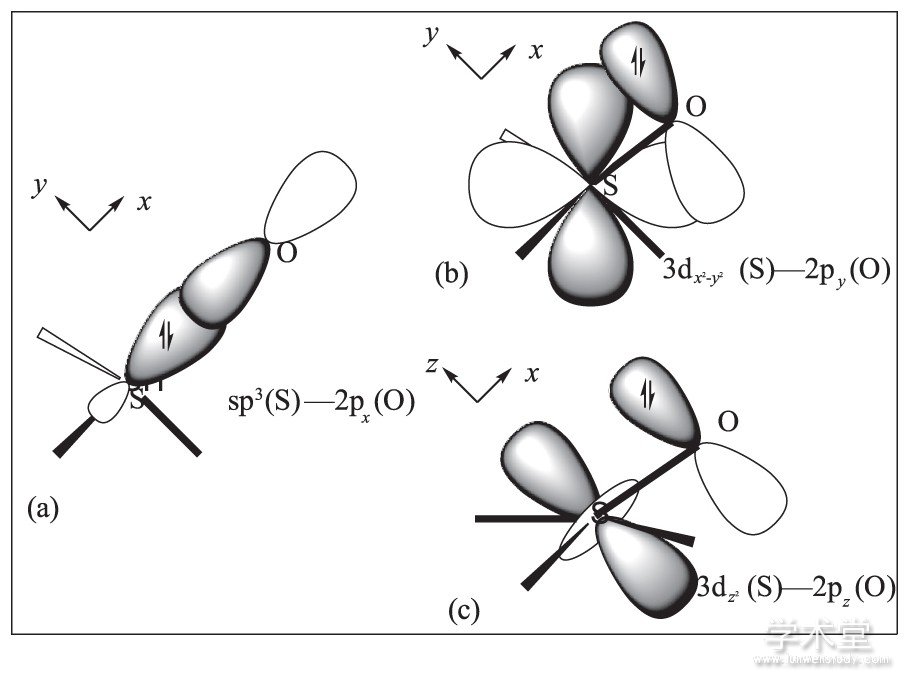
图5 推测的高压下固态SO3分子结构
3 结语
本文尝试基于现代价键理论和分子轨道理论分别对气态和固态SO3的分子结构进行解释, 弥补了无机化学教材中无解释或解释不清的缺陷, 为学生提供了具体的化学键理论应用实例, 并很好地说明了各化学键理论的应用局限性
参考文献:
[1]格林伍德, 厄恩肖.元素化学[M].曹礼庭, 等译.北京:高等教育出版社, 1996.
[2] 麦松威, 周公度, 李伟基.高等无机结构化学[M].北京:北京大学出版社, 2006.
[3]童吉灶, 付清秀.气态三氧化硫的分子结构探讨[J].上饶师范学院学报, 2011, 31 (3) :63-67.
[4]荣成, 蒋疆.三氧化硫分子杂化轨道的探讨[J].化学教育 (中英文) , 2017, 38 (12) :72-75.
[5]张桂玲, 戴柏青.超价分子SO2和SO3成键性的研究[J].化学通报, 2000 (10) :46-49.
[6] TAMM T, PYYKKO P. Possible high-pressure structure of sulfur trioxide[J]. Chem Comm, 2002:336-337.