摘要:三萜皂苷类化合物通常由一个或多个糖基连接在疏水的皂苷元上构成,其作为传统中草药的活性成分有着广泛应用。三萜皂苷类化合物的传统获取方法是从植物中提取,由于植物中三萜皂苷类化合物含量较低,植物生长受到土地资源、气候、环境等因素影响较大,严重制约了其大规模推广和应用。利用合成生物学技术,设计构建微生物细胞工厂合成三萜皂苷类化合物被认为是一种变革性的生产方法,成为新的研究热点。在三萜皂苷类化合物的合成过程中,糖基转移酶起着重要作用。本文将阐述利用糖基转移酶合成三萜皂苷类化合物的研究进展,为三萜皂苷类化合物的进一步应用提供参考。
关键词:三萜皂苷; 糖基化; 糖基转移酶; 合成生物学;
作者简介: 李诺楠(1995—),女,硕士研究生,lnuonan@163.com; 李春(1970—),男,博士,教授,lichun@bit.edu.cn;
收稿日期:2019-05-31
基金: 国家自然科学基金重点项目(21736002);
The applications of glycosyltransferases in the synthesis of triterpenoid saponins
LI Nuonan LI Chun
School of Chemistry and Chemical Engineering, Beijing Institute of Technology The State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology
Abstract:Triterpenoid saponins are usually composed of one or more glycosyl groups attached to hydrophobic aglycones, which are widely used as active ingredients in traditional Chinese herbal medicines. The traditional method for obtaining triterpenoid saponins is extracted from plants, due to the low content of triterpenoid saponins in plants and the limitation of plant growth by land resources, climate and environment, it has greatly restricted its large-scale promotion and application. Thus,It’s hard to be applied and popularized on large scale. The use of synthetic biology principles to design and construct microbial cell factories to synthesize triterpenoids is considered to be the most promising alternative and has become a new research hotspot. Glycosyltransferases play a key role in the synthesis of triterpenoid saponins. This article will describe the research progress in the synthesis of triterpenoid saponins using glycosyltransferases, and provide a reference for the further application of triterpenoid saponins.
Keyword:triterpenoid saponins; glycosylation; glycosyltransferases; synthetic biology;
Received: 2019-05-31
引 言
三萜类化合物是一类由6个异戊二烯单元(C5H8)组成的结构多样的化合物,在植物中这类化合物常以其糖基化形式存储[1]——即三萜皂苷。三萜皂苷由疏水的三萜皂苷元连接一个或多个糖基构成[2,3](图1)。植物体内的三萜皂苷类化合物在植物体防御微生物和食草动物侵害及信号传导等方面起到重要作用[2]。现代药理学研究证实,一些三萜皂苷类化合物对人体也有很强的生理活性,因此存在较高的药用价值[2],在医疗健康行业[4]、食品行业[5,6]、农业[7]等方面均有应用,受到广泛关注。三萜皂苷类化合物的传统制备方法是从植物中提取,但由于植物中含量较低[5,8],且提取工艺复杂,加之植物生长周期较长,受到气候环境等因素影响较大[9],无法为天然产物提取提供稳定的原料来源,极大地限制了其大规模生产。此外,也有利用植物细胞培养的方法生产这类化合物[10],但由于培养植物细胞所需周期长、操作复杂且生产成本较高,并且存在目标代谢产物的产量不稳定等问题[11],难以进行工业化生产;化学合成法方面,由于这类天然产物结构较复杂,合成过程繁琐,合成的产物中存在手性异构体难以分离,不易实现工业化。微生物由于具有培养周期短,可利用廉价碳源,适于进行大规模发酵等优点,为解决植物天然产物获取过程中存在的资源短缺和环境污染等问题提供了新的思路[12]。运用合成生物学方法构建用于生产三萜皂苷类化合物的微生物细胞工厂已成为热门研究课题。
图1 部分三萜皂苷类化合物结构式
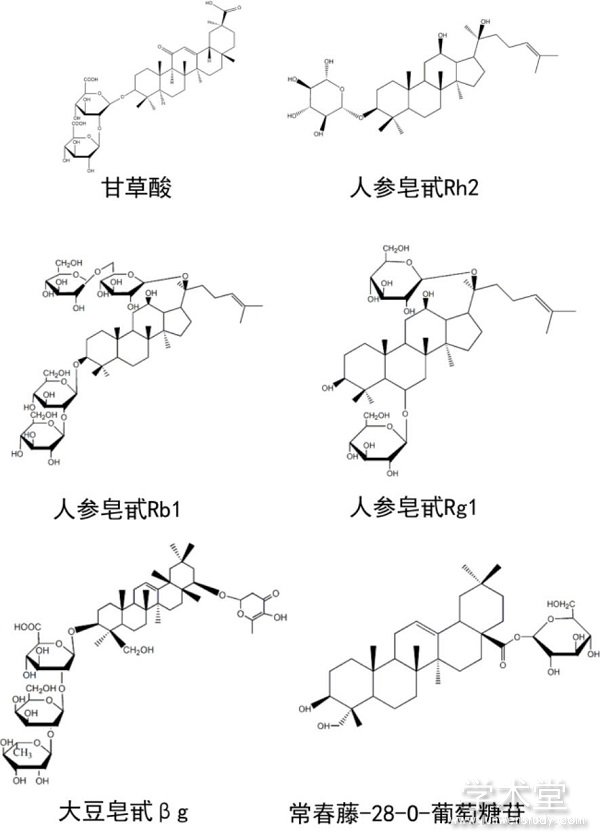
Fig.1 Structural formulae of some triterpenoid saponins
利用合成生物学方法,构建微生物细胞工厂生产植物天然产物的关键是对其代谢途径进行解析,挖掘关键基因元件并对其进行优化,提高外源基因与底盘宿主的适配性,进而对代谢途径进行优化。在三萜皂苷类化合物合成过程中,三萜骨架的糖基化是关键的反应,它利用糖基转移酶使糖基和天然产物之间形成特定的糖苷键来合成糖苷类化合物。本文在对三萜皂苷应用前景与制备现状进行分析的基础上,综述了糖基转移酶及其在三萜皂苷合成中的应用,为三萜皂苷类化合物未来的工业化生产提供思路。
1 三萜皂苷的应用前景及制备现状
1.1 三萜皂苷的应用前景
在植物中,三萜皂苷类化合物被认为是植物抵御病原微生物和食草动物侵害的一种自我保护机制[9,13],在植物防御侵害和信号传导等方面均起着重要作用[14]。由于这些化合物对人体也有生理活性[15],因此除了在医药领域,在与人类密切相关的其它领域如食品、药品、化妆品等领域也都有广泛需求。例如,被誉为“神草”的人参作为一种传统的名贵中药,在我国的使用历史已有上千年,《神农本草经》记载人参具有安神,明目,延年益寿的功效。人参皂苷是一类以原人参二醇、原人参三醇、齐墩果酸为苷元的糖基化产物的总称[16],现代药理学研究证实,人参及人参制品发挥临床药理作用主要是由于三萜皂苷类化合物在这些疾病的治疗中发挥着作用[4,17]。人参皂苷提取物被广泛应用到各个领域,市面上已有多种人参皂苷提取物相关的食品、保健品和药品销售。与人参同属五加科的常春藤因其四季常青的特点常被用作装饰植物,从常春藤的叶子中提取得到的常春藤提取物在抗氧化[18]、抗肿瘤[19]等方面均表现出较强的效果,通过对其提取物成分进行HPLC分析,结果表明常春藤提取物种中含有多种齐墩果烷型三萜皂苷[20]。作为传统中药的甘草,其有效成分甘草酸也是一种三萜皂苷,具有保肝护肝、抗炎、平喘等功效[5],在药品、化妆品等行业有广泛应用,同时,因甘草酸具有甜味,也被用作甜味剂添加到食品中[21]。由于三萜皂苷类化合物的需求广泛,因此,如何高效获取这类化合物成为了人们关注的焦点。
1.2 三萜皂苷的制备现状
长久以来,获取三萜皂苷类化合物的方式主要是从植物中提取,如从甘草中提取的甘草酸[22]、从人参中提取的人参皂苷[23]。随着社会的发展,这种生产方式所带来的弊端也日益显现。首先,栽培植物会占用土地资源,植物的生长周期一般较长且植株生长受到光照、温度、气候等因素影响较大;其次,这些三萜皂苷类化合物大多属于植物次级代谢产物,在植物中含量较低,且含量受到环境因素影响较大[24,25];除此之外,从植物中提取这些化合物的过程较繁琐,涉及到研磨粉碎、萃取、分离、浓缩、干燥、结晶等步骤[22],提取效率较低,提取过程中需用到大量有机试剂作为溶剂,所产生的废液也会对环境造成污染。
细胞全能性理论的提出为获取天然产物开辟了一条新的路径,即通过植物细胞培养的方法获取植物天然产物,但植物细胞培养也存在着对营养要求严苛、培养过程中易出现褐化现象等问题[26];此外,不同细胞系之间合成天然产物的能力存在较大差异,如何筛选得到稳定的高产细胞系也是研究人员面临的一大难题,植物细胞难以进行大规模培养,这也阻碍了其工业化应用。
除了以上两种方法外,化学合成法在三萜皂苷合成中也难以实现大规模应用。由于三萜皂苷结构复杂,化学合成步骤繁琐,所需反应条件严苛、且合成过程中可能存在难分离的手性化合物,这些因素使得化学合成法在经济效益上不具备竞争力,难以进行推广。
面对这些问题,人们迫切地需要一种绿色的、可持续的、经济效益高的生产模式来突破传统生产方法的困境。微生物具备培养周期短、可利用廉价碳源等优势,为可持续发展提供了可能。为解决传统的制备方法带来的弊端,研究人员积极探索利用微生物来构建细胞工厂,实现高效绿色地生产植物天然产物,为此做出了许多尝试,通过利用微生物合成萜类及皂苷类化合物已经取得了一些不错的成果。2013年,Keasling等人在抗疟疾药物前体青蒿酸的合成中取得的成功为人们提供了极大的信心[27],此后,越来越多的结构更复杂的皂苷类化合物被合成,如多种人参皂苷[28,29,30,31]、积雪草皂苷[32,33],常春藤皂苷[34,35,36]等。而在利用微生物合成天然产物的过程中,目标基因元件的挖掘对于解析天然产物的合成途径至关重要。
在生物体内,萜类化合物主要是由异戊烯基焦磷酸(IPP)单元聚合而成,IPP主要由甲羟戊酸途径(MVA途径)和甲基赤藓糖-4-磷酸途径(MEP途径)产生(图2)。在自然界中,三萜和倍半萜通过MVA途径合成,而单萜、二萜和四萜通过MEP途径合成(图2)[2]。在三萜皂苷的合成过程中,第一个造成三萜骨架多样化的反应是氧化鲨烯环化酶(OSC)催化的环化反应,不同的植物体内含有种类多样的OSC酶,可以催化形成不同的三萜基本骨架。随后细胞色素P450酶(CYP450)对三萜骨架进行修饰,得到引入功能性官能团(-OH,-COOH等)的皂苷元[37,38]。CYP450功能的多样性进一步导致了形成的三萜产物的多样性,同时,CYP450修饰使得进一步的糖基化修饰成为可能,也改善了萜类化合物的水溶性和生物活性[2]。在植物天然产物的合成中,催化糖基化反应的酶主要是UDP-糖基转移酶(UGT),这类酶以核苷酸糖作为糖基供体,三萜皂苷元作为糖基受体,在UGT的催化下,二者之间可以形成糖苷键,生成三萜皂苷[39]。
图2 MVA 途径和MEP途径示意图
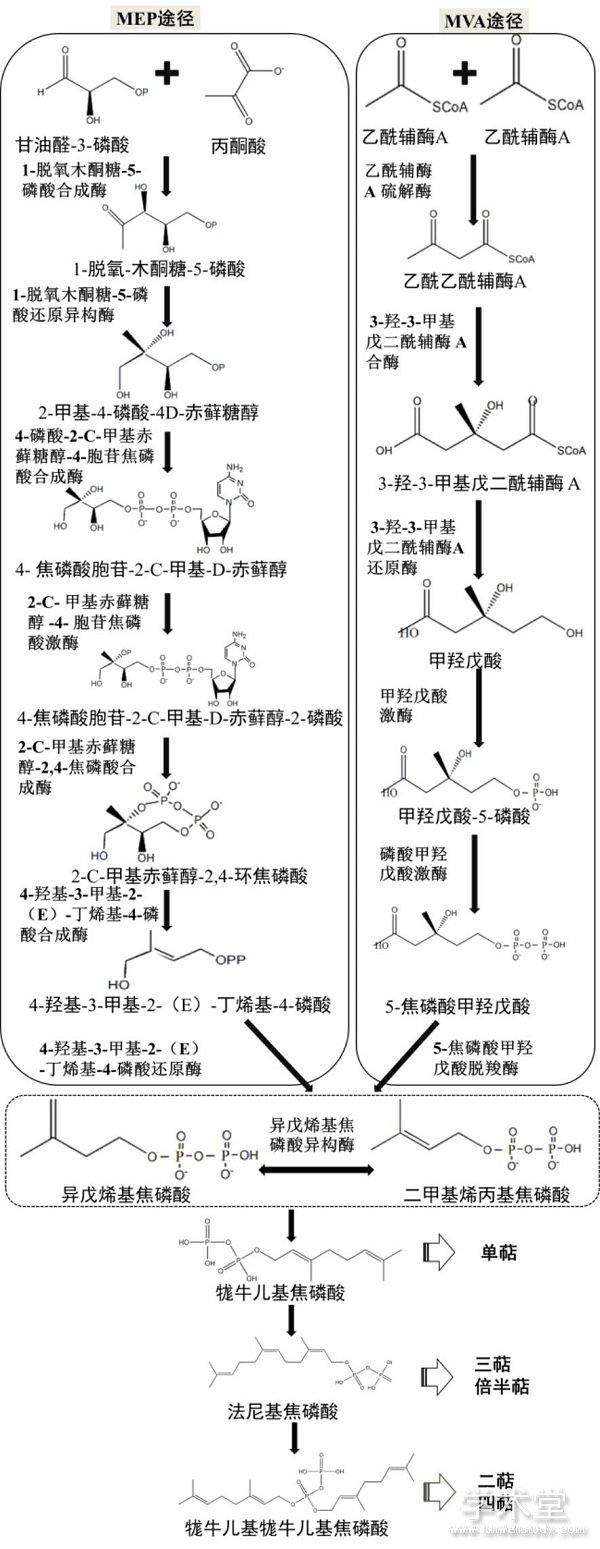
Fig.2 Schematic diagram of MVA pathway and MEP pathway
1.3 三萜皂苷合成相关基因的挖掘
通过对植物天然产物代谢途径进行解析,可以挖掘植物天然产物代谢途径的特征基因元件,进而实现三萜皂苷的高效生产。
随着测序技术的不断变革和进步,越来越多的非模式植物尤其是药用植物的基因组相继被解析[8,40,41]。测序信息有助于预测三萜皂苷合成相关的基因[42],通过差异转录组测序分析挖掘候选基因,如通过比较高产和低产植物或组织之间的转录组差异,可以挖掘出三萜皂苷合成相关的关键基因。例如,通过对甘草的转录组数据进行分析,Liu等[43]挖掘到了773个与甘草中次级代谢产物合成相关的基因,40个萜类化合物骨架合成相关的基因,16个与甘草酸合成相关的基因。在竹节参的转录组分析中[17],Zhang等通过对竹节参的转录组重头组装以及高通量RNA-seq分析,从19.6 Gbp的转录组数据中发现了66,403条 Unigenes,并对其中34,639条Unigenes进行了注释,在这其中预测出了与皂苷骨架修饰相关的34个细胞色素P450酶基因和18个UDP-糖基转移酶基因。Tang等[44]从姜状三七(一种人参属植物)的转录组中首次挖掘到了4种齐墩果酸葡萄糖醛酸基转移酶,能特异性地在齐墩果酸的C-3位羟基上转移葡萄糖醛酸基团,生成齐墩果酸3-O-β-葡萄糖醛酸,为合成齐墩果酸型人参皂苷打下了良好的基础。
除了挖掘底物特异性强的酶,也有学者将底物杂泛性的酶应用到天然产物合成途径中。Dai等[45]就利用一种来自于枯草芽孢杆菌168(Bacillus subtilis 168)的糖基转移酶Bs-YjiC来合成人参皂苷,体外实验证实,以原人参三醇(PPT)作为糖基受体,UDP-葡萄糖作为糖基供体时,Bs-YjiC能将葡萄糖基团转移到PPT的C3位OH,C6位OH和C12位OH上,合成了五种PPT型人参皂苷,其中包括人参皂苷Rh1和四种非天然的人参皂苷,表明来自于微生物的底物杂泛性的糖基转移酶在合成新型人参皂苷方面具有很大的潜力。而另一种来自于枯草芽孢杆菌 Bacillus subtilis的底物杂泛性的酶UGT109A1也展示出极强的底物杂泛性,将UGT109A1在大肠杆菌中异源表达,分别以人参皂苷Re、Rf、Rh1、和R1作为糖基受体,UDP-糖作为糖基供体进行体外反应,结果表明,UGT109A1可以将糖基转移到人参皂苷Re和人参皂苷R1的C-3位OH上,也可以将糖基转移到人参皂苷 Rf和人参皂苷Rh1的C-3位羟基和C-12位羟基上,产物中包括多种非天然的人参皂苷[46]。此外,也有研究者利用酵母内源的糖基转移酶UGT51来生产人参皂苷,通过解析UGT51的晶体结构,并依据晶体结构对其进行半理性设计,将其体外催化原人参二醇生成人参皂苷 Rh2的效率提高了1800倍,通过将改造后的糖基转移酶UGT51导入到具备了原人参二醇合成途径的酿酒酵母中,使得酿酒酵母生产人参皂苷Rh2的产量从0.0032 mg/g DCW (Dry Cell Weight)增加到0.39 mg/g DCW[47]。这些研究显示出了底物杂泛性的酶在植物三萜皂苷类天然产物异源合成中的巨大潜力,为利用底物杂泛性的酶进行天然产物合成提供了指导。
2 糖基转移酶与三萜皂苷的合成
三萜皂苷由疏水的皂苷元连接一个或多个糖基构成,其中糖基转移酶在这一过程中起着重要作用,糖基化改变了植物中三萜化合物的一些理化性质和生物活性[48]。
糖基转移酶是一类将活化的糖基供体转移到受体分子上的酶,为糖基转移酶提供糖基供体的分子较多,其中主要分为核苷酸糖和磷酸酯糖以及磷酸化的糖[49],其中以UDP-糖作为糖基供体的一类糖基转移酶命名为UDP-糖基转移酶[50]。糖基化反应在自然界分布广泛,其受体包括蛋白质、脂质、核酸以及一些天然小分子(主要是一些次级代谢产物)等[51]。糖基化化合物在生物体内直接发挥广泛功能,包括储存能量、维护细胞结构的完整性、信息存储与传输、分子识别、细胞之间相互作用、细胞调节、免疫反应、毒性和化学防御等[8,51,52]。
2.1 糖基转移酶的分类及催化机理
糖基化一般参与天然产物合成过程中的最后一步反应,有助于形成植物次级代谢产物的多样性。目前普遍认可的糖基转移酶分类方法是按照氨基酸序列相似度来进行分类,CAZy数据库(http://www.cazy.org)对已报道的糖基转移酶进行了分类,根据氨基酸序列相似度、催化机制等差异,将其分为106个家族[48]。而根据糖基转移酶所催化形成的糖苷键类型分类,又可分为O-糖苷键类糖基转移酶、N-糖苷键类糖基转移酶、S-糖苷键类糖基转移酶、C-糖苷键类糖基转移酶等,其中,催化植物天然产物形成的糖基转移酶以O-糖苷键型为主,少数为N-糖苷键型和S-糖苷键型[51]。
糖基转移酶催化糖基转移到亲核的糖基受体上,以糖基供体上的异头碳构象在转移到糖基受体上是否发生改变可将糖基转移酶分为保留型和反转型,若构象不发生变化即为保留型,构象发生改变即为反转型[51](图3)。反转型糖基转移酶采用的是直接置换SN2样反应,酶催化活性位点氨基酸的侧链作为碱基,对受体进行亲核攻击,形成过渡态,随后催化基质从受体基质上夺取一个质子促使对糖异构体进行亲核攻击,并促使糖苷键形成,构象发生改变。对于保留型的糖基转移酶的催化机制尚无定论,一种假设是保留型糖基转移酶遵循双置换理论,即糖基和酶先形成共价中间体,后转移到受体分子上形成糖苷键[10]。
接下来将以三类典型三萜皂苷的合成为例,介绍糖基转移酶的挖掘及应用。
图3 反转型和保留型糖基转移酶催化机制
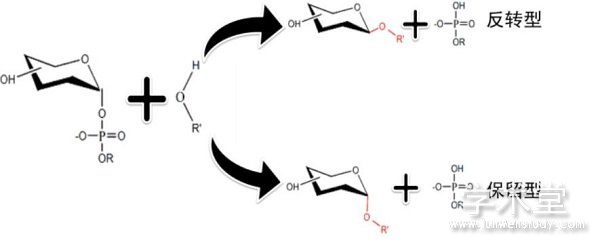
Fig.3 Inverting and retaining glycosyltransferase catalysis mechanism
2.2 糖基转移酶在三萜皂苷合成中的应用
2.2.1 人参皂苷合成相关的糖基转移酶
人参是我国名贵中药,被誉为“神草”,人参对于调节血压、代谢、免疫等方面均有作用[53,54],但直到人参皂苷类化合物从人参中被提取出来,人参的药用机理才被证实[53],其中的人参皂苷类化合物被确定是人参发挥提高免疫力[53]、降血压[53]、抗肿瘤等功效的主要物质[4,53,55,56,57]。在2013年,Dai等[28]通过在酿酒酵母中引入来自于人参的达玛烯二醇-II合酶基因和原人参二醇合酶基因以及来自于拟南芥的NADPH-细胞色素P450还原酶基因,成功地在酿酒酵母中构建了原人参二醇(PPD)合成路径,原人参二醇产量达到了0.05 mg/g DCW,之后,又通过过表达截短的3-羟基-3-甲基-戊二酰辅酶A还原酶基因、法尼基焦磷酸合酶基因、鲨烯合酶基因、2,3-氧化鲨烯合酶基因来增加前体鲨烯和2,3-氧化鲨烯的供应,并通过对原人参二醇合酶基因进行密码子优化提高了该酶在酿酒酵母中的表达量,这些策略共同使得原人参二醇的产量提高了262倍。最后,通过两相发酵的方法使得原人参二醇的产量达到了8.40 mg/g DCW (1189 mg/L),达玛烯二醇-II的产量达到了10.94 mg/g DCW (1548 mg/L),该研究为利用酿酒酵母生产人参皂苷提供了基础。2015年,中国科学院上海植物生理生态研究所和中国科学院上海药物研究所以及复旦大学生命科学学院和生物医学科学研究所联合合作,从人参中克隆得到了两个UGT基因,其中UGTPg45选择性地将葡萄糖基转移到原人参二醇及其人参皂苷的C3羟基上,UGTPg29选择性地将一个葡萄糖基团转移到Rh2的C3位的葡萄糖基团上。基于此,将这两个糖基转移酶基因转移到可以合成原人参二醇的酿酒酵母中,实现了利用葡萄糖来生产稀有的人参皂苷Rh2和Rg3[58]。此后,该研究团队通过对酿酒酵母底盘宿主的MVA途径进行优化以及提高CYP450基因表达水平,原人参二醇的摇瓶产量达到了529.0 mg/L,在10L发酵罐产量可达到11.02 g/L,极大地提高了人参皂苷的前体原人参二醇的供应量。通过增加糖基转移酶UGTPg45的基因拷贝数及对其进行启动子工程改造,并通过对UGTPg45进行定向进化提高其催化效率,此外,通过挖掘新的糖基转移酶UGTPn50,在这些策略的共同作用下,同时利用两个酶生产人参皂苷Rh2,摇瓶产量达到了179.3 mg/L,在10L 发酵罐中产量达到了2.25 g/L [30]。2014年,Zhou等人通过从NCBI数据库公布的人参基因数据库中挖掘到了479689个组装的cDNA序列,通过利用植物次级代谢产物糖基转移酶保守序列(PSPG-box)确定了512个潜在的UGT编码序列,并克隆得到了16个基因序列,在这些序列中发现了一个可以催化生成人参皂苷CK的糖基转移酶UGTPg1[59]。此后,研究者还分别在酿酒酵母[47]、枯草芽孢杆菌[46]等微生物中发现了一些底物杂泛性的酶,分别可以催化生成人参皂苷Rh2和一些非天然的人参皂苷产物。这些研究较全面的地解析了相关人参皂苷的合成路径,为实现天然产物的合成生物学制造及利用微生物生产天然产物提供了范例。
2.2.2 甘草次酸衍生物合成相关的糖基转移酶
甘草是我国传统中药,有着“十方九草”的美誉。研究发现,甘草及提取自甘草的活性成分具备祛痰[60]、平喘[61]、抗病毒[62]和保肝护肝[63]等功效。甘草中的皂苷类化合物含量在5%-11%不等[64]。目前,在甘草中分离得到的三萜皂苷均为齐墩果烷型三萜苷元的衍生物[64]。其中,以甘草次酸作为苷元的三萜皂苷类化合物占比例较大。此前,甘草次酸合成相关的关键酶及合成途径已相继被解析[65,66,67],甘草次酸是甘草酸的苷元,在糖基转移酶的作用下,两个葡萄糖醛酸基团被转移到甘草次酸的C-3位OH上,得到甘草酸(图1)。目前,与甘草酸合成相关的糖基转移酶的报导较少,在2016年,Xu等[68]报导了在甘草中挖掘到了一种新的糖基转移酶,该酶可以催化连续两步的转糖基反应,但相关研究未见后续报导。在2018年,He等人[69]通过对已报道的的乌拉尔甘草转录组数据进行分析来挖掘可以形成C-30位酯键的糖基转移酶基因,在43个候选基因中,成功克隆得到了16个基因,以甘草酸作为糖基受体,以UDP-葡萄糖作为糖基受体,验证挖掘到的新的糖基转移酶的催化活性,最终筛选得到了一个新的糖基转移酶UGT73F17,该酶可将葡萄糖基团转移到甘草酸的30位羟基上,生成甘草皂苷A3,UGT73F17对五环三萜类化合物的C-30/C-29的羧基具有严格的区域特异性,并对糖基供体表现出高度的杂泛性,且该酶只能催化齐墩果烷型三萜及其衍生物的C29/30位糖基化。除此之外,Liu等[70]报导了利用来自于欧洲山芥的糖基转移酶BVEc催化甘草次酸生成其糖基化衍生物,糖基转移酶BVEc可以将葡萄糖基转移到甘草次酸的3号位上,生成3-O-单葡萄糖基甘草次酸。这些研究对探索甘草中三萜皂苷类化合物合成方式具有指导意义。
2.2.3 大豆皂苷及其相关糖基转移酶
大豆中主要的皂苷类化合物就是大豆皂苷,根据其苷元不同被分为DDMP型皂苷和Group A皂苷,DDMP皂苷以大豆甾醇B作为苷元,Group A皂苷以大豆甾醇A作为苷元。DDMP皂苷及其衍生物对人体健康有一定的益处[71,72],部分Group A类皂苷因其涩味而影响其口感[2]。大豆皂苷βg是典型的DDMP型皂苷,也是大豆中的主要的皂苷,在大豆甾醇B的3号位羟基上连接着三种糖基——葡萄糖醛酸基、半乳糖基和鼠李糖基,UGT73P2和UGT91H4分别负责转移第二个和第三个糖基到糖链上[73],而关于在大豆皂苷三号位上转移葡萄糖醛酸基团的糖基转移酶曾在大豆微粒体中被检测到[74],但是相关基因信息尚未被报导。除了C-3位的糖基化,Group A皂苷的C-22位羟基也可与糖基结合,Sayama 等[75] 报导了UGT73F4和UGT73F2可分别将木糖和葡萄糖转移到已经与C-22位羟基结合的阿拉伯糖上,但负责将阿拉伯糖基转移到C-22位羟基上的糖基转移酶尚未被解析。
3 展望
利用合成生物学和代谢工程手段,设计快速、便捷的异源合成三萜皂苷类化合物的方法有着巨大的应用前景,在这个过程中,糖基转移酶起着关键作用。由于糖基转移酶具有独特的区域选择性和立体选择性,因此,在解析酶的晶体结构基础上,阐明不同的糖基转移酶在三萜皂苷的不同位置和不同寡糖链形成中的催化机制对于高效合成三萜皂苷及新型皂苷类化合物具有重要意义。目前,研究较多的糖基转移酶主要是参与形成O-糖苷键的糖基转移酶,但对于参与形成N-糖苷键、S-糖苷键以及C-糖苷键的糖基转移酶的研究较少,这类糖基转移酶对于合成新的糖苷化合物,特别是对于人体具有生物活性物质来说是极具吸引力的。
综上所述,当前采用合成生物学方法,利用糖基转移酶进行糖基化反应合成三萜皂苷类产物的研究受到广泛关注。尽管目前通过构建微生物细胞工厂来获取天然产物的生产方式与预期还有一定差距,对于天然产物合成途径相关的基因元件的挖掘以及合成路径的解析还处于初步探索阶段,如何精确高效地预测相关基因元件一直是人们面临的问题。此外,利用微生物细胞工厂获取植物天然产物的方式还不能完全替代传统的方法,微生物合成一些天然产物的产量尚不足以达到工业化要求。但可以预见,伴随着合成生物学和代谢工程的发展,以及高通量测序技术和代谢组学技术的发展,非模式植物的基因组和转录组的测序将会更加高效准确,通过对这些基因组、转录组数据进行挖掘,有望加快三萜皂苷生物合成相关的新基因的发现,对于三萜皂苷类天然产物合成途径的解析也将会逐步深入。伴随着人工智能理论和技术的发展,未来,通过将人工智能等自动化技术与新基因的挖掘、筛选,代谢途径的优化,高效细胞工厂的构建结合起来,将大大地降低人力物力耗费、节省时间成本。
通过挖掘相关基因元件,设计合成路径来构建细胞工厂,高效获取这类天然产物将继续成为未来一段时间的研究方向。近些年,随着酵母等微生物用于生产植物天然产物方面取得了显着进展,重组酵母的三萜皂苷途径工程有望发展成为一种适合于三萜皂苷类化合物工业化生产的工艺。相信在不久的将来,人们将迎来一个全新的利用微生物合成植物天然产物的合成生物学时代。
符 号 说 明
CYP450——细胞色素P450酶
DCW——细胞干重
DMAPP——二甲基烯丙基焦磷酸
HPLC——高效液相色谱
IPP——异戊烯基焦磷酸
MVA——甲羟戊酸
MEP——甲基赤藓糖-4-磷酸
NADPH——还原型烟酰胺腺嘌呤二核苷酸磷酸
OSC——氧化鲨烯环化酶
PPT——原人参三醇
PSPG-box——植物次级代谢产物糖基转移酶保守序列
UGT——尿苷二磷酸糖基转移酶
βAS——β-香树脂醇合酶
参考文献
[1] Vincken J P, Heng L, Groot A D, et al. Saponins, classification and occurrence in the plant kingdom[J]. Phytochemistry, 2007, 68(3): 275-297.
[2] Sawai S, Saito K. Triterpenoid biosynthesis and engineering in plants[J]. Frontiers in Plant Science, 2011, 2(25): 1-8.
[3] Gauthier C, Legault J, Pichette A. Recent progress in the synthesis of naturally occurring triterpenoid saponins[J]. Mini-Reviews in Organic Chemistry. 2009, 6(4): 321-344.
[4] Qi L W, Wang C Z, Yuan C S. Ginsenosides from American ginseng: chemical and pharmacological diversity[J]. Phytochemistry, 2011, 72(8): 689-699.
[5] Zhao Y J, Lv B, Feng X D, et al. Perspective on biotransformation and de novo biosynthesis of licorice constituents[J]. Journal of Agricultural and Food Chemistry, 2017, 65(51): 11147-11156.
[6] Itkin M, Davidovich-Rikanati R, Cohen S, et al. The biosynthetic pathway of the nonsugar, high-intensity sweetener mogroside V from Siraitia grosvenorii[J]. Proceedings of the National Academy of Sciences. 2016, 113(47): E7619-E7628.
[7] Scognamiglio M, D'Abrosca B, Fiumano V, et al. Oleanane saponins from Bellis sylvestris Cyr. and evaluation of their phytotoxicity on Aegilops geniculata Roth[J]. Phytochemistry, 2012, 84(12): 125-134.
[8] Zhao Y J, Li C. Biosynthesis of plant triterpenoid saponins in microbial cell factories[J]. Journal of Agricultural and Food Chemistry, 2018, 66(46): 12155?12165.
[9] Szakiel A, P?czkowski C, Henry M. Influence of environmental biotic factors on the content of saponins in plants[J]. Phytochemistry Reviews, 2011, 10(4): 471-491.
[10] Lairson L L, Henrissat B, Davies G J, et al. Glycosyltransferases: structures, functions, and mechanisms[J]. Annual Review of Biochemistry, 2008, 77: 521-555.
[11] Roberts S C. Production and engineering of terpenoids in plant cell culture[J]. Nature Chemical Biology, 2007, 3(7): 387-395.
[12] Zhao F L, Bai P, Nan W H, et al. A modular engineering strategy for high‐level production of protopanaxadiol from ethanol by Saccharomyces cerevisiae[J]. AIChE Journal, 2019, 65(3): 866-874.
[13] Kuzina V, Ekstr?m C T, Andersen S B. Identification of defense compounds in Barbarea vulgaris against the herbivore Phyllotreta nemorum by an ecometabolomic approach[J]. Plant Physiology, 2009, 151(4): 1977-1990.
[14] Augustin J M, Sylvia D, Tetsuro S, et al. UDP-glycosyltransferases from the UGT73C subfamily in Barbarea vulgaris catalyze sapogenin 3-O-glucosylation in saponin-mediated insect resistance[J]. Plant Physiology, 2012, 160(4): 1881-1895.
[15] Xu J, Wang X D, Zhang H Y, et al. Synthesis of triterpenoid derivatives and their anti-tumor and anti-hepatic fibrosis activities[J]. Natural Product Research, 2018: 1-7.DOI:10.1080/14786419.2018.1499642.
[16] 戴住波, 王勇, 周志华, 等. 植物天然产物合成生物学研究[J]. 中国科学院院刊, 2018, 33(11): 106-116.
[17] Zhang S P, Wu Y Y, Jin J, et al. De novo characterization of Panax japonicus C. A. Mey transcriptome and genes related to triterpenoid saponin biosynthesis[J]. Biochemical and Biophysical Research Communications, 2015, 466(3): 450-455.
[18] Gül?in ?, Mshvildadze V, Gepdiremen A, et al. The antioxidant activity of a triterpenoid glycoside isolated from the berries of Hedera colchica: 3-O-(beta-D-glucopyranosyl)-hederagenin[J]. Phytotherapy Research, 2006, 20(2): 130-134.
[19] Cheng L, Liang S, Wu J, et al. A hederagenin saponin isolated from Clematis ganpiniana induces apoptosis in breast cancer cells via the mitochondrial pathway[J]. Oncology Letters, 2018, 15(2): 1737-1743.
[20] 刘家鑫, 陈明明, 杨雪艳, 等. 常春藤药材HPLC指纹图谱及8种成分的含量测定方法[J]. 沈阳药科大学学报, 2017, 34(11): 979-986.
[21] 田庆来, 官月平, 张波, 等. 甘草有效成分的药理作用研究进展[J]. 天然产物研究与开发, 2006,18(2): 343-347.
[22] 崔杏雨, 崔健, 陈树伟. 甘草酸制备新工艺的研究[J]. 太原理工大学学报, 2001, 32(3): 271-273.
[23] 韩金玉, 刘翀, 王华, 等. 正相液相制备色谱分离纯化三七叶甙中人参皂甙单体Rb3[J]. 高校化学工程学报, 2005, 19(2): 192-196.
[24] 孟祥颖, 刘银燕. 氮, 磷, 钾配合施用对人参质量影响的研究[J]. 质量指南, 1996, (6): 36-37.
[25] 张治安,徐克章. 光照条件对参株碳水化合物和人参皂甙含量的影响[J]. 吉林农业大学学报, 1994, (3): 15-17.
[26] 邢建民, 赵德修, 李茂寅, 等. 植物细胞培养生产黄酮类化合物研究进展[J]. 中国生物工程杂志, 2001, 21(1): 47-50.
[27] Paddon C J, Westfall P J, Pitera D J, et al. High-level semi-synthetic production of the potent antimalarial artemisinin[J]. Nature, 2013, 496(7446): 528.
[28] Dai Z B, Liu Y, Zhang X A, et al. Metabolic engineering of Saccharomyces cerevisiae for production of ginsenosides[J]. Metabolic Engineering, 2013, 20: 146-156.
[29] Dai Z B, Wang B B, Liu Y, et al. Producing aglycons of ginsenosides in bakers’yeast[J]. Scientific Reports, 2014, 4: 3698.
[30] Wang P P, Wei W, Ye W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency[J]. Cell Discovery, 2019, 5(1): 5.
[31] Jung S C, Kim W, Park S C, et al. Two ginseng UDP-glycosyltransferases synthesize ginsenoside Rg3 and Rd[J]. Plant and Cell Physiology, 2014, 55(12): 2177-2188.
[32] Kim O T, Um Y, Jin M L, et al. A novel multifunctional C-23 oxidase, CYP714E19, is involved in asiaticoside biosynthesis[J]. Plant and Cell Physiology, 2018, 59(6): 1200-1213.
[33] Kim O T, Jin M L, Lee D Y, et al. Characterization of the asiatic acid glucosyltransferase, UGT73AH1, involved in asiaticoside biosynthesis in Centella asiatica (L.) Urban[J]. International Journal of Molecular Sciences, 2017, 18(12): 2630.
[34] Han J Y, Chun J H, Oh S A, et al. Transcriptomic analysis of Kalopanax septemlobus and characterization of KsBAS, CYP716A94 and CYP72A397 genes involved in hederagenin saponin biosynthesis[J]. Plant and Cell Physiology, 2017, 59(2): 319–330.
[35] Erthmann P ?, Agerbirk N, Bak S. A tandem array of UDP-glycosyltransferases from the UGT73C subfamily glycosylate sapogenins, forming a spectrum of mono- and bisdesmosidic saponins[J]. Plant Molecular Biology, 2018, 97(1/2): 1-19.
[36] Liu Q, Khakimov B, Cárdenas P D, et al. The cytochrome P450 CYP72A552 is key to production of hederagenin‐based saponins that mediate plant defense against herbivores[J]. New Phytologist, 2019, 222(3): 1599-1609.
[37] Sun W T, Qin L, Xue H J, et al. Novel trends for producing plant triterpenoids in yeast[J]. Critical Reviews in Biotechnology, 2019, 39(5): 618-632.
[38] Augustin J M, Kuzina V, Andersen S B, et al. Molecular activities, biosynthesis and evolution of triterpenoid saponins[J]. Phytochemistry, 2011, 72(6): 435-457.
[39] Seki H, Tamura K, Muranaka T. P450s and UGTs: key players in the structural diversity of triterpenoid saponins[J]. Plant and Cell Physiology, 2015, 56(8): 1463-1471.
[40] Jeena G S, SFatima, Tripathi P, et al. Comparative transcriptome analysis of shoot and root tissue of Bacopa monnieri identifies potential genes related to triterpenoid saponin biosynthesis[J]. BMC Genomics, 2017, 18(1): 490.
[41] Luo H M, Sun C, Sun Y Z, et al. Analysis of the transcriptome of Panax notoginseng root uncovers putative triterpene saponin-biosynthetic genes and genetic markers[J]. BMC Genomics, 2011, 12(5): S5.
[42] Moses T, Pollier J, Faizal A, et al. Unraveling the triterpenoid saponin biosynthesis of the African shrub Maesa lanceolata[J]. Molecular Plant, 2015, 8(1): 122-135.
[43] Liu Y L, Zhang P F, Song M L, et al. Transcriptome analysis and development of SSR molecular markers in Glycyrrhiza uralensis Fisch[J]. Plos One, 2015, 10(11): e0143017.
[44] Tang Q Y, Chen G, Song W L, et al. Transcriptome analysis of Panax zingiberensis identifies genes encoding oleanolic acid glucuronosyltransferase involved in the biosynthesis of oleanane-type ginsenosides[J]. Planta, 2018, 249(2): 393–406.
[45] Dai L H, Li J, Yang J G, et al. Use of a promiscuous glycosyltransferase from Bacillus subtilis 168 for the enzymatic synthesis of novel protopanaxatriol-type ginsenosides[J]. Journal of Agricultural and Food Chemistry, 2018, 66(4): 943?949.
[46] Zhang T T, Gong T, Hu Z F, et al. Enzymatic synthesis of unnatural ginsenosides using a promiscuous UDP-glucosyltransferase from Bacillus subtilis[J]. Molecules, 2018, 23(11): 2797.
[47] Zhuang Y, Yang G Y, Chen X H, et al. Biosynthesis of plant-derived ginsenoside Rh2 in yeast via repurposing a key promiscuous microbial enzyme[J]. Metabolic Engineering, 2017, 42: 25-32.
[48] Rahimi S, Kim J, Mijakovic I, et al. Triterpenoid-biosynthetic UDP-glycosyltransferases from plants[J]. Biotechnology Advances, 2019. DOI:org/10.1016/j.biotechadv.2019.04.016.
[49] Gloster T M. Advances in understanding glycosyltransferases from a structural perspective[J]. Current Opinion in Structural Biology, 2014, 28: 131-141.
[50] Meech R, Hu D G, McKinnon R A, et al. The UDP-glycosyltransferase (UGT) superfamily: new members, new functions, and novel paradigms[J]. Physiological Reviews, 2019, 99(2): 1153-1222.
[51] Liang D M, Liu J H, Wu H, et al. Glycosyltransferases: mechanisms and applications in natural product development[J]. Chemical Society Reviews, 2015, 44(22): 8350-8374.
[52] Osbourn A. Saponins and plant defence — a soap story[J]. Trends in Plant Science, 1996, 1(1): 4-9.
[53] Leung K W, Wong A S T. Pharmacology of ginsenosides: a literature review[J]. Chinese Medicine, 2010, 5(1): 20.
[54] Lu J, Yao L, Li J X, et al. Characterization of UDP-glycosyltransferase involved in biosynthesis of ginsenosides Rg1 and Rb1 and identification of critical conserved amino acid residues for its function[J]. Journal of Agricultural and Food Chemistry, 2018, 66(36): 9446-9455.
[55] Xu Q F, Fang X L, Chen D F. Pharmacokinetics and bioavailability of ginsenoside Rb1 and Rg1 from Panax notoginseng in rats[J]. Journal of Ethnopharmacology, 2003, 84(2): 187-192.
[56] Lee S J, Lee J S, Lee E, et al. The ginsenoside metabolite compound K inhibits hormone-independent breast cancer through downregulation of cyclin D1[J]. Journal of Functional Foods, 2018, 46: 159-166.
[57] Liao L M, Zhang Y, Lin S F, et al. Enzymatic Transformation from protopanaxadiol ginsenoside Rb1 into rare ginsenoside C-K and its anti-cancer activity[J]. Advanced Materials Research, 2013, 641: 752-755.
[58] Wang P P, Wei Y J, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts[J]. Metabolic Engineering, 2015, 29: 97-105.
[59] Yan X, Fan Y, Wei W, et al. Production of bioactive ginsenoside compound K in metabolically engineered yeast[J]. Cell Research, 2014, 24(6): 770.
[60] 高雪岩, 王文全, 魏胜利, 等. 甘草及其活性成分的药理活性研究进展[J]. 中国中药杂志, 2009, 34(21): 2695-2700.
[61] Armanini D, Fiore C, Mattarello M J, et al. History of the endocrine effects of licorice[J]. Experimental and Clinical Endocrinology & Diabetes. 2002, 110(06): 257-261.
[62] Cinatl J, Morgenstern B, Bauer G, et al. Glycyrrhizin, an active component of liquorice roots, and replication of SARS-associated coronavirus[J]. The Lancet, 2003, 361(9374): 2045-2046.
[63] Mabuchi A, Wake K, Marlini M, et al. Protection by glycyrrhizin against warm ischemia-reperfusion-induced cellular injury and derangement of the microcirculatory blood flow in the rat liver[J]. Microcirculation, 2010, 16(4): 364-376.
[64] 谢彦, 徐淑永,曾和平. 甘草属植物中三萜类化合物研究概述[J]. 广州化工, 2004,32(1): 1-5.
[65] Zhu M, Wang C X, Sun W T, et al. Boosting 11-oxo-β-amyrin and glycyrrhetinic acid synthesis in Saccharomyces cerevisiae via pairing novel oxidation and reduction system from legume plants[J]. Metabolic Engineering, 2018, 45: 43-50.
[66] Seki H, Sawai S, Ohyama K, et al. Triterpene functional genomics in licorice for identification of CYP72A154 involved in the biosynthesis of glycyrrhizin[J]. The Plant Cell, 2011, 23(11): 4112-4123.
[67] Seki H, Ohyama K, Sawai S, et al. Licorice β-amyrin 11-oxidase, a cytochrome P450 with a key role in the biosynthesis of the triterpene sweetener glycyrrhizin[J]. Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(37): 14204-14209.
[68] Xu G J, Cai W, Gao W, et al. A novel glucuronosyltransferase has an unprecedented ability to catalyse continuous two-step glucuronosylation of glycyrrhetinic acid to yield glycyrrhizin[J]. New Phytologist, 2016, 212(1): 123–135.
[69] He J B, Chen K, Hu Z M, et al. UGT73F17, a new glycosyltransferase from Glycyrrhiza uralensis, catalyzes the regiospecific glycosylation of pentacyclic triterpenoids[J]. Chemical Communications, 2018, 54(62): 8594-8597.
[70] Liu X C, Zhang L, Feng X D, et al. Biosynthesis of glycyrrhetinic acid-3-O-monoglucose using glycosyltransferase UGT73C11 from Barbarea vulgaris[J]. Industrial & Engineering Chemistry Research, 2017, 56(51): 14949-14958.
[71] Lee S O, Simons A L, Murphy P A, et al. Soyasaponins lowered plasma cholesterol and increased fecal bile acids in female golden Syrian hamsters[J]. Experimental Biology and Medicine, 2005, 230(7): 472-478.
[72] Kinjo J, Imagire M, Udayama M, et al. Structure-hepatoprotective relationships study of soyasaponins I-IV having soyasapogenol B as aglycone[J]. Planta Medica, 1998, 64(03): 233-236.
[73] Shibuya M, Nishimura K, Yasuyama N, et al. Identification and characterization of glycosyltransferases involved in the biosynthesis of soyasapoin I in Glycine max[J]. FEBS Letters, 2010, 584(11): 2258-2264.
[74] Kurosawa Y, Takahara H, Shiraiwa M. UDP-glucuronic acid: soyasapogenol glucuronosyltransferase involved in saponin biosynthesis in germinating soybean seeds[J]. Planta, 2002, 215(4): 620–629.
[75] Sayama T, Ono E, Takagi K, et al. The Sg-1 glycosyltransferase locus regulates structural diversity of triterpenoid saponins of soybean[J]. The Plant Cell, 2012, 24(5): 2123–2138.